甲苯氯化中氯化氢的氧化与循环
甲苯氯化制备对氯甲苯和邻氯甲苯的方法[发明专利]
![甲苯氯化制备对氯甲苯和邻氯甲苯的方法[发明专利]](https://img.taocdn.com/s3/m/54f25eba690203d8ce2f0066f5335a8102d26619.png)
[19]中华人民共和国国家知识产权局[12]发明专利申请公布说明书[11]公开号CN 101497552A [43]公开日2009年8月5日[21]申请号200910030310.7[22]申请日2009.03.19[21]申请号200910030310.7[71]申请人江苏钟腾化工有限公司地址212300江苏省丹阳市化工路3号[72]发明人钟华 陆敏山 刘巧宝 孙建平 潘晓鑫 [74]专利代理机构镇江京科专利商标代理有限公司代理人夏哲华[51]Int.CI.C07C 25/02 (2006.01)C07C 17/12 (2006.01)C07C 17/383 (2006.01)权利要求书 3 页 说明书 8 页 附图 3 页[54]发明名称甲苯氯化制备对氯甲苯和邻氯甲苯的方法[57]摘要甲苯氯化制备对氯甲苯和邻氯甲苯的方法,是原料甲苯进干燥器干燥后和氯气在催化剂的作用下,进行直接氯化,得到混氯甲苯、副产盐酸和少量残渣,氯化工艺得到的混氯甲苯作为原料送到混氯甲苯分离工艺,经精密分馏得到邻氯甲苯,对氯甲苯和少量的残液。
采用本发明,塔式固定床循环氯化工艺,这保证了气液接触更加充分,反应热能及时移出,反应效果更佳,副产物减少,解决了传统吸收过程中正压或常压系统中氯化氢气体泄漏导致的环境污染问题。
避免了废水的产生,两塔串联连接的精馏分离方式,降低了塔的安装高度,提高了分离效率,最终产品对氯甲苯和邻氯甲苯的纯度均≥99.9%wt。
200910030310.7权 利 要 求 书第1/3页 1、甲苯氯化制备对氯甲苯和邻氯甲苯的方法,是原料甲苯进干燥器干燥后与氯气在催化剂的作用下,进行直接氯化得到混氯甲苯、副产盐酸和少量残渣,氯化工艺得到的混氯甲苯作为二次原料送到混氯甲苯分离工艺,经精密分馏得到邻氯甲苯、对氯甲苯和少量的残液;其特征在于:1)、所述的直接氯化法:是以甲苯为原料,经干燥器(1)干燥后与辅助催化剂在配料槽(2)内搅拌均匀,将物料打入氯化塔(3)内,启动氯化循环泵,缓慢开启氯气进料流量计,在催化剂的作用下进行氯化反应,根据反应塔内温度控制氯气流量,塔温控制在25℃-72℃之间,绝压压力为0.06~0.095Mpa,氯化液循环氯化,通过冷却器(4)移出反应热;氯化产生的氯化氢气体通过尾气吸收装置生成盐酸,在取样检测达到指标值后停止氯化,向蒸馏釜(5)出料,蒸馏釜(5)釜温60℃-155℃,釜内绝压0.05~0.085Mpa,氯化液在蒸馏釜(5)内先利用真空抽吸和蒸汽加热进行曝气,脱除溶解的氯化氢气体,然后再经过蒸馏去除催化剂,进入脱甲苯塔(6),脱除未反应的甲苯和轻组分后得到主要含对氯甲苯和邻氯甲苯的混合物即混氯甲苯;2)、所述的混氯甲苯分离工艺:是将混氯甲苯连续进入塔内温度为70℃-130℃,绝压压力为0.003~0.025Mpa的初分塔(10)顶部,塔顶富含邻氯甲苯的混合物进入邻塔I(12),邻塔I(12)的汽相直接通入邻塔I I(14)底部,邻塔I(12)和邻塔I I(14)的塔内温度为70℃-125℃,绝压压力为0.008~0.028Mpa,邻塔II(14)底部物料通过循环泵泵入邻塔I(12)顶部,邻塔I I(14)顶部得到产品邻氯甲苯其含量≥99.9%wt,邻塔I(12)塔底馏分进初分塔(10)循环分离;同时初分塔(10)底部富含对氯甲苯的物料进入对塔II(17)顶部,对塔II塔(17)顶得到轻组分进初分塔循环分离,对塔II(17)塔底物料通过循环泵泵入对塔I(15)顶部,对塔I(15)和对塔I I (17)的塔内温度为80℃-135℃,绝压压力为0.005~0.020Mpa,对塔I(15)的汽相直接通入对塔I I(17)的底部,对塔I(15)底部得到对氯甲苯中间料进入贮槽(18),对氯甲苯中间料泵入塔内温度为90℃-140℃,绝压压力为0.003~0.015Mpa的对精塔(19)顶部连续精馏,塔顶得到含量≥99.9%wt高纯度的对氯甲苯,塔底为残液。
一氯甲苯

总结:
上述四种方法中,玻璃柱串联连续氯化法和 釜式光照氯化法是一种间歇氯化、间歇精 馏的间歇生产法,其优点是质量稳定、易控 制,但是产能小、效率低;提馏氯化法和精 馏氯化法是一种连续化的生产方法,但受国 内设备材质抗腐蚀性能差、自控硬件不过 关等因素的影响,使产品质量经常出现问题。 连云港泰乐集团投巨资从比利时引进的一 套连续精馏的生产装置,不仅实现了连续化 生产,而且因其设备材质抗腐蚀性能优越、 强有效的DCS 控制系统,其产品质量一直在 国内独居鳌头。
该工艺的特点:(1)单套装置的生产能 力大,每套装置年产量可达5kt左右。 (2)由于采用氯化反应和蒸馏相结合, 氯化反应更加完全、彻底。(3)原料消 耗较低,产品纯度较高,一般可达 9916%~9919%。(4)粗品转化率提高,副 反应减少,是目前国内较为先进的生产 工艺。(5)缺点是:由于采用间歇式操 作,操作稳定性差,操作难度大。
此工艺是在比利时引进技术基础上优化改进而来,除具有其 原工艺的优点外,甲苯精制采用特殊除水技术,稳定、无需 能耗,因此进一步降低了蒸汽消耗
.
双效连续精馏工艺流程图
连续氯化流程示意图
生产原理
目前国内采用的氯化苄生产工艺是甲苯氯化法,即: 甲苯在沸腾状态下通氯进行光氯化反应,得到氯化 液粗品,然后再进行分离得到产品氯化苄。根据各 个生产厂家最终产品的不同,氯化工艺又分为两种 情况:一种是以生产氯化苄为主的工艺,另一种工 艺是在生产氯化苄的同时联产苄叉二氯和苄叉三 氯、邻氯甲苯、间氯甲苯、对氯甲苯等产品。虽 然以上两种工艺略有不同,但其氯化反应机理相同, 由链的引发、链的传递和链的终止三部分组成。
3. 低温氯化法 氯化反应在一组反应柱中进行,几个反 应柱呈并联状态,原料甲苯经计量后进入第 一个反应柱,然后通过每个反应柱的液位差 进入下一个反应柱;氯气经计量后分别进入 每个反应柱的底部,与甲苯反应生成氯化苄; 反应料液靠液位差溢流进入粗品低位槽。 整个反应过程温度控制在60~100°C,反应 料液的氯化苄含量控制在40%左右。
苯甲醛生产工艺
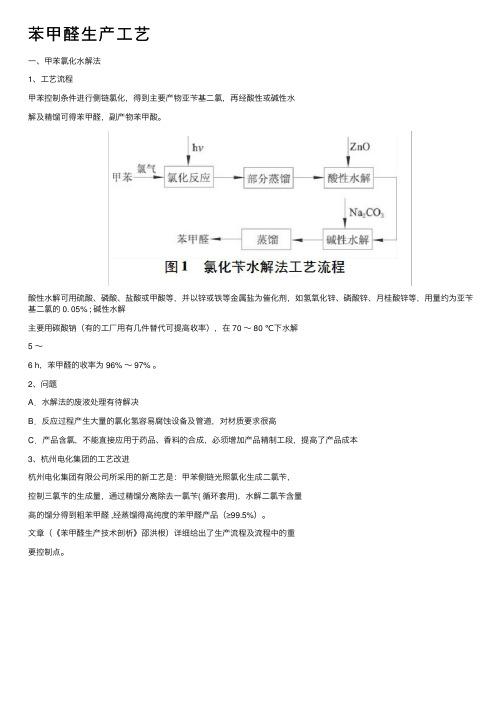
苯甲醛⽣产⼯艺⼀、甲苯氯化⽔解法1、⼯艺流程甲苯控制条件进⾏侧链氯化,得到主要产物亚苄基⼆氯,再经酸性或碱性⽔解及精馏可得苯甲醛,副产物苯甲酸。
酸性⽔解可⽤硫酸、磷酸、盐酸或甲酸等,并以锌或铁等⾦属盐为催化剂,如氢氧化锌、磷酸锌、⽉桂酸锌等,⽤量约为亚苄基⼆氯的 0. 05% ; 碱性⽔解主要⽤碳酸钠(有的⼯⼚⽤有⼏件替代可提⾼收率),在 70 ~ 80 ℃下⽔解5 ~6 h,苯甲醛的收率为 96% ~ 97% 。
2、问题A.⽔解法的废液处理有待解决B.反应过程产⽣⼤量的氯化氢容易腐蚀设备及管道,对材质要求很⾼C.产品含氯,不能直接应⽤于药品、⾹料的合成,必须增加产品精制⼯段,提⾼了产品成本3、杭州电化集团的⼯艺改进杭州电化集团有限公司所采⽤的新⼯艺是:甲苯侧链光照氯化⽣成⼆氯苄,控制三氯苄的⽣成量,通过精馏分离除去⼀氯苄( 循环套⽤),⽔解⼆氯苄含量⾼的馏分得到粗苯甲醛 ,经蒸馏得⾼纯度的苯甲醛产品(≥99.5%)。
⽂章(《苯甲醛⽣产技术剖析》邵洪根)详细给出了⽣产流程及流程中的重要控制点。
⼆、甲苯液相氧化法1. 钴盐为催化剂、溴化物为催化助剂、空⽓为氧源的液相氧化⼯艺此⼯艺中苯甲醛作为副产物⽣产,经常出现在以甲苯为原料⽣产⼰内酰胺(意⼤利SNIA⼯艺)、苯甲酸的⼯艺流程中。
国外早已⼯业化,国内没有使⽤此法将苯甲醛作为主产品的⽣产⼚家。
优点:产品不含氯,应⽤范围⼴缺点:氧化⼯艺不好控制,甲苯很容易被过度氧化成苯甲酸;产品中杂质较多,除苯甲醇、苯甲酸外还存在苯甲酸苄酯等酯类化合物。
⽽且,甲苯的单程转化率不超过20%,若要提⾼苯甲醛的选择性还需要进⼀步降低甲苯转化率到个位数⽔平,增加了⽣产中的动⼒消耗改进措施:A.可以通过加⼊惰性⽓体的⽅式控制氧源中氧⽓的浓度防⽌过度氧化B.降低反应温度,减少物料在反应器中的停留时间C.在反应体系中加⼊⼀种或多种脂肪族或芳⾹族的含氮化合物,提⾼苯甲醛在反应产物中的分布2. 三氧化⼆锰法绿⾊氧化⼯艺利⽤⼆氧化锰在 650 ℃下灼烧得到三氧化⼆锰,使⽤该原料与中等浓度的硫酸与甲苯在反应器内进⾏固、油、⽔三相反应,甲苯氧化成苯甲醛。
氯化反应过程中氯资源的循环利用

6 0C 5  ̄ 左右煅 烧 2 3h 利用过 量溶 液重 复浸 渍 、 , 干燥
和煅烧 , 即可得 到所需 催化剂 。
1 2 试 验装置Байду номын сангаас及流 程 .
试 验装 置及 流程如 图 1 所示 , 主要 由 H 1 取部 C制 分 、 C 催 化 氧 化部 分 、 气 循 环 利 用 部 分 组 成 。在 H1 氯 内置 日光灯 管 的环流 氯 化反 应 器 中进 行 甲苯 光 氯化 反应 ,0  ̄下 甲苯 充 分 氯 化得 到不 含 氯 气 的氯 化氢 10C
有效 提高 了氧 化转化 率 , 直接将 氧化混 和气 体 中氯 并
气完 全用 于 甲苯氯化 。
Ⅱ 堕 坌
( ea m t col t nc nier gJ ns aj gC l g f n r ao eho g , aguN i 0 6 D pr e o Mi e c oi E g e n , aguN ni o eeo f m t nT cnl yJ ns 眦j g20 4 ; t n f r er s n i i n l Io i o i n 1
cl d x ao a re u i a Ⅸ d—bdr c r i a yt f ho eoi t nW S a i otn e i r di crd f e at t ct s o 7一A2 3ae h mu e atnt p r e ow h a l J0 dncri m. nr c o m e— l o e i e
Ke wo d h do e h o d o i a o c lrn t le e r c ce y rs y rg n c lr e i xd t n i ho i e ou n e y l
2021届高考化学主观题定点突破07 包含特殊装置的有机实验(解析版)

突破07 包含特殊装置的有机实验1.氯化苄(C6H5CH2Cl)为无色液体,是一种重要的有机化工原料。
现在实验室模拟工业上用甲苯与干燥氯气在光照条件下加热反应合成氯化苄、分离出氯化苄并检验样品的纯度,其装置(夹持装置略去)如图所示:回答下列问题:(1)仪器E的名称是____________;其作用是_______________________;其进水口为____________(填“a”或“b”)。
(2)装置B中的溶液为____________;装置F的作用是________________________。
(3)用恒压滴液漏斗代替分液漏斗的优点是__________________。
(4)装置A中反应的离子方程式为____________________________________。
(5)检测氯化苄样品的纯度:①称取13.00g样品于烧杯中,加入50.00mL4mol•L-1NaOH水溶液,水浴加热1小时,冷却后加入35.00mL 40%HNO3,再将全部溶液转移到容量瓶中配成100mL溶液。
取20.00mL溶液于试管中,加入足量的AgNO3溶液,充分振荡,过滤、洗涤、干燥,称量固体质量为2.87g,则该样品的纯度为______%(结果保留小数点后1位)。
②实际测量结果可能偏高,原因是________________________。
【答案】(1)球形冷凝管导出Cl2、HCl气体,冷凝回流甲苯 b (2)饱和食盐水防止水蒸气进入装置(3)使漏斗与烧瓶内压强一致,液体顺利流下(4)2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O (5)97.3 样品混有二氯化苄、三氯化苄等杂质【解析】(1)根据仪器构造可知仪器E的名称是球形冷凝管,其作用是导出Cl2、HCl气体,冷凝回流甲苯;冷却时才有逆向冷却,则其进水口为b;(2)生成的氯气中含有氯化氢,则装置B中的溶液为饱和食盐水,用来除去氯化氢;装置F中的无水氯化钙是干燥剂,其作用是防止水蒸气进入D装置;(3)恒压滴液漏斗可以保持内外压强相等,因此用恒压滴液漏斗代替分液漏斗的优点是使漏斗与烧瓶内压强一致,液体顺利流下;(4)装置A中制备氯气,反应的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;(5)①2.87g固体是氯化银,物质的量是2.87g÷143.5g/mol=0.02mol,因此根据氯原子守恒可知氯化苄的物质的量是0.02mol×100mL/20mL=0.1mol,质量是0.1mol×126.5g/mol=12.65g,则该样品的纯度为12.65g13.00g×100%=97.3%;②由于样品混有二氯化苄、三氯化苄等杂质,因此实际测量结果可能偏高。
甲苯与氯气反应方程式

甲苯与氯气反应方程式甲苯与氯气反应是一种重要的有机合成反应,在化学工业中有着广泛的应用。
该反应可以通过以下方程式表示:C6H5CH3 + Cl2 → C6H5Cl + HCl甲苯与氯气反应生成氯代甲苯和氯化氢。
甲苯是一种有机化合物,化学式为C6H5CH3。
它是一种无色液体,有特殊的香气,常用作溶剂和原料。
氯气是一种无色刺激性气体,化学式为Cl2,具有强烈的腐蚀性。
甲苯与氯气反应是一种卤代烃的合成反应,该反应通常在光照或加热的条件下进行。
在该反应中,甲苯的苯环上的氢原子被氯气中的氯原子取代,形成氯代甲苯。
反应过程中,氯气分子中的一个氯原子与甲苯分子中的氢原子发生亲电取代反应,生成一个氯代甲苯分子,并释放出一个氯化氢分子。
这个反应属于亲电取代反应,由于甲苯中的苯环具有电子密度较高的特点,容易受到亲电试剂的攻击。
氯气中的氯原子是一种强亲电试剂,可以与甲苯中的氢原子发生取代反应。
在反应中,氯原子被苯环上的氢原子替代,形成氯代甲苯。
甲苯与氯气反应的机理可以简单描述为以下几个步骤:1. 氯气分子吸附到甲苯的苯环上。
2. 氯气中的氯原子与甲苯分子中的氢原子发生亲电取代反应,生成氯代甲苯。
3. 生成的氯代甲苯与氯气继续反应,进一步取代甲苯分子中的氢原子,生成更多的氯代甲苯。
4. 反应生成的氯化氢与甲苯中的氢原子进一步反应,生成氯代甲苯和氯化氢。
甲苯与氯气反应是一种重要的有机合成反应,可以用于制备氯代甲苯。
氯代甲苯是一种重要的有机化合物,在化学工业中有广泛的应用,可以用作溶剂、化学试剂和原料。
此外,甲苯与氯气反应还可以用于制备其他卤代甲苯化合物,如溴代甲苯和碘代甲苯。
甲苯与氯气反应是一种重要的有机合成反应,通过该反应可以合成氯代甲苯和氯化氢。
这个反应的机理涉及亲电取代反应,甲苯中的氢原子被氯气中的氯原子取代。
甲苯与氯气反应在化学工业中具有广泛的应用,可以用于制备各种卤代甲苯化合物。
氯化定义

一、氯化1、定义氯化是指以氯原子取代有机化合物中氢原子的反应,根据氯化反应条件的不同,有热氯化、光氯化、催化氯化等,在不同条件下,可得不同产品。
广泛应用的氯化剂有:液态氯、气态氯、气态氯化氢、各种浓度的盐酸、磷酰氯、硫酰氯、三氯化磷等。
2、应用氯化反应广泛应用于制造溶剂、各种杀虫剂、医药、农药、精细化工原料及中间体。
3、氯化反应的危险性分析(1)氯化反应的各种原料、中间产物及部分产品都是有不同程度的火灾危险性。
如烷烃、芳烃等。
(2)氯化剂具有极大的危险性,氯气为强氧化剂,能与可燃气体形成爆炸性气体混合物,能与可燃烃类、醇类、羧酸和氯化烃等形成二元混合物,极易发生爆炸。
氯气与烯烃形成的混合物,在受热时可自燃;与乙炔的反应更为激烈,有氧气存在时,甚至在-78℃的低温也可发生爆炸。
(3)氯化反应是放热反应,有些温度高达500℃,甚至更高,如反应失控,可造成超压爆炸。
某些氯化反应可自行加速,导致爆炸危险。
(4)液氯气化时高热使液氯剧烈气化,可造成内压过高而爆炸。
工艺操作不当使反应物倒灌至液氯钢瓶,则可能与氯发生激烈反应引起爆炸。
(5)氯化氢吸收装置如发生故障,不能完全被吸收,大量氯化氢逸出会造成中毒事故及腐蚀事故的发生。
(6)氯气缓冲罐若不定期排放三氯化氮,可能因三氯化氮积聚造成爆炸事故的发生。
4、氯化反应的安全技术要点(1)车间厂房设计应符合国家爆炸危险场所安全规定。
应严格控制各种点火源,车间内电气设备要防爆,通风良好。
易燃易爆设备和部位应安装可燃气体监测报警仪,本岗位采用自动控制、自动报警、自动泄压等方法以提高安全度,并设置完善的消防设施。
(2)最常用的氯化剂是氯气。
在化工生产中,氯气通常液化储存和运输,常用的容器有储罐、气瓶和槽车等。
储罐中的液氯进入氯化器之前必须先进入蒸发器使其汽化。
在一般情况下不能把储存氯气的气瓶或槽车当储罐使用,否则有可能使被氯化的有机物质倒流进气瓶或槽车,引起爆炸。
一般情况下,氯化器应装设氯气缓冲罐,以防止氯气断流或压力减小时形成倒流。
2022-2023学年安徽省安庆市九校联盟九年级下学期第一次月考化学试题

2022-2023学年安徽省安庆市九校联盟九年级下学期第一次月考化学试题1.美丽昆明要靠我们共同创造和维护。
下列做法不合理的是A.垃圾分类处理B.乘坐公共交通工具出行C.大量使用一次性餐具D.积极植树造林2.下列食物中富含蛋白质的是A.冰糖B.食用油C.青菜D.鸡蛋3.火把节是彝族、白族等民族的传统节日,下列准备篝火的过程中涉及化学变化的是A.砍伐枯木B.枯树劈柴C.架空木柴D.点燃木柴4.化学实验操作要注重规范性和安全性,这是实验成功的关键。
下列操作正确的是A.闻药品气味B.取用少量液体C.点燃酒精灯D.倾倒液体5.如图是元素周期表中硫元素信息示意图和硫原子结构示意图,对图中信息理解错误的是A.硫元素是非金属元素B.硫元素的元素符号为 SC.硫原子的核外共有三个电子层D.硫原子的最外层已达到了稳定结构6.磷酸氯(C18H32ClN3O8P2),用于治疗对氨敏感的恶性疟,间日疟等疟疾,也可用于治疗肠外阿米巴病,还有抗风湿作用等。
下列有关磷酸氯的说法正确的是A.磷酸氨属于无机物B.磷酸氯峰中氢元素的质量分数最大C.磷酸氯喹中碳、氢元素的质量比为27:4D.磷酸氯是由碳、氢、氯、氮、氧、磷六种原子构成的7.“中国高铁,世界第一”。
高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理之一是:。
下列说法正确的是A.含镍不锈钢的硬度小于纯铁B.含镍不锈钢的抗腐蚀性能比纯铁差C.含镍不锈钢属于一种铁合金D.含镍不锈钢的熔点高于纯铁8.下列化学符号中的数字“”表示的意义不正确的是A.:“ ”表示两个钠元素B.:“ ”表示一个二氧化氮分子含有两个氧原子C.:“ ”表示两个氢氧根离子D.:“ ”表示镁元素的化合价为价9.类比、迁移和推理是化学学习常用的思维方法。
下列有关说法正确的是A.溶液是由两种或两种以上的物质组成的,则溶液一定是混合物B.原子不显电性,则不显电性的微粒一定是原子C.CO和CO 2的组成元素相同,则它们的化学性质相同D.中和反应生成盐和水,则生成盐和水的反应一定是中和反应10.2023年3月《中国科学院刊》报道了我国生物乙醇重整制氢技术的重大进展。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2005年11月 Journal of Ch ina U n iversity of M in ing & T echno logy N ov. 2005
2 试验结果与讨论
2. 1 活性组分对催化剂活性的影响 在 HC l 流 量 100 mL m in, 摩 尔 比 HC l O 2≈
1 1, 床层温度360~ 410℃的条件下, 试验分别考察 了以 Χ2A l2O 3作载体, 采用不同铬源所制得的催化 剂的活性, 结果如表1所示.
表1 不同铬源催化剂活性比较 Table 1 Com par ison of the activ ity of
氯气是一种非常重要的基础化工原料, 广泛应 用于化学、冶金、造纸、纺织、医药、石油化工、饮水 消毒和环保行业. 我国每年消耗氯气达576万 t, 已 居世界第二位[1 ].
在工业上生产有机氯产品时会产生大量副产
氯化氢, 氯原子的利用率最大为50%. 这些氯化氢 气体大多用水吸收副产盐酸, 因其中含一定量的有 机杂质, 其用途大受限制, 有些地区甚至用碱中和 后直接排放, 不仅影响氯产品生产的经济效益, 也 有可能造成环境的污染, 因此大量副产氯化氢的有
the ca ta lyst from d ifferen t source
铬 h) 80. 7 (8 h) 83. 0 (8 h)
66. 0 (50 h) 84. 3 (80 h)
注: 括号内数据为累积试验时间1
从表1可以看出, 以铬源 和 制得的催化剂 在起始时活性相当, 较以铬源 制得的要好得多. 铬源 制成的催化剂在使用20 h 后, 活性就出现 了明显的下降, 在50 h 后转化率降为66% , 而铬源
在氯化氢气体发生稳定和催化氧化装置操作 稳定情况下, 将氧化反应器出口混合气体经缓冲瓶 自然冷却除去大部分水汽后, 再经浓硫酸干燥直接 送入氯化反应装置 C 进行氯化反应. 氯化反应器 的结构与甲苯光氯化反应器相同, 其容积约为光氯 化反应器的2 3. 通过分析其中氯化产物的组成和 分析计算混和气体中氯气的利用率, 从而考察氯气 直接循环利用的可行性.
经 典 D eacon 反 应 2HC l ( g ) + 1 2O 2 ( g ) C l2 (g) + H 2O (g) 在热力学上是一个快速放热反应, 因此升高温度不利于平衡转化率的提高. 但在实际 应用中, 温度太低或太高都不适于工业化生产. 太 高催化剂容易失活, 太低活性则不够.
本实验装置由甲苯光氯化反应装置A , HC l 催 化氧化装置 (固定床反应器)B , 甲苯氯化反应器 C 3部分构成, 如图1所示.
图1 氯资源循环利用工艺装置流程示意图 F ig. 1 Schem atic diagram of the reuse of ch lo rine 11 氯化钢瓶; 2, 141 缓冲瓶; 31 毛细管流量计; 41 取 样管; 51 光氯化反应器; 61 热电偶测温管; 71 日光灯 插孔; 81 冷凝器; 91 有机气体吸收塔; 101 热电偶测温 管; 111 催化剂装填孔; 121 固定床控温装置; 131 氧化 反应器; 15, 161 尾气吸收瓶; 171 转子流量计; 181 氧 气钢瓶; 191 氯化反应器; 201 三通考克、缓冲冷凝瓶
累计时间 h HC l 转化率 % 累计时间 h HC l 转化率 %
8
83
104
89. 9
32
84. 6
128
89. 0
56
82. 8
152
88. 3
80
89. 3
从结果可以看出, 在 HC l 流量100 mL m in, 摩 尔比 HC l O 2≈ 1 1, 试验条件下可获得超过80% 以 上的转化率. 2. 2 温度对 HCl 转化率的影响
HC l 催化氧化反应器采用固定床反应器, 反应 器直径 <24 mm , 高度600 mm , 由硬质玻璃制成, 反 应炉三段加热控温, 以满足催化剂床层温度所需. 反应器中心内置 <5玻璃管, 用于置放热电偶测温. HC l 和O 2经三通汇合充分混合后从氧化反应器上 部进入, 固定床上部为非催化惰性填料段 (约200 mm ) , 混合气体经过预热管和惰性填料段充分预 热后进入催化剂床层, 发生催化氧化反应. 氧化反 应器出口气体为氧气、氯化氢、氯气和水蒸汽的混 合气体. 氧化反应产生的氯气量采用碘量法分析; 同时, 氯气量滴定结束后继续用氢氧化钠标准溶液 滴定分析残余的 HC l 气体量.
(1. Schoo l of Chem ical Engineering and T echno logy, Ch ina U n iversity of M in ing & T echno logy, Xuzhou, J iangsu 221008, Ch ina; 2. Co llege of Chem istry and Chem ical Engineering, N an jing U n iversity of T echno logy, N an jing, J iangsu 210009, Ch ina)
Abstract: T he direct recycle of ch lo rine w as studied in th is paper. T he hydrogen ch lo ride from the by2p roduct of to luene pho to ch lo rination w as directly used as ox idation reaction raw gas. A fter being sim p ly treated, the m ixed gases from ox idation reacto r w ere inducted in to ch lo rination reacto r to ch lo rinate to luene. T he ch rom ic ox ide catalyst w as p repared by im p regnating Χ2A l2O 3, w h ich has a stable activity and there w as no obvious deactivation after 150 hours activity test. H igh HC l conversion of 80% w as obtained under the condition s of the reaction tem perature of 360℃, the raw m aterial HC l O 2 m o le ratio of 1 1, feed space tim e of 5 h. T he ch lo rine recycling resu lt show s that it is feasible that the m ixed gases from ox idation reacto r can be directly utilized in to luene ch lo rination w ith som e p roper catalyst. T he ch lo rine from ox idation reacto r utilization ratio could reach 100%. Key words: hydrogen ch lo ride; catalytic ox idation; ch lo rine; catalyst; recycle
第6期 万永周等: 甲苯氧化中氯化氢的氧化与循环
823
制成的催化剂在累积试验时间80 h 后转化率仍 然在80% 以上.
为进一步考察, 对铬源 制成的催化剂进行了 重复制备和试验, 在上述相同条件下进行了寿命初 步测试试验, 结果见表2所示.
表2 催化剂寿命试验 Table 2 Test of the ca ta lyst l ive tim e
R ecycle and Catalytic O x idation of H ydrogen
Ch lo rination D uring To luene Ch lo rination
W AN Yong2zhou1, CU IM i2fen2, Q IAO Xu2, ZHAN G Shuang2quan1, D IN G Shu2guang1
8 22 中国矿业大学学报 第34卷
效利用已经成为迫切需要解决的问题. 自从1875年 D eacon 首先提出以多种惰性多孔
物质为载体的Cu,M n 和 Fe 的盐作催化剂, 用氧气 氧化 HC l 制取氯气过程以来, 很多国外公司对氯 化氢氧化过程进行了大量的研究[225]. 国内清华大 学韩明汉等[6]于1997年开展了 HC l 催化氧化反应 小试研究, 对 B en son 等[7] 提出的两步法进行了一 些改进. 迄今为止, 这些研究大多停留在小试或中 试阶段, 究其原因主要在于催化剂活性不够稳定、 工业反应器材质的选择困难以及难以与工业有机 氯化过程衔接等方面. 本文试图以甲苯氯化副产物 HC l 直接作为反应原料气, 采用自制催化剂, 在固 定床中考察催化剂性能, 探索 HC l 催化氧化制氯 气的适宜工艺条件, 并对氧化得到的氯气直接循环 利用的可行性进行了初步研究.
收稿日期: 2005 06 10 基金项目: 中国矿业大学青年科研基金项目 (OH 4538) 作者简介: 万永周 (19752) , 男, 河南省郑州市人, 讲师, 硕士研究生, 从事废弃物资源化利用、工业催化相关方面的研究. E-ma il: w yz212@ 163. com Tel: 051623884079
1 试验部分
1. 1 催化剂的制备 催化剂制备采用过量溶液浸渍法, 分别称取一
