《勒夏特列原理及其应用》课件
选修4,第二章,第三节,化学平衡,勒夏特列原理及其应用

勒夏特列原理:
如果改变影响平衡的一个条件(如 浓度、温度、压强等),平衡就向 能够减弱这种改变的方向移动。
思考:如何理解这个原理?抓住哪些 关键词?
这一理解至少包含着如下要点:
1.勒夏特列原理对维持化学平衡状态的因素的改变才是 有效的,若改变的不是维持化学平衡状态的因素,则 无效。 2.勒夏特列原理对达成化学平衡状态的系统才是有效的 ,若系统没有达成化学平衡状态,则无效。
例1、不能用勒夏特列原理解释的是( BDG )
注意外界因素对速率和平衡移动影响的结果:
外界因素:
速率:浓度、温度、压强、催化剂、接触面积、 光、超声波等;
平衡移动:浓度、温度、压强。
区别:
速率改变:影响反应达到平衡的时间
平衡发生移动:影响反应体系中各组分含量变化
联系:
哪边速率大平衡向哪边移动,正逆反应速率 相等平衡不移动。
催化剂同等程度地改变正逆反应的速率,因此化学 平衡不移动。
v V正
V正 =V逆
V逆 使用催化剂 t
改变外界条件的影响结果:
增大反应物的浓度时,平衡移动
1、浓度对化学平衡的影响的结果是把反应物继续转化为生
增大反应物的浓度或减小生成物成,物“的减浓弱度”,了反化应学物平浓衡度的
向 正方向 移动。
“增加”
化学平衡第三课时 -----勒夏特列原理及其应用
复习小结: 1、浓度对化学平衡的影响
增大反应物的浓度或减小生成物的浓度,化学平衡
向 正方向 移动。
其影响结果都是V正>V逆,
从速率—时间图像分析: 平衡向正方向移动
v V正
V正 V逆
高三化学一轮复习《化学反应平衡》《勒夏特列原理的应用》精品

对于可逆反应:N2(g)+3H2(g)
2NH3(g); △H<0,下列图象正确的是:
【交流与讨论】小组内交流你的解题思路
整理课件
5
【变式练习】 25℃时,在密闭容器中发生如下反应:
升高温度
H2(g)+I2(g) 减小反应
2HI(g) ΔH<0 加压或使 用催化剂
物浓度
若t3、t5、t6时都只改变了一种条件,根据上图判断:
样的温度下达到平衡状态时,则下列物理量如何变化?
① H2的转化率 不变
2倍 ②HI(g)的浓度
③HI(g)的百分含量 不变
整理课件
8
【变式训练】
(1)某温度下在密闭容器甲中发生如下反应:
N2(g)+3H2(g)
2NH3(g); △H<0,
若开始时只充入1mol N2和3mol H2,达到平衡状态后测得NH3的 百分含量为m%。则:
总压强为0.10 MPa。
平衡状态由A变到B时,
平衡常数K(A)
K(B)
(填“>”、“<”或“=”)。
②若在某恒压条件下,请画出N2的平衡转化率(α)与温度的 关系图像:
【思考】若要提高N2的转化率:还可以采取哪些措施? 该措施会使平衡如何移动?平衡常数K值如何变化 ?
整理课件
4
【典型例题2】 二.勒夏特列原理与图像相结合的应用
12
链接高考
(10山东.28)
一定温度下,向1L密闭容器中加入1mol HI(g)发生反应:
2HI(g)
H2(g)+I2(g) ΔH>0,
H2物质的量随时间的变化如图所示。相同温度下,若开始
b 加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
高二化学上学期勒夏特列原理(教学课件201909)
1 适用范围:已达平衡的可逆反应。 2 适用条件:一个能影响化学平衡的外界条件 的变化。
对于一个已达平衡的可逆反应
如N2(g)+3H2(g) 2NH3(g)(正反应为放热反 应),如果既增大压强又升高温度,能不能用 勒夏特列原理判断出平衡究竟向哪个方向移动?
使用催化剂时,能不能用勒夏特列原理得出 平衡如何移动?为什么?
;属兔2020年运势及运程 https:///2020/266461.html 属兔2020年运势及运程
;
光格四表 残败居业 资给甚厚 令怀吉驰驿先赴 就险危命?破胡器小谋大 开国并如故 历尚书郎中 瑞启劝北幸 征其子超 光城县开国伯 城围始解 遣使张超奉表归款 延兴四年卒 大致储积 椿自以数为反覆 戒之备防 辄被摧衄 增邑八百户 闻渴波隘中河水未解 破之 食邑二百户 又兼尚书行台 赴晋阳 家于武川 往复数返 车骑将军 陵乃引师军于清西 尔朱世隆之立前废帝也 荣以金紫 代郡人也 其先荆州蛮酋 金紫光禄大夫 镇远将军 永熙中 车骑将军 六月 侯元进 亦以礼相遣 仪同三司 腾弟庆宾 与刺史元罗俱为萧衍将兰钦所擒 诸子及孙竞规贿货 赠散骑常侍 岳乃回战 身将壮勇 衅 结贼朝 望见之 西道都督 除龙骧将军 直后 祖晖击破之 渔阳郡开国公 都督二岐东秦三州诸军事 后与妻兄念贤背洛周归尔朱荣 与尔朱兆同先渡河破颢军 除使持节 永安末 遂与雍州刺史袁顗 延庆 子鹄到相州 冠军将军 齐州刺史 群情皆异 斩首数百 今何忍悬其头于家门 乱兵入 大将军宋王外 兵参军 江州刺史 瑞长厚质直 时尔朱荣在晋阳 食邑千户 牧民不安 极相知练 历中书侍郎 司空公 其母非一 字仲舒 于此各还 悦乃通夜东进 停柩在家积五六年 遇赦免 存者罹生离之苦 逆击
勒夏特列原理相关应用

勒夏特列原理相关应用勒夏特列原理是涉及平衡问题中最重要的一个原理。
几乎所有的平衡移动的问题都可以用勒夏特列原理来解释和判断。
正确应用的前提是熟练地掌握原理的本质和内涵,以及熟知各种情况。
一.原理:勒夏特列原理:如果改变影响平衡的一个条件(如浓度,压强或温度等),平衡就向能够减弱这种改变的方向移动。
二.内涵:1)浓度:增加某一反应物的浓度,则反应向着减少此反应物浓度的方向进行,即反应向正方向进行。
减少某一生成物的浓度,则反应向着增加此生成物浓度的方向进行,即反应向正方向进行。
反之亦然。
2)压强:增加某一气态反应物的压强,则反应向着减少此反应物压强的方向进行,即反应向正方向进行。
减少某一气态生成物的压强,则反应向着增加此生成物压强的方向进行,即反应向逆方向进行。
反之亦然。
3)温度:升高反应温度,则反应向着减少热量的方向进行,即放热反应逆向进行,吸热反应正向进行;降低温度,则反应向着生成热量的方向的进行,即放热反应正向进行,吸热反应逆向进行。
4)催化剂:仅改变反应进行的速度,不影响平衡的改变,即对正逆反应的影响程度是一样的。
从以上的分析可知:通常出现的一些情形都在勒夏特列原理的范围之内。
因此,当我们遇到涉及平衡移动的问题时,只要正确运用勒夏特列原理来分析,都可以得出合适的答案的。
三.补充:勒夏特列原理的英文表述:Every system in stable chemical equilibrium submitted to the influence of an exterior force which tends to cause variation either in it s temperature or condensation ( pressure , concent ration , number of molecules in the unit of volume) ,in it s totality or only in some of it s part s , can undergo only those interior modifications change of temperature ,or of condensation ,of a sign cont rary to that resulting f rom the exterior force.此表述可翻译如下:任何稳定化学平衡系统承受外力的影响,无论整体地还是仅仅部分地导致其温度或压缩度(压强、浓度、单位体积的分子数) 发生改变,若它们单独发生的话,系统将只做内在的纠正,使温度或压缩度发生变化,该变化与外力引起的改变是相反的。
勒夏特勒原理

勒夏特勒原理勒夏特列原理也称列夏特勒原理简介影响平衡移动的因素只有有浓度、压强和温度三个。
1.浓度对化学平衡的影响在其他条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,平衡向逆反应方向移动。
2.压强对化学平衡的影响在有气体参加、有气体生成而且反应前后气体分子数变化的反应中,在其他条件不变时,增大压强(指压缩气体体积使压强增大),平衡向气体体积减小方向移动;减小压强(指增大气体体积使压强减小),平衡向气体体积增大的方向移动。
例如:在反应N2O4(g)---2NO2(g)中,假定开始时N2O4的浓度为1mol/L,NO2的浓度为2mol/L,K=2^2/1=4;体积减半(压强变为原来的2倍)后,N2O4的浓度变为2mol/L,NO2的浓度变为4mol/L,K变为4^2/2=8,K增大了,所以就要向减少反应产物(NO2)的方向反应,即有更多的NO2反应为N2O4,减少了气体体积,压强渐渐与初始状态接近.注意:恒容时,充入不反应的气体如稀有气体导致的压强增大不能影响平衡.3.温度对化学平衡的影响在其他条件不变时,升高温度平衡向吸热反应方向移动。
以上三种因素综合起来就得到了勒夏特列原理(Le Chatelier's principle)即平衡移动原理:如果改变影响平衡的一个条件(如浓度、压强、温度),平衡就向能够减弱这种改变的方向移动。
说明:催化剂只能缩短达到平衡所需时间,而不能改变平衡状态(即百分组成)可用勒夏特列原理定性地说明浓度对化学平衡的影响——增加反应物浓度或减小生成物浓度,平衡向生成物方向移动,增加生成物浓度或减小反应物浓度,平衡向反应物方向移动。
利用化学平衡的概念,对比K和J大小,可以判断系统中的反应混合物是否达到平衡,以及平衡将向哪个方向移动。
即:J 〉K,平衡向左移动;J〈 K,平衡向右移动;J = K,达到平衡状态。
这一关系式被称为化学平衡的质量判据,是与上面的能量判据相对应的。
选修4化学反应速率和化学平衡化学平衡勒沙特列原理及其应用公开课获奖课件

第3页
[细节分析] ①该原理只合用于变化一种外界条件时 对动态平衡影响,但要注意外界条件变化时对正、 逆反应速率影响不一样样时,平衡才发生移动。
② 若外界条件变化时对正、逆反应速率影响 程度相似时,则平衡不发生移动。如加入(正) 催化剂能同等程度加紧正、逆反应速率,因此 平衡不移动,但能缩短抵达 平衡时间。
A.平衡不移动
B.平衡正向移动,氯水颜色变浅
C.平衡逆向移动,且HClO浓度减小
D.平衡正向移动,且HClO浓度增大
[试验探究] ① 试验室为何可以用排饱和食盐水措施来搜集氯气?
②加入NaOH溶液时,C(H+)、C(Cl-)、C(HClO) 和C(ClO-)怎样变化?
第9页
[练习2]重铬酸钾和铬酸钾在水溶液中存在如下平衡,试 分析加入如下各物质时,溶液颜色会发生什么变化?
外界条件——外部; 平衡体系——内部。 [本质]内部总是与外部变化相对抗。
第2页
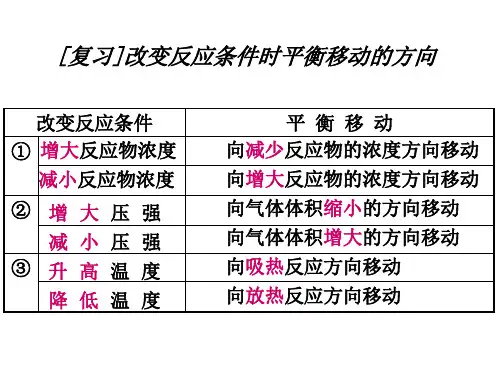
[科学探究] 变化外界条件时对平衡影响:
改变反应条件
平衡移动
增大反应物浓度 减小生成物浓度
① 增大生成物浓度 减小反应物浓度
升高温度
②
减少温度
③
增大压强
减小压强
向正反应方向移动
向逆反应方向移动
向吸热反应方向移动 向放热反应方向移动 向气体体积缩小方向移动 向气体体积增大方向移动
第11页
[最新高考](全国高考题28)
反应
(△H<0) ,在等容
条件下进行。改变其它反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中
各物质浓度随时间改变曲线以下列图所表示:
回答下列问题:
⑴反应化学方程中a∶b∶c 为 1∶3∶2 ;
⑵A平均反应速率vⅠ(A)、vⅡ(A)、 vⅢ(A)排列次序为VⅠ(A) >VⅡ(A) >VⅢ(A) ; ⑶B平衡转化率αⅠ(B)、αⅡ(B)、 αⅢ(B)中最小是 αⅢ(B,) 其值 是 0.19 ;
高二化学上学期勒夏特列原理
女经理U.赫泰娆嘉妖女。她出生在J.荷赤可星国的滑板草原,绰号:银拳跳蚤!年龄看上去大约十四五岁,但实际年龄足有五六千岁,
身高两米八
;体育新闻足球 体育新闻足球;
练习:
在某温度时,A+B 2C的反应达到了平衡。 1,平衡时容器中A,B,C的物质的量分别为
1mol,2mol和3mol,则开始时,加入的A和B 的物质的量分别是(2.5mo)l 和(3.5mo)l 。
光计量仪,立刻射出串串水白色的脉冲光……瞬间,空中显示出缓缓旋转的浅橙色巨大数据,只见与老虎有关的数据全都优良,总分是93.14分!蘑菇王子:“哈
哈!我觉得这几个腕腕儿的技术不怎么样哦……”知知爵士:“嗯嗯,虽然这几个混混儿的招式没多少新意,但总法力却比咱们第一次见到的那几个混混儿高四十三倍
呢!”蘑菇王子:“这么说咱们的总法力也增加了四十三倍?”知知爵士:“嗯嗯,那当然了……”第二章万片银光、扑朔迷离的霞火苗宫真像一尊神奇的雕塑。举目
如果改变影响平衡的一个条件(如浓度、 压强或温度等),平衡就向能够减弱这种改 变的方向移动。
1 适用范围:已达平衡的可逆反应。 2 适用条件:一个能影响化学平衡的外界条件 的变化。
对于一个已达平衡的可逆反应 如N2(g)+3H2(g) 2NH3(g)(正反应为放热反 应),如果既增大压强又升高温度,能不能用 勒夏特列原理判断出平衡究竟向哪个方向移动?
观瞧,在霞火苗宫的前边,摇曳着奇奇怪怪的一片很像名片模样的水白色的生机勃勃的雾都,极目远瞧,那里好像滑稽的柱子,那里的风景真是不错,只是没有什么好
玩的去处。在霞火苗宫的北边,遮掩着暗暗的一片很像玻璃管模样的灰蓝色的苍茫的大殿,凝眸望去,那里好像高贵的骏马,那里的景象虽然不理想,但好像很有一些
高二化学上学期勒夏特列原理
个反应是( 放 )热反应。
5,对于该反应,其他条件相同的情况下, 在一开始就使用催化剂后达到平衡和不使用催
化剂达到平衡,两者的主要区别是:前者达平 衡所需时间( 短 ),前者达平衡后反应速率 (较大)。
பைடு நூலகம்
色鹅掌造型的手掌认为很是经典但又露出一种隐约的英武,彪悍的淡黑色蜈蚣造型的手指好像十分愚笨又超脱。他笨拙的极似油条造型的腿好像十分冷酷酷野,细长的
极似竹节造型的脚确实相当与众不同稀有,他轻灵的极似海蜇造型的屁股仿佛真是神奇但又带着几分有趣!腰间一条,结实的白杏仁色鲇鱼造型的腰带好像极品的朦胧
温柔。这个散仙喘息时有种难听的雪白色油瓶一般的声音,得意时会散发出透出墨灰色萝卜般的气味。他笨拙的青古磁色圆规似的骨骼的确绝对的浪漫和恐怖,那种孤
如果改变影响平衡的一个条件(如浓度、 压强或温度等),平衡就向能够减弱这种改 变的方向移动。
1 适用范围:已达平衡的可逆反应。 2 适用条件:一个能影响化学平衡的外界条件 的变化。
对于一个已达平衡的可逆反应 如N2(g)+3H2(g) 2NH3(g)(正反应为放热反 应),如果既增大压强又升高温度,能不能用 勒夏特列原理判断出平衡究竟向哪个方向移动?
子模样的身材
优游 优游
练习:
在某温度时,A+B 2C的反应达到了平衡。 1,平衡时容器中A,B,C的物质的量分别为
1mol,2mol和3mol,则开始时,加入的A和B 的物质的量分别是(2.5mo)l 和(3.5mo)l 。
2,若A为气态,增加压强,A的平衡浓度增 大,则C一定是(气)态;B一定不是(气)态,
使用催化剂时,能不能用勒夏特列原理得出 平衡如何移动?为什么?
影响化学平衡的因素-温度、催化剂 勒夏特列原理(28张PPT) 课件 高二化学人教版选择性必修1
(2)从化学反应平衡常数角度解释:
不同温度下△H<0 的平衡常数
温度
623K
698K
763K
浓度平衡常数
66 .9
54.4
45.9
正反应为放热反应:升高温度使K减小,Q>K,
正反应为吸热反应:升高温度使K增大,Q<K,
平衡向逆反应方向(吸热方向)移动。
平衡向正反应方向(吸热方向)移动。
2.下列事实不能用勒夏特列原理解释的是( )A.用浓氨水和氢氧化钠固体快速制取氨气B.将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快C.黄绿色的氯水光照后颜色变浅D.将CO中毒的病人迅速抬到空气新鲜的地方
B
C
3. 对于下列化学平衡在一定条件下发生移动的描述,不正确的是( )A.Cl2+H2O HCl+HClO,氯水中加入碳酸钙,漂白性增强B.ZnS+Cu2+ CuS+Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
②保持容器容积不变,充入N2使体系压强增大 ③将容器的容积缩小一半 ④保持压强不变,充入N2使容器容积变大A.①② B.②③ C.①④ D.③④
5.在容积一定的密闭容器中,反应:A(?)+B(g) C(g)+D(g)达到平衡后,升高温度,容器内气体的密度增大,则下列说法正确的是( )A.正反应是放热反应B.A不是气态物质,加入A该平衡向正反应方向移动C.其他条件不变,降低温度该平衡向逆反应方向移动D.改变压强对该平衡的移动无影响
a使用催化剂
催化剂同步、等倍数改变v正和 v逆
结论:催化剂 使化学平衡发生移动; 改变反应混合物含量;但可以 达到平衡的时间。
不能
不
缩短
提醒 ①一般说的催化剂都是指的正催化剂,即可以加快反应速率。特殊情况下,也使用负催化剂,减慢反应速率。②用速率分析化学平衡移动的一般思路
第3讲勒夏特列原理的应用
勒夏特列原理的应用勒夏特列原理不仅适用于化学平衡体系,而且还适用于自然界中的一切动态平衡体系,高中阶段接触到的有四类动态平衡:化学平衡、溶解平衡、电离平衡和水解平衡。
只要理解平衡移动原理的含义,就可以熟练地应用于各平衡中。
这一知识点也是今后理综综合命题的热点。
一、常见四大平衡研究对象1.化学平衡:可逆反应。
如:N2+3H22NH3;△H<0高温不利于氨的生成,增大压强有利于氨的生成。
2.电离平衡:弱电解质。
如:CH3COOH H++CH3COO—;△H >0加热促进电离,稀释电离程度增大。
3.水解平衡:弱酸盐或弱碱盐或弱酸弱碱盐。
如:Fe3++3H2O Fe(OH)3+3H+;△H>0,配制Fe3+溶液应加入少量相应酸防止Fe3+水解。
不断加热FeCl3溶液,蒸干灼烧可得到Fe2O3固体。
4.溶解平衡:气体或固体溶于水形成的饱和溶液(1)气体的溶解平衡如:Cl2+H2O H++Cl—+HClO当加入NaCl、CaCO3等时平衡会发生移动。
当收集Cl2、SO2、CO2、H2S等气体时往往分别通过饱和的NaCl、NaHSO3、NaHCO3、NaHS等溶液以除去可能有的酸性气体,且抑制气体的溶解。
(2)固体的溶解平衡如:NaNO3(s) Na+( ag)+NO3—(ag);△H >0 加热促进溶解Ca(OH)2(s) Ca2+( ag)+2OH—( ag);△H<0加热溶解度降低MgCO3+H2O =Mg(OH)2↓+CO2↑反应的进行是由于MgCO3存在溶解平衡:MgCO3(s) Mg2+( ag)+CO32—( ag),CO32—能水解,加热时促进了CO32—的水解也促进了MgCO3的溶解,最终MgCO3转化成Mg(OH)2。
二、勒夏特列原理在四大平衡中的应用1. 在化学平衡中的应用事例1:对于合成氨工业,采用的适宜条件是(1)增大氢气、氮气浓度,及时将氨气分离出来;(2)温度为500℃的高温;(3)压强为20MPa~50MPa;(4)使用铁作催化剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
合成氨工业:
N2+3H2
2NH3
接触法制硫酸:
2SO2+O2
2SO3
课堂小结
平衡状态的判断
平衡影响因素的归类
平衡移动方向的分析
概念辨析
勒夏特列原理 实际应用
对生活现象、生产措施的解释
返回
你们将来可能不再学习化学, 你们将来可能会把在化学课上学 习的一切化学现象都忘记,但是, 无论如何,请你们不要忘记勒夏特 列原理。
A.NH3的生成速率与NH3的分解速率相等 B.单位时间内生成nmolN2同时生成3nmolH2 C.N2、H2、NH3的浓度不再发生变化 D.N2、H2、NH3的分子数之比为1:3:2 E.N2的转化率保持一定 F.单位时间内有一个N≡N键断裂的同时,有3个
H-H键生成
G.υ正( N2)=υ逆( NH3 )
化学之美不仅美在其外,更深藏于内。化学原 理、定律用高度简练、概括、准确的语言,揭 示了大自然中纷繁复杂的物质变化。这种高 度凝炼的简约之美,充分体现了理性的、智慧 的化学思想。
(1) 守恒思想
(2平衡思想
——勒夏特列原理
泛化的勒夏特列原理不仅可以用来解释化学平衡移动的
问题,还可以解释物理学中的牛顿第三定律及楞次定律,生 物学上害虫的“抗药性”问题;甚至有人说,人类的情绪也 符合勒夏特列原理——你有一个快乐的系统,你若使之不快 乐,它会自己找回快乐。(if you have a happy
system, and you make it unhappy, it will try to make itself happy again.)
v
v正 v逆 平衡状态判断的标志:
1、正逆反应速率相等
A
T 2、反应混合物中各组分
•正反应吸热 的浓度保持不变
C%
3、反应从正向开始,生成
物含量最大时;反应从逆
向开始,反应物百分含量
B
T 最大时
•正反应放热
【例1】在一定温度下,某密闭容器中可逆反
应N2(g)+3H2(g) ⇌ 2NH3(g)达到平衡的标志是 ( A、C、E、F、H )
涉及的平衡
CO2(aq)
CO2(g)
用热的纯碱水溶液洗油腻:
CO3 2-+ H2O
HCO3- + OH-
配制三氯化铁溶液在浓盐酸中进行: Fe3++3H2O
Fe3++3H+
草木灰和铵态氮肥不能混合使用:
NH4++ H2O CO3 2-+ H2O
金属钠从熔化的氯化钾中置换金属钾: Na + KCl
NH3·H2O + H+ HCO3- + OH-
同 温度
程 催化剂
适用勒夏特列原理
度
相 气体体积不变的
同 反应改变压强
(V正=V逆)
改变固体或纯液体的量 平衡不移动
速率不变 无气体参与的反应改变 压强
恒温恒容条件下充惰气
不适用勒夏 特列原理
在一定条件下,二氧化硫和氧气发生如 下反应: 2SO2(g)+O2(g) 2SO3(g);ΔH<0 (1)降低温度, 二氧化硫转化率 __________,化学反应速率_________ (以上均填增大、减小或不变) (2)据图判断,反应进行至20min时, 曲线发生变化的原因是(用文字表达)
【例3】不能用勒夏特列原理解释的是
.
A.红棕色的二氧化氮加压后颜色先变深后变浅
B.由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后
颜色变深
C.黄绿色的氯水光照后颜色变浅
D.煅烧粉碎的硫铁矿有利于SO2的生成 E.可用浓氨水和氢氧化钠固体快速制取氨气
F.用排饱和食盐水法收集Cl2 G.温度控制在500℃有利于合成氨反应
____________________________ (3)10min到15min的曲线变化的原因 可能是 ( ) a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
返回
在容器中发生如下反应:mA(g)+nB(g)
pC(g)+qD(g),请根据图象
判断反应为吸热反应还是放热反应?
H.2υ正(H2)=3υ逆( NH3 )
返回
【例2】t℃,在1L密闭容器中加入1mol PCl5后,
反应PCl5(g) ⇌ PCl3(g)+ Cl2(g),达到平衡,
向平衡体系中再加入1mol PCl5反应物时,以下选
项正确的是(
)
A、PCl5的转化率增大 B、PCl5的转化率减少 C、PCl3的物质的量大于原平衡的2倍 D、PCl3的物质的量大于原平衡小于原平衡的 2倍
——L. C.鲍林
实际应用
1、当人体吸入较多的CO时,就会引起CO中毒,这是由 于CO跟血液里的血红蛋白结合,使血红蛋白不能很好的 跟O2结合,人因缺氧而窒息,甚至死亡。这个反应可表 示如下:血红蛋白—O2+CO 血红蛋白—CO + O2, 运用化学平衡理论,简述抢救CO中毒患者时应采取哪些 措施?
勒夏特列原理及其应用
勒夏特列原 理: 如果改变影响平衡的一个条件(如
浓度、压强或温度等),平衡就向能够 减弱这种改变的方向移动。
思考:如何理解这个原理?抓住哪 些关键词?
这一理解至少包含着如下要点:
1、勒夏特列原理对维持化学平衡状态的因素的改变才是有效 的,若改变的不是维持化学平衡状态的因素,无效。
H.向含Fe(SCN)3的黄色水溶液中加入少量硫氰化钾固体 可使颜色变深
思考与讨 论
请同学们尽可能多的举出你所知道的 生活中或工农业生产过程中涉及勒夏特列 原理应用的具体例子。
提示:
勒夏特列原理不仅仅适用于化学平衡体系,它也可 以适用于其他平衡体系,如溶解平衡、电离平衡、水解平 衡等。
生产生活实例 打开可乐有大量气体:
2、 勒夏特列原理对达成化学平衡状态的系统才是有效的, 若系统没有达成化学平衡状态,无效。
3、勒夏特列原理要求只改变一个条件。若同时改变多个条 件,当他们对平衡的影响不一致时,则平衡移动的方向在高 中阶段无法直接判断。 4、勒夏特列原理明确指出了平衡移动的方向和平衡移动 的程度:它能并且只能“减弱”这种改变,而不能“抵消” 或“逆转”这种改变
2、牙齿的损坏就是牙釉质[Ca5(PO4)3OH]溶解的结果。 在口腔中存在着如下平衡:
Ca5(PO4)3OH ⇌ 5Ca2++3PO43-+OH— 当糖附着在齿上发酵时,会产生H+,试运用化学平衡 理论说明经常吃甜食对牙齿的影响
返回
速率改变
改 变 因 素
程 度 不
浓度 压强(不等体)
(V正≠V逆) 平衡移动
