高一化学新人教版同步精讲必修1第31讲卤族元素
高一化学新人教版同步精讲必修1第31讲卤族元素

第31讲卤族元素一、卤族元素概述1. 定义卤族元素为第VIIA族的元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)。
2. 原子结构3. 相似性与递变性下载最新免费模拟卷,到公众号:一枚试卷君①相似性:最外层电子数都是_____,容易______一个电子。
②递变性:随着核电荷数逐渐增大,电子层数逐渐________,原子半径逐渐________。
【答案】7 得到增多增大增多增大二、卤素的物理性质都有颜色,有毒,在水中溶解度不大。
2.递变性随着核电荷数逐渐增大,颜色逐渐加深,熔、沸点逐渐______,密度逐渐______。
【答案】升高增大三、卤素单质的化学性质1.与氢气反应H2+I22HI①与氢气反应的难易程度:_________________2. 卤素单质间的置换反应22222I2Cl2>Br2>I2 I->Br->Cl-3. 卤素单质与水反应①卤素单质与水发生的反应可用通式表示:X2 + H2O === HX + HXO(X表示Cl、Br、I)②F2与水反应的化学方程式为:2F2+ 2H2O=== 4HF + O2四、卤素化学性质递变性的微观解释核电荷数减少→电子层数减少→对电子引力增强→越容易得到电子→元素的非金属性增强→单质的氧化性增强。
五、元素非金属性强弱的判断方法1. 与H2化合越_______,非金属性越强。
2. 与H2生成的气态氢化物越_______,非金属性越强。
3. _______氧化物对应水化物的酸性越_____,非金属性越强。
4. 单质氧化性越______或阴离子还原性越______,非金属性越强。
【答案】容易稳定最高价强强弱题型一:卤素单质的结构与性质【例1】(2021·莎车县第一中学高一期中)氯、溴、碘单质的化学性质相似,主要原因是( ) A.单质均有颜色B.均为双原子分子C.原子最外层电子数均为7D.均为非金属元素【答案】C【解析】A项,单质均有颜色,属于物质的性质,故A不符;B项,均为双原子分子,属于物质的组成,故B不符;C项,原子最外层电子数均为7,属于物质结构,结构上有相似,决定了氯、溴、碘单质的化学性质相似,故C符合;D项,均为非金属元素,属于物质的组成,故D不符;故选C。
高一化学卤族元素.doc

第二节卤族元素Ⅰ.学习重点:1.掌握卤族元素性质变化的规律2.了解可逆反应的涵义3.掌握卤离子的检验方法4.了解卤化银的性质、用途及碘与人体健康的有关知识Ⅱ.学习难点:卤族元素的性质比较及变化规律Ⅲ.训练习题一、选择题1.卤族元素随核电荷数的增加,下列叙述正确的是()A.单质的颜色逐渐加深 B.气态氢化物的稳定性逐渐增强C.单质的熔点逐渐升高 D.单质的氧化性逐渐增强2.砹(At)是卤素中核电荷数最多的元素,推测砹或砹的化合物下列性质错误的是()A.砹为有色固体 B.HAt很稳定C.AgAt不溶于水 D.砹单质熔沸点比碘单质熔沸点高3.按元素核电荷数递增的顺序,下列各项递变逐渐减弱或减小的是()A.卤素单质的氧化性 B.卤素阴离子的半径C.卤素阴离子的还原性 D.卤化氢的稳定性4.不能将溴水、碘水中的溴、碘萃取出来的溶剂是()A.四氯化碳 B.直馏汽油 C.酒精 D.苯5.溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,能与许多非金属单质反应生成相应卤化物,能与水反应等。
其与水反应的方程式为IBr+H2O HBr+HIO 下列关于IBr的叙述中不正确的是()A.IBr是一种有色物质B.在许多反应中IBr是强氧化剂C.在IBr与水的反应中,它既是氧化剂又是还原剂D.与NaOH溶液反应生成NaIO6.能用加热方法除去下列物质中括号内的杂质的是()A.KClO3(MnO2) B.Na2CO3(NaHCO3)C.NaCl(KCl) D.KI(I2)7.在甲、乙、丙三种溶液中各含一种卤素离子,往甲中加淀粉和氯水,则溶液变蓝色,再往丙中加淀粉和氯水,无明显现象。
则甲、乙、丙依次含有()A.Br-、I-、Cl- B.Cl-、I-、Br-C.I-、Br-、Cl- D.Br-、Cl-、I-8.向含有NaBr、KI的溶液中通入过量的Cl2,然后将溶液蒸干,并灼烧固体,最后得到的物质是()A.KCl B.NaCl和KCl C.NaCl和KBr D.NaCl、KCl和I2 9.鉴别NaCl、NaBr、NaI三种溶液可以选用的试剂是()A.碘水、淀粉溶液 B.溴水、汽油C.氯水、四氯化碳 D.硝酸银溶液、稀硝酸10.下列方法可用于制备卤化氢气体的是()A.NaCl与浓HNO3加热热制备HClB.CaF2与浓H2SO4加热制备HFC.NaBr与浓H3PO4加热制备HBrD.NaI与浓H2SO4加热制备HI11.取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是()A.1:1:2 B.2:1:3 C.6:3:2 D.3:2:112.氟化氢水溶液叫氢氟酸,它应贮存在()A.玻璃瓶中 B.铅容器中 C.瓷瓶中 D.塑料瓶中13.某溶液中Cl-、Br-、I-三者物质的量之比是1:2:3,通入一定量的Cl2,当反应完成后,该比值变为3:2:1,则反应的Cl2与原溶液中I-的物质的量之比是()A.1:2 B.1:3 C.1:4 D.1:614.下列各组溶液不用其他试剂,就可以将它们区别开的是()A.盐酸、NaOH、Na2CO3、Na2SO4B.盐酸、AgNO3、NaOH、NaNO3C.NaOH、MgSO4、Na2CO3、NaHSO4D.BaCl2、Na2SO4、CaCl2、Ca(NO3)215.为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。
高一化学同步精美课件(人教版2019必修第一册)415卤族元素

一定条件
3F2+Xe ======= XeF6
2F2+2H2O=4HF+O2
③HF是弱酸,有毒;能腐蚀玻璃,保存在铅制器皿或塑料瓶中; 在HX中HF沸点最高。 (HF常温下为液态)
④AgF易溶于水,CaF2(萤石)难溶。 HF的制备: CaF2 +H2SO4(浓) = CaSO4 + 2HF↑
[补充]:卤素单质及其化合物的特性 (2)溴
2. 溴化银(AgBr)被用于制作感光胶卷和变色玻璃。
感光胶卷
变色眼镜
3. 碘化银(AgⅠ)被用于人工降雨
B 1.下列说法不正确的是( )
A√.HBr比HCl的还原性强 还原性:F-> Cl- > Br- > IB×.卤素是较强的非金属元素,故其单质只有氧化性
Cl2 + H2O = HCl + HClO,Cl元素既体现出氧化性,也体现出还原性
① I2遇淀粉变蓝色 (用于鉴定I2的存在)
②I2易升华(可用来分离I2与沙子、食盐晶体等) ③ I2易溶于有机溶剂。
④食盐中加入KIO3可防治甲状腺肿大。
I2和河沙
加热法:分离提纯碘
卤素单质及其化合物的用途
1. 碘单质(I2)被用于制作碘酊(别名:碘酒) 用于一般皮肤消毒和手术前手术局部皮肤的消毒 。
C√.碘难溶于水,易溶于有机溶剂 D√.碘单质能使湿润的碘化钾淀粉试纸变蓝
C 2.下列关于卤素(用X表示)的叙述中,正确的是( )
A.卤素单质都可与水反应生成相应的无氧酸和含氧酸 B.HX的热稳定性随卤素核电荷数增加而增强 C.少量Cl2通入到NaBr和NaI的混合溶液中,Cl2优先氧化ID.X-的还原性依次为F->Cl->Br->I-
高三化学 卤族元素复习 知识精讲 人教版
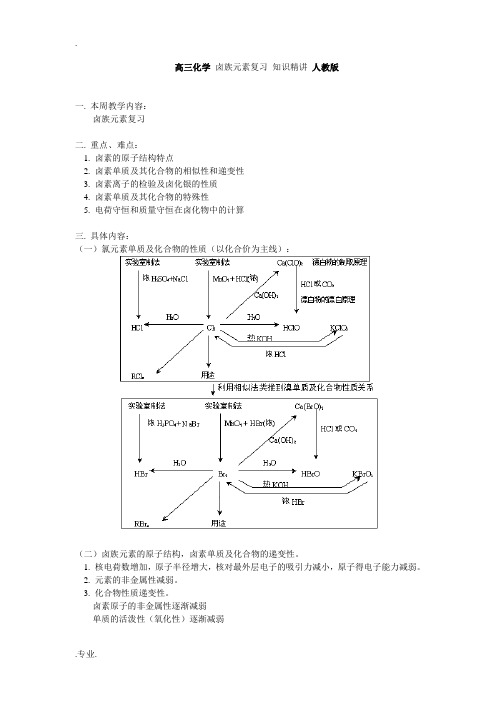
高三化学卤族元素复习知识精讲人教版一. 本周教学内容:卤族元素复习二. 重点、难点:1. 卤素的原子结构特点2. 卤素单质及其化合物的相似性和递变性3. 卤素离子的检验及卤化银的性质4. 卤素单质及其化合物的特殊性5. 电荷守恒和质量守恒在卤化物中的计算三. 具体内容:(一)氯元素单质及化合物的性质(以化合价为主线):(二)卤族元素的原子结构,卤素单质及化合物的递变性。
1. 核电荷数增加,原子半径增大,核对最外层电子的吸引力减小,原子得电子能力减弱。
2. 元素的非金属性减弱。
3. 化合物性质递变性。
卤素原子的非金属性逐渐减弱单质的活泼性(氧化性)逐渐减弱实验事实 ⎩⎨⎧单质间的相互置换化合的难易程度与.2.12H(三)卤素单质的共性和特性1. 卤素常见的化合价有1-、+1、+3、+5、+7 几种,但F 只有1-价,并无正价,因为F 是最活泼的非金属。
2 卤素的单质都能跟水反应,常温一般生成HX 和HXO ,但F 2跟H 2O 反应生成HF 和O 2。
3. 卤素单质一般不跟稀有气体起反应,但氟却能跟跟氙、氪等起反应,生成氟化物。
4. 卤素单质一般不跟淀粉发生显色反应,但碘遇淀粉变蓝色,这是碘的特性。
5. 卤化氢都极易溶于水,形成对应HX 溶液,且酸性按HF 、HCl 、HBr 、HI 的顺序依次增强,其中HCl 、HBr 、HI 均是一元强酸,但HF 的稀溶液却是一种弱酸。
6. 卤族元素中的Cl 、Br 、I 的含氧酸有HXO 、HXO 2 、HXO 3、 HXO 4,但F 却没有对应的含氧酸。
7. 卤化银一般是难溶的物质 ,且溶解性按AgF →AgI 的顺序依次减小,但唯有AgF 是易溶于水的;CaCl 2、CaBr 2、CaI 2都能溶于水,但唯有CaF 2难溶。
(四)用氧化还原反应的理论加深对卤素单质及化合物性质的理解1. 对卤素单质间的置换以及卤素与单质Fe 反应后铁的价态问题:一般情况下,有氧化性强弱关系:氧化态 F 2 > Cl 2 > Br 2 > Fe 3+ > I 2 > Fe 2+还原态 F - Cl - Br - Fe 2+ I -Fe由此可见:F 2、Cl 2、Br 2均能将Fe 2+ 氧化成Fe 3+,而I 2则不能氧化Fe 2+。
高一化学卤素人教版知识精讲

高一化学卤素人教版【同步教育信息】一. 本周教学内容:卤素二. 教学目标:1. 卤素结构的相似点和递变性。
2. 卤素单质的物理性质。
3. 卤素单质的化学性质及递变性。
4. 卤化银和含碘化合物的主要性质。
5. 了解可逆反应的含义。
三. 教学重点、难点:重点:卤素性质变化规律。
难点:可逆反应的涵义。
−得电子能力减弱−→−−−−−−−→−单质氧化性减弱−−−−−→−阴离子还原性增强(二)卤素单质的物理性质:2F2Cl2Br 2I 状态(熔沸点)气气 液 固熔沸点升高颜色 浅黄绿色 黄绿色 深红棕色 紫黑色 颜色加深 密度 密度增大水中溶解度 反应 溶解 溶解 微溶 在水中溶解度减小说明:1. 卤素单质在不同溶剂的颜色:2. 液溴的保存:由于液溴极易挥发,具有强腐蚀性,因而实验室通常将液溴装入磨砂玻璃塞的试剂瓶,并加入一定量水。
3. 碘的升华:固态物质不经液态而直接变成气态的现象。
四. 卤素单质的化学性质:1. 卤素都能与金属反应生成金属卤化物。
NaF Na F 222=+32223FeF Fe F =+NaCl Na Cl 222点燃+32223FeCl Fe Cl ∆+NaBr Na Br 222∆+32223FeBr FeBr ∆+NaI Na I 222=+222I Fe FeI +∆+说明:(1)这些反应均是卤素单质得电子,表现氧化性。
(2)2I 的氧化性最弱,只能将Fe 氧化为2+价。
(3)自然界里,也存在着许多的金属跟卤素的化合物,如氟化钙、氯化钠、氯化镁、(2)2F 、2Cl 、2Br 、2I 与2H 反应条件越来越严格,剧烈程度越来越差。
(3)卤化氢的稳定性:HI HBr HCl HF >>> (4)氢卤酸的酸性:HI HBr HCl HF <<< (5)还原性:HI HBr HCl HF <<< 3. 卤素与水及碱的反应:222422O HF O H F +=+)(22I Br Cl X HXO HX O H X 、、=+=+)(222I Br Cl X O H NaXO NaX NaOH X 、、=++=+总结:卤素单质的非金属性(氧化性、活动性):2222I Br Cl F >>>4. 卤化银:(1)---I Br Cl 、、的鉴定:未知溶液⎪⎪⎩⎪⎪⎨⎧−−→−↓−−→−↓−−→−↓−−−→−---+I Br Cl HNO HNO HNO AgNO 不溶:则含黄色不溶:则含浅黄色不溶:则含白稀稀稀3333 (2)卤化银的性质:① 既不溶于水,也不溶于酸(AgF 除外)② 都有感光性:在光照条件下会发生分解。
4.2.1卤族元素课件高一上学期化学人教版

即学即练2
1、随着卤族元素原子序数递增,下列说法正确的是( B)
A.单质的熔、沸点逐渐降低 B.最高价氧化物对应水化物的酸性逐渐减弱(F除外) C.单质的氧化性逐渐增强 D.气态氢化物的稳定性逐渐增强
2、下列对卤素的说法不符合递变规律的是( D )
A.F2、Cl2、Br2、I2的氧化性逐渐减弱 HCl、HBr、HI的热稳定性逐渐减弱
结论
①与H2反应的难易程度:越来越 困难 ②生成气态氢化物的稳定性:依次 减弱 ③与H2反应所需要的条件:逐渐 升高 ④与H2反应剧烈程度:逐渐 减弱 ⑤卤素的非金属性强弱:F>Cl>Br>I)
卤化氢
1、物理性质: 卤化氢均为无色有刺激性气味的气体,易溶于水,易挥发 与空气中水蒸气结合形成白雾
2、氢化物三大性质比较 ①热稳定性:HF>HCl>HBr>HI ②酸性:HF(弱)<HCl<HBr<HI ③还原性:HF<HCl<HBr<HI
变规律,对砹及其化合物的叙述,正确的是 ( C )
A.与H2化合能力:At2>I2 B.砹在常温下为白色固体
C.砹原子的最外电子层上有7个电子
D.砹能从NaCl溶液中置换出氯单质
五、卤素及其化合物的特性 氟 ①无正价,无含氧酸,氧化性最强,F-的还原性最弱
②2F2+2H2O===4HF+O2; ③与H2反应在暗处即爆炸 ④HF是弱酸,腐蚀玻璃,应保存在铅制器皿或塑料瓶中,有毒
4、KIO3碘酸钾:加碘盐的配料,受热时易分解
课后作业
1、卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的
原因是( D )
A.原子核内质子数增多起主要作用 B.相对原子质量逐渐增大起主要作用 C.其单质的密度增大起主要作用 D.随着核电荷数增加电子层数增大起主要作用
高一化学《卤族元素》知识点解读
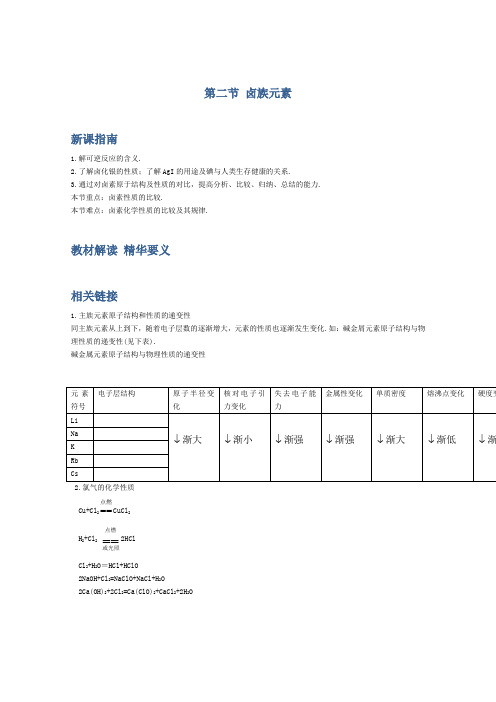
第二节 卤族元素新课指南1.解可逆反应的含义.2.了解卤化银的性质;了解AgI 的用途及碘与人类生存健康的关系.3.通过对卤素原于结构及性质的对比,提高分析、比较、归纳、总结的能力. 本节重点:卤素性质的比较.本节难点:卤素化学性质的比较及其规律.教材解读 精华要义相关链接1.主族元素原子结构和性质的递变性同主族元素从上到下,随着电子层数的逐渐增大,元素的性质也逐渐发生变化.如:碱金屑元素原子结构与物理性质的递变性(见下表).碱金属元素原子结构与物理性质的递变性2.氯气的化学性质 Cu+Cl 2点燃==CuCl 2H 2+Cl 2==点燃或光照2HClCl 2+H 2O =HCl+HClO 2NaOH+Cl 2=NaClO+NaCl+H 2O 2Ca(OH)2+2Cl 2=Ca(ClO)2+CaCl 2+2H 2O知识详解知识点1 卤族元素简介Ⅰ卤族元素的概念氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)五种元素统称为卤族元素,简称卤素(其中砹具有放射性,不稳定,中学化学不作要求).Ⅱ卤族元素的原子结构(1)氟、氯、溴、碘的原子结构示意图为:由卤族元素原子结构示意图可知,卤族元素的原子结构有如下显著特点:F Cl Br I———————→原子的核电荷数逐渐增大原子核外电子层数逐渐增大原子核外最外电子层电子数均为7(2)卤族元素的原子半径大小关系如图4-18所示:由图4-18所示可知,卤族元素原子半径变化的规律为:F Cl Br I———————→原子的核电荷数逐渐增大原子半径逐渐增大(3)由于原子结构决定了元素的性质,卤素原子的最外层都是7个电子,很容易得到1个电子而形成最外层为8个电子的稳定结构,所以卤族元素的性质具有一定的相似性.又由于从氟到碘,卤素原子半径逐渐变大,所以卤素的性质按氟、氯、溴、碘的顺序也将逐渐变化,即具有递变性.同时,由于卤素的原子结构各不相同,故其性质又具有各自的特殊性.知识点2 卤紊单质的物理性质(重点、难点)卤素单质的物理性质Cl2 黄绿色气体 3.214g/L -101 -34.6 226cm3 有Br2 深红棕色液体 3.119g/cm3 -7.2 58.78 4.16g 有I2 紫黑色固体 4.93g/cm3 113.5 184.4 0.029g 有Ⅰ相似性卤素单质都有颜色,都有毒,都不易溶于水(F2与水反应),都易溶于苯、四氯化碳等有机溶剂.Ⅱ递变性卤素单质物理性质的递变性见下表.卤素单质物理性质的递变性单质颜色变化密度变化熔点变化沸点变化溶解度变F2↓渐深↓渐大↓渐高↓渐高↓渐小Cl2Br2I2【注意】①在描述性质变化时,要注意程度副词:渐深、渐浅、渐小、渐高、渐低的选择.即颜色用深、浅,密度用大、小,温度用高、低,性质用强、弱.②对表中的内容要用心阅读、区别对待.如颜色、状态、毒性等要牢记,对有关数据作一般了解,不要死记.Ⅲ特殊性(1)单质颜色不同在常见的气体中,大多数是无色的.F2淡黄绿色、Cl2黄绿色、Br2(蒸气)红棕色、I2(蒸气)紫色是卤素单质气体的颜色特征.与Br2(蒸气)颜色相近的气体,在中学化学里还有NO2.固态I2的颜色为紫黑色,在中学化学里常见的化学试剂中,颜色为紫黑色的还有固态KMnO4.卤素单质在各种不同的溶剂中,颜色各不相同(见下表):卤素单质在不同溶剂中的颜色水中CCl4汽油C2H5OH F2强烈反应反应反应反应Cl2黄绿色黄绿色黄绿色黄绿色Br2黄→橙橙→橙红橙→橙红橙→橙红I2深黄→褐紫→深紫浅紫红→紫红褐色【注意】此表从左向右表示(浓度小的颜色)→(浓度大的颜色),只作一般了解,记住溴水一般为橙色,碘水一般为深黄色,在有机溶剂中,其颜色一般变深,接近单质颜色.(2)溴的状态特殊观察溴的颜色和状态,纯溴为深红棕色液体,易挥发,具有较强的腐蚀性.所以溴通常保存在棕色细口瓶中(如图4-19所示),加水封,用玻璃塞(严禁用橡胶塞)塞紧瓶口,放置冷暗处.必要时可用石蜡封口.[说明] ①在常温下,非金属单质只有溴为液态,金属单质只有汞为液态.②取用液溴时,可将胶头滴管伸入纯溴层中,再挤压胶头,将液溴吸出,不能用倾倒的办法,因为这样只能倒出溴水.(3)碘的升华实验4-7:碘的升华实验实验目的:探究碘的升华现象.实验原理:I2(s) ∆=I2(g).实验用品:如图4-20所示.实验步骤:按图4-20所示的方法。
人教高中化学第一册必修卤族元素课件(通用)

素
写:A+ + B- + H+ + OH- = AOH + HB
元
除ICl外,Mg3N2、CaC2、NaH、Al2S3、
素
CH3COONa等水解均遵循该“规律”。
性 质
不要认为Cl2跟水发生歧化反应,有电子 转移,卤素互化物与水反应也一定是氧化 还原反应,水解反应的实质是水电离出H+
比
与显负价的原子或原子团结合,水电离出
元 素
在第④步操作中用稀硫酸浸洗银时,是除去银里的少量
铁,I2单质易升华,易溶于有机溶剂(如酒精、四氯化碳 等),提纯I2可用升华和萃取的方法。单质淀粉遇I2的水
性 溶液显蓝色,这是检验I2的常用方法(也是检验淀粉的常
质
用方法)。AgI的稳定性较差,见光分解生成单质银和碘 。
比 【答案】(1)FeI2 FeCl3 (2) C (3)升华 (4)将碘加在淀粉
较
OH-与显正价的原子或原子团结合。
【例 2】( 1 9 9 7 年 全 国 高 考 题 ) 为 实 现 中 国
2000年消除碘缺乏病的目标,卫生部规定食
卤 素 元
盐 存 IO必在3-+须。5I加已-+6碘知H,在+=其3溶I2中液+3的中H碘2IOO以。3-碘可根酸据和钾此I-发(反K生应IO反,3)应形可:用式 试纸和一些生活中常见的物质进行实验,证
质 AgBr 188
11.1
比 较
154.6
11.1/33.4=1/n,n=3
Agcl 143.5 33.4
得n=3
解法二:守恒法
卤
AgBr、AgCl共15.46 g,则4.66g BrCln可结合 Ag+为:15.46-4.66=10.8 g,即0.1mol,有
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第31讲卤族元素一、卤族元素概述1. 定义卤族元素为第VIIA族的元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)。
2. 原子结构3. 相似性与递变性①相似性:最外层电子数都是_____,容易______一个电子。
②递变性:随着核电荷数逐渐增大,电子层数逐渐________,原子半径逐渐________。
【答案】7 得到增多增大增多增大二、卤素的物理性质都有颜色,有毒,在水中溶解度不大。
2.递变性随着核电荷数逐渐增大,颜色逐渐加深,熔、沸点逐渐______,密度逐渐______。
【答案】升高增大三、卤素单质的化学性质1.与氢气反应H2+I22HI①与氢气反应的难易程度:_________________2. 卤素单质间的置换反应22222I2Cl2>Br2>I2 I->Br->Cl-3. 卤素单质与水反应①卤素单质与水发生的反应可用通式表示:X2 + H2O === HX + HXO(X表示Cl、Br、I)②F2与水反应的化学方程式为:2F2+ 2H2O=== 4HF + O2四、卤素化学性质递变性的微观解释核电荷数减少→电子层数减少→对电子引力增强→越容易得到电子→元素的非金属性增强→单质的氧化性增强。
五、元素非金属性强弱的判断方法1. 与H2化合越_______,非金属性越强。
2. 与H2生成的气态氢化物越_______,非金属性越强。
3. _______氧化物对应水化物的酸性越_____,非金属性越强。
4. 单质氧化性越______或阴离子还原性越______,非金属性越强。
【答案】容易稳定最高价强强弱题型一:卤素单质的结构与性质【例1】(2021·莎车县第一中学高一期中)氯、溴、碘单质的化学性质相似,主要原因是( ) A.单质均有颜色B.均为双原子分子C.原子最外层电子数均为7D.均为非金属元素【答案】C【解析】A项,单质均有颜色,属于物质的性质,故A不符;B项,均为双原子分子,属于物质的组成,故B不符;C项,原子最外层电子数均为7,属于物质结构,结构上有相似,决定了氯、溴、碘单质的化学性质相似,故C符合;D项,均为非金属元素,属于物质的组成,故D不符;故选C。
题型二:卤素单质及化合物的性质【例4】(2021·广东华侨中学高一期中)已知卤素单质的氧化性强弱为F2>Cl2>Br2>I2,排在前面的卤素单质可将排在后面的卤素从它的盐溶液中置换出来,如Cl2+2NaBr=2NaCl+Br2。
下列说法或化学方程式不成立的是A.Cl2与I-在水溶液中不能大量共存B.2NaF+I2=2NaI+F2C.还原性:Cl-<Br-<I-D.少量Cl2通入到NaBr和NaI的混合溶液中,Cl2优先氧化I-【答案】B【详解】A.由氧化性:Cl2>I2可知,Cl2与I-在水溶液中会发生反应生成I2和Cl-,不能大量共存,A正确;B.由氧化性:F2>I2可知,2NaF+I2=2NaI+F2不能发生,B错误;C.单质的氧化性越强,对应阴离子的还原性越弱,由氧化性:F2>Cl2>Br2>I2可知,还原性:Cl-<Br-<I-,C正确;D.少量Cl2通入到NaBr和NaI的混合溶液中,由于还原性:Br-<I-,Cl2优先氧化I-,再氧化Br-,D正确;故选B。
【例5】某学生往一支试管里按一定次序分别加入下列几种物质:A.KI溶液B.淀粉溶液C.NaOH溶液D.氯水,发现溶液颜色按下面次序变化:℃无色→℃棕黄色→℃蓝色→℃无色。
依据溶液颜色的变化回答下列问题:(1)加入以上药品的顺序是___________________________________________________(2)写出℃→℃的离子反应方程式:_____________________________________________(3)写出℃→℃的化学反应方程式:_____________________________________________【答案】(1)A、D、B、C(2)2I-+Cl2===I2+2Cl-(3)3I2+6NaOH===5NaI+NaIO3+3H2O题型三:类卤化合物/拟卤素的性质【变6-2】(2021·全国·高三专题练习)BrCl是一种卤素互化物,与Cl2性质相似,也能与水或碱溶液反应。
下列说法正确的是A.BrCl与水反应生成HBrO和HCl,该反应属于氧化还原反应B.1molBrCl与KBr溶液完全反应时转移的电子为1molC.BrCl可与Cl2反应得到Br2D.BrCl与稀氢氧化钠溶液反应可生成NaBr和NaClO【答案】B【详解】A.BrCl+H2O =HBrO+HCl,反应中化合价无变化,因此该反应属于非氧化还原反应,故A错误;B.BrCl+KBr=KCl+Br2,BrCl中Br化合价降低1个价态变为Br2,因此1mol BrCl与KBr 溶液完全反应时转移的电子为1mol,故B正确;C.Cl2氧化性比BrCl氧化性强,因此BrCl不与Cl2反应,故C错误;D.BrCl中Br为+1价,因此BrCl与稀氢氧化钠溶液反应可生成NaCl和NaBrO,故D错误。
综上所述,答案为B。
【变7-1】(2021·全国·高三专题练习)(CN)2、(OCN)2、(SCN)2等化合物的性质与卤素单质相似,称为“类卤素”。
已知卤素单质和“类卤素”的氧化性由强到弱的顺序为:F2、(OCN)2、Cl2、Br2、(CN)2、(SCN)2、I2。
下列叙述正确的是()A.反应I2+2SCN-=2I-+(SCN)2能自发进行B.反应Cl2+2CN-=2Cl-+(CN)2不能自发进行C.还原性:F-<OCN-<Br-<SCN-D.“类卤素”在碱性溶液中不能发生自身的氧化还原反应【答案】C【详解】在氧化还原反应中,氧化剂的氧化性强于氧化产物;A.根据I2+2SCN-=2I-+(SCN)2可知氧化性I2强于(SCN)2,由信息可知,氧化性(SCN)2强于I2,所以该反应不能自发进行,故A错误;B.Cl2+2CN-=2Cl-+(CN)2可知,氧化性Cl2强于(CN)2,与信息一致,所以该反应可以自发进行,故B错误;C.氧化性越强,则其对应的还原产物的还原性越弱,氧化性由强到弱为F2、(OCN)2、Br2、(SCN)2,所以还原性为F-<OCN-<Br-<SCN-,故C正确;D.卤素在氢氧化钠溶液中会发生X2+2OH-=X-+XO-+H2O(X为Cl、Br和I),该反应为氧化还原反应,由此可知,类卤素具有相似的性质,即在碱性溶液中发生自身氧化还原反应,故D错误;故答案为:C。
题型四:元素非金属性强弱的判断【变8-1】(2021·安徽省蚌埠第三中学高一月考)下列有关叙述中,能说明非金属元素M比N的非金属性强的是A.非金属单质N能从M的化合物中置换出非金属单质MB.M 原子比N原子容易得到电子C.气态氢化物水溶液的酸性H m M>H n ND.氧化物水化物的酸性H m MO x>H n NO y【答案】B【分析】M为非金属元素,且M的主要化合价为+3价,则M为B元素。
【详解】A.非金属单质N能从M的化合物中置换出非金属单质M,则氧化性N>M,说明非金属性N强于M,A项不选;B.M原子比N原子容易得到电子,说明非金属性M强于N,B项选;C.非金属性强弱与氢化物的酸性没有关系,C项不选;D.H m MO x和H n NO y,不一定是最高价含氧酸,不能比较非金属性强弱,D项不选;答案选B。
【变8-2】(2021·全国·高一课时练习)下列有关叙述:①非金属单质M能从N的化合物中置换出非金属单质N;②M原子比N原子容易得到电子;③单质M跟H2反应比N跟H2反应容易得多;④气态氢化物水溶液的酸性H m M>H n N;⑤氧化物对应水化物的酸性H m MO x >H n NO y;⑥熔点M>N,能说明M比N的非金属性强的是()A.①②③B.②⑤C.①②③④⑤D.全部【答案】A【详解】①根据非金属单质间的置换反应可推断M比N的非金属性强,①正确;②根据得电子的难易程度可以推断M比N的非金属性强,②正确;③根据单质与H2反应的难易程度可以推断M比N的非金属性强,③正确;④根据气态氢化物水溶液的酸性不能推断M、N的非金属性强弱,如元素的非金属性:O>S,但水为中性物质,H2S的水溶液显酸性,④错误;⑤如果不是元素最高价氧化物对应的水化物的酸性,则不能推断M、N的非金属性强弱,⑤错误;⑥熔点属于物理性质,其高低与物质化学性质无关,不能用于比较元素非金属性的强弱,⑥错误;综合分析可知:能够证明元素非金属性强弱的依据是①②③,故合理选项是A。
题型五:卤素的综合实验【例10】某学生做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象。
请你帮助该学生整理并完成实验报告。
(1)实验目的:____________________________________________________。
(2)实验用品:仪器:①________;②________(请填写两种主要玻璃仪器)。
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳。
(3)实验内容:(5)问题和讨论:同一主族元素,自上而下,元素原子的电子层数增多,原子半径________,原子核对最外层电子的吸引力逐渐________。
【答案】(1)探究同一主族元素性质的递变规律(2)①试管②胶头滴管(4)同一主族元素,自上而下,元素的非金属性依次减弱(5)增大减弱【解析】(1)元素周期律包括同一周期与同一主族性质的变化规律。
根据给出的实验药品不难看出,该学生想以同一主族元素为例,设计实验验证同一主族元素性质的递变规律。
(2)本实验属于试管实验,主要使用试管和胶头滴管。
(4)该小题具有一定的开放性,比如:Cl2、Br2、I2的氧化性依次减弱或非金属性依次减弱都可以,但最好与该实验的实验目的相对应:即同一主族元素,自上而下,元素的非金属性依次减弱。
(5) 同一主族元素,自上而下,元素原子的电子层数增多,原子半径增大,原子核对最外层电子的吸引力逐渐减弱。
【题1】(2020·云南·陇川县民族中学高二期末)下列化学方程式或离子方程式书写有误的是()A.Cl2+2I-===I2+2CI-B.I2+2Br-===Br2+2I-C.Cl2+2Br-===Br2+2Cl-D.Br2+H2O===HBr+HBrO【答案】B【详解】A.由卤素间的置换反应规律可知,氧化性:Cl2>I2,该离子方程式正确,故A正确;B.由卤素间的置换反应规律可知,氧化性:Br2>I2,该反应不能发生,故B错误;C.由卤素间的置换反应规律可知,氧化性:Cl2>Br2,该离子方程式正确,故C正确;D.由Cl 2与水反应进行类推,Br 2和水反应生成溴化氢和次溴酸,该离子方程式正确,故D 正确。
