材料腐蚀理论 第四章 金属的钝化
腐蚀学原理金属的钝化

图5-8 氧化剂浓度的影响
若提高介质同金属表面的相对运动速度 如搅拌 ,则由于扩散层变薄,进而提高了氧的还原速度,使iL2>iPP 图5-9 。这样共轭极化曲线便交于点2,进入钝化区。
图5-9 搅拌的影响
溶液组分如溶液酸度、卤素离子、络合剂等也能影响金属钝化。通常金属在中性溶液中比较容易钝化,这与离子在中性溶液中形成的氧化物或氢氧化物的溶解度较小有关。在酸性或碱性溶液中金属较难钝化。这是因为在酸性溶液中金属离子不易形成氧化物,而在碱性溶液中又可能形成可溶性的酸根离子 例如MO2-2 的缘故。许多阴离子尤其是卤素离子的存在,甚至可以使已经钝化了的金属重新活化。例如,氯离子的存在可以使不锈钢出现点蚀现象。活化剂浓度越高,破坏越快。活化剂除氯外,按其活化能力的大小可排列为如下次序: Cl->Br->I->F-> >OH-> 视条件不同这个次序也是有变化的。 电流密度、温度以及金属表面状态对金属钝化也有显著影响。例如,当外加阳极电流密度大于致钝电流密度iPP时,可使金属进入钝化状态。提高阳极电流密度可加速金属钝化,缩短钝化时间。温度对金属钝化影响也很大,当温度升高时,往往由于金属阳极致钝电流密度变大及氧在水中溶解度下降,使金属难于钝化。反之,温度降低,金属容易出现钝化。金属表面状态如金属表面氧化物能促使金属钝化。又如用氢气处理后的铁,暴露于空气中使其表面形成氧化膜,再在碱中阳极极化,会立即出现钝化。若未在空气中暴露,立即在碱中进行阳极极化,则需经较长时间后才能出现钝化。
问题:为什么两种方法得到的极化曲线形状不一样
不同方法测得的阳极钝化曲线
a 控制电位法; b 控制电流法
解读: AB段:为金属的活性溶解区。在此区间金属进行正常的阳极溶解,溶解速度受活化极化控制,其中直线部分为Tafel直线。 BC段:为金属的活化—钝化过渡区。B点对应的电位称为初始钝化电位EPP,也叫致钝电位。B点对应的临界电流密度称为致钝电流密度,用iPP表示。因为一旦电流密度超过iPP,电位大于EPP,金属就开始钝化,此时电流密度急剧降低。但BC段为活化—钝化过渡区,在此电位区间,金属表面状态发生急剧变化,并处于不稳定状态。 CD段:为金属的稳定钝化区。电位达到C点后,金属转入完全钝态,通常把这点的电位称为初始稳态钝化电位EP。CD电位范围内,电流密度通常很小,为μA/cm2数量级,而且几乎不随电位变化,称为维钝电流密度iP。维钝电流密度很小反映了金属在钝态下的溶解速度很小。 DE段为金属的过钝化区。电位超过D点后电流密度又开始增大。D点的电位称为过钝化电位Etp。此电位区段电流密度又增大了,通常是由于形成了可溶性的高价金属离子,如不锈钢在此区段因有高价铬离子形成,引起钝化膜的破坏,使金属又发生腐蚀了。 2Cr3++7H2O → Cr2O72-+14H++6e
金属的钝化

1.2钝化过程 Process of Passivation
硝酸清洗通常被指称为钝化,意味着在此过程中金属表面形成了一层保护性的惰性薄膜。实际上,酸处理主要是去除影响在不锈钢表面形成惰性氧化薄膜的污物,同时也有助于加快氧化过程。清洗要钝化的船舱以至水白(Water white)的程度。用约15%的硝酸溶液(10-20%)清洗整个船舱表面。切记将酸加入水中,而不是将水加入酸中,以将混合产生的热量减到最小。为了保证得到15%的溶液浓度,测出水流装满200升圆桶的时间,以计算淡水供应的流速。应用这一流速向船舱内注入所要求量的水。建议使用足量的溶液以使得钝化过程中泵吸不间断。用不锈钢质的泵将要求量的酸加入船舱内,并由适当的HOSE直接导入船舱里的水中。如果要钝化大量船舱,建议在第一个船舱内配制溶液然后逐个船舱传输。注意在传输过程中会产生溶液损失,因此溶液可能需要中途加注。钝化大量船舱时,应监控溶液的质量,通过测量溶液的pH值和观测溶液的颜色来控制溶液的浓度和污物。用盲板适配器,将规定数量的洗舱管和机器联接起来。(应用尽可能多的洗舱机)洗舱口应盖住以免溶液流出到低碳钢甲板上。不锈钢管鞍套可以很好地盖住这些开口。应不断让水流过甲板,以便稀释偶尔流到甲板上的酸。
2.2钝化步骤 Process of Passivation:将蒸汽喷射器装进船舱内,可装在梯子上,也可装在位于中央的洗舱口处。开始向船舱内加入蒸汽,加汽短时间之后,打开装在酸容器上的吸入球阀。调整球阀,使得硝酸缓慢地、均匀地和连续不断地加入到蒸汽中,持续一段至少为30分钟的时间。这一点很重要,否则,硝酸将不会形成雾状融入蒸汽中。如果硝酸的小滴太大,它们将直接掉到船舱底部而不产生效果。当有适量的硝酸注入船舱(4升/100立方米)时,停止注入蒸汽,并关闭船舱保持3-4小时。这段时间过后,以淡水清洗船舱约一小时。在停止冲洗过程之前应检查冲洗后的水其pH值是否达到可接受的水平(6-7)。对船舱进行目测,并测量隐蔽区域表面的pH值。如果手头有钝化仪,也一并使用。报告:向相应船队提交一份钝化处理的报告。如定期使用蒸汽法进行钝化处理,将会产生令人满意的效果。然而,如果船舱的状况已严重恶化,则强烈推荐使用循环方法进行处理。应当认识到,每艘船和每种情况都有所不同。所以,建议负责人根据自己所处的特殊情况评估这些步骤,并且依照自己的最佳判断进行处理。
材料腐蚀与防护-第四章-电化学腐蚀动力学

• 分类:表观极化曲线和理想极化曲线。 • *理想极化曲线----以单电极反应的平衡电位作为起始 电位的极化曲线。 • *表观极化曲线或实测极化曲线---- 由实验测得的腐蚀 电位与外加电流之间关系曲线。 • • 注意:表观极化曲线的起始电位只能是腐蚀电位而不 是平衡电极电位。
在金属腐蚀与防护研究中,测定金属电极表观极化曲线是 常用的一种研究方法。
第一节 第二节 第三节 第四节
本章主要内容 极化现象 极化 去极化 腐蚀极化图
第一节 极化
• 问题:因为具有很大腐蚀倾向的金属不一定必然对应着高 的腐蚀速度。 如:Al的平衡电极电位很负,从热力学上看它的腐蚀倾向很 大,但在某些介质中铝却比一些腐蚀倾向小的金属更耐蚀 。 • 因此,认识电化学腐蚀动力学规律及其影响,在工程上具 有更现实的意义。
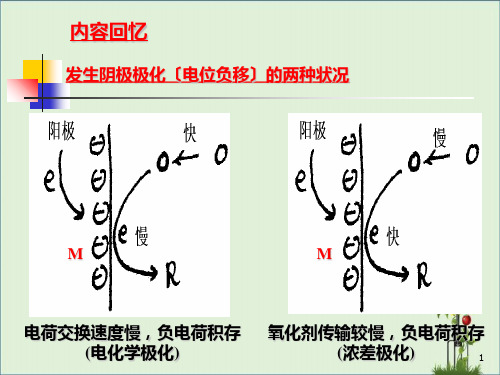
2.2 去极化的方法: • 在溶液中增加去极剂(H+、O2-等)的浓度、升温、搅拌 以及其他降低活化过电压的措施,都将增强阴极去极化作 用; • 在溶液中加入络合物或者沉淀剂,它们会与金属离子形成 难溶的络合物或沉淀物,不仅可以使金属表面附近溶液中 的金属离子浓度降低,并能一定程度地减弱阳极极化作用 。 • 在溶液中升温、搅拌等均会加快金属离子进入溶液的速度 ,从而减弱阳极极化作用。 • 如果在溶液中加入某些活性阴离子,就有可能使已经钝化 的金属重新处于活化状态。
2)确定金属的腐蚀速度 • 利用极化曲线外延法求自腐蚀电流Icorr ,一种电化学技术 确定金属腐蚀速度的方法之一。
3.3 腐蚀速度计算及耐蚀评价
• 1)腐蚀速度计算 • 用腐蚀电池的腐蚀电流表征 • 电化学腐蚀过程严格遵守电当量关系。即一个一价的金属 离子在阳极区进入溶液,必定有一个一价的阴离子在阴极 获得一个电子;一个二价的金属的金属离子在阳极区进入 溶液,也必然有一个二价或两个一价的阴离子或中性分子 在阴极取走两个电子,如此类推。 • 金属溶解的数量与电量的关系遵循法拉第定律,即电极上 溶解(或析出)1mol的物质所需的电量为96500c,因此, 已知腐蚀电流或电流密度就能计算出所溶解(或析出)物 质的数量。
金属表面钝化处理

金属表面钝化处理金属表面钝化处理是一种常见的金属防腐方法,通过在金属表面形成一层钝化膜来提高金属材料的抗腐蚀性能。
本文将从钝化膜的形成原理、常用的钝化处理方法以及钝化处理的应用范围等方面进行介绍,以帮助读者更好地了解和应用金属表面钝化处理技术。
钝化膜的形成原理主要是通过金属与外界环境中的氧、水等发生反应,形成一层致密的氧化层或氢氧化层,从而阻止金属继续与环境中的腐蚀介质接触,达到防腐的目的。
钝化膜的形成过程是一个动态平衡过程,一方面金属不断与腐蚀介质接触,另一方面钝化膜不断形成和修复,最终形成一个稳定的、具有一定厚度和致密性的钝化膜。
常用的金属表面钝化处理方法包括化学钝化、电化学钝化和热处理钝化等。
化学钝化是通过将金属表面浸泡在含有特定成分的化学溶液中,使金属表面与溶液中的化学物质发生反应,形成一层致密的钝化膜。
电化学钝化是利用电化学原理,在电解液中通过外加电压控制金属表面的氧化还原反应,形成钝化膜。
热处理钝化是将金属材料加热至一定温度,在氧气或氧化剂的作用下形成钝化膜。
这些方法各有优缺点,选择适合的钝化处理方法需根据具体金属材料的性质和使用环境进行考虑。
金属表面钝化处理具有广泛的应用范围,常见的应用领域包括汽车制造、航空航天、建筑工程、海洋工程等。
在汽车制造中,金属零件经过钝化处理后能够提高其耐蚀性和耐磨性,延长使用寿命。
在航空航天领域,钝化处理能够保护飞机零件在恶劣的大气环境下的腐蚀,确保飞机的安全飞行。
在建筑工程中,金属结构经过钝化处理后能够提高其抗腐蚀性能,延长使用寿命。
在海洋工程中,钝化处理能够保护金属结构在海水中的腐蚀,确保工程的安全运行。
金属表面钝化处理是一种有效的金属防腐方法,通过形成一层致密的钝化膜来提高金属材料的抗腐蚀性能。
钝化膜的形成原理、常用的钝化处理方法以及钝化处理的应用范围等方面的内容在本文中得到了详细介绍。
通过合理选择和应用钝化处理技术,可以提高金属材料的使用寿命,降低维护成本,保证工程的安全运行。
材料腐蚀理论第四章金属的钝化

Fe-Cr合金在10%硫酸中的钝化曲线(Cr 含量的影响)
• Cr 增加,致钝电流下降,维钝电流降低。致钝电位和活化峰电位负移, 钝化区电位增宽, 说明Cr 增强钝性,提高耐蚀。
• 过钝化区发生析O2反应、Cr+6生成,进入二次钝化区。
2)钝化介质的影响
• 金属在介质中发生钝化,主要是有钝化剂的存在 • 钝化剂的性质与浓度对金属钝化发生很大影响 • 氧化性介质、非氧化性介质都可能使某些金属钝化,
钝态遭到局部破坏,产生点蚀。
4)温度的影响
• 介质温度愈低,金属愈易钝化 • 温度升高,钝化受到破坏 • 原因:化学吸附和氧化反应一般都是放热反应,降低温度
有利于反应发生,从而有利于钝化。
Effect of aluminium on the passivation of zinc–aluminium alloys in artificial seawater at 80 °C, Corrosion Science 66 (2013) 67–77
lgi Cl-浓度对不锈钢阳极极化曲线的影响
点蚀电位:在含Cl-介质中金属钝态开始提前破坏的电位 Cl-浓度愈高,点蚀电位愈负,愈发生点蚀
• Cl-对钝化膜的破坏原因
–成相膜理论认为
• Cl-半径小,穿透能力强,比其他离子更易透过薄膜中
的小孔或缺陷,与金属作用生成可溶性化合物 –吸附理论认为
• Cl-具有很强的被金属吸附的能力,与氧存在竞争吸附, 一旦Cl-优先吸附,把金属表面的氧排挤掉,导致金属
值Epp时,金属表面状态发 Ept
D
生突变,开始钝化,电流
密度急剧下降。
Epp
致钝电位
imax 致钝电流密度
第四章钝化

Fe、Ni、Cr、Mo、Al等在稀硫酸中均可发 生因阳极极化引起的钝化
钝化的定义
钝化就是指热力学不稳定的金属或合金由于阳极过 程受阻而引起金属腐蚀速度下降的现象。(或由于 阳极过程受阻而引起金属耐蚀性提高的现象。) 钝化是金属表面状态的突变,金属的本质没有变化 金属钝化后所处的状态称作钝态(Passive State) ,而 钝态金属所具有的性质称之为钝性。
EF与致钝电位EPP的关系: 二者很接近,但并不相同。两者之间可相差百分 之几伏,所以有时可把EPP近似地看作EF 因为: ①EF是钝化膜活化的电位,而EPP是产生钝化的电位; ②EF是在断电后测得的,而EPP是在通电下测得的,故 包含有钝化膜的电阻降和膜孔隙中溶液的浓度极化。
2)破裂电位Eb、保护电位EP及亚稳孔出现电位Em
过钝化区:金属 高价离子溶解, 钝化膜破坏,及 析氧反应 钝化区:形成钝化 膜电位维持在钝化 区可保护金属—— 电化学阳极保护
活化区:阳极金属 溶解(低价离子)
E Etp
•四个特性区 • 四个特性区 • 四个特性电位: • 四个特性电位 过钝化区 E0、 Epp、Ep、Etp • 两个特性电流:
4.2金属钝化的特性曲线
图4-3 可钝化金属的典型阳极极化曲线
A~B区:活性溶解区。金 属处于活性溶解状态,按 正常的阳极溶解规律溶 解,溶解速度受活化极化 控制。金属以低价的形式 溶解为水化离子。 M → Mn+ + ne E↑,i↑,基本服从Tafel规 律。 对于铁来说,即为: Fe → Fe2+ + 2e
C点:对应的电位称E维;电流i维 D点:过钝化电位Etp
D~E区:过钝化区 (Transpassive Potential) 。 电流再次随电极电位的升高而 增加,这是由于氧化膜进一步 氧化生成更高价的可溶性氧化 物。钝化膜被破坏,腐蚀重新 加剧。 E↑ , i ↑ M203+4H20→M20-7+8H++6e 如不锈钢中的六价铬离子的形 成即属此情况,它是由于钝化 膜被破坏,因而使金属的溶解 速度上升。
金属钝化的名词解释

金属钝化的名词解释金属钝化是指一种物理和化学过程,通过这种过程可以使金属表面形成一层具有良好稳定性和抵御腐蚀能力的氧化物或其他化合物层。
金属钝化可以防止金属表面与环境中的氧、湿度、酸碱等物质接触,从而减缓或消除金属的腐蚀现象。
在工业生产和实际应用中,金属钝化被广泛应用于金属制品和构件的防腐蚀处理中。
一、金属钝化的原理金属钝化的原理主要包括化学反应和物理屏障机制。
在化学反应层面上,金属与环境中的氧、湿度、酸碱等物质发生反应,形成一层稳定的金属氧化物或其他化合物。
这层氧化物的存在使得金属表面与外部环境的腐蚀物质无法直接接触,从而降低了金属腐蚀的速度。
在物理层面上,金属钝化层的形成可形成一层物理屏障,阻挡外界物质对金属表面的直接接触,从而实现金属表面的保护作用。
二、金属钝化的方法1. 金属表面涂层:通过在金属表面涂覆一层抗腐蚀性较强的涂层,形成一种物理屏障和化学反应层,实现金属钝化的目的。
常见的涂层材料包括油漆、瓷釉、镀层等。
这些涂层能够阻隔金属表面与外界环境的直接接触,减少氧、湿度以及酸碱等腐蚀物质的侵蚀。
2. 化学处理:利用化学方法,在金属表面形成一层稳定的氧化物或者化合物层。
常见的化学处理方法有酸洗、氧化、镀膜等。
这些处理方法通过改变金属表面的化学性质,形成一层具有保护性质的钝化层,防止金属的腐蚀。
3. 电化学方法:利用电化学原理,在金属表面施加电流,通过阳极氧化或者阳离子沉积的方式,形成一层致密、均匀且具有较高保护性能的钝化膜。
这种方法适用于对金属表面进行钝化膜增厚的处理,如电镀、阳极氧化等。
三、金属钝化的应用金属钝化在工业生产和实际应用中具有广泛的应用价值。
1. 防腐蚀:金属钝化主要用于金属制品和构件的防腐蚀处理。
通过在金属表面形成保护性的钝化层,减缓或消除金属腐蚀现象,延长金属制品的使用寿命。
2. 美观装饰:金属钝化可以改变金属表面的外观,增加金属制品的装饰性和美观性。
常见的金属钝化方法包括电镀和阳离子沉积等,可以在金属表面形成不同颜色的膜层,使金属制品呈现出丰富多样的外观效果。
7-金属腐蚀电化学理论基础(钝化)-4详解
氢气, 气泡形式, 金属表面溶液得到搅拌
三种类型均有, 主要是阴极活化极化控制
中性氧分子, 具对流和扩散两种方式,
扩散系数较小
浓度小, 温度升高、盐浓度增加时
溶解度下降
水分子或氢氧根离子, 只能以对流和扩散方式离开金属表面,
无附加搅拌作用
以阴极控制居多, 主要是氧扩散控制
24
2.0 0 -2 -4 -6
1.6
1.2
3+
Fe
0.8
0.4
E(V)0
2+
Fe
-0.4
2-
FeO4 Fe2O3
注:考虑的稳定平衡相是 Fe、Fe2O3、Fe3O4
-0.8
0 -2
-4
-1.2
-6
Fe3O4 Fe
-1.6 -2 0 2
4
6 8 10 12 14
pH
Fe-H2O体系的电位—pH图
C
腐蚀区
B
过钝化区
D 钝化区
A
免蚀区
Fe/H2O体系的电位—pH图
分为三大区域: (1) 腐 蚀 区 , 只 有 Fe2+ 、 Fe3+ 、 FeO4 2-、HFeO2 2-稳定 (2)免蚀区,Fe稳定,不发生腐蚀 (3) 钝化区,Fe2O3、Fe3O4稳定, 表示金属化物稳定即钝化; (4) 根据(a)、(b)线及Fe2+、Fe所 处位置可判断可能的腐蚀反应:
icorriM,0expMRnM TF EcorrEM e icorriO,0expORnOTF EOe Ecorr
lgiH,o lgiM,o lgicorr lgi
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、阳极钝化的特性曲线
钝化的发生是金属阳极过程中的一种特殊表现。为研究钝 化现象,必须研究金属阳极溶解时的特性曲线 采用恒电位法测得金属钝化过程典型的阳极极化曲线
1)金属阳极钝化曲线四个区域 (1)A-B段——活性溶解区 金属按正常的阳极溶解, 曲线从金属腐蚀电位出发, 电流随电位的升高 而增大 ,服从Tafel规律 FeFe2+ + 2e
Nyquist plots of different Zn alloys after anodic polarization to various potentials vs. SCE at immersion times of (a) 48 h (0.8 V for all Zn alloys), (b) 288 h (0.3 V for pure Zn and Zn-0.15Al alloy, 0.5 V for Zn-0.3Al alloy and 0.7 V for Zn–1.0Al alloy) and (c) 720 h (0.8 V for all Zn alloys) in artificial seawater at 80 C.
第四章 金属的钝化
一、金属钝化现象与阳极钝化
关于金属的钝化现象,在18世纪初就已发现。如Fe在
稀硝酸中腐蚀很快,而在浓硝酸中腐蚀速度很慢,
这种现象即为金属的钝化
1. 钝化的分类
根据金属钝化产生条件,钝化分为
– 化学钝化 – 阳极钝化
• 化学钝化
• 钝化现象 – 把Fe放在HNO3中,观察Fe的溶解速度与 HNO3浓度的关系。 – 发现Fe在稀硝酸中剧烈地溶解,且溶解速 度随硝酸浓度的增加而迅速增大。 – 当硝酸的浓度增加到30—40%时,Fe的溶 解速度达到最大。 – 若继续增加硝酸浓度超过40%,则Fe的溶 解速度突然下降到原来的四千分之一。 (这一现象称为钝化) – 如果继续增加硝酸浓度到超过90%,腐蚀 速度又有较快的上升(称为过钝化) Fe的溶解速度与硝酸浓度的关系
钝化膜具有电子传导性质,介于半导体和绝缘体之间的弱电子导体
• 影响金属钝化的因素
• 合金成分的影响 • 钝化介质的影响
• 活性离子对钝化膜的破坏作用
• 温度的影响
1)合金成分的影响
–不同金属具有不同的钝化趋势 –合金化是提高金属耐蚀性的有效方法 –合金的耐蚀性与合金元素的种类和含量有直接关系 –加入的合金元素的含量符合n/8定律时,合金的耐蚀性显 著提高。
Effect of aluminium on the passivation of zinc–aluminium alloys in artificial seawater at 80 °C, Corrosion Science 66 (2013) 67–77
研究对象
• 晶界清晰可见 • 与纯锌相比,Zn-1.0Al的晶粒尺寸更小,表明Al的加入减 小晶粒尺寸,
断阳极电流后不久,金属的钝态便会受到破坏,亦即属自动 活化了。
佛莱德电位
钝 态 金 属 电 位 变 化 曲 线
• 电极电位开始迅速从正值往负值变化,然后在一小 段时间(几 秒到几分钟)范围内电位改变很缓慢,最后电位又急速地下降
到金属的活化电极电位值 • 佛莱德电位EF
• 佛莱德电位与维钝电位接近,并不相等
– 金属的溶解速度大大降低,即使金属转为钝态
• 这种保护膜通常是金属的氧化物。
• 近年来,利用X光衍射、电子显微镜等表面测试仪器 对钝化膜的成分、结构、厚度进行了广泛研究 • 膜的厚度一般为1—10nm,与金属材料有关。
• 应注意的是:金属处于钝态时,并不等于它已经完全停止溶
解,只是溶解速度大大降低。因为钝化膜具有微孔,钝化后 金属的溶解速度由微孔内金属的溶解速度决定。 • 钝态金属的溶解速度和电极电位无关(膜的溶解纯粹是化学 过程)。
钝化区
活化—钝化过渡 区 B
活化区
A
imax
金属钝化过程的阳极极化曲线
(4)D-E区——过钝化区 当电极电位进一步升高, 电流随电位升高而增大,
Ept
D C
E
过钝化区
钝化膜被破坏,腐蚀加剧
Ept 过钝化电位
Ep EF Epp
钝化区
2 M 2O3 4H2O M 2O7 8H 6e
• EF愈正,表明金属丧失钝态的可能性愈大;反之, 则容易保持钝态
• EF与溶液的PH值之间存在线形关系
EF =EF0- 0.0592PH (EF0为标准状态下的Flade电位)
二、金属的自钝化
• 定义:由于腐蚀介质中氧化剂的还原反应而促成的金 属钝化。 • 自钝化产生条件
– 氧化剂(钝化剂)的氧化还原平衡电位高于该金属的致钝电位,即
吸附膜
(a)
(b)
(c)
(d)
(e)
(a) 吸附膜:由氧或其他物质的单分子或多分子层组成 (b) 三维氧化物聚合物成相膜:首先有氧的多分子吸附膜转变生成氧化物膜,如铁在酸性溶液 中内层为Fe3O4,外层为Fe2O3膜 (c) 在无保护性膜上形成的成相膜:如铜在中性溶液中先形成Cu2O膜,然后形成CuO膜 (d) 氢氧化物沉积层覆盖的成相膜:如铁在中性溶液中形成的钝化膜 (e) 同组成的多孔膜覆盖的成相膜:如铝在阳极氧化后在其表面形成多孔氧化物膜
的小孔或缺陷,与金属作用生成可溶性化合物 –吸附理论认为 • Cl-具有很强的被金属吸附的能力,与氧存在竞争吸附, 一旦Cl-优先吸附,把金属表面的氧排挤掉,导致金属 钝态遭到局部破坏,产生点蚀。
4)温度的影响
• 介质温度愈低,金属愈易钝化 • 温度升高,钝化受到破坏 • 原因:化学吸附和氧化反应一般都是放热反应,降低温度 有利于反应发生,从而有利于钝化。
化学作用而产生的钝化现象,称为化学钝化,或自钝
化。 • 金属变为钝态时,有一个普遍现象:金属的电极电位
朝正的方向移动
• 阳极钝化
• 在不含活性Cl-的电解质溶液中,由阳极极化也可引
起金属的钝化
• 阳极钝化:采用外加阳极电流的方法,使金属由活 性状态变为钝态的现象,称为阳极钝化或电化学钝 化。
• 阳极钝化和化学钝化,二者无本质区别。
Ep
p
a
b
II
I
ip
易钝化金属在氧化能力不同的介质中 钝化行为示意图
f Ep
t
–线III:代表中等浓度的
IV
e d c Ep
p
氧化剂,曲线有一个交点
III a b II
e,位于稳定钝化区。所
以,只要将金属浸入介质,
I ip 易钝化金属在氧化能力不同的介质中 钝化行为示意图
自然与介质作用成钝态
–线IV:强氧化剂,曲线交
显著提高而产生钝化。
实验证明,只要在金属表面最活泼的、最先溶解
的表面区域上(晶格缺陷、畸变处)吸附氧单分
子层,即可抑制阳极过程,使金属钝化
钝化膜
• 金属之所以发生钝化,是因为在金属表面形成钝化 膜。钝化膜有不同类型
孔 成相膜 金属 成相膜 无保护性膜 金属 沉积层 成相膜 金属 成相膜 金属
• 钝化剂的性质与浓度对金属钝化发生很大影响
• 氧化性介质、非氧化性介质都可能使某些金属钝化,
3)活性离子对钝化膜的破坏作用
无Cl-
• 介质中的活性离子,如Cl-、
E
Br-、I-等,尤其以Cl-最容易
使不锈钢的钝化膜发生破坏。 一般在远未达到过钝化电位
Ept
Eb! Eb2
Cl-含量增加
前,已出现显著阳极溶解电
Fe-Cr合金在10%硫酸中的钝化曲线(Cr 含量的影响)
• Cr 增加,致钝电流下降,维钝电流降低。致钝电位和活化峰电位负移, 钝化区电位增宽, 说明Cr 增强钝性,提高耐蚀。 • 过钝化区发生析O2反应、Cr+6生成,进入二次钝化区。
2)钝化介质的影响
• 金属在介质中发生钝化,主要是有钝化剂的存在
3)阳极钝化特征曲线的特点 阳极钝化曲线存在着 四个特征电位 四个特征区 两个特征电流密度 Epp、 EF、 Ep、 Ept 活化区、过渡区、钝化区、过钝化区 ip、 imax
金属在整个阳极过程中,由于电极电位所处范围不同, 电极反应不同,腐蚀速度也不一样
3、佛莱德电位 对于因采用阳极极化法使金属处于钝态的金属来讲,当中
流。 • Cl-对钝化膜的破坏作用不是 发生在整个金属表面,而是 带有局部点状腐蚀的特点
Eb3
lgi
Cl-浓度对不锈钢阳极极化曲线的影响
点蚀电位:在含Cl-介质中金属钝态开始提前破坏的电位 Cl-浓度愈高,点蚀电位愈负,愈发生点蚀
• Cl-对钝化膜的破坏原因
–成相膜理论认为
• Cl-半径小,穿透能力强,比其他离子更易透过薄膜中
• Potentiodynamic polarization curves of different Zn alloys at (a) 48 h, (b) 288 h and (c) 720 h of immersions in artificial seawater at 80 C.
• •
•
48小时,锌铝合金阳极电流密度高于纯锌 288小时,锌铝合金和纯锌均发生钝化现象, 可能是在样品表明形成保护性化合物或腐 蚀产物。合金的平均钝化电流密度高于纯 锌 720小时,钝化现象均消失,表明钝化膜溶 解。
– 线I:氧化剂的氧化性很弱,阴、阳 极极化曲线有交点a,位于活化区, 不能进入钝态 – 线II:氧化性较弱或氧化剂浓度不 高,极化曲线有3交点, • b点在活化区,如果金属原先处 于该点活化态,则仍然不会钝化, 继续腐蚀 • c点在过渡区,电位不稳定,如 果开始处于钝态,由于某种原因 活化,则不能恢复钝态 • d点在钝化区,如果金属原先处 于该点为钝态,则仍然维持钝态
