第06篇 美国CLIA’88临床检验各专业室内质量控制文件
美国CLIA能力比对检验的分析质量要求
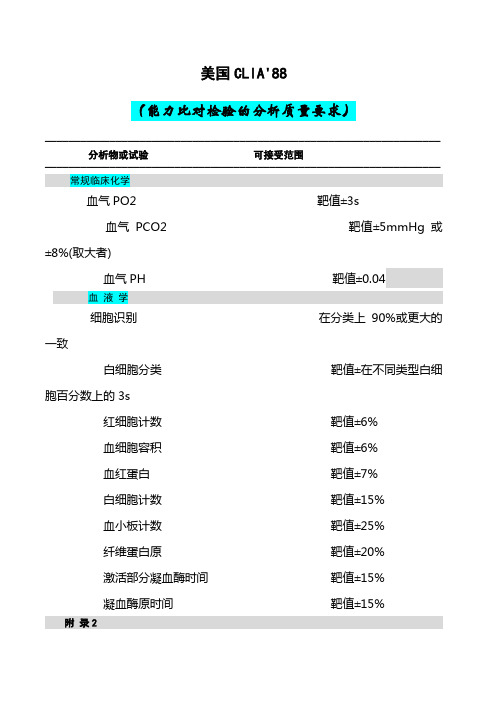
美国CLIA'88(能力比对检验的分析质量要求)───────────────────────────────────────────────────────────────────分析物或试验可接受范围───────────────────────────────────────────────────────────────────常规临床化学血气PO2 靶值±3s血气PCO2 靶值±5mmHg 或±8%(取大者)血气PH 靶值±0.04血液学细胞识别在分类上90%或更大的一致白细胞分类靶值±在不同类型白细胞百分数上的3s红细胞计数靶值±6%血细胞容积靶值±6%血红蛋白靶值±7%白细胞计数靶值±15%血小板计数靶值±25%纤维蛋白原靶值±20%激活部分凝血酶时间靶值±15%凝血酶原时间靶值±15%附录2常用质控规则及含义:质控规则是解释质控数据和判断分析批控制状态的标准。
以符号AL(或A-L)表示, 其中A 是测定质控标本数或超过控制限(L)的质控测定值的个数,L是控制界限。
当控制测定值满足规则要求的条件时,则判断该分析批违背此规则。
常用质控规则有:(: 平均数;s:标准差): 一个质控结果超过±2s,为违背此规则,提示警告。
12s: 一个质控结果超过±2.5s,为违背此规则,提示存在随机误差。
12.5s1: 一个质控结果超过±3s,为违背此规则,提示存在随机误差。
3s: 同批两个质控结果之差值超过4s, 即一个质控结果超过+ 2s,另一质控结果超过R4s- 2s。
也适用于超过+ 2.5s及- 1.5s,为违背此规则,表示存在随机误差。
: 两个连续质控结果同时超过+ 2s 或- 2s,为违背此规则,表示存在系统误差。
22s: 一个质控品连续的四次测定结果都超过+ 1s或- 1s,两个质控品连续两次测定都41s超过+ 1s或- 1s,为违背此规则,表示存在系统误差。
CLIA‘88质量管理技术基础1

(二)统计质量控制的含义 主要是区别于广义的质量控制。
二、控制品 (一)定义:专门用于质量控制目的的标 本或溶液,不能用作校准。(IFCC 本或溶液,不能用作校准。(IFCC ) (二)制备:控制品用基础材料(人或动 物血清)经过处理,添加了无机和(或) 有机化学品、生物体的提取物、防腐剂 等。
五、第三代室内质控的方法 (一)质控品进行20-30天测定,计算各项 (一)质控品进行20-30天测定,计算各项 目的X 目的X、S。 (二)确定控制限:控制限要控制结果不 超过规定TEa,由于偏倚的存在,所以, 超过规定TEa,由于偏倚的存在,所以, 最好是以1/4或1/5的TEa为质控图上的CV。 最好是以1/4或1/5的TEa为质控图上的CV。 计算出S 计算出S。
(七)质控规则的应用: 使用1 使用13s/12s等规则判断。 (八)失控的处理及原因分析
(九)质控数据的处理 1、每月月底统计当月的X、SD、CV%。 、每月月底统计当月的X SD、CV%。 每月月底统计当月各项目去除失控数据 后的X SD、CV%。 后的X、SD、CV%。 2、统计当月及以前每个测定项目在控数 据的累积X SD、CV%。 据的累积X、SD、CV%。 3、分析当月的X、SD、CV%与累积结果 、分析当月的X SD、CV%与累积结果 的差异。 4、打印每月各项目室内质控数据汇总表及 失控分析。
Байду номын сангаас
(二)暂定靶值的设定:为了确定靶值,新批号 (二)暂定靶值的设定:为了确定靶值,新批号 的质控品应与当前使用的质控品一同进行测定。 根据20或更多独立批获得的至少20次质控测定 根据20或更多独立批获得的至少20次质控测定 结果,计算出平均值及SD,去除3SD以外的数 结果,计算出平均值及SD,去除3SD以外的数 据后,重新计算平均值,将此平均值作为暂定 靶值。以此暂定靶值作为下一个月室内质控图 的靶值进行室内质控;一个月结束后,将该月 的在控结果与前20个质控测定结果汇集在一起, 的在控结果与前20个质控测定结果汇集在一起, 计算第一个月的累积平均数,以此累积的平均 数作为下一个月质控图的靶值。重复上述操作 过程,连续三个月。
clia88归纳的质量控制要素

clia88归纳的质量控制要素
质量控制是一种通过采取各种措施来确保产品或服务达到一定质量标准的管理方法。
clia88归纳的质量控制要素如下:
1. 建立明确的质量目标:明确产品或服务的质量标准和要求,为质量控制提供明确的目标和方向。
2. 进行质量规划:制定质量控制计划,包括确定需要实施的质量控制活动、确定质量控制的时间表和资源需求等。
3. 设定质量指标:制定一系列量化的质量指标,用于评估产品或服务的质量水平。
4. 确保供应商质量:与供应商建立良好的合作关系,确保供应商提供的材料或服务符合质量要求。
5. 进行过程控制:在产品或服务的生产或提供过程中进行监控和调整,以确保产品或服务达到质量要求。
6. 进行质量检验:通过对产品或服务进行抽样测试或全面检查,确认产品或服务是否符合质量要求。
7. 进行质量改进:基于质量控制的结果,进行持续的改进和优化,提高产品或服务的质量水平。
8. 建立质量文化:通过培训和宣传,建立员工对质量的意识和责任感,推动全员参与质量控制。
9. 建立反馈机制:建立顾客投诉和反馈机制,及时解决问题,改进和提升产品或服务的质量。
10. 管理质量记录:建立健全的质量文档管理系统,包括记录
质量控制的过程和结果,为质量控制提供依据和参考。
这些质量控制要素相互关联,在整个质量控制过程中共同作用,以确保产品或服务质量的稳定性和可靠性。
美国CLIA'88能力比对检验的分析质量要求

美国CLIA'88(能力比对检验的分析质量要求)───────────────────────────────────────────────────────────────────分析物或试验可接受范围───────────────────────────────────────────────────────────────────常规临床化学血气PO2 靶值±3s血气PCO2 靶值±5mmHg 或±8%(取大者)血气PH 靶值±0.04血液学细胞识别在分类上90%或更大的一致白细胞分类靶值±在不同类型白细胞百分数上的3s红细胞计数靶值±6%血细胞容积靶值±6%血红蛋白靶值±7%白细胞计数靶值±15%血小板计数靶值±25%纤维蛋白原靶值±20%激活部分凝血酶时间靶值±15%凝血酶原时间靶值±15%附录2常用质控规则及含义:质控规则是解释质控数据和判断分析批控制状态的标准。
以符号AL(或A-L)表示, 其中A 是测定质控标本数或超过控制限(L)的质控测定值的个数,L是控制界限。
当控制测定值满足规则要求的条件时,则判断该分析批违背此规则。
常用质控规则有:(: 平均数;s:标准差): 一个质控结果超过±2s,为违背此规则,提示警告。
12s: 一个质控结果超过±2.5s,为违背此规则,提示存在随机误差。
12.5s: 一个质控结果超过±3s,为违背此规则,提示存在随机误差。
13s: 同批两个质控结果之差值超过4s, 即一个质控结果超过+ 2s,另一质控结果超过R4s- 2s。
也适用于超过+ 2.5s及- 1.5s,为违背此规则,表示存在随机误差。
: 两个连续质控结果同时超过+ 2s 或- 2s,为违背此规则,表示存在系统误差。
22s: 一个质控品连续的四次测定结果都超过+ 1s或- 1s,两个质控品连续两次测定都41s超过+ 1s或- 1s,为违背此规则,表示存在系统误差。
美国CLIA’88临床检验各专业室内质量控制文件

美国CLIA’88临床检验各专业室内质量控制文件(一)美国CLIA’88质量控制要求美国临床实验室改进修正法案最终规则(CLIA final rule)于2003年1月24日通过,2003年4月24日实施。
其中K-非豁免试验的质量体系,分析系统中493.1256标准:控制程序(control procedures)对各专业质量控制提出具体要求。
1、控制程序根据美国CLIA’88最终规则Sec.493.1256标准:控制程序(a)对于每一检测系统,实验室负责制定控制程序,监测整个分析过程的准确度和精密度。
(b)实验室必须建立检测控制物的数量、类型和频率,如果适合,实验室应按Sec.493.1256 (b)(3)规定验证或建立性能规范。
(c)控制程序必须(1)立即检测出由于检测系统故障、不利的环境条件及操作者性能而产生的误差。
(2)长期监测由于检测系统性能和环境条件改变和操作者性能变化而可能影响到的准确度和精密度性能。
(d)除了CMS批准的程序,如国家操作手册附录C中规定(CMS Pub.7)的外,提供了等效质量检测,实验室必须(1)执行本节规定的质量控制程序,除非在493.1261到493.1278部分其他专业和亚专业有其他的规定。
(2)对于每一检测系统,当他们满足或超出本节(d)(3)部分要求时,执行的质量控制程序使用厂家规定或实验室建立的个数和频率。
(3)每天检测患者标本时至少每天检测一次控制品,或执行如下的步骤(i)每一定量检测程序,包括两个不同浓度水平的控制品;(ii)对每一定性的检测程序,包括一个阴性和一个阳性控制品;(iii)对于产生分级或滴度结果的检测程序,分别包括阴性控制品和具有分级或滴度反应性的控制品;(iV)对于具有提取阶段的每一检测系统,包括两个控制品,其中一种能够检出提取阶段的误差;(v)对于每一种分子扩增程序,包括两个控制品,如果反应抑制性是假阴性结果的显著性来源,一个控制品能够检出抑制性作用。
美国CLIA88质量要求

美国CLIA88质量要求美国CLIA’88能力比对检验的分析质量要求分析物或试验可接受范围常规临床化学谷丙转氨酶靶值±20%白蛋白靶值±10%碱性磷酸酶靶值±30%淀粉酶靶值±30%谷草转氨酶靶值±20%胆红素靶值±6.84mmol/L(0.4mg/dL)或±血气PO2靶值±3s血气PCO2靶值±5mmHg或±8%(取大者)血气PH靶值±0.04钙,总靶值±0.250mmol/L(1.0mg/dL)氯靶值±5%胆固醇靶值±10%高密度脂蛋白胆固醇靶值±30%肌酸激酶靶值±30%肌酸激酶同功酶MB升高(存在或不存在)或靶值±3s肌酐靶值±0.265umol/L(0.3mg/dL)或±葡萄糖靶值±0.33mmol/L(6mg/dL)或±铁靶值±20%乳酸脱氢酶靶值±20%LD同功酶LD1/LD2(+或-)或靶值±30%镁靶值±25%钾靶值±0.5mmol/L钠靶值±4mmol/L总蛋白靶值±10%甘油三酯靶值±25%尿素氮靶值±0.71mmol/L尿素(2mg/dL尿素尿酸靶值±17%内分泌皮质醇靶值±25%游离的甲状腺素靶值±3s人绒毛膜促性腺激素(HCG)靶值±3s或(阳性或阴性)T3 uptake靶值±3s(方法)三碘甲状腺素原氨酸靶值±3s促甲状腺激素靶值±3s甲状腺素靶值±20%或12.9%(1.0ug/dL)(取大毒理学酒精,血靶值±25%血铅靶值±10%或±酰氨咪嗪(carbamazepine)靶值±25%地高辛(digoxin)靶值±20%或0.2ug/dL(更大)乙琥胺(ethosuximide)靶值±20%庆大霉素靶值±25%锂靶值±0.3mmol/L或±20%(更大)苯巴比妥(Phenobarbital)靶值±20%苯妥英(phenytion)靶值±25%扑痫酮(primidone)靶值±25%普鲁卡因酰氨(procainamid)(及代谢物) 靶值±25%奎尼丁(quinidine)靶值±25%茶碱(theophylline)靶值±25%妥布霉素(tobramycin)靶值±25%丙戊酸靶值±25%血液学细胞识别在分类上90%或更大的一致白细胞分类靶值±在不同类型白细胞百分数上红细胞计数靶值±6%血细胞容积靶值±6%血红蛋白靶值±7%白细胞计数靶值±15%血小板计数靶值±25%纤维蛋白原靶值±20%激活部分凝血酶时间靶值±15%凝血酶原时间靶值±15%一般免疫学1—抗胰蛋白酶靶值±3s抗核抗体靶值±2个稀释或(阳或阴)抗-HIV反应或不反应补体3靶值±3s补体4靶值±3s—甲胎蛋白靶值±3s肝炎(HBsAg,anti-HBc,HBeAg)反应(阳性)或不反应(阴性)IgA靶值±3sIgE靶值±3sIgG靶值±25%IgM靶值±3s传染性单核细胞增多(症)靶值±2个稀释或(阳性或阴性) 类风湿因子靶值±2个稀释或(阳性或阴性) 风疹(Rubella)靶值±2个稀释或(阳性或阴性)。
临床医学检验主管技师考试辅导《临床实验室质量管理》室内质量控制讲义

室内质量控制基本统计量平均数:用来说明一组变量值的集中趋势、中心位置或平均水平。
标准差(s):表示结果分布的宽度极差(R):一组数值中最大值与最小值的差值变异系数(CV):(标准差÷均值)×100%1.平均数常用的平均数有算术平均数、几何平均数、中位数和百分位数及众数等,前三种较为常见。
算术平均数又简称为均数,样本均数用拉丁字母表示,是一组变量值数值上的平均,即结果之和除以结果个数。
式中∑是希腊字母,为求和符号;X为变量值;n为变量值个数(样本个数)。
2.方差方差(简记σ2或S2)计算公式如下:总体方差σ 2 =∑(X-μ)2/N(μ总体均数)样本方差由上式可知:方差考虑了每个变量值X与均数之差,称为离均差。
由于离均差有正有负,而总和为0,这样仍不能反映变异度的大小,故将离均差平方后再相加,称为离均差平方和。
但此值的大小除了与变异度有关外,还与变量值的个数的多少有关。
为了消除这一影响,取其均值。
3.标准差标准差(符号为σ,s)计算公式如下:总体标准差在实际工作中,总体均数不易得到,常用样本均数作为总体均数μ的估计值;用样本标准差s作为总体标准差σ的估计值,则:S=由于用代替μ,∑(X-)2比∑(X-μ)2小,用n代替N,计算标准差常比实际σ偏小,为了克服这一缺点,英国统计学家W.S.Gossett于1908年建议用n-1来代替分母中的n。
当n很大时,n-1与n相差甚微、亦可用n作分母。
上式中n-1称为自由度。
其意义是随机变量值能“自由”取值的个数。
应用标准差时应注意:①它表示变量值的离散程度。
标准差越大,变量值分布越散,均数的代表性越差,即s越大,代表性越小,反之亦然。
但当资料的度量单位不同或均数相差较大时,两组资料的标准差不能直接相比。
②常与均数结合一起描述正态分布特征。
通过±s的倍数形式来概括描述变量值的分布,可对资料的频数分布作出概括性的估计。
③按上述原理,来确定检验结果的参考区间。
CLIA’88更新规则介绍

CLIA’88的更新
• 这个要求也应用于:掉换检测系统、或仪器 (相同或不同的型号)、增加新项目、或改 变检测试剂盒的厂商时。
• 该要求不适用于2003年4月24日前实验室检测 的项目。 • 要点!实验室的技术主管或主任应参与设计 和评价性能指标检查的实验,检测系统的厂 商也可通过提供确认方案和相应的评价样品 予以协助。
CLIA’88的更新
校准: 要求校准的项目,你必须继续按照 厂商要求,进行校准和校准确认。 但是,校准确认至少半年进行一次, 在检验的可报告范围内,至少用三 个水平予以确认。
CLIA’88的更新
人员:从2003年2月24日起,高度复杂 检验的所有新的PhD主任,必须经认可 的部门确认。未经认可部门确认的PhD 主任,在2003年2月24日前,已经在高 度复杂检验中任主任的,应在原有条款 指导下,继续担任主任。有关认可的部 门清单,可以从网上查阅: /clia/direclcon. asp。担任高度复杂检验主任的M.D或 D.O资格没有改变。
CLIA’88的更新-校准
我怎样进行校准?
检测系统的说明应叙述进行校准的 过程,以及何时和多长时间进行校 准。
CLIA’88的更新-校准
进行校准用什么材料?
检测系统的说明应确定使用的校准 品号码、类型、和浓度。
CLIA’88的更新-校准确认
校准确认
在校准确认上有什么新的要求?
不,实验室总是负责校准和校准确认或“核 对”校准。但是,对中等复杂的检测系统校 准的核对过程,尚未作出规定。法规现在叙 述了怎样和何时对非简易项目(中等和高度 复杂项目)进行校准确认。 记住:每次进行标准确认都必须确保记录在 实验室的文档内。
CLIA’88的更新-校准确认
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
美国CLIA’88临床检验各专业室内质量控制文件(一)美国CLIA’88质量控制要求美国临床实验室改进修正法案最终规则(CLIA final rule)于2003年1月24日通过,2003年4月24日实施。
其中K-非豁免试验的质量体系,分析系统中493.1256标准:控制程序(control procedures)对各专业质量控制提出具体要求。
1、控制程序根据美国CLIA’88最终规则Sec.493.1256标准:控制程序(a)对于每一检测系统,实验室负责制定控制程序,监测整个分析过程的准确度和精密度。
(b)实验室必须建立检测控制物的数量、类型和频率,如果适合,实验室应按Sec.493.1256 (b)(3)规定验证或建立性能规范。
(c)控制程序必须(1)立即检测出由于检测系统故障、不利的环境条件及操作者性能而产生的误差。
(2)长期监测由于检测系统性能和环境条件改变和操作者性能变化而可能影响到的准确度和精密度性能。
(d)除了CMS批准的程序,如国家操作手册附录C中规定(CMS Pub.7)的外,提供了等效质量检测,实验室必须(1)执行本节规定的质量控制程序,除非在493.1261到493.1278部分其他专业和亚专业有其他的规定。
(2)对于每一检测系统,当他们满足或超出本节(d)(3)部分要求时,执行的质量控制程序使用厂家规定或实验室建立的个数和频率。
(3)每天检测患者标本时至少每天检测一次控制品,或执行如下的步骤(i)每一定量检测程序,包括两个不同浓度水平的控制品;(ii)对每一定性的检测程序,包括一个阴性和一个阳性控制品;(iii)对于产生分级或滴度结果的检测程序,分别包括阴性控制品和具有分级或滴度反应性的控制品;(iV)对于具有提取阶段的每一检测系统,包括两个控制品,其中一种能够检出提取阶段的误差;(v)对于每一种分子扩增程序,包括两个控制品,如果反应抑制性是假阴性结果的显著性来源,一个控制品能够检出抑制性作用。
(4)对于薄层层析(i)如果适当时,在每一板或卡上点上含有所有已知的物质或药物组的校准品,其经薄层层析识别,由实验室报告;(ii)适当时,在每板或卡上包括至少一个控制品,应与患者标本检测步骤一样处理,包括提取过程。
(5)对于每个电泳程序,和患者标本一样处理,至少有一个控制品,其含有确定或检测的物质。
(6)当引入完全改变的试剂,执行了主要的预防性维护;或更换影响试验性能的任何关键部件时,在恢复患者检测之前,应按照本节的规定进行控制品的检测。
(7)在整个检测时间内,所有进行试验的检验人员均使用相同的控制品进行检测。
(8)应与检测患者标本一样的方式来检测控制品。
(9)当校准品作为控制品时,使用与用于建立切值或校准检测系统不同批号的校准品。
(10)建立或验证所有控制品的可接受的标准。
(i)当使用的控制品提供定量的结果时,必须确定每一批号控制品的统计参数(如:均值和标准差)。
(ii)实验室可使用商品化定值的控制品,其定值是与实验室所使方法和仪器有关;实验室需要对其值进行验证。
(iii)通过长时期同时检测已有统计学参数的控制品,实验室应建立起非定值控制品的统计学参数。
(e)对于试剂、培养基和供应品的检查,实验室必须做如下的工作:(1)当制备或打开时,若合适,检查每批自制的、或商品的每个批号的试剂、培养基平板、染色液、抗血清和鉴定系统(使用两个或更多物质、或两个或更多以上的试剂、或各种组合的系统)的阳性和阴性反应性,以及反应性等级。
(2)每个工作日(除了本亚章的规定外),检查染色物质的反应性以保证出现预期的染色特征。
如适当,应包括阳性和阴性反应性的控制品。
(3)每次使用时,检查荧光和免疫组织化学染色剂对反应阴性和阳性时的反应性。
(4)在之前,或与最初同时使用(i)如果检测要求无菌,应对每一批号培养基进行无菌试验;(ii)检测每批培养基对各菌种的支持生长的能力,必要时,可选择或抑制特定的生物,或产生生化反应。
(iii)当向厂家报告培养基任何的变质时,文件记录培养基的物理特征。
(5)按照制造商说明书,使用试剂、培养基和供应品,并对检验结果负责。
(f)在报告患者试验结果之前,控制品的结果必须满足实验室的,以及必要时,厂家检测系统可接受准则的要求。
(g)实验室必须记录执行的所有控制程序。
(h)如果无法获得控制品,实验室必须有替代机制检出即刻的误差及长期监测检测系统性能。
必须文件记录替代控制程序的性能。
2、 Sec.493.1261标准:细菌学(a)实验室必须使用控制生物体来检查下列的阳性和阴性的反应性:(1)每日检查所使用的β-内酰胺酶。
(2)每周要检查所做的革兰染色。
(3)当制备或打开每一批(实验室自制)、批号(商品制备)和抗血清的运输时,需要每6个月检查一次。
(b)对于抗生素敏感试验,实验室必须在之前、同时、最初使用时,使用批准的控制生物体,来检查每批培养基、抗生素。
(1)对于每天进行的试验,实验室必须使用适当的控制的生物体来检查程序。
(2)在报告患者结果之前,实验室控制生物体的区带大小或最低抑制浓度必须在规定的界限之内。
(c)实验室必须文件记录如本节规定执行的所有控制程序。
3、Sec.493.1262标准:分枝杆菌学(a)每日检查,实验室必须用至少一种快酸生物体,其可产生阳性反应和一种快酸生物体产生阴性反应来检查用于分枝杆菌鉴定的所有试剂或检测程序。
(b)对于抗分枝杆菌敏感试验,实验室必须在之前、或同时在最初使用,使用批准的控制生物体,来检查每批培养基、抗分支杆菌剂。
(1)实验室必须建立可接受控制结果的界限。
(2)每周执行的试验,实验室必须使用适当的质控生物体来检查程序。
(3)在报告患者结果之前,控制生物体的结果必须在建立的界限之内。
(c)实验室必须文件记录如本节规定执行的所有控制程序。
4、Sec.493.1263标准:真菌学(a)当制备或打开时,用控制生物体检查每批自制的、或商品的每个批号的试剂和乳(酸)酚棉蓝的运输的反应性。
(b)对于真菌敏感试验,实验室必须在之前或同时、最初使用,使用适当的控制生物体,来检查每一批号的培养基、抗真菌试剂。
(1)实验室必须建立可接受质控结果的界限。
(2)每天执行的试验,实验室必须使用适当的质控生物体来检查程序。
(3)在报告患者结果之前,质控生物体的结果必须在建立的界限之内。
(c)实验室必须文件记录如本节规定执行的所有控制程序。
5、Sec.493.1264标准:寄生虫学(a)实验室必须具有可获得的参考标本的载物片或照片,如果可获得寄生虫鉴定的粗的标本,可使用这些作为实验室与诊断标本进行适当比较的参考。
(b)实验室必须校准和使用校准的目镜测微计来确定卵和寄生虫的大小,如果大小是关键参数。
(c)每月使用,实验室必须使用粪便样本控制品检查永久的染色将证实染色特征。
(d)实验室必须文件记录如本节规定执行的所有控制程序。
6、Sec.493.1265标准:病毒学(a)当使用细胞培养来分离或鉴定病毒时,实验室必须同时培养一种细胞底物的控制品或非接种的细胞作为阴性控制品。
(b)实验室必须文件记录本节规定的执行的所有控制程序。
7、Sec.493.1267标准:常规化学对于血气分析,实验室必须执行如下步骤:(a)根据厂家的说明书和厂家推荐的最少的频次进行校准或验证校准。
(b)每8小时检测一个控制品样本,每天检测应使用低和高值的控制品。
(c)除非自动化仪器至少每30分钟内部验证校准,每次检测标本都应同时测一份控制品。
(d)文件记录本部分规定的执行的所有控制程序。
8、Sec.493.1269标准:血液学(a)对于使用血球计数器手工进行细胞计数的(1)每8个小时操作必须检测一个控制品。
(2)患者标本和控制品必须进行双份检测。
(b)对于所有非手工的凝血检测系统,每8个小时的操作和每次更换试剂,实验室必须包括两个水平的控制品。
(c)对于手工凝血试验(1)在检测患者样本和每次更换试剂之前,每次执行的试验必须检测两个水平的控制品;(2)患者标本和控制品必须以双份进行检测。
(d)实验室必须文件记录本节规定的所执行的所有控制程序。
9、Sec.493.1271 标准:免疫血液学(a)患者检测(1)实验室必须按照厂家的说明书执行AB0型,D(Rho)型,未预见到抗体检测、抗体识别和相容性试验,如果适用,从21 CFR 606.151(a)到(e)。
I(2)实验室必须通过用抗-A和抗-B试剂与未知红细胞同时进行检测来确定AB0 血型。
对于确认AB0血型,用已知Al和B红细胞与未知血清进行检测。
l(3)实验室必须通过未知红细胞与抗-D(抗-RhD)血型试剂一起检测来确定D(RhD)型(b)免疫血液学检测和血液和血制品的分配。
血液和血产品的检测和分配必须遵守21 CFR 606.100(b)(12);606.160(b)(3)(ii)和(b)(3)(v);610.40;640.5(a),(b),(c),和(e);和640.11(b)。
(c)血液和血液产品的保存。
血液和血液产品必须保存在适当的条件下,应包括适当的温度警报系统,并定期对其检查。
(1)可听见的警报系统必须监测适当的血液和血液产品24小时时间内的保存温度。
(2)必须文件记录警报系统的检查。
(d)保留输血的样本。
根据实验室已建立的程序,输完血的每一单位的样本必须保留为出现输血反应后的进一步检测。
实验室必须立即处理已过有效期不用保留作进一步检测的血液。
(e)输血反应的调查。
(1)根据其已建立的程序,实验室执行相容性试验,或发出血液或血液产品,必须迅速地调查机构内发生的所有输血反应,机构有调查责任及给医护人员提供关于输血程序改进的建议。
(2)若适用时,实验室必须文件记录采取所有必需的纠正措施,防止输血反应的再发生,以及审核所有的政策和程序确保它们对于保证输血安全是适当的。
(f)实验室必须文件记录本节规定的所执行的所有控制程序。
(二)临床化学检验质量控制根据美国CLIA’88最终规则规定的质量控制程序如下:每一定量检测程序,包括两个不同浓度的控制品。
通过上述的质量控制方法选择和设计指南(允许总误差、不精密度和不准确度,90%误差检出概率和小于5%的假失控概率等)对常规化学检验项目设计质控方法,其误差检出概率可满足要求。
如果选择的质控方法其误差检出概率处于中度和低度的情况,根据全面质控策略(total QC strategy),可采用其他的质量控制方法和质量改进措施。
(三)临床血液学检验质量控制其统计质控方法设计方案同常规化学检测项目。
由于控制品有效期较短,不可能完全使用上述临床化学使用的绘制质控图方法,此时可采用短期控制品绘制质控图的方式,另一方面可采用保留患者样品、患者样品双份测定的方法进行质量控制。
