专题01 锂电池-2019高考复习专题——电化学(原卷版)
历年高考化学锂(离子)电池试题汇编

2006-2019年高考化学锂(离子)电池试题汇编1.(2018全国卷Ⅲ,11)一种可充电锂-空气电池如图所示。
当电池放电时,O 2与Li +在多孔碳材料电极处生成Li 2O 2-x (x =0或1)。
下列说法正确的是A.放电时,多孔碳材料电极为负极B.放电时,外电路电子由多孔碳材料电极流向锂电极C.充电时,电解质溶液中Li +向多孔碳材料区迁移D.充电时,电池总反应为Li 2O 2-x =2Li+(1-0.5x )O 2【答案】D【解析】由题意知,放电时负极反应为Li -e -===Li +,正极反应为(2-x )O 2+4Li ++4e -===2Li 2O 2-x (x =0或1),电池总反应为1-x 2O 2+2Li===Li 2O 2-x 。
该电池放电时,金属锂为负极,多孔碳材料为正极,A 项错误;该电池放电时,外电路电子由锂电极流向多孔碳材料电极,B 项错误;该电池放电时,电解质溶液中的Li+向多孔碳材料区迁移,充电时电解质溶液中的Li +向锂材料区迁移,C 项错误;充电时电池总反应为Li 2O 2-x ===2Li +(1-x 2)O 2,D 项正确。
2.(2018浙江卷,17)锂(Li)—空气电池的工作原理如图所示下列说法不正确...的是A.金属锂作负极,发生氧化反应B.Li +通过有机电解质向水溶液处移动C.正极的电极反应:O 2+4e —==2O 2—D.电池总反应:4Li+O 2+2H 2O==4LiOH【答案】C【解析】金属锂失电子作负极,发生氧化反应,A 正确;在原电池内电路中,阳离子向正极运动,B 正确。
正极浸在电解质水溶液中,故正极反应为:O 2+4e —+2H 2O=4OH —C 错误;电池总反应4Li+O 2+2H 2O=4LiOH ,D 正确。
3.(2017全国III.11)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a 常用掺有石墨烯的S 8材料,电池反应为16Li +x S 8===8Li 2S x (2≤x ≤8)。
2019年高考化学必刷题 考点43 锂电池 含解析

2019年高考化学必刷热考题考点43 锂电池1.全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2⩽x⩽8).下列说法错误的是( )A.电池工作时,正极可发生反应:2Li2S6+2Li++2e−=3Li2S4B.电池充电时间越长,电池中的Li2S2量越多C.石墨烯的作用主要是提高电极a的导电性D.电池工作时,外电路中流过0.04mol电子,负极材料减重0.28g【答案】B2.LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。
电池反应为FePO4+Li=LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。
下列有关LiFePO4电池说法正确的是( ) A.可加入硫酸以提高电解液的导电性B.放电时电池内部Li+向负极移动C.充电过程中,电池正极材料的质量增加D.放电时电池正极反应为FePO4+Li++e-=LiFePO4【答案】D【解析】A.金属锂可以和硫酸发生化学反应,所以不能加入硫酸以提高电解质的导电性,故A错误;B.放电时,该装置是原电池,原电池中阳离子移向正极,故B错误;C.充电时,正极LiFePO4= FePO4+Li++e-,正极材料LiFePO4被消耗,质量减少,故C错误;D.放电时,该装置是原电池,正极发生还原反应: FePO4+Li++e-=LiFePO4,故D正确;综上所述,本题选D。
3.热激活电池可用作火箭、导弹的工作电源。
一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。
该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。
下列有关说法不正..确.的是A.放电时,电子由Ca电极流出B.放电过程中,Li+向PbSO4电极移动C.每转移0.2mol电子,理论上生成20.7 g PbD.负极反应式:PbSO4+2e-+2Li+=Li2SO4+Pb【答案】D4.锂电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。
2019年高考电化学试题解析及相应知识点归纳16页word文档

1、(全国II卷理综化学10)右图为直流电源电解稀Na2SO4水溶液的装置。
通电后在石墨电极a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是()A.逸出气体的体积a电极的小于b电极的B.一电极逸出无味气体,另一电极逸出刺激性气味气体C.a电极附近呈红色,b电极附近出现蓝色D.a电极附近呈蓝色,b电极附近出现红色【标准答案】10.D【试题解析】惰性电极电解硫酸钠溶液实质是电解水,根据电池符号判断电解池的阴阳极分别是a和b,a 电极(阴极)的电极反应式为:4H+ +4e- =2H2↑,修正为:4H2O+4e- =2H2↑+4OH- ,即a电极附近的溶剂水分子得电子放出氢气的同时产生大量的OH-,使得a电极附近呈蓝色(紫色石蕊遇到碱呈蓝色);b电极(阳极)的电极反应式为:4OH- -4e- =2H2O+O2↑,修正为:2H2O-4e- =O2↑+4H+ ,即b电极附近的溶剂水分子失电子放出氧气的同时产生大量的H+,使得b电极附近呈红色(紫色石蕊遇到酸呈红色);电解的总反应式为:2H2O电解2H2↑+O2↑,所以A、B、C都错。
【相关知识点归纳】了解铜的电解精炼、镀铜、氯碱工业反应原理也是考纲要求。
惰性电极电解电解质溶液要考虑的7个问题是:①参与电极反应的物质是谁?溶质或溶剂或者溶质和溶剂。
②电解产物有哪些物质?③电解前后溶液的pH变化?④电解一段时间后,电解质溶液的复原方法?⑤溶质完全参与电极反应后,根据阴极质量的增重或阳极析出的气体的体积(在标准状况下的体积)求溶液的pH 。
⑥会书写阴阳极的电极反应式和总的电解反应式。
⑦会判断两极滴入酸碱指示剂(石蕊、酚酞)或放一块润湿的淀粉KI试纸的现象。
2、(四川延迟考试卷理综9)在碱性锌锰干电池中,已知氢氧化钾为电解质,发生的电池总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2下列该电池的电极反应正确的是()A.负极反应为Zn-2e-=Zn2+ B.负极反应为Zn+2H2O-2e-= Zn(OH)2+H+C.正极反应为2MnO2+2H++ 2e-=2MnOOH D.正极反应为2MnO2+2H2O + 2e-=2MnOOH+2OH-[答案] D.[相应知识点归纳]检查电极反应式的方法:⑴.负极发生氧化反应,正极发生还原反应。
锂离子电池电化学原理考核试卷

五、主观题(本题共4小题,每题10分,共40分)
1.请简述锂离子电池的工作原理,并说明在放电过程中,锂离子是如何在正负极之间移动的。
2.描述锂离子电池在过充和过放状态下可能发生的化学反应,以及这些反应对电池性能和安全性造成的影响。
20.以下哪个不是锂离子电池的优点?()
A.高能量密度
B.低自放电率
C.无记忆效应
D.价格昂贵
(答题区域结束)
二、多选题(本题共20小题,每小题1.5分,共30分,在每小题给出的四个选项中,至少有一项是符合题目要求的)
1.锂离子电池的负极材料在放电过程中会发生哪些变化?()
A.锂离子从负极材料中脱嵌
A.过充
B.过放
C.短路
D.所有的上述情况
11.锂离子电池在存储过程中,以下哪种做法是正确的?()
A.完全充满电状态存储
B.完全放电状态存储
C. 30%-50%电量存储
D.可以随意存储
12.锂离子电池的充放电效率是多少?()
A. 50%
B. 70%
C. 85%
D. 95%
13.锂离子电池的倍率性能是指什么?()
3. √
4. ×
5. ×
6. ×
7. ×
8. ×
9. √
10. ×
五、主观题(参考)
1.锂离子电池工作原理是通过锂离子在正负极之间的脱嵌实现充放电。放电时,锂离子从负极移动到正极,嵌入正极材料中。
2.过充时可能发生正极材料结构变化和电解质分解,影响电池性能和安全;过放可能导致负极锂离子过度脱嵌,电池内阻增加。
5.为了防止锂离子电池过充,电池管理系统中会设置______。()
2019高考化学二轮冲刺复习精讲第一部分必考部分第6讲电化学基础真题追踪含解析

1/17第6讲电化学根底考向一新型化学电源的分析与推断1. 〔2021 •全国卷H〕我国科学家研发了一种室温下“可呼吸〞的Na—CO 2二次电池.将NaCIO4溶于有机溶剂作为电解液,钠和负载碳纳米管的锲网分别作为电极材料,电池的总反响为:3C02+4Na2Na 2C03 + Co以下说法错误的选项是0 A.放电时,CI04向负极移动B.充电时释放CO 2,放电时吸收C.2C.放电时,正极反响为:3CO2+4e===2CO3 + CD.充电时,正极反响为:Na + e===Na[解析]高氯酸根离子是阴离子,电池放电时为原电池装置,阴离子向负极移动,A正确;由题图结合电池总反响知,充电时释放二氧化碳,放电时吸收二氧化碳,B正确;放电时,正极反响可以理解为"CO2/172得到4e复原为C,余下的两个.进一步结合CO 2生成CO 3 〞:3CO2 + 4e===2CO3 + C, C正确;充电时电池的正极与外接电源的正极相连,作电解池的阳极,发生失电子的氧化反响,应为碳失电子生成CO2, D错误.[答案]D2.〔2021 •全国卷H〕全固态锂硫电池能量密度高、本钱低,其工作原理如下图,其中电极a常用掺有石墨烯的S8材料,电池反响为:16Li+xS 8===8Li 2Sx〔2<x<8〕.以下说法错误的选项是0 A.电池工作时,正极可发生反应:2Li 2s6+2Li+2e===3Li 2S4B.电池工作时,外电路中流过0.02mol电子,负极材料减重0.14 gC.石墨烯的作用主要是提升电极a的导电性D.电池充电时间越长,电池中Li3/172s 2的量越多[解析]原电池工作时,正极发生一系列得电子的复原反响,即:Li 2s 8fLi2s 6fLi2s 4fLi2S2,其中可能有2Li 2s6+2Li + 2e===3Li 2S4, A项正确;该电池工作时,每转移0.02 mol电子,负极有0.02 mol Li〔质量为O14g〕被氧化为Li,那么负极质量减少0.14g, B项正确;石墨烯能导电,用石墨烯作电极,可提升电极a的导电性,C项正确;充电过程中,Li 2S2的量逐渐减少,当电池充满电时,相当于到达平衡状态,电池中Li 2S2的量趋于不变,故不是电池充电时间越长,电池中Li 2s4/172的量越多,D项错误.[答案]D3. (2021 •全国卷I )微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如下图.以下有关微生物电池的说法错误的选项是()++ -+ -A.正极反响中有CO 2生成B.微生物促进了反响中电子的转移C.质子通过交换膜从负极区移向正极区D.电池总反响为 C 6H 120 6 + 60 2===6CO 2 + 6H 20[解析]由题意可知,微生物电池的原理是在微生物作用下.2与C5/176H 1206发生氧化复原反响,将化学能转化为电能,B正确;氧气在正极反响,由于质子交换膜只允许H通过,那么正极反响为:02+4e + 4H===2H 20,没有CO2生成,A项错误;负极发生反响:C6H 1206-24e --------- F + + 6H 2O===6CO2 + 24H, H在负极区生成,移向正极区,在正极被消耗,C项正确;总反响+ +为:C 6H 120 6 + 60 2===6CO 2 + 6H20, D项正确.[答案]A4. (1)(2021 •天津卷)CO6/172是一种廉价的碳资源,其综合利用具有重要意义.答复以下问题:2辅助的Al —C.2电池工作原理如下图.该电池电容量大,能有效利用C.2, 电池反响产物Al 2(C 20 4)3是重要的化工原料.电池的负极反响式:o电池的正极反响式:6O2 + 6e===6O2; 6CO2 + 6O 2===3C 20 4+ 60 2反响过程中.2的作用是o该电池的总反响式:o7/17〔2〕〔2021 •北京卷〕实验证实Ag + Fe===Ag + Fe能发生,装置如下图.其中甲溶液是,操作及现象是o〔3〕〔2021 •江苏卷〕铁炭混合物在水溶液中可形成许多微电池.将含有Cr 207的酸性废水通过铁炭混合物,在微电池正极上Cr 20 7转化为Cr〔4〕〔2021 •天津卷〕氢能是开展中的新能源,它的利用包括氢的制备、储存和应用三个环节.答复以下问题:与汽油相比,氢气作为燃料的优点是__________________________________〔至少答出两点〕.但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反响式:.〔5〕〔2021 •四川卷〕FeS.4在一定条件下可制得FeS2〔二硫化亚铁〕纳米材料.该材料可用于制造高容量锂电池,电池放电时的总反响为4Li + FeS2===Fe + 2Li 2S,正极反响式是o 2 — 3 + 2—F2 + 3+_____ 2 _,其电极反响式为[解析](1)0 2辅助的Al —CO8/172电池中,AI是活泼金属,作负极,发生氧化反响,电极反响式为Al —3e二二二AI.由电池的正极反响式可知,02先生成0 2, 02与C02反响生成C2.4—3+ ——2—和0 2,据此推测,该过程中.2的作用是催化剂.根据正、负极反响式及得失电子守恒得电池的总反响式为2AI + 6CO2===AI 2(C 20 4)3o[答案]3e===AI(或2A— 6e===2AI)催化剂2AI + 6CO 2===AI2(C2O 4) 3(2)FeSO9/174溶液取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色更深.⑶Cr 207 + 14H + 6e===2Cr+7H 20⑷污染小,可再生,来源广,资源丰富,燃烧热值高(任写其中2 个)H2 + 2OH-2e ——2— + —3 +一3+—3 + ===2H 20 (5)FeS2+4Li+4e===Fe + 2Li 2s(或FeS 2+4e===Fe + 2S)考向二电解原理在工农业生产中的应用5. (2021 •全国卷H)用电解氧化法可以在铝制品外表形成致密、耐腐蚀的氧化膜,电+ ——2-解质溶液一般为H 2SO 4—H 2C10/17204混合溶液.以下表达错误的选项是0A.待加工铝质工件为阳极B.可选用不锈钢网作为阴极C.阴极的电极反响式为:AI + 3e===AID.硫酸根离子在电解过程中向阳极移动[解析]利用电解氧化法在铝制品外表形成致密的AI 203薄膜,即待加工铝质工件作阳极,A项正确;阴极与电源负极相连,对阴极电极材料没有特殊要求,可选用不锈钢网等,B项正确;电解质溶液呈酸性,阴极上应是H放电,C项错误;在电解过程中,电解池中的阴离子向阳极移动,D项正确.[答案]C6.(2021 •全国卷I)焦亚硫酸钠(Na 2s 205)在医药、橡胶、印染、食品等方面应用广泛.答复以下问题:制备Na 2s 205也可采用三室膜电解技术,装置如下图,其中S.11/172碱吸收液中含有NaHSO 3和Na 2S03.阳极的电极反响式为+3+-电解后,室的NaHSO3浓度增加.将该室溶液进行结晶脱水,可得到Na 2s 20 5.[解析]装置图中左侧与电源正极相连,为三室膜电解槽的阳极, 由于阳极室的溶液为稀硫酸,故阳极发生的反响为2H2O-4e===4H + O2 t ,生成的H穿过阳离子交换膜进入a室与S0 2碱吸收液中的S0 3反响生成HS.3,那么a室中NaHSO 3浓度增加.[答案]2H 2O-4e===4H + O12/17 2 t a-+2——- + +7. (1)(2021 •浙江卷)研究证实,C02也可在酸性水溶液中通过电解生成甲醇,那么生成甲醇的反响发生在极,该电极反响式是O(2)(2021 •天津卷)化工生产的副产物氢也是氢气的来源.电解法制取有广泛用途的通电Na 2FeO4,同时获得氢气:Fe + 2H 2O + 2OH=====FeO 4 + 3H2t ,工作原理如图1所示.装置通电后,铁电极附近生成紫红色FeO4,银电极有气泡产生.假设氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质.:Na2FeO4只在强碱性条件下稳定,易被H 2复原.13/17①电解一段时间后,c(OH)降低的区域在(填“阴极室〞或“阳极室〞②电解过程中,须将阴极产生的气体及时排出,其原由于③ c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na 2FeO4)低于最高值的原因:o[解析](1)根据题意,二氧化碳在酸性水溶液中通过电解生成甲醇,C0 2中C呈+ 4价,CH30H中C呈一2价,结合反响前后碳元素化合价变化,可知碳元素的化合价降低,得到电子,故该电极为阴极,电极反响式为co2 + 6H + 6e===CH 30H + H20o⑵①根据题意,银电极有气泡产生是H得电子生成H2,发生复原反响,那么铁电极上0H发生氧化反响,溶液中的0H 减少,因此电解一段时间后,c(OH)降低的区域在阳极室.②H2具有复原性,根据题意:Na 2FeO4只在强碱性条件下稳定,易被H2复原.因此,电解过程中,须将阴极产生的气体及时排出,防止Na14/172FeO 4 与H2反响使产率降低.③根据题意Na 2FeO4只在强碱性条件下稳定,在M点:c(OH)低,Na 2FeO4稳定性差,且反响慢;在N点:c(OH)过高,铁电极上有Fe(OH)3生成,使Na2FeO4产率降低.[答案]⑴阴CO 2 + 6H + 6e===CH 30H + H 20(2)①阳极室②预防Na 2FeO 4与H2反响使产率降低③M点:c(OH)低,Na 2FeO4稳定性差,且反响慢或N点;c(OH)过高,铁电极上有Fe(0H)3或(Fe203)生成,使Na2FeO4产率降低考向三金属的腐蚀与防护8.(2021 •上海卷)研窕电化学腐蚀及防护的装置如下图.以下有关说法错误的选项是0A. d为石墨,铁片腐蚀加快B. d为石墨,石墨上电极反响为:.2 + 2H 2O + 4e=二二40HC. d为锌块,铁片不易被腐蚀一一+ -+ -+ --2一一2-D. d为锌块,铁片上电极反响为:2H + 2e===H2 f16/17[解析]A项,当d为石墨时,铁片为负极,腐蚀加快,正确;B项,当d为石墨时,石墨为原电池的正极,其电极反响为02 + 2H2O+4e===4OH,正确;C项,当d为锌块时,铁片为原电池的正极而受到保护,称为牺牲阳极的阴极保护法,正确;D项,当d为锌块时,铁片为正极,电极反响为:02 + 2H2O+4e===4OH,错误.[答案]D9.〔2021 •福建卷〕铁及其化合物与生产、生活关系密切.右图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.⑴该电化学腐蚀称为.⑵图中A、B、C、D四个区域,生成铁锈最多的是〔填字母〕. [解析]⑴海水接近于中性,那么铁闸发生的是吸氧腐蚀.〔2〕外表海水中.2浓度较大,腐蚀得较快,故B处产生的铁锈最多.[答案]⑴吸氧腐蚀〔2〕B题型特点:选择题填空题考向评析:常以新型电源为命题背景,考查原电池的构成及工作原理;以电解原理在工农业生产中的应用为背景,考查电解池的工作原理及电解规律;以贴近日常生活的实例为背景,考查两种电化学腐蚀的原理及区别以及常见防腐方法.17/17做题启示:二轮复习时应抓住燃料电池中介质对电极反响式的影响;新型高能充电电池四个电极式的关系等命题要点进行落实, 强化电极方程式书写练习. ----------+-。
2019年化学高考真题试题分类汇编:电化学基本原理(精编+解析版)

化学高考真题试题分类汇编电化学基本原理试题部分1.【2018新课标1卷】最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。
示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:①EDTA-Fe2+-e-=EDTA-Fe3+②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+该装置工作时,下列叙述错误的是A.阴极的电极反应:CO2+2H++2e-=CO+H2OB.协同转化总反应:CO2+H2S=CO+H2O+SC.石墨烯上的电势比ZnO@石墨烯上的低D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性2.【2018新课标2卷】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。
将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na2Na2CO3+C。
下列说法错误的是A.放电时,ClO4-向负极移动B.充电时释放CO2,放电时吸收CO2C.放电时,正极反应为:3CO2+4e−=2CO32-+CD.充电时,正极反应为:Na++e−=Na3.【2018新课标3卷】一种可充电锂-空气电池如图所示。
当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。
下列说法正确的是A.放电时,多孔碳材料电极为负极B.放电时,外电路电子由多孔碳材料电极流向锂电极C.充电时,电解质溶液中Li+向多孔碳材料区迁移D.充电时,电池总反应为Li2O2-x=2Li+(1-)O24.【2018北京卷】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl 溶液)。
下列说法不正确...的是A.对比②③,可以判定Zn保护了FeB.对比①②,K3[Fe(CN)6]可能将Fe氧化C.验证Zn保护Fe时不能用①的方法D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼5.【2017新课标1卷】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。
专题01化学用语(原卷版)

专题01 化学用语化学用语包括元素符号、化学式及化合价、离子符号、结构示意图或元素周期方块、化学方程式等。
在考试中,每种题型都会应用到化学用语。
专题训练一、选择题(20小题)1.(2022年河北省九地市中考模拟)下列化学用语正确的是()A.两个钙离子:2Ca+2B.氖气:Ne2C.在氧化钙中钙元素的化合价为+2价:+2CaO D.两个氧气分子:2O2.(2022年江苏省苏州市中考模拟)新型锂离子电池的主要成分是LiFePO4,已知锂(Li)的化合价为+1价,Fe的化合价为+2,则LiFePO4中P的化合价是()A.+2B.+3C.+5D.+63.(2022年湖北省黄冈孝感咸宁三市中考一模)下列化学用语表示正确的是()A.两个氢分子: 2H B.三个氮原子: 3NC.一个镁离子: Mg+2D.氧化钠中氧元素的化合价: 2-Na O24.(2022年湖北省荆州市第二次调研质检考试模拟)新冠病毒的传播严重危害人类健康。
在人群密集的区域通常用“84”来消毒,可以有效杀灭新冠病毒,其主要成分是次氯酸钠(NaClO),其中氯元素的化合价为()A.1价B.0价C.+1价D.+5价6.(2022年广东省深圳市中考一模)下列化学用语正确的是()A.镁离子——Mg2+B.三个氮原子——3HC.水银——Hg D.氯酸钾——KCl7.(2022年湖北省荆州市第二次调研质检考试模拟)下列化学用语所表达的意义正确的是()A.N2—2个氮原子B.Fe3+—铁离子C.2SO3—两个二氧化硫分子D.2Ca—2个钙元素7.(2022年辽宁省沈阳市实验学校中考一模)下列物质的俗名与化学式对应关系正确的是()Ca(OH)B.小苏打:NaHCO3A.生石灰:2C.氯化铁:FeCl2D.纯碱:NaOH8.(2022年江苏省苏州市中考模拟)下列物质的化学式书写正确的是()A.氯化钡BaCl B.硫酸H2SO3C.小苏打NaHCO3D.硫酸铝Al3(SO4)29.(2022年辽宁省沈阳市实验学校中考一模)下列化学用语正确的是()A.2个氮气分子:2N B.二氧化氯:ClO2C.2个亚铁离子:2Fe3+D.60个碳原子:C6010.(2022年湖北省黄冈孝感咸宁三市中考一模)在抗击“新冠肺炎”的药物中有一种药物磷酸氯喹(C18H32ClN3O8P2),它是白色的粉末,无嗅味苦,遇光变色,熔点200℃,易容于水,水溶液pH 3.84.3,不溶于乙醇乙醚。
高中电化学复习专题
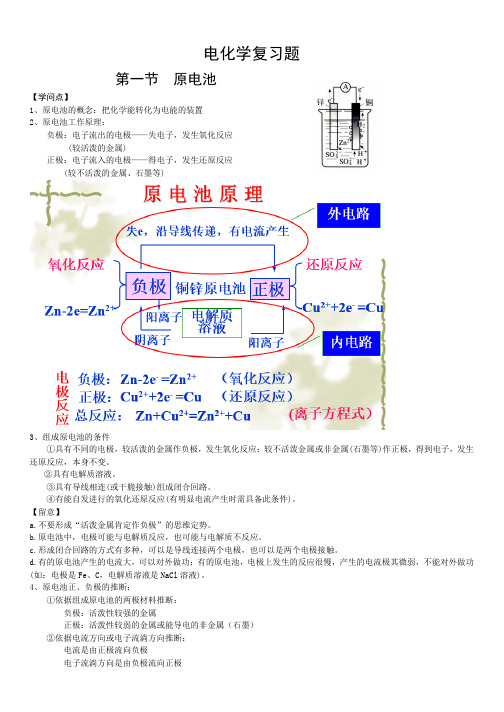
电化学复习题第一节原电池【学问点】1、原电池的概念:把化学能转化为电能的装置2、原电池工作原理:负极:电子流出的电极——失电子,发生氧化反应(较活泼的金属)正极:电子流入的电极——得电子,发生还原反应(较不活泼的金属、石墨等)3、组成原电池的条件①具有不同的电极,较活泼的金属作负极,发生氧化反应;较不活泼金属或非金属(石墨等)作正极,得到电子,发生还原反应,本身不变。
②具有电解质溶液。
③具有导线相连(或干脆接触)组成闭合回路。
④有能自发进行的氧化还原反应(有明显电流产生时需具备此条件)。
【留意】a.不要形成“活泼金属肯定作负极”的思维定势。
b.原电池中,电极可能与电解质反应,也可能与电解质不反应。
c.形成闭合回路的方式有多种,可以是导线连接两个电极,也可以是两个电极接触。
d.有的原电池产生的电流大,可以对外做功;有的原电池,电极上发生的反应很慢,产生的电流极其微弱,不能对外做功(如:电极是Fe、C,电解质溶液是NaCl溶液)。
4、原电池正、负极的推断:①依据组成原电池的两极材料推断:负极:活泼性较强的金属正极:活泼性较弱的金属或能导电的非金属(石墨)②依据电流方向或电子流淌方向推断:电流是由正极流向负极电子流淌方向是由负极流向正极③依据原电池两极发生的变更来推断:负极:失电子发生氧化反应 正极:得电子发生还原反应 ④依据电极反应现象负极:不断溶解,质量削减正极:有气体产生或质量增加或不变5、金属活泼性的推断:①金属活动性依次表②原电池的负极(电子流出的电极,质量削减的电极)的金属更活泼 ;③原电池的正极(电子流入的电极,质量不变或增加的电极,冒气泡的电极)为较不活泼金属 6、原电池的电极反应:(难点)a. 负极反应:X -ne -=X n+b. 正极反应:溶液中的阳离子得电子的还原反应 7、有盐桥的原电池盐桥是将热的琼脂溶液(可以是KCl 溶液或可以是NH 4NO 3溶液)倒入U 形管中(不能产生裂隙),将冷后的U 形管浸泡在KCl 饱和溶或NH 4NO 3溶液中制得。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题一锂电池1.锂海水电池常用在海上浮标等助航设备中,其示意图如图所示。
电池反应为2Li+2H2O===2LiOH+H2↑。
电池工作时,下列说法错误的是()A. 金属锂作负极B. 电子从锂电极经导线流向镍电极C. 海水作为电解质溶液D. 可将电能转化为化学能2.某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如下图所示,已知电池总反应为:2Li+ SO2Cl2= 2LiCl+SO2↑。
下列叙述中错误的是A. 电池工作时负极材料是Li,发生氧化反应B. 电池工作时电子流向:锂电极→导线→负载→碳棒C. 电池工作时,外电路流过0.2 mol电子,标准状况下生成4.48 L气体D. 电池工作过程中,石墨电极反应式为SO2Cl2+2e-=2Cl-+SO2↑3.下图是采用新能源储能器件将CO2 转化为固体产物,实现CO2 的固定和储能灵活应用的装置。
储能器件使用的Li-CO2电池组成为钌电极/CO2-饱和LiClO4-DMSO电解液/锂片。
下列说法正确的是A. Li -CO2 电池电解液由LiClO4和DMSO溶于水得到B. CO2 的固定中,每转移8 mole-,生成3mol气体C. 过程Ⅱ中电能转化为化学能D. 过程Ⅰ的钌电极的电极反应式为2Li2CO3 +C-4e-=4Li++3CO2↑4.中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下图1,电池的工作原理如下图2。
下列有关说法正确的是A. 放电时,纸张中的纤维素作锂电池的正极B. 开关K闭合给锂电池充电,X为直流电源负极C. 放电时,Li+由正极经过有机电解质溶液移向负极D. 充电时,阳极的电极反应式为:Li2O2+2e-=O2↑+2L i+5.锂电池的构造如图所示,电池内部“→”表示放电时Li+的迁移方向,电池总反应可表示为:Li1-x CoO2+Li x C6 LiCoO2+6C,下列说法错误的是()A. 该电池的负极为LiCoO2B. 充电时Li+向C电极电极移动C. 充电时的阴极反应:Li1-x CoO2+xLi++xe-===LiCoO2D. 外电路上的“→”表示放电时的电子流向6.近几年科学家发明了一种新型可控电池一一锂水电池,工作原理如图所示。
下列有关说法不正确的是A. 电极a的材料是LiB. 电极b上发生还原反应,气体N是氢气C. 消耗锂的质量为14 g 时,产生22.4L气体ND. 该装置是一次电池7.锂空气电池放电时的工作原理如图所示。
下列叙述正确的是A. 放电时Li+由B极向A极移动B. 电池放电时总反应方程式为4Li+O2 +2H2O===4LiOHC. 电解液a、b之间可采用阴离子交换膜8.锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是A. 整个反应过程中,氧化剂为O2B. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-C. 放电时,当电路中通过0.1 mol电子的电量时,有0.1 mol Li+透过固体电解质向Cu极移动,有标准状况下1.12 L氧气参与反应D. 通空气时,铜被腐蚀,表面产生Cu2O9.锂空气充电电池有望成为电动汽车的实用储能设备。
工作原理示意图如下,下列叙述正确的是A. 该电池工作时Li+向负极移动B. Li2SO4溶液可作该电池电解质溶液C. 电池充电时间越长,电池中Li2O 含量越多D. 电池工作时,正极可发生: 2Li+ +O2+ 2e-=Li2O210.Li-Cu-空气燃料电池的原理示意如图,电池通入空气腐蚀铜电极而产生正极反应物Cu2O。
下列有关说法正确的是A. 电池工作时,正极上有金属锂析出B. 电池工作时,负极区溶液中c(OH-)增大C. 电池放电过程中的总反应为:2Cu+2Li++2OH-=2Li+Cu2O+H2OD. 停止通入空气一段时间,电池将停止放电11.一种新型的“锂-呼吸CO2电化学装置”的结构如下图所示,下列说法正确的是A. 该装置可由电能转变为化学能B. 利用该技术可减少温室气体CO2的排放C. 正极的电极反应为:C2O42--2e-=2CO2D. 每生成10.2gLi2C2O4,有0.2molLi+从正极迁移至负极12.金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度。
它无电时也无需充电,用作燃料电池时,可更换正极的水性电解液和卡盒以及负极的金属锂就可以连续使用,分离出的氢氧化锂可采用电解其熔融物法回收锂而循环使用。
其工作示意图见图,下列说法不正确的是A. 放电时,负极的电极反应式为Li-e-=Li+B. 熔融的氢氧化锂用惰性电极电解再生时,金属锂在阴极得到C. 有机电解液可以是乙醇等无水有机物D. 放电时,正极的电极反应式为:2H2O+O2+4e-=4OH-13.锂空气电池充放电基本原理如图所示,下列说法不正确的是A. 充电时,锂离子向阴极移动B. 充电时阴极电极反应式为Li++e-===LiC. 放电时正极电极反应式为O2+4e-+2H2O===4OH-D. 负极区的有机电解液可以换成水性电解液14.某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如图所示,已知电池反应为:2Li+SO2Cl2=2LiCl+SO2↑。
下列叙述中错误的是A. 电池工作时负极材料是Li,发生氧化反应B. 将电解质溶液改为LiCl的水溶液,电池性能会更好C. 电池工作时电子流向:锂电极→导线→负载→碳棒D. 电池工作过程中,石墨电极反应式为SO2Cl2+2e−=2Cl−+SO2↑15.新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。
下列说法正确的是A. Li+穿过固体电解质向正极移动而得到LiOH溶液B. 放电时,当外电路中有1 mol e-转移时,水性电解液离子总数增加N AC. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗11.2 L O2D. 放电时,负极反应式:Li-e-+OH-=LiOH16.锂碘电池的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电解质是熔融薄膜状的碘化锂,正极的电极反应式为P2VP·nI2+2e-+2Li+=P2VP·(n-1)I2+2LiI。
下列说法正确的是A. 该电池放电时,锂电极发生还原反应B. 该电池发生的总反应为2Li+P2VP·nI2=P2VP·(n-1)I2+2LiIC. P2VP和I2的复合物是绝缘体,不能导电D. 该电池工作时,碘离子移向正极17.在新型储能体系,可充电锂二氧化碳电池被称为“可呼吸电池2.0”,该电池的总反应式为:Li+CO2+O2Li2CO3(未配平).其工作原理如下图所示(放电时产生的碳酸锂固体储存于碳纳米管中,TEGDME是一种有机溶剂)。
下列说法中正确的是A. 放电时,CO2发生还原反应B. 若有1.12L.CO2参与反应,则有0.2mol电子发生转移C. 放电时,Li+从右向左移动D. 充电时,阳极反应为2Li2CO3-4e-=2CO2↑+O2↑+4Li+18.锂-空气电池是一种新型的二次电池,由于具有较高的比能量而成为未来电动汽车的希望。
其放电时的工作原理如图所示。
下列说法正确的是A. 该电池放电时,锂电极发生了还原反应B. 放电时,Li+向锂电极迁移C. 电池中的电解液可以是有机电解液或稀盐酸等D. 充电时,电池正极的反应式为Li2O2-2e-=2Li++O219.我国研究锂硫电池获得突破,电池的总反应是16Li+S8 8Li2S ,充放电曲线如图所示,下列说法不正确的是( )A. 充电时,电能转化为化学能B. 放电时,锂离子向正极移动C. 放电时,1mol Li2S6转化为Li2S4得到2mole-D. 充电时,阳极总电极反应式是8S2- -16e- = S820.一种Cu- Li可充电电池的工作原理如图所示,其中非水系电解液和水系电解液被锂离子固体电解质陶瓷片( LISICON)隔开。
下列说法正确的是()A. 陶瓷片允许水分子通过B. 电池放电时,N极发生氧化反应C. 电池充电时,阴极反应为Li++e-=LiD. 电池充电时,接线柱B应与外接直流电源的负极相连21.锂-空气电池的工作原理如图所示。
其中多孔电极材料选用纳米多孔金时,该电池表现出良好的循环性能。
电池反应为:2Li+O2=Li2O2。
下列说法错误A. 该电池的电解液常用锂盐的有机溶液B. 电池工作时,外电路中流过0.01 mol 电子,负极材料减重0.07gC. 电池工作时,正极反应可能经过两个过程:Li++O2+e-=LiO2Li++LiO2+e-=Li2O2D. 电池充电时间越长,电池中Li2O2越多22.某手机电池采用了石墨烯电池,可充电5分钟,通话2小时。
一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意图如图。
下列有关该电池说法不正确的是A. 金属锂是所有金属中比能量最高的电极材料B. 充电时A电极为阴极,发生还原反应C. 充电时B电极的反应:Li2S8-2e-=2Li++S8D. 手机使用时电子从A电极经过手机电路版流向B电极,再经过电池电解质流回A电极23.某锂离子电池工作原理如下图所示,电池反应为:Li1-x CoO2+Li x C LiCoO2+C。
下列说法不正..确.的是A. 放电时,电子从b极经用电器流向a极B. 放电时,若转移1mol e-,碳材料将增重7 gC. 充电时,锂离子通过隔膜进入右室D. 充电时,a极反应:LiCoO2-xe-= Li1-x CoO2+xLi+24.新型液态金属Li-Sb电池具有优良的动力传输特性,工作原理如图所示,该电池的两极及电解液被分成3层(熔融Li和Sb可互溶)。
下列说法正确的是A. 电池放电时Li为正极B. 将Li换成Na会提高该电池的比能量C. 该电池充电时阳极金属的总质量不变D. 在Sb电极中常掺入Pb,目的是降低该电池工作温度25.锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。
该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是A. 该电池负极不能用水溶液作为电解质B. 放电时,Li+透过固体电解质向Cu极移动C. 通空气时铜被腐蚀,表面产生Cu2OD. 放电时,正极的电极反应式为:O2+2H2O+4e-═4OH-26.锂—液态多硫电池具有能量密度高、储能成本低等优点,以熔融金属锂、熔融硫和多硫化锂[Li2S x(2≤x≤8)]分别作两个电极的反应物,固体Al2O3陶瓷(可传导Li+)为电解质,其反应原理如图所示。
