9. 3 平衡蒸馏和简单蒸馏
化工原理第四版陈敏恒答案

化工原理陈敏恒第三版上册答案【篇一:化工原理答案第三版思考题陈敏恒】lass=txt>传质是体系中由于物质浓度不均匀而发生的质量转移过程。
3.在传质理论中有代表性的三个模型分别为双膜理论、溶质渗透理论、表面更新理论。
5. 根据双膜理论两相间的传质阻力主要集中在相界面两侧的液膜和气膜中,增加气液两相主体的湍流程度,传质速率将增大。
8、操作中精馏塔,保持f,q,xf,d不变,(1)若采用回流比r小于最小回流比rmin,则xd减小,xw增大(2)若r增大,则xd增大, xw减小 ,l/v增大。
9、连续精馏塔操作时,增大塔釜蒸汽用量,而回流量及进料状态f,xf,q不变,则l/v变小,xd变小,xw变小。
10、精馏塔设计时采用的参数f,q,xf,d,xd,r均为定值,若降低塔顶回流液的温度,则塔内实际下降液体量增大,塔内实际上升蒸汽量增大,精馏段液汽比增大,所需理论板数减小。
11、某精馏塔的设计任务:原料为f,xf,要求塔顶为xd,塔底为xw,设计时若已定的塔釜上升蒸汽量v’不变,加料热状况由原来的饱和蒸汽改为饱和液体加料,则所需理论板数nt 增加,精馏段上升蒸汽量v 减少,精馏段下降液体量l 减少,提馏段下降液体量l’ 不变。
(增加、不变、减少)不变,增大xf,,则:d 12、操作中的精馏塔,保持f,q,xd,xw,v’,变大,r变小,l/v变小(变大、变小、不变、不确定)1.何种情况下一般选择萃取分离而不选用蒸馏分离?萃取原理: 原理利用某溶质在互不相溶的溶剂中的溶解度利用某溶质在互不相溶的溶剂中的溶解度互不相溶的溶剂中的不同,用一种溶剂(溶解度大的)不同,用一种溶剂(溶解度大的)把溶质从另一种溶剂(溶解度小的)中提取出来,从另一种溶剂(溶解度小的)中提取出来,再用分液将它们分离开来。
分液将它们分离开来再用分液将它们分离开来。
萃取适用于微溶的物质跟溶剂分离,蒸馏原理:利用互溶的液体混合物中各组分的沸点不同,利用互溶的液体混合物中各组分的沸点不同,给液体混合物加热,使其中的某一组分变成蒸气再给液体混合物加热,冷凝成液体,从而达到分离提纯的目的。
平衡蒸馏的特点

平衡蒸馏的特点
平衡蒸馏,也被称为闪蒸,是一种单级蒸馏操作。
当在单极釜内进行平衡蒸馏时,釜内液体混合物被部分汽化,并使气相与液相处于平衡状态,然后将汽液两相分开。
这种操作既可以间歇又可以连续方式进行。
以下是平衡蒸馏的一些主要特点:
1. 稳态过程:平衡蒸馏是一个稳定、连续的过程。
在操作过程中,塔顶和塔釜的组成不会随时间发生变化。
2. 气液平衡:在平衡蒸馏中,气液两相处于平衡状态,即两相温度相同,组成互为平衡。
这意味着,无论在塔顶还是塔釜,气液两相的组成都会保持不变。
3. 生产能力大:平衡蒸馏由于其连续稳定的特点,具有较大的生产能力。
4. 不能得到高纯产物:由于其分离效果相对较弱,平衡蒸馏通常不能用于得到高纯度的产物。
它常用于只需粗略分离的物料,如在石油炼制及石油裂解分离的过程中,多组分溶液的平衡蒸馏是常见的应用场景。
5. 应用广泛:除了在石油工业中的应用,平衡蒸馏还广泛应用于其他领域,如化学工业、食品工业等,用于各种物料的分离和提纯。
总的来说,平衡蒸馏是一种高效、稳定的分离技术,适用于需要大量粗略分离的情况。
如需更多信息,建议查阅化学工程书籍或咨询化学工程专家。
第二节蒸馏方式
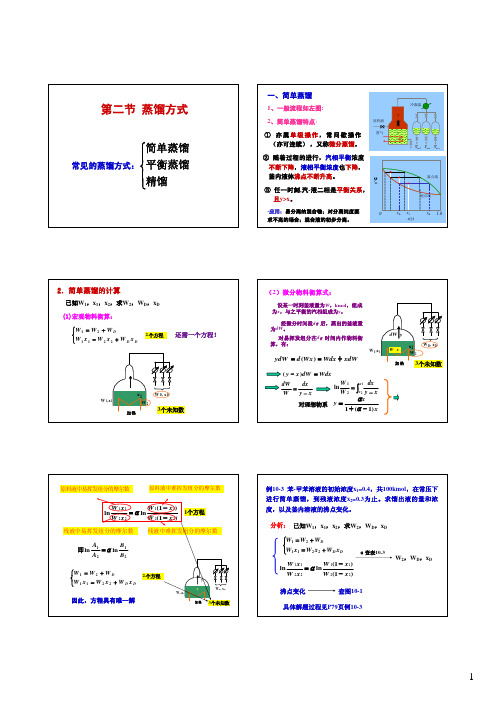
第二节 蒸馏方式
简单蒸馏 常见的蒸馏方式: 平衡蒸馏 精馏
1、一般流程如左图:
y
冷凝器
2、简单蒸馏特点: ① 亦属单级操作,常间歇操作 (亦可连续) ,又称微分蒸馏。 ② 随着过程的进行,汽相平衡浓度 不断下降,液相平衡浓度也下降, 釜内液体沸点不断升高。 ③ 任一时刻 ,汽 -液二相是平衡关系, 且y>x。
因为T0 >t0,饱和汽相 传热给饱和液相,使A、 B汽化,同时自身冷凝。
为什么利用多次简单蒸馏或多次平衡蒸馏 操作实现物系的高纯度分离是不经济的?
冷 凝
y x W1,x1 加热 WD, xD W1,x1 加热 x y WD, xD
x W1,x1 加热
冷 凝
y W D, xD
x0 t0 L
饱和液相
y V t y y0
L xW
yD
q x xW F q 1 q 1
F xF 高温 高压
P t
2)相平衡关系:
已知:F,xF,V,求yD,xW
yD
xW 1 ( 1) xW
yD
联立物料衡算式及气液平衡关系便可以确定yD, xW
q x xW F q 1 q 1 xW yD 1 ( 1) xW
( y x )dW Wdx
x2
W2
加热 W D, xD
3个未知数
dW dx W y x
对理想物系
ln
W1 W2
W 1 ,x 1
3个未知数
y
x 1 ( 1) x
x1
x2
dx y x
原料液中易挥发组分的摩尔数
原料液中难挥发组分的摩尔数
精馏复习课(期末)

塔顶易挥发组分含量高 塔底压力高于塔顶
4.已知汽液混合物进料中,汽相与液相的摩尔数之比为3:2, 易挥发组分的摩尔分数为0.3,则q=______。 0.4
精馏操作进料的热状况不同,q值就不同,沸点 进料时,q值为( );冷液进料时,q值( ); 气液混合物进料时,q值为( ),饱和蒸汽进料 时,q( ),过热蒸汽进料时,q( )。 精馏塔中的恒摩尔流假设, 其主要依据是各组分的 ______, 但精馏段与提馏段的摩尔流量由于 ________影响而不一定相等。 摩尔潜热相等 ,进料状态的不同
y1 >y2>x1>x2
6.精馏的两操作线都是直线,主要是基于_____。 恒摩尔流假设
全回流时,y-x图上精馏段操作线的位置______。
与对角线重合 连续精馏过程的进料热状态有_____,已知q=1.1, 则加料中液体量而与总加料量之比为_________。 5论板上参数的 大小(理论板的序数由塔顶向下数起),即: yn+1__yn,tn__tn+1,yn__xn (>,=,<) <,<, >
y(1-x)/(x(1-y)) 4.035
具有正偏差的非理想溶液中,相异分子间的吸引 力较相同分子间的吸引力( )。 A. 大; B. 小; C. 一样 B
9.3 平衡蒸馏与简单蒸馏
1. 平衡蒸馏与简单蒸馏适用于______的场合.
初步分离
2. 简单蒸馏过程中,釜内易挥发组分浓度____,其沸点则_____. 不断降低 不断升高
操作中精馏塔, 保持F,xF,q,提馏段上升蒸汽流 量不变,减少D,则塔顶易挥发组分回收率η变化为 ( )
减小
某连续精馏塔,因设备改造,使提馏段理论板数增加, 精馏段理论板数不变,且F、xF、q、R、V、D等均不 变,xD___,xW___. 增大 减小
蒸馏定义及特点(精)

2、按操作压力分为加压、常压和真空蒸馏
常压下为气态(如空气、石油气)或常压下泡点为室温 的混合物,常采用加压蒸馏;常压下,泡点为室温至 150℃左右的混合液,一般采用常压蒸馏;对于常压下泡 点较高(一般高于150℃)或热敏性混合物(高温下易发生分 解,聚合等变质现象),宜采用真空蒸馏,以降低操作温 度。
精馏是利用混合液中各组分间挥发度 的差异以实现高纯度分离的一种操作。平 衡蒸馏仅通过一次部分汽化和冷凝,只能 部分地分离混合液中的组分,若进行多次 的部分汽化和部分冷凝,便可使混合液中 各组分几乎完全分离。
一、精馏原理
工业上是将上图的每个分离器做成一块;或在一个圆形的塔内 装有一定高度的填料。板上液层或填料表面是汽液两相进行传热和 传质的场所。
所谓泡点是指液体在恒定的外压下,加热至开始出 现第一个气泡时的温度。露点是指气体冷却时,开始凝 聚出第一个液滴时的温度
3、按被分离混合物中组分的数目可分为两组分 精馏和多组分精馏
工业生产中,绝大多数为多组分精馏,但两 组分精馏的原理及计算原则同样适用于多组分精 馏,只是在处理多组分精馏过程时更为复杂些, 因此常以两组分精馏为基础。
4.按操作流程分为间歇蒸馏和连续蒸馏 间歇蒸馏主要应用于小规模、多品种或某些
有特殊要求的场合,工业中以连续蒸馏为主。间 歇蒸馏为非稳态操作,连续蒸馏一般为稳态操作。
三、精馏操作流程
精馏分离过程可连续操作,也可间歇操作。 精馏装置系统一般都应由精馏塔、塔顶冷凝器、 塔底再沸器等相关设备组成,有时还要配原料预 热器、产品冷却器、回流泵等辅助设备。
2.2 简单蒸馏和平衡蒸馏
对于组分挥发度相差较大、分离要求 不高的场合(如原料液的组分或多组分的初 步分离),可采用简单蒸馏和平衡蒸馏。
化工原理简答题

《化工原理》简答题:1-9.伯努利方程的应用条件是什么?答:伯努利方程的应用条件是:(1)理想流体;(2)重力场;(3)不可压缩;(4)定态流动;1-12.层流与湍流的本质区别是什么?对圆形直管内的流体流动,当2000<Re<4000时,其流动类型是什么?答:(1)两种流型的本质区别在于:层流时,流体质点作直线运动,即流体分层流动,层次分明,彼此互不混杂;湍流时,流体在总体上是沿管道轴向流动,同时,还在各个方向作随机的脉动。
(2)当2000<Re<4000时,其流动类型可能是层流,也可能是湍流,两者必居其一;即不是层流,就是湍流。
1-13.雷诺数的物理意义是什么?答:物理意义是它表征了流动流体惯性力与粘性力之比。
2-5.影响离心泵特性曲线的主要因素有哪些?答:主要影响因素有:(1)液体粘度:泵厂提供的特性曲线是用常温清水测定的,实际输送的液体粘度与清水粘度差别不大时可直接采用,若差别大时需重新测定;(2)转速:泵厂提供的特性曲线是在一定的转速下测定的,如转速变化不大(≤±20%)时,可依照流量与转速成正比换算,差别大时需要重新测定。
2-6.离心泵的工作点是如何确定的?有哪些调节流量的方法?各有何优缺点?答:(1)离心泵的工作点,是指管路中泵的实际工作情况(流量、压头)。
是由管路特性和泵的特性共同决定的,这两个特性曲线的交点即为泵的工作点。
(2)流量调节方法:a、改变管路的特性:在泵出口管路上安装调节阀,改变阀门开度即改变管路阻力系数,进而改变了管路特性曲线。
这种方法操作简单、灵活,对于调节幅度不大当需时常改变流量时尤为适用。
缺点是在阀门关小时,管路阻力损失增加,泵的工作效率降低。
b、改变泵的特性曲线:常见的是改变泵的转速。
这种方法可使泵保持在高效率区工作,能量损失小,但只能在小范围内改变流量,对于非蒸汽机驱动的泵,改变转速操作不便c、泵的组合操作:当需要大幅度增加流量或压头时,可考虑并联(大幅度增加流量)或串联(大幅度增加压头)。
化工原理第九章液体精馏

FiF Li V I Li VI
由恒摩尔假定,不同温度和组成的饱和液体焓i和汽 化潜热均相等。
20
联立上二式,得 定义:
L L I iF F I i
q
I iF分子:1kmol原料变成饱和蒸气所需的热 I i 分母:原料的摩尔汽化热
可得
L L qF
V V (1 q)F
q为加料热状态参数 q=0,饱和气体(露点);q=0,饱和液体(泡点) q<0,过热蒸气;0<q<1,气液两相,q>1,冷液
不管加料板上状态如何,离开加料板的两相温度相
等,组成互为平衡。
V,I,ym
L,i,xm-1
物料衡算式
F,iF,xF
FxF V ym1 Lxm1 Vym Lxm 相平衡方程
ym f (xm )
3)精馏段和提馏段流量的关系
V’,I,ym+1
L’,i,xm
列加料板物料和热量衡算式
F LV LV
临界压强时,气液共存区 缩小,分离只能在一定范 围内进行,不能得到轻组 分的高纯度产品。
8
9.3 平衡蒸馏和简单蒸馏
D
9.3.1 平衡蒸馏
令W q, F
则D 1q F
物料衡算:F xF D y W x
F
F DW
xF
联立得:y q x xF q 1 q 1
热量衡算:忽略组成对比热影响,
2)对理想物系
A / B
pA / xA pB / xB
p
0 A
xA
/
xA
pB0 xB / xB
pA0
pB0
3)对物系相对挥发度 1和相差2 不大
m
1 2
(1
化工原理答案第三版思考题陈敏恒

4.什么是传质简要说明传质有哪些方式传质是体系中由于物质浓度不均匀而发生的质量转移过程。
3.在传质理论中有代表性的三个模型分别为双膜理论、溶质渗透理论、表面更新理论。
5. 根据双膜理论两相间的传质阻力主要集中在相界面两侧的液膜和气膜中,增加气液两相主体的湍流程度,传质速率将增大。
8、操作中精馏塔,保持F,q,xF,D不变,(1)若采用回流比R小于最小回流比Rmin,则x D减小,xW增大(2)若R增大,则xD增大, xW减小 ,L/V增大。
9、连续精馏塔操作时,增大塔釜蒸汽用量,而回流量及进料状态F,xF,q不变,则L/V变小,xD变小,xW变小。
10、精馏塔设计时采用的参数F,q,xF,D,xD,R均为定值,若降低塔顶回流液的温度,则塔内实际下降液体量增大,塔内实际上升蒸汽量增大,精馏段液汽比增大,所需理论板数减小。
11、某精馏塔的设计任务:原料为F,xF,要求塔顶为xD,塔底为xW,设计时若已定的塔釜上升蒸汽量V’不变,加料热状况由原来的饱和蒸汽改为饱和液体加料,则所需理论板数N T 增加,精馏段上升蒸汽量V 减少,精馏段下降液体量L 减少,提馏段下降液体量L’不变。
(增加、不变、减少)12、操作中的精馏塔,保持F,q,xD,xW,V’,不变,增大xF,,则:D变大,R变小,L/V变小(变大、变小、不变、不确定)1.何种情况下一般选择萃取分离而不选用蒸馏分离萃取原理: 原理利用某溶质在互不相溶的溶剂中的溶解度利用某溶质在互不相溶的溶剂中的溶解度互不相溶的溶剂中的不同,用一种溶剂(溶解度大的)不同,用一种溶剂(溶解度大的)把溶质从另一种溶剂(溶解度小的)中提取出来,从另一种溶剂(溶解度小的)中提取出来,再用分液将它们分离开来。
分液将它们分离开来再用分液将它们分离开来。
萃取适用于微溶的物质跟溶剂分离,蒸馏原理:利用互溶的液体混合物中各组分的沸点不同,利用互溶的液体混合物中各组分的沸点不同,给液体混合物加热,使其中的某一组分变成蒸气再给液体混合物加热,冷凝成液体,从而达到分离提纯的目的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
9.3平衡蒸馏和简单蒸馏 9.3.1平衡蒸馏1.过程的数学描述蒸馏过程的数学描述不外为物料衡算式、热量衡算式及反映具体过程特征的方程,现分述如下。
(1)物料衡算式:对连续定态过程做物料衡算可得 总物料衡算: W D F += 易挥发组分的物料衡算: Wx Dy Fx F += 两式联立可得xy x x F D F --=式中: F x F ,——加料流率,kmol/s 及料液组成摩尔分数;y D ,——气相产物流率,kmol/s 及组成摩尔分数;x W ,——液相产物流率,kmol/s 及组成摩尔分数; 设液相产物占总加料量F 的分率为q ,气化率为()q FD -=1,代入上式整理可得11-=-=q x q qx y F显然,将组成为F x 的料液分为任意两部分时必须满足此物料衡算式。
以上计算中各股物料流率的单位也可用kg/s ,但各组成均须相应用质量分数表示。
(2)热量衡算加热炉的热流量Q 为()F p m t T Fc Q -=,节流减压后,物料放出显热即供自身的部分气化,故()()Fr q t T Fc F p m -=-1,由此式可求得料液加热温度为()pm e c r q t T ,1-+=式中: T t F ,——分别为料液温度与加热后的液体温度;K;e t ——闪蒸后气、液两相的平衡温度;K ;p m C ,——混合液的平均摩尔热容,KJ/(kmol •K);r —— 平均摩尔气化热,KJ/kmol 。
(3)过程特征方程式。
平衡蒸汽中可设气、液两相处于平衡状态,即两相温度相同,组成互为平衡。
因此,y 与x 应满足相平衡方程式()x f y =若为理想溶液应满足xx y )1(1-+=αα平衡温度e t 与组成x 应满足泡点方程,即()x t e φ=上述几个式子都是平衡蒸馏过程特征的方程式。
2.平衡蒸馏过程的计算当给定气化率()q -1,可依照下图所示的方法图解求出所求的气、液相组成。
9.3.2简单蒸馏1.简单蒸馏过程的数学描述描述简单蒸馏过程的物料衡算、热量衡算方程与平衡蒸馏并无本质区别,但简单蒸馏是个时变过程,而平衡蒸馏为定态过程。
因此,对简单蒸馏必须选取一个时间微元τd ,对该时间微元的始末作物料衡算。
设 W ——某瞬间釜中的液体量,它随时而变,由初态1W 变至终态2W ;x ——某瞬间釜中液体的组成,它由初态1x 降至终态2x ;y ——瞬间由釜中蒸出的气相组成,随时间而变。
若τd 时间内蒸出物料量为dW ,釜内液体组成相应地由x 降为()dx x -,对该时间微元作易挥发组分的物料衡算可得()()dx x dWW ydW Wx --+=略去二阶无穷小量,上式可写为xy dx WdW -=将此时积分得xy dx W W x x -=⎰1221ln简单蒸馏过程的特征时任一瞬间的气、液相组成y 与x 互为平衡,故描述此过程的特征方程仍未相平衡方程,即 ()x f y =联立上述两式可得: ⎪⎪⎭⎫ ⎝⎛--+-=12212111ln ln 11lnx x x x W W αα 2.简单蒸馏的过程计算原料量1W 及原料组成1x 一般已知,当给定2x 即可联立上述两式求出2W 。
由于釜液组成x 随时变化,每一瞬间的气相组成y 也相应变化。
若将全过程的气相产物冷凝后汇集一起,则馏出液的平均组成y 及数量可对全过程的始末作物料衡算而求出。
全过程易挥发组分的物料衡算式为()221121W x W x W W y -=-()212121x x W W W x y --+=例题:例9-1 理想溶液简单蒸馏时,某时刻釜残液量2W (kmol )与易挥发组分组成2x (摩尔分率)之间有如下关系式⎪⎪⎭⎫⎝⎛--+⎥⎦⎤⎢⎣⎡---=1212212111ln )1()1(ln 11ln x x x x x x W W α 式中:1W (kmol )为初始料液量,1x (摩尔分率)为初始浓度,α为平均相对挥发度。
对苯—甲苯溶液,6.01=x ,101=W kmol ,5.2=α,在1atm 下进行简单蒸馏。
试求:(1)蒸馏到残液浓度5.02=x 为止,馏出液的量D W (kmol )和平均浓度D x ;(2)若蒸馏至残液量为原加料的一半时,残液的浓度。
解:(1)将已知数据代入题给方程得4934.06.015.01ln )6.01(5.0)5.01(6.0ln 15.2110ln 2=⎪⎭⎫⎝⎛--+⎥⎦⎤⎢⎣⎡-⨯-⨯-=W 解得 11.6)4934.0ex p(102==W kmol89.311.61021D =-=-=W W W kmol7571.089.35.011.66.010D2211D =⨯-⨯=-=W x W x W x(2)依题意 2/12W W =,将有关数据代入题给方程⎪⎭⎫ ⎝⎛--+⎥⎦⎤⎢⎣⎡-⨯-⨯-=6.011ln )6.01()1(6.0ln 15.212/ln22211x x x W W 整理后得07402.0ln )1ln(5.222=+--x x上式为非线性方程,可用试差法求2x ,但收敛速度慢。
采用牛顿迭代法求可快速收敛,为此将上式写成7402.0)ln()1ln(5.2)(222+--=x x x f将上式求导得 222/1)1/(5.2)(x x x f ---='取初值 4.002=x ,则3794.0)4.0(=f ,6666.6)4.0(-='f4569.0)6666.6/(3794.04.0)(/)(02020212=--='-=x f x f x x再次迭代 0003.0)(12=x f ,7919.6)('12-=x f 45694.0)7919.6/(0003.04569.0)(/)(12121222=--='-=x f x f x x取精度410-=ε,则45694.02=x 即满足精度要求。
由本题结果可知,当非线性方程一阶导数可求时,采用牛顿迭代法求根收敛速度快。
例9-2 苯-甲苯溶液的初始料液量和初始浓度均与上题相同,在1atm 下进行平衡蒸馏(闪蒸),试求:(1)汽化率389.0=f 时离开闪蒸塔的汽相组成D y 和液相组成W x ,并与上题(1)的结果进行比较,说明什么问题?(2)定性分析,其他条件不变,原料加热温度t 升高时D y 、W x 、D 及闪蒸后汽液两相的平衡温度e t 的变化趋势。
解:(1)如图16-17所示,离开闪蒸塔的汽相组成D y 、液相组成W x 既要满足物料衡算关系又要满足相平衡关系。
总物料衡算 W D F += (a )挥发组分衡算 W D F Wx Dx Fx += (b )塔顶为全凝器,则D V =,D D x y =,将以上关系和由式(a )解出的W 一并代入式(b )并整理,得WD W F x y x x F D F V --== (c )令F W q /=表示液相的残留率,则q F W F F D F V f -=-===1/)(//。
将上 述关系代入式(c )整理得11F ---=q x x q q y (d )相平衡方程 WWD )1(1x x y -+=αα (e )将389.0=f ,611.0389.011=-=-=f q ,6.0F =x ,5.2=α分别代入式(d )和式(e )得5424.15707.11611.06.01611.0611.0W W D +-=-+--=x x y()WW WWD 1.512.515.215.2x x x x y +=-+=联立解以上两式得一元二次方程06546.07458.0W 2W =-+x x解一元二次方程得 5180.0W =x ,2638.1W -=x (舍去) 所以 7288.05180.05.115180.05.2D =⨯+⨯=y图16-15 例16-2附图本题结果与上题简单蒸馏(1)的结果比较:简单蒸馏馏出率(相当于闪蒸汽化率)为389.010/89.3/1D ==W W 与本题汽化率f 相同,但简单蒸馏馏出液平均浓度(7571.0D =x )大于平衡蒸馏汽相组成(7288.0D =y ),简单蒸馏残液浓度(45694.02=x )小于平衡蒸馏液相组成(5180.0W =x ),说明在汽化率相同的情况下,简单蒸馏分离效果比平衡蒸馏好。
其原因在于简单蒸馏的汽相组成多是与开始阶段较高的液相组成(在5180.06.0≤≤x 范围内简单蒸馏W x x ≥,只在5180.045694.0<≤x 范围内W x x ≤)成平衡的,而平衡蒸馏汽相组成只能与最终较低的液相组成5180.0W =x 成平衡。
(2)定性分析采用图解法比较方便,且图解法对非理想溶液也适用。
将式(d )中D y 、W x 的下标略去得到与连续精馏q 线方程式(16-16)相同的方程,将该方程标绘在y x -图上与相平衡曲线有一交点(如图16-16 所示),交点坐标即为D y 、W x 。
分析:其它条件不变,即原料液流量F ,原料液组成F x ,闪蒸塔压强p 均不变,原料液加热温度t 升高,F x 不变,式(f )与对角线交点F 不变,p 不变,相平衡曲线不变。
t 升高,料液在闪蒸塔内放出的显热增加,因而汽化量V (即D )增加,汽化率f 变大,液相残留率q 变小。
由图16-16可看出D y 、W x 均减少。
平衡温度e t 与液相组成W x 应满足泡点方程,图16-16示意画出了泡点线(x t ~e ),由图16-16可看出e t 升高。
结论:其它条件不变,t 升高,则D y 、W x 均减小,D 增加,e t 升高。
上式中10<<q 。
显然,将组成为F x 的原料液分为汽、液两相时,其组成y 、x 必满足物料衡算式(g )也应满足相平衡方程。
式(g )与连续精馏q 线方程的形式相同。
当连续精馏为汽液混合物进料时,即10<<q ,q 线方程实际上就是平衡蒸馏的物料衡算方程式(g ),故连续精馏汽、液混合物进料其组成y 、x 既满足q 线方程也应满足相平衡方程。
图16-16 t 改变时平衡蒸馏图解示意图。
