2014届高考化学三轮复习题:第二章 第三节 铁及其重要化合物(含解析)
高考化学综合题专题复习【铁及其化合物】专题解析含详细答案
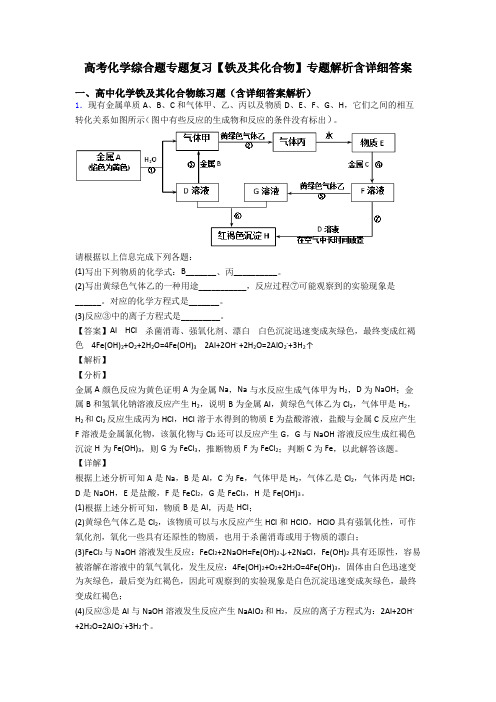
高考化学综合题专题复习【铁及其化合物】专题解析含详细答案一、高中化学铁及其化合物练习题(含详细答案解析)1.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
请根据以上信息完成下列各题:(1)写出下列物质的化学式:B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。
对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
【答案】Al HCl 杀菌消毒、强氧化剂、漂白白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+2OH- +2H2O=2AlO2-+3H2↑【解析】【分析】金属A颜色反应为黄色证明A为金属Na,Na与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应产生H2,说明B为金属Al,黄绿色气体乙为Cl2,气体甲是H2,H2和Cl2反应生成丙为HCl,HCl溶于水得到的物质E为盐酸溶液,盐酸与金属C反应产生F溶液是金属氯化物,该氯化物与Cl2还可以反应产生G,G与NaOH溶液反应生成红褐色沉淀H为Fe(OH)3,则G为FeCl3,推断物质F为FeCl2;判断C为Fe,以此解答该题。
【详解】根据上述分析可知A是Na,B是Al,C为Fe,气体甲是H2,气体乙是Cl2,气体丙是HCl;D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3。
(1)根据上述分析可知,物质B是Al,丙是HCl;(2)黄绿色气体乙是Cl2,该物质可以与水反应产生HCl和HClO,HClO具有强氧化性,可作氧化剂,氧化一些具有还原性的物质,也用于杀菌消毒或用于物质的漂白;(3)FeCl2与NaOH溶液发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化,发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色;(4)反应③是Al与NaOH溶液发生反应产生NaAlO2和H2,反应的离子方程式为:2Al+2OH- +2H2O=2AlO2-+3H2↑。
高考化学铁及其化合物一轮复习小题训练(解析版)

铁及其化合物1.铁元素是维持生命活动不可缺少的微量元素之一。
铁的元素符号是( )A.Mg B.Ca C.Fe D.Zn【答案】C【解析】铁的元素符号是Fe,C项正确。
2.下列反应不能通过化合反应直接制得的是()A.FeCl2B.FeCl3C.Fe(OH)3D.Fe(OH)2【答案】D【解析】2Fe+3Cl2点燃2FeCl3,Fe+2FeCl3===3FeCl2,4Fe(OH)2+O2+2H2O===4Fe(OH)3,Fe2++2OH-===Fe(OH)2↓,故能通过化合反应直接制得的是A、B、C。
3.既有氧化性,又有还原性的微粒是( )A.Fe B.Fe2+C.Fe3+D.Cu2+【答案】B【解析】Fe2+是铁的中间价态微粒,化合价既可以升高也可以降低,因此既有氧化性,又有还原性。
4.将铁屑溶于过量的稀盐酸后,再加入下列物质,会有Fe3+生成的是()A.硫酸B.氯水C.硫酸锌D.氯化铜【答案】B【解析】Fe+2HCl===FeCl2+H2↑,选项中,H2SO4、ZnSO4、CuCl2均不能与FeCl2反应,但氯水中的Cl2能氧化Fe2+生成Fe3+,离子方程式为2Fe2++Cl2===2Fe3++2Cl-。
5.下列关于铁及其化合物的说法中,不正确...的是( )A.金属铁可被磁铁吸引B.铁元素有可变化合价C.铁丝在氯气中燃烧生成FeCl2 D.常温下铁片遇浓硫酸会发生钝化【答案】C【解析】铁丝在氯气中燃烧生成FeCl3,C项符合题意。
6.某些补铁剂的成分中含有硫酸亚铁,长期放置会因氧化而变质。
检验硫酸亚铁是否变质的试剂是( )A.稀盐酸B.石蕊溶液C.KSCN溶液D.氯水【答案】C【解析】硫酸亚铁,长期放置会因被空气中的氧气氧化生成硫酸铁,Fe3+遇到SCN-会使溶液显血红色,因此常用KSCN溶液检验Fe3+的存在,而Fe3+与稀盐酸、石蕊试液及氯水都唔明显变化,故选C。
7.证明溶液中是否含Fe2+,操作的正确顺序是( )①加入少量KMnO4溶液②滴入少量KSCN溶液③加入少量氯水A.先①后②B.先②后①C.先②后③D.先③后②【答案】C【解析】Fe2+的检验:先加SCN-,再将Fe2+氧化成Fe3+。
2014届高考化学一轮基础典型例题讲解课件:第8讲 铁及其化合物

第8讲 铁及其化合物
考 向 互 动 探 究
2.铁的化学性质 化学方程式 (1)与非金属反应 △ 与S反 Fe+S=====FeS
应 与I2反 应 与O2反 应 与Cl2反 应
△ Fe+I2=====FeI2
点燃 3Fe+2O2=====Fe3O4
点燃 2Fe+3Cl2=====2FeCl3
考 向 互 动 探 究 典 型 易 错 必 纠 教 师 备 用 习 题
第8讲 铁及其化合物
返回目录
考纲要求
1.了解Fe及其重要化合物的主要性质及其应用。 2.以Fe2+、Fe3+的相互转化为例,理解变价金属元素 的氧化还原性。 3.能鉴别溶液中的Fe2+、Fe3+。
返回目录
网络导图
返回目录
返回目录
第8讲 铁及其化合物
考 向 互 动 探 究
问题导思 铁元素是典型的变价金属元素, 它在化合物 中主要表现为+2 价和+3 价,请归纳总结: ①Fe 单质通常与哪些氧化剂反应生成+2 价铁的化合 物?写出有关反应的化学方程式或离子方程式。 ②Fe 单质通常与哪些氧化剂反应生成+3 价铁的化合 物?写出有关反应的化学方程式。
返回目录
第8讲
铁及其化合物
考 向 2.分析铁与稀 HNO3 反应的关键 互 一是明确哪种物质过量,二是根据两种物质的量分析讨 动 论判断。 探 根据反应方程式: 究
HNO3 过量: Fe+4HNO3===Fe(NO3)3+NO↑+2H2O。① Fe 过量时: Fe+2Fe(NO3)3===3Fe(NO3)2。② ①× 2+②两者相加得总方程式: 3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O。
2.[2012· 重庆卷] Fe 与 S 混合加热生成 FeS2(
2014年高考化学试题分类解析 考点12 铁、铜元素单质及其重要化合物[新课标版]
![2014年高考化学试题分类解析 考点12 铁、铜元素单质及其重要化合物[新课标版]](https://img.taocdn.com/s3/m/acedfb36ad02de80d5d84008.png)
考点12 铁、铜元素单质及其重要化合物一、选择题1.(2014·新课标全国卷Ⅰ·8)化学与社会、生活密切相关。
对下列现象或事实的解释正确的是( )(1)注意水解原理在日常生活中的应用;(2)三价铁离子有较强的氧化性,被还原后一般生成二价铁离子。
【解析】选C。
A项,烧碱溶液为NaOH溶液,Na2CO3溶液呈碱性,油污在碱性条件下水解生成溶于水的物质,Na2CO3不能直接和油污反应,错误;B项,漂白粉久置变质是因为次氯酸钙和空气中的二氧化碳反应生成碳酸钙和次氯酸,次氯酸不稳定,分解为HCl和O2,错误;C项,碳酸钾和氯化铵能在水溶液中发生水解相互促进反应生成氨气而降低肥效,正确;D项,氯化铁中的三价铁离子能和铜反应生成二价铁离子和铜离子,错误。
2.(2014·上海高考·17)用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉。
对加入铁粉充分反应后的溶液分析合理的是( )A.若无固体剩余,则溶液中一定有Fe3+B.若有固体存在,则溶液中一定有Fe2+C.若溶液中有Cu2+,则一定没有固体析出D.若溶液中有Fe2+,则一定有Cu析出【解题指南】解答本题时应注意以下两点:(1)运用氧化性、还原性强弱分析反应;(2)注意铜与铁的活动性强弱。
【解析】选B。
Fe3+的氧化性比Cu2+的大,加入的铁粉可以恰好将原来剩余的Fe3+还原为Fe2+而没有固体剩余或析出,A、D错误;在整个过程中Fe3+被铜、铁还原为Fe2+,无论是否有固体存在,一定会含有Fe2+,B正确;加入的铁将剩余的Fe3+还原后还可以将部分Cu2+还原得铜单质,C错误。
3.(2014·北京高考·7)下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是( )A.KB.NaC.FeD.Al【解题指南】解答本题需注意氧化铝为致密的氧化物结构,可保护内层金属。
【解析】选D。
Al在空气中表面会形成一层致密的氧化物保护膜Al2O3,从而保护内层金属不被空气氧化。
2014版化学复习方略 课时提升作业 第三章 第三节 铁及其重要化合物(人教版 天津专供)

温馨提示:此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。
关闭Word文档返回原板块。
课时提升作业(八)(45分钟100分)一、选择题(本题包括10小题,每小题6分,共60分)1.(2013·哈尔滨模拟)下列氯化物中,既能由单质直接化合制得,又可由金属和盐酸反应制得的是( )A.CuCl2B.FeCl2C.FeCl3D.AlCl32.下列有关钢材在空气中生锈的说法正确的是( )A.红色铁锈的主要成分是Fe(OH)3B.钢材在空气中的反应只有氧化、还原及化合反应C.钢材在空气中的腐蚀主要为电化学腐蚀,其负极的反应为:Fe-3e-====Fe3+D.太阳、风雨、湿度对钢材的腐蚀有较大影响3.在下列有FeCl3溶液参加的反应中,与Fe3+发生氧化还原反应的是( )①FeCl3与Cu反应②FeCl3与H2S反应③FeCl3与KI反应④FeCl3滴入沸水中⑤FeCl3与NaHCO3反应⑥FeCl3溶液中滴入石蕊试液A.③④⑤⑥B.③④⑤C.④⑤⑥D.①②③4.(2013·宝坻区模拟)下列有关铁元素的叙述中正确的是( )A.Fe(OH)2易被氧化成Fe(OH)3,说明稳定性:Fe(OH)2<Fe(OH)3B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI====FeI3+3H2OD.铁元素位于周期表的第4周期第Ⅷ族5.为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是( )A.只有④B.只有③C.③和④均错D.全部错误6.用毛笔蘸取少量30% FeCl3溶液在铜片上写一个“Cu”字,放置片刻,用少量水将铜片上的溶液冲到小烧杯中,下列说法正确的是( )A.烧杯中的溶液呈黄色B.铜片无任何变化C.铜片上有凹陷的“Cu”字D.发生了反应:Fe3++Cu====Cu2++Fe2+7.某溶液中含有Cu2+、Mg2+、Fe2+、Al3+等4种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加过量盐酸,溶液中大量减少的阳离子是( )A.Cu2+B.Mg2+C.Fe2+D.Al3+8.(2013·泰州模拟)某溶液中含有的溶质是FeBr2、FeI2,若向该溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是( )①原溶液中Br-一定被氧化②通入氯气后原溶液中的Fe2+一定被氧化③不能确定通入氯气后的溶液中是否存在Fe2+④若取少量所得溶液,加入CCl4,静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化A.①②③B.②③④C.①③④D.①②③④9.某晶体水溶液中加入Fe2+的溶液,再加稀硝酸溶液立即变红,另取该晶体,加入NaOH溶液共热产生一种能使湿润红色石蕊试纸变蓝的气体,则这种晶体是( )A.KSCNB.NH4SCNC.NH4ClD.FeCl310.(能力挑战题)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示。
2014届高考化学(广西专用)一轮复习:3-2 铝及其重要化合物.pdf

第讲 一、选择题 1.Al、Fe、Cu都是重要的金属元素。
下列说法正确的是( )A.三者对应的氧化物均为碱性氧化物 B.三者的单质放置在空气中均只生成氧化物 C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al 解析 A项,Al2O3为两性氧化物;B项,Cu在空气中的CO2和H2O(g)的作用下与O2反应生成Cu2(OH)2CO3;C项,三种盐均为强酸弱碱盐,加热时都水解,且生成易挥发的HCl,随着水分和HCl的挥发,蒸干时都得到金属氧化物和其氢氧化物的混合物;D项,电解AlCl3溶液阴极上的产物为H2和Al(OH)3。
答案 C 2.将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则( )A.反应过程中得到6.72 L的气体(标况) B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) C.最终得到7.8 g的沉淀 D.最终得到的溶液中c(NaCl)=0.15 mol·L-1 解析 由题n(Na2O2)=0.2 mol,n(Al)=0.2 mol,发生反应:2Na2O2+2H2O===4NaOH+O2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑,可知生成气体0.4 mol,标况下体积为8.96 L;加入盐酸先和过量的NaOH反应,剩余0.1 mol和NaAlO2反应生成0.1 molAl(OH)3:NaAlO2+HCl+H2O===NaCl+Al(OH)3↓,最终溶液为0.3 mol NaCl、0.1 mol NaAlO2。
答案 C 3.向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。
高考化学铁及其重要化合物(解析版)

铁及其重要化合物【考情分析】1.了解铁的主要性质及其应用。
了解铁的重要化合物及其应用。
2.掌握铁及其重要化合物的制备方法。
【核心素养分析】1.宏观辨识与微观探析:认识铁及其化合物的性质及应用,能以“铁三角”转化关系理解变价元素的转化条件。
2.科学态度与社会责任:利用铁及其化合物的性质,科学认识铁及其化合物的提纯和制备工艺流程,形成严谨求实的科学态度和崇尚真理的意识。
3.科学探究与创新意识:能提出有价值的氢氧化亚铁及其他铁的化合物的制备方案,并进行实验探究。
【重点知识梳理】知识点一铁及其重要化合物的性质1.铁铁位于元素周期表中第4周期Ⅷ族,是一种应用最广泛的过渡金属元素;铁元素是一种典型的变价金属元素。
(1)结构(2)铁的物理性质银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。
(3)铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
①与非金属单质的反应②与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
③与酸的反应④与某些盐溶液反应Fe +Cu 2+===Fe 2++Cu 、Fe +2Fe 3+===3Fe 2+ 【归纳总结】①Fe 与Cl 2反应无论用量多少都生成FeCl 3,而Fe 与盐酸反应生成FeCl 2。
②铁在潮湿的空气中生成的铁锈的主要成分是Fe 2O 3,而铁在纯氧中燃烧的产物是Fe 3O 4。
③铁与一般氧化剂(如S 、HCl 、FeCl 3、CuSO 4、I 2等)反应时被氧化为Fe 2+,铁与强氧化剂(如Cl 2、Br 2、HNO 3、浓H 2SO 4等)反应时被氧化为Fe 3+。
④在电化学中铁作负极时电极反应式为Fe -2e -===Fe 2+。
(3)铁的冶炼冶炼原理:Fe 2O 3+3CO=====高温2Fe +3CO 2 2.铁的氧化物3.铁的氢氧化物(1)Fe(OH)2是白色絮状物,易被空气中的氧气氧化生成Fe(OH)3,颜色由白色变为灰绿色,最后变为红褐色,方程式为4Fe(OH)2+O 2+2H 2O===4Fe(OH)3。
2014届高考一轮复习备考课件(新课标通用)第三章第三节 铁及其重要化合物(54张幻灯片)

目录
2.A、B、C为中学常见单质,其中一种为金属,通常情况
下,A为固体,B为黄绿色气体,C为无色气体。D、E、F、
G、H、X均为化合物,其中X常温下是无色气体,其水溶液 是一种强酸,E为黑色固体,H在常温下为液体。它们之间的
转化关系如图所示(其中某些反应条件和部分反应物已略去):
目录
请回答下列问题: (1)写出下列物质的化学式:
黄色褪去,现对褪色原因进行探究。提出你的假设:
________________________________;为了对你所提出的假设 进行验证,你设计的实验方案是 ____________________________________________________。
目录
解析:解答本题的关键是熟悉铁的不同价态离子的溶液的颜 色及其转化条件,从框图可知,铁和稀盐酸反应生成 FeCl2 溶液,为淡绿色,即 D 的主要成分为 FeCl2,加入试剂 2 后 变为淡黄色溶液,联想最终变为深红色溶液 F(硫氰化铁溶 液),可以推断溶液 E 的主要成分为 Fe3 ,试剂 2 为强氧化 剂,d 项 S 不符合条件。铁和水蒸气反应生成固体 Fe3O4, Fe3O4 与盐酸反应的方程式为 Fe3O4+8HCl===2FeCl3+FeCl2 +4H2O,所以溶液 B 为 FeCl3 和 FeCl2 的混合溶液,加入试 剂 1(KSCN 溶液)后,Fe3 变为硫氰化铁,加入试剂 2(强氧 化剂),Fe2 被氧化为 Fe3 ,所以溶液颜色加深。
目录
即时应用 3.证明某溶液含有Fe2+而不含有Fe3+的实验方法是( ①先加氯水,后加KSCN溶液后显红色; ②先加KSCN溶液,不显红色,再加氯水后显红色; ③滴加NaOH溶液,先产生白色沉淀,迅速变为灰绿色,最后 呈红褐色; ④只滴加KSCN溶液不显红色。 )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、单项选择题1.某权威刊物中有这样一段描述:“在所有元素中,铁的原子核是最稳定的,因此,铁在一些大而重的红热巨星的核心堆积……结果,在宇宙的重元素中铁是相当丰富的,在地球上铁也是丰富的。
”对该段文字的正确理解是()A.铁的化学性质很稳定B.铁的化合物性质很稳定C.铁的氧化物很稳定D.铁元素很难因发生核聚变而变成其他元素解析:根据常识,铁在空气中容易生锈,可知铁化学性质活泼,A错误;铁的化合物如氧化亚铁、氧化铁、四氧化三铁、氯化铁、氯化亚铁等性质有的较活泼,B、C错误;存在于宇宙中的和地球上的铁并不一定是单质铁,且铁原子核稳定,化合态铁难以聚变,D正确。
答案:D2.用铁制较纯净的氧化铁,下列实验方案最好的是()A.使铁在潮湿的空气中缓慢氧化B.铁在氯气中燃烧,加水溶解,加入足量NaOH溶液,过滤、洗涤,然后充分加热分解C.使铁溶解于稀硫酸,然后加入足量NaOH溶液,过滤、洗涤,然后充分加热分解D.使铁与足量稀硝酸反应,然后加入足量NaOH溶液,过滤、洗涤,然后充分加热分解解析:铁在潮湿的空气中缓慢氧化,反应时间长,而且制得的氧化铁含有结晶水,A错误;B、D项中都涉及了有毒物质的使用和生成,不符合绿色化学的原则;易判断C项合理。
答案:C3.下列中学常见实验的现象或表述正确的是()A.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,滴加KSCN 溶液,溶液显血红色B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可D.向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物体为“蓝色固体”解析:过量的铁投入到一定量的稀硝酸中得到的是硝酸亚铁,不会出现血红色,所以A 错;氢氧化亚铁很容易被氧气氧化,所以边加氢氧化钠溶液边搅拌的话很容易被氧化为氢氧化铁,所以B错;CuSO4溶液中滴入过量NaOH溶液充分反应后生成Cu(OH)2沉淀,加热后过滤,滤纸上留有的是CuO,CuO为黑色固体,所以D错。
答案:C4.下列化学实验事实相应的离子方程式正确的是()A.往FeCl3溶液中加入Fe粉:2Fe3++Fe===3Fe2+B.往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2OC.往FeCl3溶液中加入Cu粉:Fe3++Cu===Fe2++Cu2+D.氧化亚铁加入稀硝酸:FeO+2H+===Fe2++H2O解析:Fe3+能氧化Fe,发生归中反应,A正确;澄清石灰水中通入过量CO2生成Ca(HCO3)2,B错误;电荷不守恒,C错误;HNO3将Fe2+氧化成Fe3+,D错误。
答案:A5.已知某硫酸、硫酸亚铁、硫酸铁混合液100 mL中,各阳离子浓度相等,硫酸根离子总浓度是6 mol·L-1,此溶液中还可溶解的铁粉的质量为()A.11.2 g B.16.8 g C.33.6 g D.5.6 g解析:设阳离子浓度为x,根据电荷守恒可以得出,x+2x+3x=6 mol/L×2,x=2 mol/L;n(H2SO4)=n[Fe2(SO4)3]=x2=2 mol/L2=1 mol/L;由反应方程式H2SO4+Fe===FeSO4+H2↑和Fe2(SO4)3+Fe===3FeSO4可知:等物质的量的硫酸或硫酸铁消耗等量的Fe,故还可以溶解Fe的物质的量为:n(Fe)=2×0.1 L×1 mol/L=0.2 mol,m(Fe)=0.2 mol×56 g/mol=11.2 g。
答案:A5题变式5-1.将Cu片放入0.1 mol·L-1FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+) c(Fe2+)=23,则Cu2+与Fe3+的物质的量之比为()A.32 B.35 C.34 D.43解析:反应的化学方程式为Cu+2Fe3+===2Fe2++Cu2+。
设溶液的体积为1 L,生成的n(Fe2+)=2a,则消耗的n(Fe3+)=2a,生成的n(Cu2+)=a,因此反应后溶液中n(Fe3+)=0.1 mol -2a, 所以有关系式:(0.1 mol-2a) 2a=23,得出a=0.03 mol。
溶液中n(Cu2+)=0.03 mol,反应后溶液中n(Fe3+)=(0.1-2×0.03)mol=0.04 mol,故溶液中Cu2+与Fe3+的物质的量之比为34。
答案:C6.下列说法正确的是()A.加入NaOH溶液产生红褐色沉淀,则原溶液中一定含有FeCl3B.一定条件下铁和O2、H2O反应的产物均为Fe3O4C.钢铁发生电化学腐蚀时负极反应式为Fe-3e-===Fe3+D.过量的铁片与冷浓硝酸反应的化学方程式为Fe+4HNO3(浓)===Fe(NO3)2+2NO2↑+2H2O解析:只能说明溶液中含有Fe3+,是否含有Cl-无法确定,A错误;铁在纯氧中燃烧生成Fe3O4,铁和水蒸气反应生成Fe3O4,B正确;铁的氧化产物为Fe2+,C错误;铁片在冷浓硝酸中发生钝化,D错误。
答案:B二、双项选择题7.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示(已知:2Fe2++Br2===2Fe3++2Br-,2Fe3++2I-===2Fe2++I2)。
则下列有关说法中,不正确的是()A.还原性:I->Br->Fe2+B.原混合溶液中FeBr2的物质的量为6 molC.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-D.原溶液中:n(Fe2+) n(I-) n(Br-)=213解析:因为还原性I->Fe2+>Br-,所以通入的Cl2先与I-反应,随后与Fe2+反应,最后与Br-反应;从图上可看出,n(I-)=2 mol,n(Fe2+)=4 mol,n(Br-)=6 mol。
原混合溶液中FeBr2的物质的量为3 mol,当通入2 mol Cl2时,I-消耗1 mol Cl2,剩余的1 mol Cl2与Fe2+反应,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-。
故选A、B两项。
答案:AB8.下列离子的检验方法合理的是()A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+B.向某溶液中加入酸性KMnO4溶液,溶液褪色,说明原溶液中一定含Fe2+C.向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中含有Fe2+,可能含有Mg2+解析:说明含Fe3+,但不排除Fe2+的存在,A错误;也可能含SO2-3等还原性离子,B 错误;红褐色沉淀只能是Fe(OH)3,而且是直接看到的红褐色沉淀,C正确;Fe(OH)2和Mg(OH)2均是白色,但是Fe(OH)2会被氧化为Fe(OH)3,红褐色掩盖白色,D正确。
答案:CD三、非选择题9.(2013·北京卷)用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):Ⅰ.向铝灰中加入过量稀H2SO4,过滤:Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:Ⅳ.加入MnSO4至紫红色消失,过滤;Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是____________________ __________________________________。
(2)将MnO-4 氧化Fe2+的离子方程式补充完整:1MnO-4+Fe2++________===1Mn2++Fe3++________(3)已知:注:根据表中数据解释步骤Ⅱ的目的:______________________ _____________________________________________________________________________________________________________。
(4)已知:一定条件下,MnO -4可与Mn 2+反应生成MnO 2,①向Ⅲ的沉淀中加入浓HCl 并加热,能说明沉淀中存在MnO 2的现象是________________________________________。
②Ⅳ 中加入MnSO 4的目的是________________________ ________________________。
解析:(1)氧化铝与硫酸反应生成硫酸铝与水,注意写成离子方程式并配平;(2)反应中MnO -4→Mn 2+,Fe 2+→Fe 3+, MnO -4系数为1,根据得失电子守恒可知, Fe 2+系数为:1×(7-2)3-2=5,由元素守恒可知, Fe 3+系数为5,由电荷守恒可知,有 H +参加反应,其系数为8,根据元素守恒可知,有H 2O 生成,其系数为4,方程式配平为:MnO -4+5 Fe 2++8H +===Mn 2++5Fe 3++4H 2O ;(3)滤液中含有Fe 2+,由表中数据可知,Fe(OH)2开始沉淀的pH 大于Al(OH)3 完全沉淀的pH 值,而Fe(OH)3完全沉淀的pH 值小于Al(OH)3开始沉淀的pH 值,pH 值约为3时,Al 3+、Fe 2+不能沉淀,步骤Ⅱ是将Fe 2+氧化为Fe 3+,调节pH 值使铁完全沉淀;(4)①MnO 2能将HCl 氧化为Cl 2,若有黄绿色气体生成说明沉淀中存在MnO 2;②Ⅲ的上层液呈紫红色,MnO -4过量,加入MnSO 4,MnO - 4 可与Mn 2+反应生成MnO 2,从而可除去过量的MnO -4。
答案:(1)Al 2O 3+6H +===2Al 3++3H 2O(2)5 8 H +5 4 H 2O(3)pH 约为3时,Fe 2+和Al 3+不能形成沉淀,将Fe 2+氧化为Fe 3+,可使铁完全沉淀(4)①生成黄绿色气体 ②除去过量的MnO -410.某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验。
(1)用上图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,就可以完成高温下“Fe 与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。
反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当__________________________(填实验现象)时,说明“铁与水蒸气”能够进行反应。
