试验碱性磷酸酶的分离提取及比活力的测定
碱性磷酸酶(ALP)测定(速率法)标准化操作程序文件

碱性磷酸酶(ALP)测定(速率法)标准化操作程序文件1:概述碱性磷酸酶英文简称AKP或ALP,是广泛分布于人体各脏器器官中,其中以肝脏为最多其次为肾脏,骨骼、肠、和胎盘等组织,。
它不是单一的酶,而是一组同功酶。
目前已发现有AKP1 、AKP2 、AKP3 、AKP4 、AKP5 与AKP6 六种同功酶。
碱性磷酸酶(ALP):是从牛肠粘膜或大肠杆菌中提取。
从大肠杆菌提取的AP分子量为80kD,酶作用的最适pH为8.0;用小牛肠黏膜提取的AP分子量为l00kD,最适pH为9.6.一般采用对硝基苯磷酸酯(p-NPP)作为底物。
它可制成片状试剂,使用方便。
产物为黄色的对硝基酚,在405nm有吸收峰。
用NaOH终止酶反应后,黄色可稳定一段时间。
2标本的收集新鲜无溶血标本,血清或血浆样本均不溶血。
血浆样本只能采用肝素或EDTA抗凝。
样本在4摄氏度可稳定7天。
采血前病人应禁食12小时,采集静脉3ml,待凝固后(最好放在37摄氏度水浴箱内45分钟)通常为加抗凝剂的血液在30-60分钟凝血析出血清。
3000r/min离心5-10分钟,分离出血清备用。
不建议采用血浆标本。
3:方法原理样本中的碱性磷酸酶催化水解磷酸对硝基苯酚,生成游离的对硝基苯酚和磷酸,引起405nm处的光吸收值升高,,通过检测405nm处光吸收值上升的速率,可以测定碱性磷酸酶的活力。
4剂来源,配置及储存试剂来源:迪瑞试剂配置:试剂一和试剂二均为液体试剂,可直接使用。
启用后在2-8度可稳定30天。
若试剂混浊,或以蒸馏水为空白在405nm处的光吸收值低于0.8A,应予丢弃。
试剂储存:试剂避光储存2-8摄氏度可稳定至标签所示失效期。
5分析仪器CS-600B全自动生化分析仪分析参数:样品量4 u/l 试剂量:第一试剂200 u/l(R1);第二试剂50 u/l测光点23—38 测定模式:速率法正反应分析波长:405nm/505nm(主波长/副波长)6计算方法ALP(U/L)=( A/min*Tv*1000)(18.8*Sv*P)式中Tv=总反应体积Sv=样本体积18.8=NADH在405nm处的毫摩尔消光系数P=比色杯光径(cm)7 线性范围:本实验的线性范围:0----850U/L8 参考范围:男性:1---12岁《500 U/L12—15岁《750 U/L》25岁40--150 U/L女性:1---12岁《500 U/L》15岁40--150 U/L9 失控控理1:立即重测同一质控品,如重测后结果仍不再允许范围,请进行下一步。
碱性磷酸酶的分离纯化及比活性与米氏常数测定
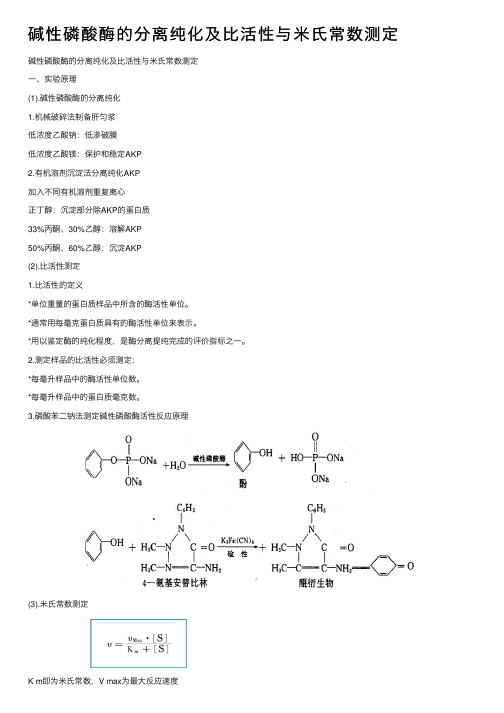
碱性磷酸酶的分离纯化及⽐活性与⽶⽒常数测定碱性磷酸酶的分离纯化及⽐活性与⽶⽒常数测定⼀、实验原理(1).碱性磷酸酶的分离纯化1.机械破碎法制备肝匀浆低浓度⼄酸钠:低渗破膜低浓度⼄酸镁:保护和稳定AKP2.有机溶剂沉淀法分离纯化AKP加⼊不同有机溶剂重复离⼼正丁醇:沉淀部分除AKP的蛋⽩质33%丙酮、30%⼄醇:溶解AKP50%丙酮、60%⼄醇:沉淀AKP(2).⽐活性测定1.⽐活性的定义*单位重量的蛋⽩质样品中所含的酶活性单位。
*通常⽤每毫克蛋⽩质具有的酶活性单位来表⽰。
*⽤以鉴定酶的纯化程度,是酶分离提纯完成的评价指标之⼀。
2.测定样品的⽐活性必须测定:*每毫升样品中的酶活性单位数。
*每毫升样品中的蛋⽩质毫克数。
3.磷酸苯⼆钠法测定碱性磷酸酶活性反应原理(3).⽶⽒常数测定K m即为⽶⽒常数,V max为最⼤反应速度*如上式表⽰,⽶⽒常数是反应速度为最⼤值的⼀半时的底物浓度,因此,⽶⽒常数的单位为mol/L。
当反应速度等于最⼤速度⼀半时,即V = 1/2 V max, K m = [S]*吸光度表⽰不同底物浓度时的酶反应速度。
以吸光度的倒数作纵坐标,以底物浓度的倒数作横坐标,按Lineweaver-Burk作图法可求出Km值。
⼆. 器材721分光光度计台式离⼼机恒温⽔浴锅微量移液器托盘天平匀浆器试管三.试剂1. 0.5mol/L醋酸镁溶液称取醋酸镁5.3625g溶于蒸馏⽔中,稀释⾄50ml.2. 0.1mol/L醋酸钠溶液称取醋酸钠0.0820g溶于蒸馏⽔中,稀释⾄10ml.3. 0.01mol/L醋酸镁---醋酸钠溶液取0.5mol/L醋酸镁溶液2ml及0.1mol/L醋酸钠溶溶液10ml,混合均匀后加蒸馏⽔稀释⾄100ml.4. 丙酮(分析纯).5. 95%⼄醇(分析纯).6. Tris缓冲液(Ph8.8) 称取Tris 6.05g,⽤蒸馏⽔溶解成50ml,为0.1mol/L Tris 液,取0.1mol/L Tris液10ml,加0.5mol/L醋酸镁2ml,加蒸馏⽔80ml,再⽤1%醋酸调pH⾄8.8,然后⽤蒸馏⽔稀释⾄100ml.7. 0.01mol/L基质液称取磷酸苯⼆钠(C6H5PO4Na2.2H2o)0.3g,4-氨基安替⽐林0.15g,分别溶于煮沸冷却后的蒸馏⽔中;两液混合并蒸馏⽔稀释⾄50ml,加0.2ml氯仿防腐,盛于棕⾊瓶中,冰箱内保存,可⽤⼀星期;临⽤时与等量0.1mol/L pH10的碳酸盐缓冲液混合即可.8. 0.1mol/L pH10的碳酸盐缓冲液称取⽆⽔碳酸钠0.318g及碳酸氢钠0.168g溶于蒸馏⽔,稀释⾄50ml.9. 碱性溶液量取0.5mol/L氢氧化钠溶液与0.5mol/L碳酸氢钠溶液各20ml,混合后加蒸馏⽔⾄100ml.10. 0.5%铁氰化钾溶液称取铁氰化钾0.25g和硼酸0.75g,各溶于20ml蒸馏⽔中,溶解后两液混合均匀,再加蒸馏⽔⾄50ml,置棕⾊瓶中暗处保存.11. 0.1mol/L醋酸镁溶液称取醋酸镁0.2145g溶于蒸馏⽔中,稀释⾄10ml.12. 酚标准液(0.1mg/ml).四.实验步骤(1). “碱性磷酸酶分离纯化”实验操作(2).“碱性磷酸酶⽐活性测定”实验操作1.样品中碱性磷酸酶活性测定:(1).取5⽀试管,编号,按表1操作:表1A’B’C’D’标准空⽩各阶段稀释液(ml) 0.1 0.1 0.1 0.1 - -0.1mg/ml酚标准液(ml) - -- - 0.1 -pH8.8Tris缓冲液(ml) - - - - - 0.1置37℃⽔浴中保温5分钟复合基质液(ml) 3.0 3.0 3.0 3.0 3.0 3.0混匀,37℃⽔浴中准确保温15分钟.保温结束后,各管⽴即加⼊1.0ml碱性溶液终⽌反应,再加⼊0.5%铁氰化物钾2.0ml,⽴即混匀,静置10min,在510nm波长下⽐⾊测定.2.酶活性单位计算每毫升酶液中酶活性单位=测定OD/标准OD X标准管中酚含量X1/0.1X稀释倍数3.样品中蛋⽩质含量的测定(1)测定蛋⽩质时,保留的A’管还需稀释5倍为A’’管,否则蛋⽩质浓度太⾼,其余各管不需再稀释,各⽤1.0ml进⾏测定.表2A’’B’C’D’空⽩各阶段稀释液(ml) 1.01.01.01.0 -0.1mg/ml酚标准液(ml) - -- -1.0pH8.8Tris缓冲液(ml) 5.0 5.0 5.0 5.0 5.0混匀,置20~25℃⽔浴中保温10分钟复合基质液(ml) 0.50.50.50.50.5(2)⽴即振摇均匀,在20~25℃保温30min后,于650nm波长处⽐⾊.(3)蛋⽩质浓度计算:从Lowry法标准曲线查得的蛋⽩质毫克数,乘以稀释倍数,即为每毫升样品中蛋⽩质毫克数.4.⽐活性及得率计算碱性磷酸酶⽐活性=每毫升样品中碱性磷酸酶活性单位数/每毫升样品中蛋⽩质毫克数纯化倍数=各阶段⽐活性数/匀浆(A液)⽐活性数得率=各阶段酶的总活性单位/匀浆(A液)中的酶的总活性单位X100%5.实验结果将上述各实验计算结果填⼊表3内.表3分离总体积蛋⽩质总蛋⽩每毫升酶总活性⽐活性纯化得率阶段(ml) 浓度(mg) 活性单位单位(U/mg ) 倍数(%)(mg/ml) (U/ml) (U)匀浆(A液)第⼀次丙酮沉淀(B液)第⼆次丙酮沉淀(C液)第三次丙酮沉淀(D液)3.⽶⽒常数测定1. 取15只试管,按照下表操作,1~7号重复两组,0 号为空⽩对照。
酶工程实验碱性磷酸酶实验报告

猪肝中碱性磷酸酶的分离纯化及部分性质研究实验报告摘要:碱性磷酸酶(alkaline phosphatase,简称ALP)广泛存在于微生物和动物体内,是一种非特异性磷酸单酯酶。
本实验材料取自猪肝,采用有机溶剂沉淀分离纯化其中所含的碱性磷酸酶,运用终止法和考马斯亮蓝法测定其酶活力和蛋白质含量。
根据酶活力变化,进行不同温度,PH对该酶的影响的实验,得出最适温度和最适PH。
关键词:碱性磷酸酶;有机溶剂沉淀;酶活力;PH;温度1 前言碱性磷酸酶是广泛分布于人体肝脏、骨骼、肠、肾和胎盘等组织经肝脏向胆外排出的一种酶。
碱性磷酸酶是一种能够将对应底物去磷酸化的酶,即通过水解磷酸单酯将底物分子上的磷酸基团除去,并生成磷酸根离子和自由的羟基,这类底物包括核酸、蛋白、生物碱等。
而该脱去磷酸基团的过程被称为去磷酸化或脱磷酸化。
本实验中所用的猪肝中的碱性磷酸酶含量颇高,且其活性可在较长时间内得以保持。
1.1实验目的掌握以有机溶剂分离技术提取蛋白质及酶的原理和方法;酶蛋白纯化过程中的活性、比活性、得率及纯化倍数的概念及计算;了解AKP的临床意义及纯化蛋白质的一般方法。
1.2 实验试剂与仪器1.2.1 实验仪器电子天平;匀浆器;紫外可见分光光度计;高速冷冻离心机;PH计;磁力加热搅拌机1.2.2实验试剂及配制95%乙醇、丙酮、正丁醇、醋酸镁、醋酸钠、Tris、考马斯亮蓝G-250、硫酸镁、氢氧化钠(1)0.01mol/L醋酸镁-0.01mol/L醋酸钠混合溶液:取0.5mol/L醋酸镁20mL 及0.1mol/L醋酸钠100mL,混匀后加蒸馏水稀释至1000mL。
(2)0.01mol/L Tris-硫酸镁缓冲液(pH8.8):称取三羟甲基氨基甲烷(Tris)12.1g,用蒸馏水溶解,并稀释至1000mL,配制0.1mol/L Tris溶液;取0.1mol/L Tris溶液100mL,加蒸馏水约700mL,再加0.5mol/L醋酸镁20mL,混匀后用1%醋酸溶液调节pH至8.8,用蒸馏水稀释至1000mL即可。
生物化学实验——小牛肠碱性磷酸酶的提纯及酶活的测定、SDS-PAGE电泳法测定蛋白质相对分子质量

生物化学实验报告小牛肠碱性磷酸酶的提纯及酶活的测定、SDS-PAGE电泳法测定蛋白质相对分子质量摘要:碱性磷酸酶是在碱性条件下水解多种磷酸酯并具有转磷酸基作用的一组酶,并且在较高温度下扔具有活性,本实验中通过一系列分离纯化获得碱性磷酸酶,催化底物对硝基苯磷酸二钠生成对硝基苯酚,对硝基苯酚在405nm光波长下有最大吸收,通过测定吸光值的变化率,可以检测测定酶活性(在特定条件下,1min内催化1μmol底物转化成产物所需要的酶量被称为一个酶活力单位);蛋白质-考马斯亮蓝结合物在595nm波长下的光吸收与蛋白质含量成正比,所以可以利用考马斯亮蓝法测定蛋白质含量。
SDS-PAGE电泳法测定蛋白质的相对分子质量,是因为SDS可以与蛋白质形成蛋白质-SDS复合物,电泳迁移率主要取决于蛋白质的分子量大小,以推断出被测蛋白样品分子量的近似值。
关键词:碱性磷酸酶;提取;小牛肠;酶活性测定;马斯亮蓝法;蛋白质含量测定;SDS-PAGE电泳法;实验部分1.1试剂与仪器试剂:正丁醇,丙酮(置于-20摄氏度冰箱保存),硫酸铵,30% 丙烯酰胺,10% 过硫酸铵,1 mol/L HAc,1 mol/L NaOH,TEMED(四甲基乙二胺),电泳缓冲液,平衡缓冲液(0.01 mol/L Tris-HCl,pH 8.0,含1.0×10-3 mol/L MgCl2和1.0×10-5 mol/L ZnCl2);底物缓冲液(1 mol/L 二乙醇胺-盐酸缓冲液,pH 9.8,含0.5×10-3 mol/L MgCl2);酶的底物溶液(用底物缓冲液配制15×10-3 mol/L 对硝基苯磷酸二钠溶液);分离胶缓冲液(1.5 mol/L Tris-HCl缓冲液,pH 8.8,已加入10% SDS)浓缩胶缓冲液(0.5 mol/L Tris-HCl缓冲液,pH 6.8,已加入10% SDS);上样缓冲液(100 mg SDS、2 mg溴酚蓝、2 g甘油,加0.1 mL巯基乙醇、2 mL 0.05mol/L pH 8.0 Tris-HCl,加超纯水定容至10 mL);染色液(含0.1% 考马斯亮蓝R250,40%甲醇和10%冰酸的染色液500 mL);脱色液(500 mL 10%甲醇和10%冰醋酸的脱色液1000 mL);电泳缓冲液(0.1% SDS,0.05mol/L Tris,0.384 mol/L甘氨酸pH 8.3)仪器:匀浆机(常州国华电气有限公司JJ-2);高速冷冻离心机(eppendorf centrifuge 5804R);恒温水浴(上海一恒科技有限公司HWS-12);紫外可见分光光度计(上海精密科学仪器有限公司UV720);双垂直电泳槽(DYCZ-24D);电泳仪(北京市六一仪器厂DYY-8C);脱色摇床:WD-9405A 1.2.1小牛肠碱性磷酸酶的提取1、刮取新鲜小牛肠内粘膜。
碱性磷酸酶比活力测定

(二)、酶活力
在37C下,以5mmol/L pNPP为底物,在pH 10.1的
碳酸盐缓冲液含2 mmol/L Mg2+的测活体系中每分
钟催化产生1 mol/L pNP的酶量定为1个酶活力单 位。
酶的比活力定义为每mg蛋白所具有的酶活力单位 数。
酶活性测定前处理
1、2号样品稀释50倍(用洗脱液稀释) 3号样品稀释20倍(用洗脱液稀释) 4号样品不稀释(用洗脱液稀释)
3. 物质浓度,液层厚度与光吸收的关系 (Lambert--Beer定律):
当一束单色光通过溶液后,光被溶液吸收的程度(D) 与溶液的浓度(C),液层的厚(L)以及入射光的强度 (I0)有关。溶液浓度越大,液层越厚,吸光越多,这 就是物质(均匀透明固体,液体,气体)对光的吸收定 律。
4. 待测溶液浓度的计算:
蛋白浓度按下式计算:
100g / mL牛血清白蛋白 = C未知
OD280
OD280
数据处理
单位时间0.1mL酶液催化产物量计算: 克分子消光系数法
PNP 1 mol / L(1cm光程)=C未知
OD40(5 8.8 103)
OD即Βιβλιοθήκη C未知=OD/(8.8103)
计算:
酶活力(U/mL) = B t V1
(3)消光系数法:
1%浓度,1cm厚度溶液中测得:K = E1cm1% 或1克分子浓度,1cm厚度溶液中测得:K = ξ C = D/E1cm%, 或 C = D/ξ
常用于紫外吸收法测定蛋白质,核酸含量,二者分 别在280nm和260nm处有最大吸收,其消光系数 可查到,在同样条件下,测定待测溶液的光密度, 带入上式即可求得C。
(1)标准管法:
在同样条件下,测得标准液和待测液的光密度(D) 值,然后计算:
碱性磷酸酶的提取分离和比活力的测定

碱性磷酸酶的提取分离和比活力的测定项目名称碱性磷酸酶的提取分离和比活力的测定xinpingzhao@实验目的1. 了解酶提取纯化的基本实验技术;2. 掌握碱性磷酸酶酶活力及比活力的测定方法实验材料新鲜兔肝或兔肾主要仪器设备匀浆器,冷冻离心机,分光光度计,电子天平等.实验原理碱性磷酸酶(简称AKP)在磷酸盐代谢中起重要作用。
核酸序列分析、DNA重组技术、酶标免疫检测技术以及临床检验中都需要利用此酶。
本实验取材于兔肝,经匀浆、正丁醇抽提、硫酸胺分段盐析或者有机溶剂沉淀,获得碱性磷酸酶制品。
本实验采用对硝基苯磷酸二钠(p-NPP)为底物的方法测定酶活。
对硝基苯磷酸二钠在碱性磷酸酶的作用下被水解为游离磷酸及对硝基苯酚,对硝基苯酚在强碱性条件下显示亮黄色,在405nm处有强烈的吸收峰。
因此可以测定405nm处的吸收值A405nm来计算产物的生成量,从而计算出酶活力,然后通过各级纯化步骤产物蛋白含量的测定,从而计算出酶的比活力.第一部分: 碱性磷酸酶的提取以下操作均在4℃进行。
方案一:1. 称取新鲜兔肝2g,剪碎后,置于玻璃匀浆器中,按1:2(m/v)加入预冷的0.05mol/LTris-HCl (pH9.0)缓冲液,匀浆后4℃抽提20 min;4℃,8000r/min离心10min;取上清;此为A 液。
另取1支试管编号为A,取0.1mLA 液,加1.9mLTris缓冲液(pH 8.8),混匀,供测酶活性用。
2.上清液中加入1/5体积预冷正丁醇脱脂20min;8000r/min离心10min,取上清;此为B液。
吸取0.1m1B 液,置于编号为B 的试管中,加入1.9m1Tris 缓冲液(pH 8.8),供测酶活用。
3.加入硫酸铵至35%饱和度;4℃30 min;8000r/min离心10min,弃沉淀;取上清;此为C 液。
吸取C 液0.2m1置于编号为c 的试管中,加入1.8m1Tris 缓冲液(PH 8.8),供测酶活性用4.然后在上清液中加入硫酸铵至75%饱和度,4℃静置30 min后8000r/min离心10min,得沉淀..用0.05mol/LTris-HCl(pH9.0)缓冲液溶解沉淀;此为D 液。
碱性磷酸酶分离纯化及比活性测定1

试剂(ml)
生理盐水 标准蛋白溶液 样品 考马斯亮蓝试剂
空白管
0.1标Biblioteka 管ABC0.1 A2液0.1 5.0 5.0 5.0 B2液0.1 5.0 C2液0.1 5.0
室温5min,各管进行A595测定 计算:样品中蛋白质的含量=A样品/A标准×C标准×稀释倍数
目录
3. 结果处理与分析
结果处理表
酶活性计算 体积 (ml) A 值
目录
检测酶提取纯化的指标
1. 酶的纯度: 用比活性代表(单位重量蛋白质样品中 的活性单位) 2. 酶的回收效率 所含酶
※在保证纯度的前提下,应尽可能提高酶的回收率
目录
实验内容
酶的提取及比活性测定
目录
碱性磷酸酶(alkaline phosphatase, AKP) 的分离纯化及比活性测定
[目的] 1.掌握AKP分离纯化的实验原理、方法 及注 意事项 2.了解检测AKP活性测定的原理和方法。
25g肝组织剪碎 +0.01M醋酸镁-醋酸钠溶液75ml,匀浆机中匀浆 取肝匀浆4ml(A液)
A1:取0.1mlA液+1.9mlpH8.8Tris缓冲液,待测活性
A2:取0.1mlA液+4.9ml生理盐水,待测蛋白浓度
+2ml正丁醇,混匀2min,室温置30min,离心 (3000rpm)5min 下清液(吸取) 沉淀(弃)
蛋白含量计算 酶的总 活性 ( U) A 值
稀 释 倍 数
酶活性 (U/ml)
稀 释 倍 数
比活 酶的 性 蛋白浓度 得率 (U/mg) (mg/ml)
A 液 B液
4 2.2
100%
C液
2
目录
8碱性磷酸酶比活力测定

8碱性磷酸酶比活力测定概述碱性磷酸酶(alkaline phosphatase,ALP)是一种广泛存在于动植物组织和微生物中的酶,其主要功能是催化磷酸盐基团的水解反应。
ALP的活性主要由酸碱度、温度、金属离子浓度等因素所影响。
ALP比活力测定可以用于快速筛选和检测酶的活性及其活性变化等。
本实验采用8碱性磷酸酶作为模型酶,采用间接比色法测定其比活力。
材料和试剂试剂:1. 空白对照:含有ALP缓冲液的管2. 标准对照:10μg/mL碱性磷酸酶溶液3. 涂板洗涤缓冲液:PBS液,pH 7.44. 反应底物:pNPP溶液5. 停止液:2mol/L NaOH溶液6. ALP缓冲液:0.1mol/L甘氨酸缓冲液,pH 9.6,含有1mmol/L MgCl2仪器:1. 组合式洗板机2. 酶标仪3. 加热器4. 温度计方法注意事项:1. 所有的样品和标准溶液都应在同一天制备,并测量前混匀。
2. 所有的试剂和材料都要神经否则可能影响实验结果。
实验操作:1. 取100μL标准对照和100μL空白对照,分别加入洗涤缓冲液中,洗涤3次。
2. 加入100μL标准对照和待测样品至96孔板中。
每个样品平行加入两个孔。
3. 加入50μL反应底物至每个孔中,将板密封,加热反应30min。
4. 加入50μL停止液,将板洗涤5次。
5. 测定吸光度值,波长为405nm。
数据处理1. 记录96孔板中每个孔的吸光度值。
2. 以标准对照为基准,计算每个孔的相对吸光度值。
3. 以样品组的平均相对吸光度值为y,以标准对照相对吸光度值为x,绘制标准曲线,计算标准曲线的斜率。
4. 计算样品的ALP比活力。
样品ALP比活力= (样品相对吸光度值/y) x 斜率。
结果与分析以标准曲线计算每个样品的ALP比活力,根据结果可以判断样品中ALP酶的比活力。
若ALP比活力高,说明该样品中ALP酶活性较强;若低,则说明其活性相对较弱。
总结。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在蛋白质或酶的分离提取过程中由于酶蛋白容易变 性而失活,为了获得较好的分离提取效果,在工作 中特别注意以下几点:
(1)
(2)
取用新鲜的材料,提取工作应在获得材料后立刻开 始,否则应在低温下保存。选择来源丰富,酶含量 高的材料。 在酶的制备过程中,每经一步处理,都需测定酶的 活力和比活力。酶的比活力定义为每mg蛋白所具有 的酶活力单位数。唯有比活力提高较大,提纯步骤 才有效。
(3)盐分级沉淀是一种应用非常广泛的方法 高浓度的盐离子在蛋白质溶液中可与蛋白质竞 争水分子,从而破坏蛋白质表面的水化膜,降低 其溶解度,使之从溶液中沉淀出来。 各种蛋白质的溶解度不同,因而可利用不同浓 度的盐溶液来沉淀不同的蛋白质。这种方法称之 为盐析。
硫酸铵因其溶解度大,温度系数小和不易使蛋 白质变性而应用最广。硫酸铵沉淀法可用于从大 量粗制剂中浓缩和部分纯化蛋白质。
硫酸铵溶液饱和度计算表(25℃)
硫酸铵终浓度,%饱和度 10 20 25 30 33 35 40 45 50 55 60 65 70 75 80 90 100
每1升溶液加固体硫酸铵的克数① 硫 酸 铵 初 浓 度 , % 饱 和 度 0 10 20 25 30 33 35 40 45 50 55 60 65 70 56 114 57 144 86 29 176 118 59 30 196 137 78 49 19 209 150 91 61 30 12 243 183 123 93 62 43 31 277 216 155 125 94 74 63 31 313 251 190 158 127 107 94 63 32 351 288 225 193 162 142 129 97 65 33 390 326 262 230 198 177 164 132 99 66 33 430 365 300 267 235 214 200 168 134 101 67 34 472 406 340 307 273 252 238 205 171 137 103 69 34 516 449 382 348 314 292 178 245 210 176 141 105 70 35 561 494 424 390 356 333 319 285 250 214 179 143 107 72 662 592 520 485 449 426 411 375 339 302 264 227 190 153 767 694 619 583 546 522 506 469 431 392 353 314 275 237
2. 操作方法 2.1 牡蛎碱性磷酸酶的分离提取 (1) 每组称取25 g牡蛎(蒸馏水洗净),加入50 mL 预先冷却的0.01 mol/L Tris-HCl 缓冲液(pH 7.5, 含0.1 mol/L NaCl),(两组一起)于高速组织 捣碎机匀浆1 min,于冰箱4℃放置1 h左右进行抽 提。 (2) 室温离心,4000 r/m 20 min,收集离心上清液并 量体积(两组分开) 。(留3 mL上清液,待测 酶的比活力。) (3) 在上清液中加入研磨成细粉的固体硫酸铵至0.35 饱和度(100 mL加入20.9 g )。缓慢加入, 不断搅拌溶解,置冰箱静置1 h左右。 (4) 室温离心,4000 r/m 10 min,收集离心上清液, 并量体积。(留3 mL上清液,对0.01 mol/L TrisHCl 缓冲液pH 7.5含0.1 mol/L NaCl 透析平衡, 待测酶的比活力。)
(5) 0.35饱和硫酸铵上清液,加入固体研磨成细粉的硫 酸铵至0.70饱和度(100 mL加入23.8 g )。缓 慢加入,不断搅拌溶解,置冰箱静置1-2 h。 (6) 室温离心,4000 r/m 10 min,收集沉淀物。 (7) 得到沉淀物,溶于5 mL含0.1 mol/L NaCl 的0.01 mol/L Tris-HCl缓冲液(pH 7.5)。装入透析袋,对 0.01 mol/L Tris-HCl pH 7.5缓冲液透析平衡,至无 SO42-被检测出为止(可用一定浓度BaCl2溶液检 验)。 (8) 取出酶溶液,冷冻高速离心(0℃ 25000 r/m 30 min)。 (9) 离心上清液即为粗酶制剂,检测酶的比活力。装入 棕色瓶于4℃冰箱保存。
上清液
缓慢加入研磨细粉的固体硫酸铵至0.35饱和度(100 mL加入20.9 g),不断搅拌溶解,置冰箱静置1 h左右。 室温离心,4000 r/m 10 min,收集离心上清液,并量体积。 (留
3 mL上清液,待测酶的比活力。) 0.35饱和硫酸铵上清液 加入固体研磨成细粉的硫酸铵至0.70饱和度(100 mL加入23.8 g)。缓慢加入,不断搅拌溶解,置冰箱静置1-2 h。 室温离心,4000 r/m 10 min,收集沉淀物。
沉淀
粗酶液
溶于5 mL含0.1 mol/L NaCl 的0.01 mol/L Tris-HCl pH 7.5。装入透 析袋,对0.01 mol/L Tris-HCl pH 7.5缓冲液透析平衡,至无SO42-被 检测出为止
离心机的使用 (1) 离心机要置水平位置,以保证旋转轴垂直地 球水平面。 (2) 样品倾入离心杯后应与离心管套一起两两平 衡,平衡后把它们放置于转子的对称位置。 (3) 盖好盖子,打开电源开关,调整离心时间和 离心速度。 (4) 启动离心后等转速达到所要求的转速后才能 离开(一般要2~3min)。 (6) 离心结束后要等到转速为零时才能打开离心 机盖,取出样品。
25 g牡蛎
匀浆液
加入50 mL预先冷却的0.01 mol/L Tris-HCl 缓冲液(pH 7.5, 含0.1 mol/L NaCl),于高速组织捣粹机匀浆1 min,于冰箱 4℃放置1 h左右进行抽提。
室温离心,4000 r/m 20 min,收集离心上清液,并量体积。 (留3 mL上清液,待测酶的比活力。)
实验 碱性磷酸酶的分离提取
目的要求: 1.学习蛋白质分离纯化的一般原理和步骤 2.掌握碱性磷酸酶制备的操作技术
1.原理
碱性磷酸酶 (Alkaline phosphatase EC 3.1.3.1 简称为ALPase)广泛存在于微生物界和动物界。 ALPase能催化几乎所有的磷酸单酯的水解反应, 产生无机磷酸和相应的醇、酚或糖。它也可以 催化磷酸基团的转移反应,磷酸基团从磷酸酯 转移到醇、酚或糖等磷酸受体上。
