(完整版)浙江师范大学无机化学试卷.doc
(完整版)无机化学考研试题(含答案,已经整理好的)

一、单选题 第2章 热化学1、在下列反应中,Q p =Q v 的反应为( )(A )CaCO 3(s) →CaO(s)+CO 2(g) (B )N 2(g)+3H 2(g) →2NH 3(g)(C )C(s)+O 2(g) →CO 2(g) (D )2H 2(g)+O 2(g) →2H 2O (l )2、下列各反应的(298)值中,恰为化合物标准摩尔生成焓的是( ) (A )2H(g)+ O 2(g)→H 2O (l ) (B )2H 2(g)+O 2(g)→2H 2O (l )(C )N 2(g)+3H 2(g)→2NH 3(g) (D )N 2(g) +H 2(g)→NH 3(g)3、由下列数据确定CH 4(g)的为( ) C(石墨)+O 2(g)=CO 2(g) =-393.5kJ·mol -1H 2(g)+ O 2(g)=H 2O (l) =-285.8kJ·mol -1CH 4(g)+2O 2(g)=CO 2(g)+2H 2O (l ) =-890.3kJ·mol -1(A )211 kJ·mol -1; (B )-74.8kJ·mol -1;(C )890.3 kJ·mol -1; (D )缺条件,无法算。
4、已知:(1)C(s)+O 2(g)→CO(g), (1)= -110.5k J·mol -1(2)C(s)+O 2(g)→CO 2(g),(2)= -393.5k J·mol -1 则在标准状态下25℃时,1000L 的CO 的发热量是( )(A )504 k J·mol -1 (B )383 k J·mol -1 (C )22500 k J·mol -1 (D )1.16×104 k J·mol -15、某系统由A 态沿途径Ⅰ到B 态放热100J ,同时得到50J 的功;当系统由A 态沿途径Ⅱ到B 态做功80J 时,Q 为 ( )(A ) 70J (B ) 30J (C )-30J (D )-70J6、环境对系统作10kJ 的功,而系统失去5kJ 的热量给环境,则系统的内能变化为 ( )(A )-15kJ (B ) 5kJ (C ) -5kJ (D ) 15kJ7、表示CO 2生成热的反应是( )(A )CO (g )+ 1/2O 2(g )=CO 2(g )ΔrHmθ=-238.0kJ.mol-1(B )C (金刚石)+ O 2(g )=CO 2(g )ΔrHmθ=-395.4kJ.mol-1(C )2C (金刚石)+ 2O 2(g )=2CO 2(g )ΔrHmθ=-787.0kJ.mol-1(D )C (石墨)+ O 2(g )=CO 2(g )ΔrHmθ=-393.5kJ.mol-1二、填空题1、25℃下在恒容量热计中测得:1mol 液态C 6H 6完全燃烧生成液态H 2O 和气态CO 2时,放热3263.9kJ ,则△U 为-3263.9,若在恒压条件下,1mol 液态C 6H 6完全燃烧时的热效应为-3267.6。
完整版)大学无机化学试题及答案

完整版)大学无机化学试题及答案1.对于H2O2和N2H4,下列叙述正确的是:(C)都具有氧化性和还原性。
2.下列含氧酸中属于三元酸的是:(C)H3PO3.3.下列各对含氧酸盐热稳定性的大小顺序,正确的是:(B)CaCO3<CdCO3.4.铝在空气中燃烧时,生成(A)单一化合物Al2O3.5.下列含氧酸根中,属于环状结构的是:(C)。
6.下列化合物与水反应放出HCl的是:(C)POCl3.7.InCl2为逆磁性化合物,其中In的化合价为(C)+3.8.鉴别Sn4+和Sn2+离子,应加的试剂为(D)硫化钠(过量)。
9.下列各组化合物中,都有颜色的一组化合物是(B)CCl4,NO2,HgI2.10.将过量SiF4通入NaOH溶液中,主要产物是(C)Na2SiO3,Na2SiF6.11.将NCl3.(缺少选项,无法判断正确与否)。
改写后的文章:无机化学试题一、选择题1.H2O2和N2H4都具有氧化性和还原性。
2.H3PO3是三元酸。
3.正确的含氧酸盐热稳定性大小顺序是:CaCO3<CdCO3.4.铝在空气中燃烧时生成单一化合物Al2O3.5.环状结构的含氧酸根是C。
6.与水反应放出HCl的化合物是POCl3.7.InCl2为逆磁性化合物,其中In的化合价为+3.8.鉴别Sn4+和Sn2+离子,应加的试剂是硫化钠(过量)。
9.有颜色的一组化合物是CCl4,NO2,HgI2.10.将过量SiF4通入NaOH溶液中,主要产物是Na2SiO3,Na2SiF6.11.(缺少选项,无法判断正确与否)。
填空题:16.N2O5很容易分解为NO2和O2.将棕黄色的NO2冷却到-15℃左右,它几乎全部转变为淡黄色的N2O5.经X射线衍射研究,证明固体N2O5含有两种离子。
17.NCl3的水解产物是NH3和HCl;PCl3的水解产物是H3PO3和HCl;SbCl3的水解产物是SbOCl和HCl;BiCl3的水解产物是BiOCl和HCl;AsCl3的水解产物是AsO(OH)和HCl。
【浙江师范大学2012年考研专业课真题】无机化学20122012

43. 实验室存放下列物质的方法分别是:白磷 45. O2+, N2, NO, CN-中互为等电子体的是 ;
44. 在面心立方金属铜晶体中,每个晶胞所含铜原子数为 46. 配置 FeCl2 溶液要用盐酸而不是蒸馏水的原因
。
三、完成化学方程式(或离子方程式) (共 5 小题,每小题 2 分,共 10 分) 47、以标准硫代硫酸钠溶液测定溶液中的 I2 含量 ; 48、铋酸钠与 MnSO4 在稀硫酸介质中反应; 49、氧化钴(III)被浓盐酸溶解; 50、碘放入足量 NaOH 溶液中; 51. 硫化铜与稀硝酸共热。 四、简答题(共 4 小题,共 20 分) 52(4 分). 已知室温下 H3PO4 的 Ka1 = 7.5× -3,Ka2 = 6.2× -8,Ka3 =2.2× -13, 10 10 10 H2O 的 Kw = 1× -14。试解释 NaH2PO4 溶液呈酸性,而 Na2HPO4 溶液呈碱性。 10 53.(4 分)什么是缓冲溶液?列举 2 例说明你所知道的缓冲溶液体系。 54.(8 分)写出下列物质的名称和结构式 P4O10; H4P2O7; CrO5; B2H6 55.(4 分)Au 不溶于浓硝酸,但可溶于王水,请给出 Au 溶于王水的反应式, 并解释王水能氧化 Au 的主要原因。 五、计算题(共 3 小题,共 30 分) 56.(12 分)298 K、标准压力时,金刚石和石墨的热力学数据如下: 石墨 Sm0/J•K•mol-1 △cHm0/ kJ•mol-1 (燃烧热) 5.7 -393.4 金刚石 2.4 -395.3
2CO(g)在 298K,101.3 kPa 压力下的
△rH 0 =171.5kJ·mol-1,下列那种方法能使平衡向右移动 m A. 降低压力,降低温度 C. 升高压力,升高温度 到的现象为 A. 先出现紫色,随后变黄色 B. 先出现黄色,随后出现紫色 C. 先出现紫色,随后出现黄色,再变成无色 D. 先出现紫色,随后变无色,最后出现黄色 15. 某化合物 A 的水合晶体 A·3H2O(s)的脱水过程为 ① A·3H2O(s) ② A·2H2O(s) ③ A·H2O(s) A·2H2O(s)+ H2O(g) A·H2O(s)+ H2O(g) A(s)+ H2O(g) K1 0 K2 0 K30 B. 降低压力,升高温度 D. 升高压力,降低温度
大学无机化学试题集及答案

大学无机化学试题集及答案第一章气体、液体和溶液的性质1. 敞口烧瓶在7℃所盛的气体,必须加热到什么温度,才能使1/3气体逸出烧瓶?2. 已知一气筒在27℃,30.0atm时,含480g的氧气。
若此筒被加热到100℃,然后启开阀门(温度保持在100℃),一直到气体压力降到1.00atm时,共放出多少克氧气?3. 在30℃时,把8.0gCO2、6.0gO2和未知量的N2放入10dm3的容器中,总压力达800 mmHg。
试求:(1) 容器中气体的总摩尔数为多少?(2) 每种气体的摩尔分数为多少?(3) 每种气体的分压为多少?(4) 容器中氮气为多少克?4. CO和CO2的混合密度为1.82g⋅dm-3(在STP下)。
问CO的重量百分数为多少?5. 已知某混合气体组成为:20份氦气,20份氮气,50份一氧化氮,50份二氧化氮。
问:在0℃,760mmHg下200dm3此混合气体中,氮气为多少克?6. S2F10的沸点为29℃,问:在此温度和1atm下,该气体的密度为多少?7. 体积为8.2dm3的长颈瓶中,含有4.0g氢气,0.50mol氧气和分压为2atm 的氩气。
这时的温度为127℃。
问:(1) 此长颈瓶中混合气体的混合密度为多少?(2) 此长颈瓶内的总压多大?(3) 氢的摩尔分数为多少?(4) 假设在长颈瓶中点火花,使之发生如下反应,直到反应完全:2H2(g) + O2(g) =2H2O(g)当温度仍然保持在127℃时,此长颈瓶中的总压又为多大?8. 在通常的条件下,二氧化氮实际上是二氧化氮和四氧化二氮的两种混合气体。
在45℃,总压为1atm时,混合气体的密度为2.56g⋅dm-3。
计算:(1) 这两种气体的分压。
(2) 这两种气体的重量百分比。
9. 在1.00atm和100℃时,混合300cm3H2和100 cm3O2,并使之反应。
反应后温度和压力回到原来的状态。
问此时混合气体的体积为多少毫升?若反应完成后把温度降低到27℃,压力仍为1.00atm,则混合气体的体积为多少毫升?(已知27℃时水的饱和蒸汽压为26.7mmHg)10. 当0.75mol的“A4”固体与2mol的气态O2在一密闭的容器中加热,若反应物完全消耗仅能生成一种化合物,已知当温度降回到初温时,容器内所施的压力等于原来的一半,从这些数据,你对反应生成物如何下结论?11. 有两个容器A和B,各装有氧气和氮气。
(完整版)无机化学题库

无机化学水平测试题(Ⅰ)一、选择题(在下列各题中,选择出符合题意的1个或2个答案,将其代号写在括号中,每题1.5分,共24分)1.下列物质中可以认为具有最大摩尔熵的是( ) A.Li(g)B.Li(s)C.LiCl ·H 2O(s)D.LiCO 3(s)2.已知在一定温度下:SnO 2(s)+2H 2(g) === Sn(s)+2H 2O(g) 1K Θ= 21.0 CO(g)+H 2O(g) === CO 2(g)+H 2(g)2K Θ=0.034因此,下列反应SnO 2(s)+2CO(g) === Sn(s)+2CO 2(g)的3K Θ=( )A.21.0B.0.714C.0.024 3D.21.63.下列化合物中,既有离子键又有共价键的物质是( ) A.NaOHB.CaCl 2C.CH 4D.NH 4Cl4.已知φΘ(Cu 2+/Cu) === 0.34 V ,φΘ(Cu +/Cu)= 0.52 V ,则φΘ(Cu 2+/Cu +)为( ) A.–0.18 V B.0.16 VC.0.86 VD.0.18 V5.下列元素原子半径排列顺序正确的是( ) A.Mg>B>Si>Ar B.Ar>Mg>Si>B C.Si>Mg>B>ArD.B>Mg>Ar>Si6.反应3A 2++2B === 3A+2B 3+在标准状态下电池的电动势E Θ为1.8 V ,某浓度时,反应的电池电动势E 为1.6 V ,则此时该反应的lg K Θ值为( )A.3×1.8/0.059 2B.3×1.6/0.059 2C.6×1.6/0.059 2D.6×1.8/0.059 27.下列离子的原子序数分别是25、26、27、28,其电子构型可以用[Ar]3d 6表示的是( ) A.Mn 2+B.Fe 2+C.Co 3+D.Ni 2+8.已知H 2S 的1a K Θ=1.0×10–7,2a K Θ=1.0×10–13,在饱和的H 2S 水溶液中c (S 2–)应为( )mol ·L –1A.1.0×10–7B.1.0×10–13C.1.0×10–4D.1.0×10–209.下列叙述正确的是 ( ) A.放热反应均为自发反应B.I 2(g)的∆f m G Θ (298.15)=0C.某反应的∆r G m >0,并不表示该反应在任何条件下都不能自发进行D.若反应的m H ∆Θr 和m G ∆Θr 均为正值,则升高温度m G ∆Θr 将增大10.配合物K 3[FeF 6]的磁矩为5.9玻尔磁子,而K 3[Fe(CN)6]的磁矩为1.9玻尔磁子,这种差别的原因是( )A.Fe 在这两种配合物中具有不同的氧化值B.K 3[Fe (CN) 6]不是配合物C.F 原子比C 原子的电负性大,使CN -比F -有更强的配位能力 D.在配体CN -的影响下,中心离子d 轨道的电子发生了重排11.某白色固体易溶于水,加入BaCl 2有白色沉淀产生,用HCl 酸化,沉淀完全溶解,再加入过量NaOH 至强碱性,加热有刺激性气体逸出。
(完整版)无机化学试题与答案,推荐文档

A. 增大 B.减小 C.不变
D.不能确定
9. 酸性溶液中,锰的元素电势图如下:
试判断发生歧化反应的物质是(
)。
A. MnO4- 和 MnO42-
B. Mn3+ 和 Mn2+ C. Mn3+ 和 MnO42-
D. MnO2 和
Mn3+
10. 以下分析报告是四种酸性未知溶液的定性分析结果,合理的是( )
8.硫化物 ZnS、CuS、 MnS、SnS、HgS 中易溶于稀盐酸的是
, 不溶
于稀盐酸但溶于浓盐酸的是
,不溶于浓盐酸但可溶于硝酸的是
,只溶于王水的是
.
9.难溶电解质 Mg(OH)2,分别在(1)纯水中;(2) MgC12 溶液中;(3)NH4C1 溶液 中溶解,溶解度大小顺序为_________ > _________ > _______.
判断反应 Pb2+ + Sn →Pb + Sn2+ 能否在下列条件下自发进行?
无机化学试题
一、选择题(20 分,每题 2 分)
1.已知:298K 时,反应
C(石墨)+ O2(g)→ CO2(g) ⊿rHmΘ=-393.5kJ ·mol-1
CO(g)+ 1/2O2(g)→ CO2(g) ⊿rHmΘ=-283.0kJ ·mol-1
则反应 C(石墨)+ 1/2O2(g)→ CO(g)的⊿rHmΘ 等于( )。
顺序是 HC1〈 HBr〈 HI 。
3.铜与浓 HNO3 反应生成 NO2,铜与稀 HNO3 反应生成 NO,所以稀 HNO3 的氧化性比浓 HNO3 强。 4.金刚石与石墨是同素异形体,由金刚石转变为石墨的△rH > 0。 5.硼酸是三元酸。 6.KMnO4 在酸中、碱中、受热、见光都不稳定。
《无机化学》考试试卷及答案

《无机化学》考试试卷及答案一、选择题(在下列各题中,选出符合题意的1个答案,写在括号中,每题1.5分,共24分)1.下列说法正确的是( )A.放热反应均为自发反应B.r S m为正的反应均为自发反应H m为负的反应均为自发反应C.r S m为正、rH m为正的反应均为自发反应D.r S m为负、r2.升高温度可以加快反应速率,其主要原因是( )A.降低了反应的活化能B.增加了活化分子百分数C.增加了活化分子总数D.增加了分子的碰撞次数3.下列各组量子数,不合理的是( ) (按n、l、m的顺序)A.(2,2,–1)B.(3,1,–1)C.(1,0,0)D.(4,3,1)4.分子中有极性键且偶极矩不等于零的是( )A.CO2B.BF3C.CH4D.CH2Cl25.室温下,稳定状态单质的标准摩尔熵是( )A.0B.1C.>0D.<06.既能用浓H2SO4干燥,又能用碱石灰干燥的物质是 ( )A.NH3B.H2C.SO2D.Cl27.已知H2S的=1.0×10–7,=1.0×10–13,在1L饱和的H2S水溶液中通0.1mol的HCl气体,c(S2–)为( )mol·L-1A.1.0×10–13B.1.0×10–4C.1.0×10–20D.1.0×10–198.将pH=5.0 与pH=9.0的两种强电解质溶液等体积混合,其pH值为( )A.1.0B.13.0C.7.0D.1.59.既溶于过量氨水,又溶于过量NaOH溶液的是( )A.Ca(OH)2B.Fe(OH)3C.Zn(OH)2D.Al(OH)310.配制I2溶液时,加入固体KI,目的是为了( ),增大I2的溶解度。
A.增加盐效应B.利用同离子效应C.降低水分子极性D.生成I3-离子11.在Al2(SO4)3溶液中加入Na2CO3,其主要产物是( )。
A.Al2(CO3)3+Na2SO4B.Al3++CO32-C.Al(OH)3+CO2D.Al2(CO3)3+CO212.40mL0.1mol·L–1HAc与20mL0.1mol·L–1NaOH混合后,溶液的pH值为( )A.3.1B.9.25C.4.75D.5.313.已知(Fe3+/Fe2+)=0.77V,(Fe2+/Fe)= –0.44V,则(Fe3+/Fe)=( )A.–0.037VB.0.55VC.0.40VD.1.65V14.27元素Co的[Co(NH3)6]3+是内轨型配合物,则中心离子未成对电子数和杂化轨道类型是( )A.4,sp3d2B.0,sp3d2C.4,d2sp3D.0,d2sp315.下列分子或离子中含有键的是( )A.SO2B.NO3-C.NO2D.NO2+三、是非题(判断下列叙述是否正确,在正确的答案后打√,在错误的答案后打×,共10分,每题1分。
大学无机化学试题及答案
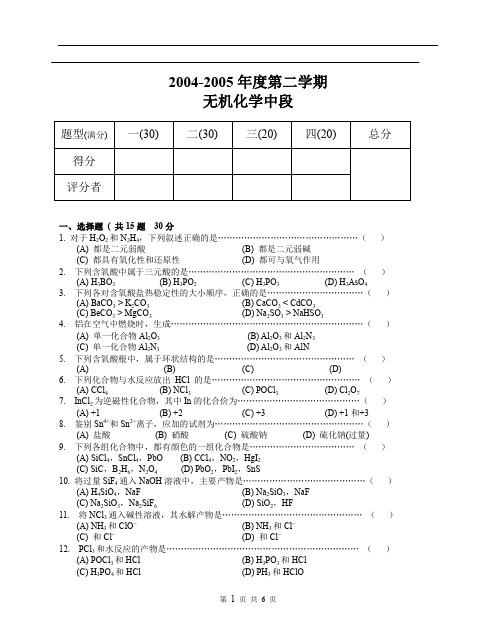
2004-2005年度第二学期无机化学中段一、选择题( 共15题30分1. 对于H2O2和N2H4,下列叙述正确的是…………………………………………()(A) 都是二元弱酸(B) 都是二元弱碱(C) 都具有氧化性和还原性(D) 都可与氧气作用2. 下列含氧酸中属于三元酸的是…………………………………………………()(A) H3BO3(B) H3PO2(C) H3PO3(D) H3AsO43. 下列各对含氧酸盐热稳定性的大小顺序,正确的是……………………………()(A) BaCO3 > K2CO3(B) CaCO3 < CdCO3(C) BeCO3 > MgCO3(D) Na2SO3 > NaHSO34. 铝在空气中燃烧时,生成…………………………………………………………()(A) 单一化合物Al2O3(B) Al2O3和Al2N3(C) 单一化合物Al2N3(D) Al2O3和AlN5. 下列含氧酸根中,属于环状结构的是…………………………………………()(A) (B) (C) (D)6. 下列化合物与水反应放出HCl 的是……………………………………………()(A) CCl4(B) NCl3(C) POCl3(D) Cl2O77. InCl2为逆磁性化合物,其中In的化合价为……………………………………()(A) +1 (B) +2 (C) +3 (D) +1和+38. 鉴别Sn4+和Sn2+离子,应加的试剂为……………………………………………()(A) 盐酸(B) 硝酸(C) 硫酸钠(D) 硫化钠(过量)9. 下列各组化合物中,都有颜色的一组化合物是………………………………()(A) SiCl4,SnCl4,PbO (B) CCl4,NO2,HgI2(C) SiC,B2H6,N2O4 (D) PbO2,PbI2,SnS10. 将过量SiF4通入NaOH溶液中,主要产物是……………………………………()(A) H4SiO4,NaF (B) Na2SiO3,NaF(C) Na2SiO3,Na2SiF6(D) SiO2,HF11. 将NCl3通入碱性溶液,其水解产物是…………………………………………()(A) NH3和ClO-(B) NH3和Cl-(C)和Cl-(D)和Cl-12. PCl3和水反应的产物是…………………………………………………………()(A) POCl3和HCl (B) H3PO3和HCl(C) H3PO4和HCl (D) PH3和HClO13. 下列各对物质,水解能力对比,正确的是………………………………………()(A)>(B)>(C) SnCl2 > SnCl4(D) PCl3 > BiCl314. 二氧化氮溶解在NaOH溶液中可得到:(A) NaNO2和H2O (B) NaNO2,O2和H2O(C) NaNO3,N2O5和H2O (D) NaNO3,NaNO2和H2O15. 下列硫化物,能溶于Na2S溶液生成硫代酸盐的是…………………………()(A) SnS (B) SnS2(C) PbS (D) Bi2S3二、填空题( 共12题30分)16. N2O3很容易分解为和。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
浙江师范大学《元素无机化学》考试卷(A)(2009~ 2010 学年第 2 学期)考试类别理科使用学生生化学院化学专业本科(09级)考试时间 120 分钟出卷时间2010年6月12日说明:允许使用计算器。
一 . 选择题(每小题只有 1 个正确答案。
每小题2分,共30分)1.下列分子或离子中,存在Π46键的是()A.NO3- B.BI 3 C.H3O+ D.HN32.下列有关离子浓度减小一半,其电极电势值增加的是( )A. Cu2+ + 2e- == CuB. Fe3+ + e- == Fe2++ - 2 2 + 2e - == 2I -C. 2H + 2e == HD. I3.Fe3+与强场和弱场配体形成八面体配合物中未成对电子的数目分别是()A.5和1 B.1和5 C.3和 1 D.5和 04.下列哪组溶液中的离子不能共存()A .NH 4+、Br -、Na+、 NO3-;B.Fe3+、 K +、Cl -、SO42-;+ 32- + 2 72-;D.Al3+ - +、NH4+。
C.Na 、SO 、H 、Cr O 、 Cl 、K5.镧系收缩的后果之一是使下列哪组元素的性质更相似()A .Mn 和 Tc B.Nb 和 Ta C.Sc 和 La D.Ru、Rh、Pd 6.下列哪种物质不溶于王水,但能溶于 HNO — HF 的混酸中()3A .Ta B.Ti C.CdS D.HgS7. 下列化合物属于缺电子化合物的是()A. Na[Al(OH) 4]B. H[BF 4]C. [B(OH) 4 ]-D. Al(CH 3)28.下列物质中酸性最弱的是A .H3 AsO B.HClO4C.H PO D.H PO4 3 4 4 2 79.单质 F2特别活泼的主要原因是()A .F(g)电离能较小;B.F 原子间孤对电子的排斥作用大;C.F-(aq)的水合热特别大;D. F 的电子亲和能大。
10.CrO4 2-(aq) 呈黄色,其属于()A .d-d 光谱B.f-f 光谱C.荷移光谱D.拉曼光谱.在普鲁士蓝 3 6 中,Fe2+和Fe3+的配位方式是()11 KFe[Fe(CN ) ]A .CN-中的 C 原子和 N 原子分别与 Fe 2+和 Fe 3+形成配位键;B .CN - 中的C 原子和 N 原子分别与 Fe 3+和 Fe 2+形成配位键; C .CN - 中的 C 原子和 N 原子均与 Fe 2+配位键;D .CN - 中的 C 原子和 N 原子均与 Fe 3+配位键。
12.下列哪种羰基化合物及其衍生物符合 18e 规则()A .Co(CO)4B .V(CO) 6C .Mn(CO)5D . Na[Co(CO)4]13.已知 TiO 2(s) + 2Cl 2(g) ==TiCl 4(l) + O 2(g),△ r G m 0 =153 kJ/mol ;2 2 rG m 02(s) + 2Cl 2(g) + C(s) =C(s) + O (g) == CO (g),△ = -394 kJ/mol ;则 TiO TiCl 4(l) + CO 2(g) 的自发性是 ( ) A .标准态下自发; B .标准态下非自发; C .低温下非自发;D .高温下自发。
14.Bi (III) 化合物很稳定,而 Bi (V) 化合物的稳定性极差,易被还原为Bi (III) 化合物,这种性质与 Bi 的下列哪种因素特别有关( )A .Bi 是重原子;B .Bi 的 6S 2惰性电子对效应C .Bi 的电子层多;D .Bi (V) 的半径小。
15.下列说法不正确 的是( )...A .碱金属碳酸盐水溶液的 pH 值总比其同浓度( mol/L )酸式盐的 pH 值高;B .As 、Se 和 Br 的最高氧化态含氧酸的氧化性分别比第三周期对应元素的强;C .一般而言,氢氧化物的 K sp 越小,其水溶液的碱性越弱; ;D .同一元素不同氧化态的物质,氧化态越高的氧化性越强。
二 . 判断题 (正确的用√、错误的用×表示;每小题1 分,共 5 分)1.含氧酸脱水缩合成多酸,一般而言,多酸的缩合度越大,其酸性越强;2.Be 和 Al 的性质相似,是由于二者的有效核电荷很接近的缘故;3.B 的最大配位数为 4,而 Al 的最大配位数可达到 6,这是由于 Al 的 3d 价轨道参与了成键的缘故;4.由于 Cu 2+的水合热大,在溶液中 Cu 2+不能转变为 Cu (I )的化合物;5.第一过渡系元素容易形成低氧化态,其高氧化态有较强氧化性;而第二、三过渡系元素倾向于形成高氧化态,其对应化合物的氧化性不显著。
三. 填空题(每空1分,共25分)1.HX 的还原性越强,其水溶液的酸性(1);2.XeOF4的结构是( 2);+-2-3.在 O2、 O2、 O2、 O2、中,氧化性最强的是(3),4.P4O6的结构式为(4)。
5.最硬的单质是( 5),沸点最高的金属是( 6),导电性最好的金属( 7)。
6.H3PO3是( 8)元酸, PO43-存在的两个大π键是( 9);7.硼砂的水溶液具有缓冲作用,是因为产生物质的量相等的H3BO3和( 10);8.Na2HPO4水溶液呈( 11)性;9.Ⅱ A 碳酸盐的热稳定性从上到下增强,是因为M 2+的反极化作用逐渐( 12);10.乙硼烷是缺电子化合物, B 原子以( 13)方式杂化,分子中除了有四个B— H 键外,还有两个( 14)键;11.比较大小和高低(用〉或〈表示)碱性: Zn(OH) 2(15) Ca(OH)2;离子性: CaCl2( 16)CuCl 2;熔点: SnCl4( 17)SnCl2水溶性: Hg2Cl2(18) HgCl 2;水解性: Fe2+( 19)Fe3+;磁矩: [V(CO) 6] (20)[Cr(CO) 6] (CO 是强场配体 )12.我国研制的“长征二号”火箭的主要燃料是偏二甲肼,已知它是一种分子结构不对称的极性化合物,分子相对质量为 60,其中,C 40 %,H 13.33 %,其余是 N。
火箭起飞时,可以看到一级火箭冒出红棕色气体,这是为了保证贮箱的安全,由保险门自动开启排出部分高压氧化剂变化而来的。
偏二甲肼的结构简式为(21),此燃料的氧化剂为(22);燃烧反应的化学方程式是(23)。
13.用马氏试砷法检验 As2O3俗称“砷镜”反应, Sb2O3也发生类似的“锑镜”反应。
区别砷镜和锑镜的试剂是(24)。
14.棕色环实验除了可以鉴别 NO3-外,还可以鉴别(25)。
四 . 完成并配平下列化学方程式(每小题1分,共10分)1.KBrO 3 + KBr + H +加热2.P4 + KOH3.NaBiO 3 + Mn 2+ + H+加热4.Pb3O4 + HCl ( 浓)5.Pt + HNO3 + HCl6.HgCl 2 + SnCl2 (过量 )7.KMnO 4 + K 2SO3 + KOH8.VO2+ + SO32- + H+9.Ni 2O3 + HCl( 浓 )10.Ce4+ + H 2O2五. 简答题(10 分)1.某混合溶液中仅含 Fe3+、Al 3+和 Cr3+,请设计一方案分离之。
(5 分)2.某人做实验时,发现 SnS 被 (NH4)2S 溶液溶解,你认为可能的原因是什么?如何证明你的判断是正确的?( 3 分)3.为什么说 PCl3既是 Lewis 酸,又是 Lewis 碱?( 2 分)六 . 计算题(10 分)已知(Fe3+/Fe2+) = 0.77V,(Ag +/Ag) = 0.799V;K 稳([Fe(CN)6]3-)≈ 1042,K 稳([Fe(CN) 6] 4-)35;Ksp,AgI≈×-17 ,(Ag +/Ag )= 。
试通过计算说明≈ 10 1 10 0.799V6 3-+ Ag + I- 6]4-+ AgI 反应的自发性。
( 10 分)[Fe(CN) ] [Fe(CN)(假定除 [Fe3+] 、[Fe2+]和[Ag +]外,其它离子的浓度均为1 mol/dm-3)七 . 推断题(10 分)一种盐 A 溶于水后,加入浓盐酸有刺激性气体 B 产生,同时有黄色沉淀 C 析出,气体 B 能使酸性 KMnO 4溶液褪色;若通 D 气体于 A 中, D 气体消失并得溶液E,E 与钡盐溶液作用,生成难溶于稀酸的白色沉淀F;向滤液中加入 AgNO3,有大量可溶于氨水的白色沉淀生成;将沉淀 C 与固体 G 共熔得 A ;固体 G 与稀硫酸作用得气体 B,将 B 通入黄绿色溶液H 中生成白色沉淀I,I 为逆磁性,易被潮湿的空气氧化;向溶液H 中滴加 NaOH,有兰色胶状沉淀生成,加热该胶状沉淀立即转变为黑色难溶物J,J 在浓盐酸中又变成黄绿色溶液H。
向溶液 H 中加过量的NaOH 至沉淀溶解,再滴加适量葡萄糖溶液,微热后有砖红色不溶物K 析出;将 K 与稀硫酸作用得蓝色溶液L 和固体 M ,M 不溶于稀硫酸可溶于浓硫酸得蓝色溶液L 。
试确定 A、C、D、F、G、H、I、J、K、M 各为何物。
