常规考马斯亮蓝染色试剂盒
考马斯亮蓝染色套装使用说明

考马斯亮蓝染色套装使用说明货号:P1305保存:室温保存,至少一年有效。
规格:100ml+500ml产品简介:本考马斯亮蓝染色套装(Commassie Blue Staining Kit)采用了最经典的考马斯亮蓝染色和脱色方法,以考马斯亮蓝G-250为染料,可用于SDS-PAGE或非变性PAGE等蛋白电泳凝胶的常规染色和脱色,或Western 转膜后PAGE胶上残余蛋白的检测。
产品内容:考马斯亮蓝染色液100ml考马斯亮蓝脱色液500ml说明书1份使用方法:1、电泳结束后,取凝胶放入适量考马斯亮蓝染色液中(至少5倍胶体积),确保染色液可以充分覆盖凝胶。
2、将凝胶置于摇床上缓慢摇动,室温染色至少2小时,低丰度蛋白染色需4小时以上。
3、染色结束后移除染色液,染色液通常可重复利用2-3次,但染色效果会略有影响。
4、将凝胶浸泡于和染色液等量体积的脱色液中,摇床上脱色4-8小时,期间更换3-5次脱色液。
注意事项:1.染色时间4小时以上效果最佳。
2.脱色可根据目的蛋白丰度和脱色效果随时终止,或延长脱色时间。
3.脱色越彻底,检测的蛋白量越低,脱色24小时一般可以检测出0.1ug蛋白量。
4.脱色后,将凝胶保存在水中,拍照或扫描保存图像。
或制成干胶保存。
相关试剂:P1300-500考马斯亮蓝蛋白胶快速染色液PC0020BCA蛋白浓度测定试剂盒PR1400低分子量蛋白MARKERPR1700预染次高分子量蛋白MARKERI1020IPTG溶液(50mg/ml)A101030%丙烯酰胺(29:1)T10705×Tris-甘氨酸电泳缓冲液P1300SDS-PAGE凝胶制备试剂盒。
P0017C 考马斯亮蓝染色脱色液_常规法_

使用说明:
1. 常规染色脱色方法: a. 电泳结束后,取凝胶放入适量考马斯亮蓝染色液中,确保染色液可以充分覆盖凝胶。 b. 置于水平摇床或侧摆摇床上缓慢摇动,室温染色1小时或更长时间。
注:具体的染色时间取决于凝胶的厚度和染色时的温度。凝胶较厚,温度较低,则染色时间宜适当延长。凝胶较薄,温 度较高,则染色时间可以适当缩短。通常染色至凝胶的颜色和染色液的颜色非常接近,在染色液中几乎看不清凝胶时, 可以认为已染色充分。染色2-4个小时或更长时间不会对最终的染色效果产生负面影响。 c. 倒出染色液。染色液可以回收重复使用至少2-3次。 d. 加入适量考马斯亮蓝染色脱色液,确保脱色液可以充分覆盖凝胶。 e. 置于水平摇床或侧摆摇床上缓慢摇动,室温脱色4-24小时。期间更换脱色液2-4次,直至蓝色背景基本上全部被脱去,并 且蛋白条带染色效果达到预期。通常蛋白条带在脱色1-2小时后即可出现。 注:脱色期间可以在脱色液中加入一片吸水纸,可以使部分染料吸附在吸水纸上,加快脱色。脱色时间过长也会导致蛋 白条带的颜色变浅。 f. 完成脱色后,可以把凝胶保存在水中,用于后续的拍照等。保存在水中的凝胶会发生溶涨。如需避免溶涨,可以把胶保 存在含20%甘油的水中。长期保存可以制备干胶。 2. 快速染色脱色方法: a. 电泳结束后,取胶放入适量考马斯亮蓝染色液中,微波炉加热至接近沸腾或刚刚沸腾,立即停止加热。 通常对于胶浓度大于10%的胶比较坚韧,在发生煮沸时不易破损;对于胶浓度小于10%的胶,宜尽量避免煮沸,以免出现 胶碎裂的情况。 b. 随后在染色液温度较高的情况下,摇床上摇动5-10分钟。 c. 倒出染色液。染色液可以回收重复使用至少2-3次。 d. 加入适量考马斯亮蓝染色脱色液,确保染色液可以充分覆盖凝胶。 e. 微波炉加热至接近沸腾或刚刚沸腾,立即停止加热。 f. 随后在脱色液温度较高的情况下,在摇床上摇动5-10分钟。此时通常可以观鲜的脱色液,重复步骤e和步骤f,直至蓝色背景基本上全部被脱去,蛋白条带染色效果达到预期。 h. 完成脱色后,可以把凝胶保存在水中,用于后续的拍照等。保存在水中的凝胶会发生溶涨。如需避免溶涨,可以把胶保
考马斯亮蓝试剂使用的具体操作
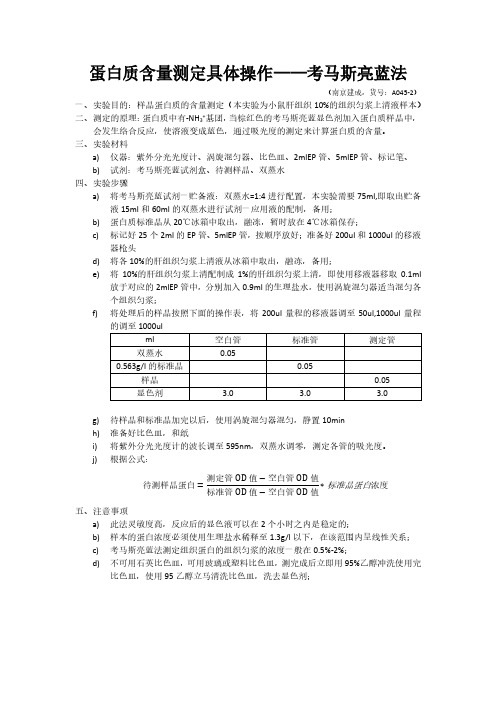
蛋白质含量测定具体操作——考马斯亮蓝法(南京建成,货号:A045-2)一、实验目的:样品蛋白质的含量测定(本实验为小鼠肝组织10%的组织匀浆上清液样本)二、测定的原理:蛋白质中有-NH3+基团,当棕红色的考马斯亮蓝显色剂加入蛋白质样品中,会发生络合反应,使溶液变成蓝色,通过吸光度的测定来计算蛋白质的含量。
三、实验材料a)仪器:紫外分光光度计、涡旋混匀器、比色皿、2mlEP管、5mlEP管、标记笔、b)试剂:考马斯亮蓝试剂盒、待测样品、双蒸水四、实验步骤a)将考马斯亮蓝试剂一贮备液:双蒸水=1:4进行配置,本实验需要75ml,即取出贮备液15ml和60ml的双蒸水进行试剂一应用液的配制,备用;b)蛋白质标准品从20℃冰箱中取出,融冻,暂时放在4℃冰箱保存;c)标记好25个2ml的EP管、5mlEP管,按顺序放好;准备好200ul和1000ul的移液器枪头d)将各10%的肝组织匀浆上清液从冰箱中取出,融冻,备用;e)将10%的肝组织匀浆上清配制成1%的肝组织匀浆上清,即使用移液器移取0.1ml放于对应的2mlEP管中,分别加入0.9ml的生理盐水,使用涡旋混匀器适当混匀各个组织匀浆;f)将处理后的样品按照下面的操作表,将200ul量程的移液器调至50ul,1000ul量程的调至1000ulg)待样品和标准品加完以后,使用涡旋混匀器混匀,静置10minh)准备好比色皿,和纸i)将紫外分光光度计的波长调至595nm,双蒸水调零,测定各管的吸光度。
j)根据公式:待测样品蛋白=测定管OD值−空白管OD值标准管OD值−空白管OD值∗标准品蛋白浓度五、注意事项a)此法灵敏度高,反应后的显色液可以在2个小时之内是稳定的;b)样本的蛋白浓度必须使用生理盐水稀释至1.3g/l以下,在该范围内呈线性关系;c)考马斯亮蓝法测定组织蛋白的组织匀浆的浓度一般在0.5%-2%;d)不可用石英比色皿,可用玻璃或塑料比色皿,测完成后立即用 95%乙醇冲洗使用完比色皿,使用95乙醇立马清洗比色皿,洗去显色剂;。
考马斯亮蓝染色

考马斯亮蓝染色一产品简介:本考马斯亮蓝染色试剂盒(Commassie Blue Staining Kit)采用了最经典的考马斯亮蓝染色和脱色方法,以考马斯亮蓝R250为染料,可用于SDS-PAGE或非变性PAGE等蛋白电泳凝胶的常规染色和脱色,或Western转膜后PAGE胶上残余蛋白的检测。
使用本试剂盒,采用常规染色脱色方法累计时间达到2-3小时后可以观察到蛋白条带;采用快速染色脱色方法20分钟左右即可观察到蛋白条带。
观察到最清晰的蛋白条带则需染色脱色更长时间。
本试剂盒中的染色液和脱色液经过改良,不含有毒的甲醇,但含有刺激性气味的乙酸。
二保存条件:室温保存,至少一年有效。
注意事项:可以使用枪头盒或适当大小的培养皿作为染色和脱色的容器。
本染色液呈酸性,有轻微腐蚀性,使用时请作必要防护。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
三使用说明:1. 常规染色脱色方法:a. 电泳结束后,取凝胶放入适量考马斯亮蓝染色液中,确保染色液可以充分覆盖凝胶。
b. 置于水平摇床或侧摆摇床上缓慢摇动,室温染色1小时或更长时间。
注:具体的染色时间取决于凝胶的厚度和染色时的温度。
凝胶较厚,温度较低,则染色时间宜适当延长。
凝胶较薄,温度较高,则染色时间可以适当缩短。
通常染色至凝胶的颜色和染色液的颜色非常接近,在染色液中几乎看不清凝胶时,可以认为已染色充分。
染色2-4个小时或更长时间不会对最终的染色效果产生负面影响。
c. 倒出染色液。
染色液可以回收重复使用至少2-3次。
d. 加入适量考马斯亮蓝染色脱色液,确保脱色液可以充分覆盖凝胶。
e. 置于水平摇床或侧摆摇床上缓慢摇动,室温脱色4-24小时。
期间更换脱色液2-4次,直至蓝色背景基本上全部被脱去,并且蛋白条带染色效果达到预期。
通常蛋白条带在脱色1-2小时后即可出现。
注:脱色期间可以在脱色液中加入一片吸水纸,可以使部分染料吸附在吸水纸上,加快脱色。
脱色时间过长也会导致蛋白条带的颜色变浅。
考马斯亮蓝法——完整版

二、试剂与器材
1. 试剂:
(1)考马斯亮蓝试剂: 考马斯亮蓝G—250 100mg溶于50ml 95%乙醇,加入100ml
85% H3PO4,用蒸馏水稀释至1000ml, 滤纸过滤。最终试 剂中含0.01%(W/V)考马斯亮蓝G—250, 4.7%(W/V)乙 醇,8.5%(W/V)H3PO4。
(2)标准蛋白质溶液: 纯的牛血清血蛋白,根据其纯度同0.15mol/L NaCl配制成100
考马斯亮蓝试剂 (ml) 5 5 5 5 5 5 5
摇匀,1h内以0号管为空白对照,在595nm处比色
A595nm
以A595nm为纵坐标,标准蛋白含量为横坐标(六个点为10ug、20 ug、30 ug、40 ug、50 ug、60 ug),在坐标轴上绘制标准曲线。
2、样品中蛋白质含量的测定
另取两支干净的试管(做一重复),加入合适浓度的 待测样品,使其测定值在标准曲线的范围内,测定方法同 上,由样品液的吸光度查标准曲线即可求出含量。
双缩脲反应;磷 钼酸-磷钨酸试 剂 被 Tyr 和 Phe 还 原
非蛋白氮(可 用三氯乙酸沉 淀蛋白质而分 离)
硫酸铵; Tris缓冲液; 某些氨基酸
各种嘌吟和嘧 啶; 各种核苷酸
硫酸铵; Tris缓冲液; 甘氨酸; 各种硫醇
用于标准蛋白质 含量的准确测定; 干扰少;费时太 长
用于快速测定, 但不太灵敏;不 同蛋白质显色相 似
2缺点四bradford法的优缺点1由于各种蛋白质中的精氨酸和芳香族氨基酸的含量不同因此bradford法用于不同蛋白质测定时有较大的偏差在制作标准曲线时最好选用球蛋白为标准蛋白质以减少这方面的偏差
考马斯亮蓝法——完整版
一、基本原理
酸性溶液两者结合,使染料溶液 的最大吸收峰的位置,由465nm变 为595nm,溶液的颜色也由棕黑色 变为兰色。
考马斯亮蓝G250染料试剂

仅供科研版本号:170313考马斯亮蓝G250染料试剂【产品组成】【保存条件】室温,避光,3个月【产品概述】Bradford法是常用的蛋白浓度检测的方法,与传统方法相比,更简单、更稳定、兼容性更好。
Bradford 法测定蛋白浓度不受绝大部分样品中的化学物质的影响。
样品中β-巯基乙醇的浓度可高达1M,DTT的浓度可高达5mM。
但受高浓度的去垢剂的影响明显,故在用BradfordProteinAssayKit进行蛋白定量时,需确保SDS低于0.01%,TritonX-100低于0.05%,Tween20,60,80低于0.015%,含高浓度去污剂的蛋白定量,建议采用BCAProteinAssayKit。
考马斯亮蓝G250染料试剂由考马斯亮蓝G250、乙醇、磷酸组成,用于考马斯染料结合(Bradford)分析的总蛋白测量,其特点在于对蛋白样品中可能存在的大多数盐、溶剂、缓冲液、硫醇、金属螯合剂、还原性物质等均不排斥。
检测浓度下限达到25μg/ml,最小检测蛋白量达到0.5μg,待测样品体积为1~20μl,在50~1000μg/ml浓度范围内有较好的线性关系。
【使用方法】1、稀释蛋白标准(一般为BSA5mg/ml)使其终浓度为0.5mg/ml。
注意:蛋白样品在什么溶液中,蛋白标准也应用什么溶液稀释,也可以用0.9%NaCl或PBS稀释蛋白标准。
2、将标准品按0,1,2,4,8,12,16,20μl加到96孔板的蛋白标准孔中,加蛋白标准稀释液补足至20μl。
3、加适当体积样品到96孔板的样品孔中,补加标准品稀释液至20μl。
4、各孔加入200μl考马斯亮蓝G250染料试剂,室温放置3~5min。
5、酶标仪测定595nm波长处的吸光值,560~610nm之间的波长也可。
6、根据标准曲线计算出样品中的蛋白浓度。
【注意事项】1、待测蛋白溶解于什么样的稀释液中,蛋白标准也应溶解于什么样的稀释液中,否者待测蛋白与蛋白标准中所含非蛋白成分不一致,有可能导致测定不准确。
碧云天考马斯亮蓝染色试剂盒 P0017A 说明书

碧云天生物技术/Beyotime Biotechnology订货热线:400-168-3301或800-8283301订货e-mail:******************技术咨询:*****************碧云天网站微信公众号网址:考马斯亮蓝染色试剂盒(常规法)产品编号产品名称包装P0017A 考马斯亮蓝染色试剂盒(常规法) 1盒产品简介:本考马斯亮蓝染色试剂盒(Coomassie Blue Staining Kit)采用了最经典的考马斯亮蓝染色和脱色方法,以考马斯亮蓝R250为染料,可用于SDS-PAGE或非变性PAGE等蛋白电泳凝胶的常规染色和脱色,或Western转膜后PAGE胶上残余蛋白的检测。
使用本试剂盒,采用常规染色脱色方法累计时间达到2-3小时后可以观察到蛋白条带;采用快速染色脱色方法20分钟左右即可观察到蛋白条带。
观察到最清晰的蛋白条带则需染色脱色更长时间。
本试剂盒中的染色液和脱色液经过改良,不含有毒的甲醇,但含有刺激性气味的乙酸。
包装清单:产品编号产品名称包装P0017A-1 考马斯亮蓝染色液100mlP0017A-2 考马斯亮蓝染色脱色液500ml—说明书1份保存条件:室温保存,至少一年有效。
注意事项:可以使用枪头盒或适当大小的培养皿作为染色和脱色的容器。
本染色液和脱色液呈酸性,有轻微腐蚀性,使用时请作必要防护。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:1.常规染色脱色方法:a.电泳结束后,取凝胶放入适量考马斯亮蓝染色液中,确保染色液可以充分覆盖凝胶。
b.置于水平摇床或侧摆摇床上缓慢摇动,室温染色1小时或更长时间。
注:具体的染色时间取决于凝胶的厚度和染色时的温度。
凝胶较厚,温度较低,则染色时间宜适当延长。
凝胶较薄,温度较高,则染色时间可以适当缩短。
通常染色至凝胶的颜色和染色液的颜色非常接近,在染色液中几乎看不清凝胶时,可以认为已染色充分。
5×考马斯亮蓝G-250(蛋白定量用)

5×考马斯亮蓝G-250(蛋白定量用)货号:PC0015规格:100mL/500mL保存:开封使用后请密封保存,本试剂盒自订购之日起九个月内有效。
产品简介:考马斯亮兰G-250染料,在酸性溶液中与蛋白质结合,使染料的最大吸收峰的位置(Imax),由465nm 变为595nm,在一定的浓度范围内,测定的吸光度值A595与蛋白质浓度成正比。
Bradford法测定蛋白浓度不受绝大部分样品中的化学物质的影响,样品中巯基乙醇的浓度可高达1M,二硫苏糖醇的浓度可高达5mM,但受略高浓度的去垢剂影响,需确保SDS的浓度低于0.1%,Triton X-100低于0.1%,Tween20,60,80低于0.06%。
自备试剂:PBS、BSA标准品(5mg/ml)操作说明:一.微孔酶标仪法1.完全溶解蛋白标准品,取10ul,稀释至250ul,使终浓度为0.2mg/ml。
待测蛋白样品在什么溶液中,标准品也宜用什么溶液稀释。
但是为了简便起见,也可以用0.9%NaCl或PBS稀释标准品。
2.5×G250染色液使用前请颠倒3-5次混匀,取1ml5×G250染色液,加入4ml双蒸水,混匀成1×G250染色液,此1×G250染色液可在4℃保存一周。
3.将标准品按0,2,4,6,8,12,16,20微升分别加到96孔板中,加PBS稀释液补足到20微升。
4.将样品作适当稀释(最好多做几个梯度,如作2倍、4倍、8倍稀释),加20微升到96孔板的样品孔中。
由于移液器在取小量时的误差,标准线前面的点可能不很准确,所以尽可能的让样品点落在标准线1/2后。
5.各孔加入200微升稀释后的1×G250染色液,室温放置3-5分钟。
6.用酶标仪测定A595,或560-610nm之间的其它波长的吸光度。
7.根据标准曲线计算出样品中的蛋白浓度。
二.分光光度计法如无酶标仪,染色反应可在离心管中进行,反应液混匀后加入比色皿中,使用分光光度计测定吸光值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常规考马斯亮蓝染色试剂盒
简介:
常规考马斯亮蓝染色试剂盒(Commassie Blue Staining Kit)采用了最经典的考马斯亮蓝R250染色和脱色方法,可用于SDS-PAGE 或非变性PAGE 等蛋白电泳凝胶的常规染色和脱色或Western 转膜后PAGE 胶上残余蛋白的检测。
常规考马斯亮蓝染色试剂盒中的染色液和脱色液经过改良,不含有毒的甲醇,含有刺激性气味的乙酸。
采用常规染色脱色方法累计时间达到2~3h 后可以观察到蛋白条带,采用快速染色脱色方法20min 左右即可观察到蛋白条带。
组成:
操作步骤(仅供参考):
(一)常规染色脱色方法
1、PAGE 电泳后取凝胶放入适量Commassie Blue Stain 中,确保染色液充分覆盖凝胶。
2、置于水平摇床或侧摆摇床上缓慢摇动,室温染色1h 或更长时间。
具体的染色时间取决于凝胶的厚度和染色时的温度。
凝胶较厚,温度较低,则染色时间宜适当延长。
凝胶较薄,温度较高,则染色时间可以适当缩短。
3、倒出染色液,该染色液可以回收重复使用2~3次。
4、加入适量Commassie Blue 脱色液,确保脱色液可以充分覆盖凝胶。
5、置于水平摇床或侧摆摇床上缓慢摇动,室温脱色。
期间更换脱色液2~4次,直至蓝色背景基本上全部被脱去,并且蛋白条带染色效果达到预期。
6、完成脱色后把凝胶保存在水中,用于后续的拍照等。
保存在水中的凝胶会发生溶涨。
如需避免溶涨,可以把胶保存在含20%甘油水溶液中,长期保存可以制备干胶。
(二)快速染色脱色方法
1、PAGE 电泳结束后取胶放入Commassie Blue stain 中,微波炉加热至接近沸腾或刚刚沸腾,立即停止加热。
通常对于胶浓度大于10%的胶比较坚韧,在发生煮沸时不易破损;对于胶浓度小于10%的胶,宜尽量避免煮沸,以免出现胶碎裂的情况。
2、随后在染色液温度较高的情况下,在室温摇床上摇动。
3、倒出染色液,染色液可以回收重复使用2~3次。
编号 名称 PT0020 600ml Storage 试剂(A): Commassie Blue Stain 100ml RT 试剂(B): Commassie Blue 脱色液 500ml RT 使用说明书
1份
4、加入适量Commassie Blue脱色液,确保脱色液可以充分覆盖凝胶。
5、微波炉加热至接近沸腾或刚刚沸腾,立即停止加热。
6、随后在脱色液温度较高的情况下,在摇床上摇动5~10min。
此时通常可以观察到比较清楚的蛋白条带。
8、完成脱色后,把凝胶保存在水中,用于后续的拍照等。
保存在水中的凝胶会发生溶涨。
如需避免溶涨,可以把胶保存在含20%甘油水溶液中,长期保存可以制备干胶。
注意事项:
1、染色时如果把凝胶和染色液一起放置在微波炉中适当加热,可以大大加快染色速度。
但
加热时宜尽量避免沸腾,以免出现因暴沸而导致的凝胶碎裂。
2、如果希望染色的背景更低,希望获得更加清晰的蛋白条带,可以加入适量的室温蒸馏水
进行洗涤。
通过蒸馏水洗涤可以进一步降低背景。
3、常规染色脱色方法耗时较长,但检测灵敏度更高,染色效果更加稳定。
快速染色脱色方
法通常检测灵敏度略低,并且在微波炉加热的过程中有时会出现暴沸导致凝胶碎裂的情况,需特别注意。
4、本染色液呈酸性,有轻微腐蚀性,使用时请作必要防护。
5、为了您的安全和健康,请穿实验服并戴一次性手套操作。
