配位化学 第3章 配合物性质与表征
合集下载
配合物化学-1-基础知识

第一章 基础知识
④ 配位数
配位数指中心离子所结合的配位原子的总数。
中心离子最常见的配位数一般是4和6,少数是2和8;更高配 位数的情况少见。
影响配位数的因素:
几何因素(中心离子半径、配体的大小及几何构型) 静电因素(中心离子与配体的电荷) 中心离子的价电子层结构 外界条件(浓度、温度等)
化学式
第一章 基础知识
(b)配位原子
表1-1 配位原子
C
N P As Sb
O S Se Te
H F Cl Br I
第一章 基础知识
(C)按配位原子分类的常见配体
配位原子
卤素 O
配体举例
F -,Cl - ,Br - , I H2O,OH- ,ONO-,RCOO-,C2O42-
N
C S
NH3,NO,NO2-,NH2-CH2-CH2-NH2(乙二胺)
第一章 基础知识
1 配合物的生成与发现 2 配合物的组成与结构 3 配合物的类型 4 配合物的命名
5 配位个体的立体结构
6 配合物的异构现象
第一章 基础知识
1 配合物的生成与发现
Tassaert在从事钴的重量分析的研究过程中,偶用氨水代替 氢氧化钠加入CoCl2溶液中,由于加入过量氨水后得不到他预期 的Co(0H)2沉淀,他便将所得溶液放置过夜,以待第二天继续进 行实验,在这放置过程中,有关物质间继续缓慢地反应(空气参 加了反应)。 到第二天,在该体系中出现了一种橙黄色的晶体,后来经化 学分析确定,其组成为上述的CoCl36NH3。随后又陆续制得了 CoCl35NH3(紫红色)和CoCl3· 5NH3· H2O(红色)等。这些物质在当 时被称为复杂化合物。
第一章 基础知识
第3章 配合物的立体化学【配位化学】

六配位的三角棱柱体(Trigonal Prism, TP-6)少见, 在某些含硫配体配合物中见有此结构,如 [Re(S C Ph ) ],还有有机金属化合物[W(CH ) ]等。
也发现有规则六角形的结构,这主要是由配体的 结构决定的,如K+与二苯并-18-冠-6的配合物 (见前面的图)。
3.高配位数配合物
四角锥构型(SPY-5)的例子有: [VO(acac)2](bisacetylacetonatovanadyl), [Cu2 Cl8] 4- 中通过两个Cl-连接两个四角锥体(见下图)。 [SbCl5]2-呈现SPY-5构型。
N N
Cu I N
N
CN=6的配合物最多,通常为规则的或稍有畸变 的八面体(Octahedron, OC-6),例如Co(NH3)6Cl3, Cr(CO)6, [Fe(CN)6]4-. 主族元素化合物有如Al(acac)3, [InCl6]3-, [PCl6]- 等。
例如[Zr(OX)4]4-,(OX=C2O42-), [Mo(CN)8]4-.特点是: 两个配位原子间相距较近的双齿配体,易形成十二 面体配位构型,如[Co(NO3)4]2-(NO3-双齿配体,形 成一个四员环),又如[Cr(O2)4]5- (过氧根离子O22-中 2个O原子形成三员环)。上述两种构型都可看作是 由立方体变形所致。
第三章 配合物的立体化学(Stereochemistry of Coordination Compounds)
§3-1 概述
配合物的立体化学主要讨论配合物的配位几何构 型CG(Coordination Geometry)和异构现象 (Isomerism).配合物的几何构型指配位体(配位原 子)围绕配位中心的立体排布方式(从几何图形角 度看)。几何构型也可用配位对称性 CS(Coordination Symmetry)的方法来近似描述. 如 [M(H2O)4]+,其CG为 T-4;CS近似为 Td点群。
也发现有规则六角形的结构,这主要是由配体的 结构决定的,如K+与二苯并-18-冠-6的配合物 (见前面的图)。
3.高配位数配合物
四角锥构型(SPY-5)的例子有: [VO(acac)2](bisacetylacetonatovanadyl), [Cu2 Cl8] 4- 中通过两个Cl-连接两个四角锥体(见下图)。 [SbCl5]2-呈现SPY-5构型。
N N
Cu I N
N
CN=6的配合物最多,通常为规则的或稍有畸变 的八面体(Octahedron, OC-6),例如Co(NH3)6Cl3, Cr(CO)6, [Fe(CN)6]4-. 主族元素化合物有如Al(acac)3, [InCl6]3-, [PCl6]- 等。
例如[Zr(OX)4]4-,(OX=C2O42-), [Mo(CN)8]4-.特点是: 两个配位原子间相距较近的双齿配体,易形成十二 面体配位构型,如[Co(NO3)4]2-(NO3-双齿配体,形 成一个四员环),又如[Cr(O2)4]5- (过氧根离子O22-中 2个O原子形成三员环)。上述两种构型都可看作是 由立方体变形所致。
第三章 配合物的立体化学(Stereochemistry of Coordination Compounds)
§3-1 概述
配合物的立体化学主要讨论配合物的配位几何构 型CG(Coordination Geometry)和异构现象 (Isomerism).配合物的几何构型指配位体(配位原 子)围绕配位中心的立体排布方式(从几何图形角 度看)。几何构型也可用配位对称性 CS(Coordination Symmetry)的方法来近似描述. 如 [M(H2O)4]+,其CG为 T-4;CS近似为 Td点群。
配位化学与过渡金属配合物的配位方式、结构与性质与配合物的应用

配 单击此位处添化加副学标题与过渡金属配合 物的配位方式、结构与性 质 汇报人与:XX配合物的应用
目录
01 02 03 04 05 06
添加目录项标题 配位化学基础
过渡金属配合物的配位方式 过渡金属配合物的结构与性质
过渡金属配合物的应用 未来展望与挑战
01
添义与重要性
添加标题
添加标题
添加标题
反应机理:指配合物与其它物质 发生化学反应的具体过程和步骤, 包括反应的起始、中间和终了状 态,以及反应过程中的能量变化 和物质变化。
反应条件的影响:温度、压力、 溶剂等反应条件也会影响配合物 的反应性。
05
过渡金属配合物的应用
在工业催化领域的应用
在石油化工中,过渡金属配 合物催化剂广泛应用于烯烃 聚合、烷基化等反应
结构与性质关系: 配合物的结构对 其磁性、光学性 质和热稳定性等 性质有重要影响。
配合物的反应性及反应机理
配合物的反应性:指配合物与其 它物质发生化学反应的能力,主 要取决于中心原子或离子的性质 和配体的性质。
配体的影响:配体的性质可以影 响配合物的反应性,例如取代基 的性质、配体的空间位阻等。
添加标题
中心原子:通常是金属离子
配位数:中心原子与配位体 之间的配位比,通常为2-4
配位键:由配位体提供孤对 电子与中心原子共用形成的
共价键
03
过渡金属配合物的配位方式
配位体的分类与作用
配位体的分类:中性配位体和带电配位体 中性配位体的作用:提供孤电子对与中心金属原子形成配位键 带电配位体的作用:通过静电作用与中心金属原子形成配位键 配位体的选择对配合物的性质和应用具有重要影响
生变化。
配合物的磁性、光学性质及热稳定性
目录
01 02 03 04 05 06
添加目录项标题 配位化学基础
过渡金属配合物的配位方式 过渡金属配合物的结构与性质
过渡金属配合物的应用 未来展望与挑战
01
添义与重要性
添加标题
添加标题
添加标题
反应机理:指配合物与其它物质 发生化学反应的具体过程和步骤, 包括反应的起始、中间和终了状 态,以及反应过程中的能量变化 和物质变化。
反应条件的影响:温度、压力、 溶剂等反应条件也会影响配合物 的反应性。
05
过渡金属配合物的应用
在工业催化领域的应用
在石油化工中,过渡金属配 合物催化剂广泛应用于烯烃 聚合、烷基化等反应
结构与性质关系: 配合物的结构对 其磁性、光学性 质和热稳定性等 性质有重要影响。
配合物的反应性及反应机理
配合物的反应性:指配合物与其 它物质发生化学反应的能力,主 要取决于中心原子或离子的性质 和配体的性质。
配体的影响:配体的性质可以影 响配合物的反应性,例如取代基 的性质、配体的空间位阻等。
添加标题
中心原子:通常是金属离子
配位数:中心原子与配位体 之间的配位比,通常为2-4
配位键:由配位体提供孤对 电子与中心原子共用形成的
共价键
03
过渡金属配合物的配位方式
配位体的分类与作用
配位体的分类:中性配位体和带电配位体 中性配位体的作用:提供孤电子对与中心金属原子形成配位键 带电配位体的作用:通过静电作用与中心金属原子形成配位键 配位体的选择对配合物的性质和应用具有重要影响
生变化。
配合物的磁性、光学性质及热稳定性
配位化学第三章

实例:
[Ti(H2O)6]3+ K3[Mn(CN)6] K3[Fe(CN)6]
Ti3+: 3d1 Mn3+: 3d4 Fe3+: 3d5
µ=1.73 n =1 µ=3.18 n =2 µ=2.40 n =1
配位化学第三章
配合物的空间构型与中心离子的 杂化类型、配位数的关系
配位数 2
4
6
杂化
类型 sp
CN-的成键π2pz 轨道肩并肩重叠形成离域π键。
CN
NC
CN
Ni2+
配位化学第三章
NC
3.1.2 价键理论的应用
(1)解释了配合物的空间构型 (2)说明配合物的磁性 (3)比较同类配合物的稳定性
配位化学第三章
举例说明:
1. 已知[Ag(NH3)2]+的μm=0,用VB法说明其空
间结构。
4d
5s
5p
Ag+ [Kr]
4d
5p
[Ag(NH3)2]+
NH3 NH3 sp杂化 所以[Ag(NH3)2]+的空间构型为直线型。
配位化学第三章
2. [BeX4]2-的空间构型为四面体。为什么?
Be2+
1s
2s
2p
[BeX4]2-
1s
X- X- X- X-
sp3杂化
在[BeX4]2- 中,由于Be2+采取sp3杂化,所以 [BeX4]2-的 空间构型是正四面体。
dsp2
sp3 sp3d2或d2sp3
型空 间 构
直线形 平面正方形
四面体
八面体
举例:Ag(NH3)2 Ni(C)N24 NiCl24
配位化学 第3章 配合物性质与表征

第
3
章
配合物的性质与表征
The properties and spectroscopic characterization of coordination compounds
本章教学内容
配合物的性质
配合物的光谱表征
3.1
3.2
3.1 配合物的性质
在溶液中形成配合物时,常常出现颜色、溶解度、电 极电势以及pH 值的改变等现象。根据这些性质的变化,可 以帮助确定是否有配合物生成。 溶解度 一些难溶于水的金属氯化物,溴化物,碘化物,氰化物 可以依次溶解于过量的C1-,Br-,I-,CN-和氨中,形成可溶 性的配合物,如难溶的AgCl 可溶于过量的浓盐酸及氨水中。 金和铂之所以能溶于王水中,也是与生成配离子的反应有关。 Au + HNO3 + 4HCl = H[AuCl4]+ NO + 2H2O 3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O
酸碱性 一些较弱的酸如 HF 、 HCN 等在形成配合酸后,酸性往 往增强。 如: HF 与 BF3 作用生成配合酸 H[BF 4 ] ,而四氟硼酸的碱金 属盐溶液在水中呈中性,这就说明H[BF4 ]应为强酸。又如 弱酸HCN与AgCN形成的配合酸H[Ag(CN)2]也是强酸。这种 现象是由于中心离子与弱酸的酸根离子形成较强的配键, 从而迫使 H + 移到配合物的外界,因而变得容易电离,所以 酸性增强。 同一金属离子氢氧化物的碱性因形成配离子而有变化, 如[Cu(NH3)4](OH)2的碱性就大于Cu(OH)2。原因是 [Cu(NH3)4]2+的半径大于Cu2+离子的半径和OH-离子的结合 能力较弱,OH-离子易于解离。
3
章
配合物的性质与表征
The properties and spectroscopic characterization of coordination compounds
本章教学内容
配合物的性质
配合物的光谱表征
3.1
3.2
3.1 配合物的性质
在溶液中形成配合物时,常常出现颜色、溶解度、电 极电势以及pH 值的改变等现象。根据这些性质的变化,可 以帮助确定是否有配合物生成。 溶解度 一些难溶于水的金属氯化物,溴化物,碘化物,氰化物 可以依次溶解于过量的C1-,Br-,I-,CN-和氨中,形成可溶 性的配合物,如难溶的AgCl 可溶于过量的浓盐酸及氨水中。 金和铂之所以能溶于王水中,也是与生成配离子的反应有关。 Au + HNO3 + 4HCl = H[AuCl4]+ NO + 2H2O 3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O
酸碱性 一些较弱的酸如 HF 、 HCN 等在形成配合酸后,酸性往 往增强。 如: HF 与 BF3 作用生成配合酸 H[BF 4 ] ,而四氟硼酸的碱金 属盐溶液在水中呈中性,这就说明H[BF4 ]应为强酸。又如 弱酸HCN与AgCN形成的配合酸H[Ag(CN)2]也是强酸。这种 现象是由于中心离子与弱酸的酸根离子形成较强的配键, 从而迫使 H + 移到配合物的外界,因而变得容易电离,所以 酸性增强。 同一金属离子氢氧化物的碱性因形成配离子而有变化, 如[Cu(NH3)4](OH)2的碱性就大于Cu(OH)2。原因是 [Cu(NH3)4]2+的半径大于Cu2+离子的半径和OH-离子的结合 能力较弱,OH-离子易于解离。
第三章配合物的稳定性

该规则初步解释如下: 一般来说,属于硬酸的金属离子倾向于与其他原子以 静电引力结合,因而作为配合物的中心离子的硬酸与 配位原子电负性较大的硬碱较易结合。如(1)(2) (3)。 而软酸金属离子与配位原子间主要以共价键结合,倾 向于和配位原子电负性较小的软碱结合。如(4)。 对(6)的解释: N < < P>As> Sb σ键→增强
3. 软硬酸碱规则应用实例
硬酸金属离子易与配位原子为O,F的硬碱结合,NH3 的硬度不如OH-,因此在这些金属离子水溶液中,不能 形成氨的配合物,如Mg2+,La3+,Al3+,Fe3+,只能得到氢氧 化物沉淀. 而软酸金属离子则可以在水溶液中形成NH3的配合 物,如Ag+,Cd2+等,[Ag(NH3)2]+.
碱
硬碱: OH-, F-, NH3,H2O,PO43-,SO42-,CO32,ClO4-,NO3-,ROH等(N,F,O)
交界碱: Br2+-, py,NO2-, Cl-,SO32- ,N2等 I-, CN-, S2-,CO,C2H4,R3P,R3As等 软碱: (S,P,As)
硬碱:体积小,变形性小,电负性大,难被氧化
例如:配位化学中,作为中心离子的硬酸与配位原子 各不相同的配体形成配合物倾向为: F>Cl>Br>I (1) O>>S>Se>Te (2) N>>P>As>Sb (3) 而与软酸中心离子形成配合物倾向为: F< Cl <Br< I (4) O < < S ~ Se ~ Te (5) N < < P>As> Sb (6)
分步稳定常数:
ML + L ML2
[ MLn ] 累积稳定常数: n K1 K 2 K n n [ M ][ L]
齐鲁工业大学教学日历
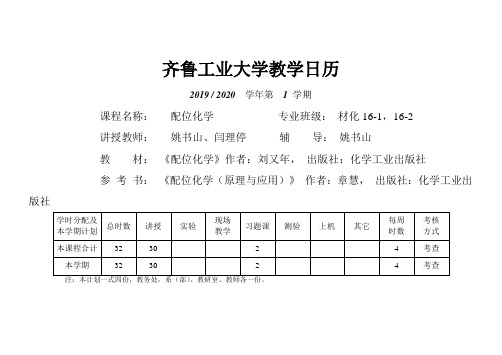
30
2
4
考查
注:本计划一式四份,教务处,系(部)、教研室、教师各一份。
周次
时数
讲授内容
实验内容
课外作业
讲授
实验
习题课
上机
其它
5
4
第一章:配位化学导论
配位化学的形成与简介,配位化学的基本概念
配合物的分类与命名、配合物的立体结构
6
4
第二章:配合物的结构和Leabharlann 键理论2.1配合物的空间构型,
2.2配合物的异构现象
齐鲁工业大学教学日历
2019/2020学年第1学期
课程名称:配位化学专业班级:材化16-1,16-2
讲授教师:姚书山、闫理停辅导:姚书山
教材:《配位化学》作者:刘又年,出版社:化学工业出版社
学时分配及本学期计划
总时数
讲授
实验
现场
教学
习题课
测验
上机
其它
每周
时数
考核
方式
本课程合计
32
30
2
4
考查
本学期
32
10
4
第4章配合物的合成方法
常见的配合物合成方法:液相法,低热固相反应法,水(溶剂)热合成法,微波合成法
11
4
1
第5章金属有机化学
5.1绪论
金属有机化学的发展史,金属有机化合物的定义与分类,有效原子序数(EAN)规则
5.2金属羰基配合物
金属羰基配合物的结构与化学键,金属羰基配合物的性质和反应,金属羰基配合物的制备,金属羰基配合物在催化合成中的应用
7
3
1
第二章:配合物的结构和成键理论
2.3配合物的化学键理论,价键理论,晶体场理论,分子轨道理论
2
4
考查
注:本计划一式四份,教务处,系(部)、教研室、教师各一份。
周次
时数
讲授内容
实验内容
课外作业
讲授
实验
习题课
上机
其它
5
4
第一章:配位化学导论
配位化学的形成与简介,配位化学的基本概念
配合物的分类与命名、配合物的立体结构
6
4
第二章:配合物的结构和Leabharlann 键理论2.1配合物的空间构型,
2.2配合物的异构现象
齐鲁工业大学教学日历
2019/2020学年第1学期
课程名称:配位化学专业班级:材化16-1,16-2
讲授教师:姚书山、闫理停辅导:姚书山
教材:《配位化学》作者:刘又年,出版社:化学工业出版社
学时分配及本学期计划
总时数
讲授
实验
现场
教学
习题课
测验
上机
其它
每周
时数
考核
方式
本课程合计
32
30
2
4
考查
本学期
32
10
4
第4章配合物的合成方法
常见的配合物合成方法:液相法,低热固相反应法,水(溶剂)热合成法,微波合成法
11
4
1
第5章金属有机化学
5.1绪论
金属有机化学的发展史,金属有机化合物的定义与分类,有效原子序数(EAN)规则
5.2金属羰基配合物
金属羰基配合物的结构与化学键,金属羰基配合物的性质和反应,金属羰基配合物的制备,金属羰基配合物在催化合成中的应用
7
3
1
第二章:配合物的结构和成键理论
2.3配合物的化学键理论,价键理论,晶体场理论,分子轨道理论
第3章 配位化学PPT课件

第一节 配位化学基础
1.2 配合物的组成及命名
(1) 配合物的命名规则
(c) 同类配体(无机或有机类)按配位原子元素符号的英 文字母顺序排列。
[Co(NH3)5H2O]Cl3 三氯化五氨·一水合钴(III) (d) 同类配体同一配位原子时,将含较少原子数的配体排 在前面。 [Pt(NO2)(NH3)(NH2OH)(Py)]Cl 氯化硝基·氨·羟氨·吡啶合铂(II)
3 第 章 配位化学
顺-[PtCl2(NH3)2]
目标&要求
掌握较复杂配合物的命名规则 掌握配合物的立体异构现象 掌握配合物化学键基本理论
(价键理论、晶体场理论、配体场理论、分子轨道理论)
了解新型配合物的类型及应用
一、配位化学基础 二、配位立体化学 三、配位化学理论 四、新型功能配合物及应用
第一节 配位化学基础
1.4 配合物的分类
按中心原子数目分类:
单核配合物和多核配合物
按配合物所含配体种类分类:
单一配体配合物和混合配体配合物
按配体的齿数分类:
简单配合物、螯合物、大环配合物等
按配合物价键特点分类:
经典配合物和非经典配合物
第二节 配位立体化学
2.1 配合物的几何构型 2.2 配合物的异构现象
CH2CH2NH2 NH
CH2CH2NH2
二乙三胺(dien)
第一节 配位化学基础
1.3 配体的基本类型及配位能力 四齿配体
二水杨醛缩乙二胺(Salen)
第一节 配位化学基础
1.3 配体的基本类型及配位能力 六齿配体
乙二胺四乙酸钠(EDTA)
第一节 配位化学基础
1.3 配体的基本类型及配位能力 冠醚 (大环醚)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
羧基的反对称伸缩振动频率高于伸缩振动频率,两者之间 差值的大小与其配位模式有关。所以,可以根据羧酸对称伸缩 振动和不对称伸缩振动值差值Δν,判断羧酸是否参与配位及其 配位方式。游离羧酸根离子的Δν在160 cm-1左右,如果配合物 红外光谱中的Δν远大于160 cm-1,一般认为羧酸根以单齿方式 配位;如果配合物红外光谱中的Δν比160 cm-1小得多,一般认 为羧酸根以螯合方式配位;当羧酸根以双齿方式进行配位,其 Δν 与游离酸根离子的 Δν 差不多。如果遇到这种情况,可以通 过两种方法对双齿配位和游离羧酸进行区别:一种方法是看配 合物红外谱图中1700 cm-1左右有没有强的吸收峰。如果有说明 羧酸根未参与配位,反之说明羧酸根以双齿方式进行配位;另 外一种方法是,观察600-50cm-1是否有金属-配体的特征频率。 如果有,说明配体与金属发生配位作用,反之,说明配体未参 与配位。当配体中含有两种或两种以上配位原子时,通过金属 - 配体特征频率的位置,还可以判断与金属配位的是哪个原子。
139.2 pm 98.2 pm O H
N 118.5 pm O
143.2 pm 95.8 pm O H
O N 117.0 pm
顺式
亚硝酸的结构
反式
NO2- 的结构
判断金属配合物的形成
其他应用 测定配合物的稳定常数 荷移光谱的应用
振动光谱 在配体和金属形成配合物时,配体的对称性和振动 能级受到影响,其振动光谱发生改变,并且,在配体和 金属之间产生新的振动。 配合物的振动光谱主要包括三种振动:配体振动,骨 架振动和偶合振动。这些振动中,有的振动只能在红外 光谱中观测到,称之为红外活性振动;有的只能在拉曼 光谱中观测到,被称为拉曼活性振动;而有些振动在红 外和拉曼光谱中均可观测到,称为红外和拉曼活性振动。 红外光谱和拉曼光谱都属于振动光谱,我们这里分别介 绍其在配合物研究中的应用。
d-d 跃迁:
过渡金属离子的 d 轨道或 f 轨道未被填满,常发生 d-d跃迁 或f-f跃迁, d-d跃迁是电子从中心原子的一个d轨道跃迁到较高能级的 d轨道,分为自旋允许跃迁和自旋禁阻跃迁两种。自旋允许跃 迁较强,而自旋禁阻跃迁由于是禁阻的,只是由于配体的微 扰效应引起的,故而较弱。 因为d-d间的能级差不大,因而常常处在可见光区。当配 合物中配位能力较弱的配体被配位能力更强的配体取代时, d-d间的能级差发生变化,d-d吸收带的位置会根据光谱化学 序发生移动。如果新配体的加入改变了配合物的对称性,吸 收带的强度也会发生变化。这些变化与配合物的反应有关, 故而,可以用于研究配合物的反应和组成。例如,当 [Co(H2O)6]2+中的水被 Cl-取代,配合物由八面体对称变为四 面体对称,配合物的颜色由粉红色变为蓝色,消光系数变得 更大。
区别配合物的键合异构体 当配体中有两个不同的原子都可以作为配位原子时, 配 体可以不同的配位原子与中心原子键合而生成键合异构配合 物。可以用紫外光谱区别两个异构体,并确立其可能的结构。
如:[Co(NH3)5NO2]Cl2(1)与 [Co(NH3)5ONO]Cl2(2) 互为键合异构体,其紫外吸收峰如下图所示:
b) 顺反异构体的研究 在顺反异构体中,反式异构体的对称性比顺式异构体的对 称性较高。对称性的降低会使红外活性振动数目增加,反式 异构体中非红外活性的振动,在顺式异构体中可能会成为红 外活性的振动。因此,顺式异构体红外光谱具有比反式异构 体红外光谱更多的谱带。将同一配合物两种异构体的红外光 谱进行比较,可以根据谱带的多少,区分哪一种为顺式,哪 一种为反式。
拉曼散射在配合物研究中的应用:
判断配合物的形成及配位方式
L-半胱氨酸(a)及L-半胱氨酸锌配合物(b)的拉曼光谱图
核磁共振
将磁性原子核放入强磁场后,用适宜频率的电磁波照射, 磁性原子核吸收能量,发生原子核能级跃迁,同时产生核 磁共振信号,得到核磁共振光谱。 利用核磁共振光谱进行结构测定,定性与定量分析的方法 称为核磁共振波谱法,简称 NMR。
拉曼散射的基本类型: • 正常拉曼散射——实验室使用最多的拉曼散射 共振拉曼散射——比正常拉曼散射效应强 102~104 倍。 从共振拉曼光谱可以得到有关生色团的结构信息,共 振拉曼光谱在生物化学、无机配合物研究中起着重要的作 用。 表面增强拉曼散射 指当一些分子被吸附到某些粗糙的金属(如银、铜或 金)的表面上时,它们的拉曼信号的强度会增加 104-107倍。
配体内的跃迁 有机配体分子中的电子跃迁包括 σ→σ* , n→σ* , n→π* , π→π* 四种。其中,大多数有机化合物的吸收光谱是电子 n→π*和π→π*跃迁的结果。因为紫外-可见光谱的波长范围在 200-700 nm,σ→σ*和n→σ*跃迁所需要的能量较大,所以, 能在紫外区观测到这两种跃迁的分子较少。而 n→π* 和π→π* 跃迁的吸收峰恰好位于 200-700 nm范围内,因此,配体分子 内的跃迁主要是 n→π* 和 π→π*跃迁。如果金属和配体之间主 要是静电作用,金属原子对配体吸收光谱的影响较小,配合 物的吸收光谱与配体的吸收光谱类似。如果金属和配体之间 形成共价键,则配合物的吸收峰向紫外方向移动,共价程度 越强,吸收峰移动得越远。
246.75 nm
234.5 nm
17.3.3 氮的含氧酸及盐
亚硝酸及其盐 HNO2 中 N 采取 sp2 杂化,形成一个单键和一个双键。 HNO2 具有顺式和反式两种结构。研究证明:常温下 反式比顺式更稳定。NO2- 中 N 采取 sp2 杂化,形成两 个σ键和一个π3 4 键,几何构型为 “V” 字形
氧化与还原 当金属离子形成配离子后,它的标准电极电位值一般是 要降低的。 如:Hg2+和Hg之间的标准电极电位+0.85V。如加入CN- 离 子使 Hg2+形成Hg(CN)42- 离子后,Hg2+的浓度不断减小, 直到 Hg2+全部形成配离子。Hg(CN)42-和Hg 之间的电极电 位为-0.37V。 一般配离子越稳定(稳定常数越大),它的标堆电极电 位越负(越小)。从而金属离子越难得到电子,越难被还原。 事实上在HgCl42-溶液中投入铜片,铜片表面立即镀上一层 汞,而在Hg(CN)42- 溶液中就不会发生这种现象。
电荷跃迁: 在中心原子和配体间可能发生电子的跃迁,可以是由中 心原子的分子轨道向配体的分子轨道跃迁,也可以是由配体 的分子轨道向中心原子的分子轨道跃迁。当配体是可氧化的, 中心原子是高氧化态时,电子从配体向中心原子跃迁。且配 体还原能力越强,中心原子氧化能力越高,电荷跃迁的波长 就越长。当不饱和配体和低氧化态中心原子形成配合物时, 电子由中心原子向配体跃迁。一般说来,电荷跃迁波长比dd跃迁较短,强度更强。
第
3
章
配合物的性质与表征
The properties and spectroscopic characterization of coordination compounds
本章教学内容
配合物的性质
配合物的光谱表征
3.1
3.2
3.1 配合物的性质
在溶液中形成配合物时,常常出现颜色、溶解度、电 极电势以及pH 值的改变等现象。根据这些性质的变化,可 以帮助确定是否有配合物生成。 溶解度 一些难溶于水的金属氯化物,溴化物,碘化物,氰化物 可以依次溶解于过量的C1-,Br-,I-,CN-和氨中,形成可溶 性的配合物,如难溶的AgCl 可溶于过量的浓盐酸及氨水中。 金和铂之所以能溶于王水中,也是与生成配离子的反应有关。 Au + HNO3 + 4HCl = H[AuCl4]+ NO + 2H2O 3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O
Cl L Cr L Cl L Cr L L Cr Cl L
(A)
二L顺位 (B) 二Cl反位
Cl Cl
二L反位 (C) 二Cl顺位
二L顺位 Cl 二Cl顺位
(2)拉曼光谱
拉曼散射及原理:
光被透明介质分子散射后频率发生变化,这一现象称为拉曼 散射。 在散射光谱中,频率与入射光频率 ν0 相同的成分称为瑞利 散射,频率对称分布在 ν0 两侧的谱线或谱带 ν0±ν1 即为拉 曼光谱。其中频率较小的成分 ν0-ν1 称为斯托克斯线,频率 较大的成分 ν0+ν1 称为反斯托克斯线。靠近瑞利散射线两侧 的谱线称为小拉曼光谱;远离瑞利线的两侧出现的谱线称 为大拉曼光谱。
所谓磁性原子核是指自旋量子数I≠0的原子核,因为I = 0的原子核没有磁距,不产生共振吸收。在I≠0的原子核 31 14 19 1 中,I =1/2的原子核,如 1 H、 13 6 C、 7 N、 9 F、15 P 等,其 核电荷球形均匀分布于核表面。它们的核磁共振现象较 简单,谱线窄,适宜检测,是核磁共振研究的主要对象。 在配合物的 NMR 技术研究中,常用的核有1H,13C,11B, 31P,113Cd,195Pt 以及 117Sn,119Sn等。
(2)电子光谱在配合物研究中的应用 表征配合物的形成 可以根据配体配位前后紫外光谱的变化,判断配体是 否与金属离子发生了配位。
重金属离子 加入后,发生 了配位作用, 使配体分子的 共轭体系发生 显著的变化, 最大吸收峰显 著红移。
确定配合物的组成 当溶液中的金属离子与配位体都无色,只有形成的配 合物有色,并且只形成一种稳定的配合物,配合物中配体 的数目n也不能太大时,可以用紫外光谱测定配合物的组 成比。 连续变换法(Job法)
在保持溶液中金属离子浓度 CM与配体浓度CL总摩尔数不变 的前提下,改变CM与CL的相对 量,配制一系列溶液。以吸光 度 A 为纵坐标,配体摩尔分数 XL为横坐标作图,得一曲线。 在这一曲线中,吸光度 A 最大 时,溶液中配体与金属离子摩 尔数之比与配合物的组成一致, 由此可得到配合物组成 ( n = xL/1-xL)。
