实验5离体蛙心灌注
离体蛙心灌流实验
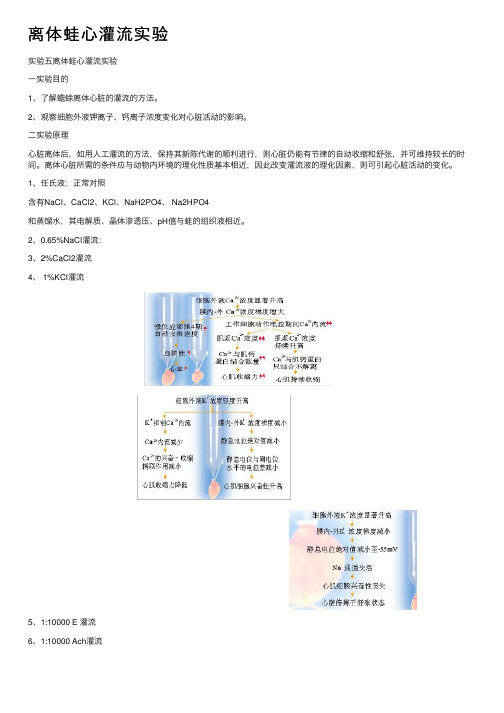
离体蛙⼼灌流实验实验五离体蛙⼼灌流实验⼀实验⽬的1、了解蟾蜍离体⼼脏的灌流的⽅法。
2、观察细胞外液钾离⼦、钙离⼦浓度变化对⼼脏活动的影响。
⼆实验原理⼼脏离体后,如⽤⼈⼯灌流的⽅法,保持其新陈代谢的顺利进⾏,则⼼脏仍能有节律的⾃动收缩和舒张,并可维持较长的时间。
离体⼼脏所需的条件应与动物内环境的理化性质基本相近,因此改变灌流液的理化因素,则可引起⼼脏活动的变化。
1、任⽒液:正常对照含有NaCl、CaCl2、KCl、NaH2PO4、 Na2HPO4和蒸馏⽔,其电解质、晶体渗透压、pH值与蛙的组织液相近。
2、0.65%NaCl灌流:3、2%CaCl2灌流4、 1%KCl灌流5、1:10000 E 灌流6、1:10000 Ach灌流7、⼼得安β1受体阻断剂,抑制肾上腺素与β1受体结合,使E不能发挥作⽤。
8.、阿托品M受体阻断剂,抑制Ach减慢⼼率,加速房室传导,增加⼼房收缩⼒。
三实验器材微机⽣物信号处理系统, physiology系统,学校服务器系统,蟾蜍离体蛙⼼,任⽒液,1%KCl,3%CaCl2,65%NaCl,1/10000 E,⼼得安+1/10000,1/10000 Ach,阿托品+1/10000 Ach。
四实验步骤1、标本制备(观看视频)2、仪器及标本的连接3、具体软件操作:1)离⼦试剂:任⽒液→0.65%NaCl溶液→任⽒液清洗→1%KCl溶液→任溶液→任⽒液清洗⽒液清洗→2%CaCl22)药物试剂:肾上腺素(E)→任⽒液清洗→⼼得安→任⽒液清洗→Ach,任⽒液清洗→阿托品→任⽒液清洗。
五实验结果表1 离体蛙⼼灌流数据记录六结果分析此实验说明⼼脏具有⾃律性,兴奋性,传导性,收缩性,离体⼼脏静脉窦还能产⽣兴奋并传导到⼼房和⼼室,引起⼼脏有节律的兴奋和收缩。
体内细胞所直接⽣存的环境较为稳定,内环境的稳态是细胞、器官维持正常⽣存和活动的必要条件,所以改变灌流的溶液,会引起⼼脏收缩的改变。
离体蛙心灌流实验

目的原理观察内环境理化因素相对稳定对维持心脏正常节律性活动的重要作用,了解肾上腺素、乙酰胆碱等激素、神经递质对心脏活动的调节意义。
实验对象与用品大蛙或蟾蜍。
斯氏蛙心套管、蛙心夹、蛙板、蛙类手术器械、二道仪、任氏液、长滴管、铁支架等(试剂见实验项目)。
方法步骤(一)实验准备操作对蛙行双刺毁,仰卧固定于蛙板上,用铁剪刀剪去胸壁,再用眼科剪小心地剪开心包膜,暴露心脏,识别心脏动脉球、静脉窦(背面)等结构(图17-1A、B、C)。
用蛙心夹夹住蛙心尖部,蛙心夹用线固定在蛙板上,松紧以动脉、心房、心室拉直呈水平位为合适。
于主动脉分支下预埋一条棉线做一虚结备用。
把主动脉左支上端结扎,在近动脉球处剪一向心斜切口(注意要剪破血管内膜,每次心缩时有血自切口涌出,但不要把血管剪断。
剪口位置视套管尖端长度与心脏大小而定),左手用眼科镊提起切口缘,右手将注有任氏液的斯氏套管插入动脉干内,然后走手持左侧血管分支上的结扎线向外拉,右手将蛙心套管送入动脉球;把蛙心夹上的连线从固定物上取下,提起心尖,使心室与动脉球约呈100°-200°的钝角,然后当心室缩紧时把套管平直往心室方向推进。
当感觉套管进入心室后再把心尖放平,随即将套管稍向心室推进,调整合适位置,可见套管内液面随心跳而升降。
即将已作虚结之丝线把血管和套管固定起来,余线则扎于套管的玻璃小钩上,以免心脏滑脱。
提起套管,剪断与心脏相连的血管和组织(注意勿损伤静脉窦及两心房),摘出心脏。
用任氏液洗去心内外的余血后,注入新鲜任氏液备用。
可在套管的下1/3处结一线作为标志,每次换任氏液时使液面与此线相平。
接好二道生理仪和机械-电换能器(图17-2)选用适当参数,待记录。
(二)实验项目1.描记正常心跳曲线并分析其疏密、规律性、幅度、顶点及基线的含义。
2.温度的影响:把套管内换成4℃任氏液,同时作好标记,观察曲线变化,待效应明显后,即换入室温任氏液。
待曲线恢复正常后,再进行下一项目。
实验5蛙心灌流

实验步骤
5、连接试验仪器:将插好离体心脏的插管 固定在支架上, 将蛙心夹上的系线绕过一 个滑轮与张力换能器相连。打开实验系统 进行记录。
注ห้องสมุดไป่ตู้:勿使灌流液滴到换能器上。
观察项目
(1)打开实验系统记录正常心搏曲线。 (2)将插管内全部更换为0.65%NaCl溶液,观
察心搏曲线的频率及振幅的变化。当曲线出现明 显变化时,立即吸去插管中的灌流液(作好冲洗 标记),用新鲜任氏液清洗2—3次,待心搏恢复 正常。 (3)向插管内加入1滴2%CaCl2溶液,观察并记 录心搏曲线的变化。当出现明显变化时,立即更 换任氏液(方法同上),待心搏恢复正常。 (4)向插管中加1-2滴1%KCl溶液,记录心搏 曲线的变化。当心搏曲线变化时,立即同(2)法 更换灌流液,待心搏恢复。 (5)同(2)法记录插管中加入1—2滴 1∶100000肾上腺素溶液后心搏曲线的变化。 (6)同(2)法记录插管中加入1—2滴 1∶1000000乙酰胆碱溶液后心搏的变化。
实验步骤
1、破坏蟾蜍脑和脊髓后呈仰卧位固定在 蛙板上。剪开胸骨表面皮肤,沿正中线 剪开胸骨,仔细剪开心包膜,暴露心脏 。
实验步骤
2、用连线的蛙心夹在心舒期夹住心尖 。用橡皮泥将蛙心夹的连线固定于 蛙板上。
实验步骤
3、插管:结扎右主动脉。在左主动脉干下穿一棉线 达一松结备用。用眼科剪刀剪开左主动脉根部的 前壁,开口呈“V”字形,将盛有任氏液的蛙心插 管由此开口处向动脉圆锥方向插入左主动脉,当 心室收缩时再经主动脉瓣向心室内插入。不可插 得过深,以免心壁堵住插管下口。此时可见插管 中液面随心脏搏动而上下移动,用滴管吸去插管 中的血液,更换新鲜任氏液,提起备用线,将左 、右主动脉连同插入的插管扎紧(不得漏液), 再将结线固定在插管的小玻璃钩上。
离体蛙心灌流

离体蛙心灌流一、实验目的1、学习离体蛙心灌流的方法;2、观察钠、钾、钙三种离子对心脏活动的影响。
3、观察肾上腺素、乙酰胆碱等因素对心脏活动的影响。
二、动物与器材动物:蟾蜍器材:斯氏蛙心套管、套管夹、常用手术器械、任氏液、张力换能器、蛙心夹、0.65%NaCl溶液、5%NaCl溶液、2%CaCl2溶液、1%KCl溶液、1:5000肾上腺素溶液、1:10000乙酰胆碱溶液、300u/ml肝素溶液三、方法与步骤1、离体蛙心的制备:双毁髓→左主动脉结扎→左右两主动脉下方活结备用→剪口,插管(管内盛任氏液与肝素)→结扎备用线(套管+左右主动脉)→剪断动脉→结扎并剪断静脉。
2、固定套管并用任氏液换洗血液;进入RM6240系统。
3、观察并记录正常心搏曲线;4、向套管内分别加入以下溶液(0.65%NaCl溶液2d 、5%NaCl溶液2d、1%KCl溶液1-2d 、2%CaCl2溶液1d 、1:5000肾上腺素溶液1-2d 、1:10000乙酰胆碱溶液1-2d ),观察并记录曲线变化。
四、注意事项制备蛙心标本时,勿伤静脉窦;各溶液作用一旦出现,应立即用新鲜任氏液换洗,以免心肌受损,而且待心跳恢复正常后方能进行下一步实验;蛙心插管内液面应保持恒定;每次更换或滴加溶液必须做标记;五、实验结果:实验项目实验现象0.65%NaCl 加入后心搏曲线振幅变小5%NaCl 心搏曲线振幅下降,达正常曲线振幅一半以下(图二)更换溶液后恢复,(图三)但恢复后曲线振幅减小。
2%CaCl2 心搏曲线振幅首先变大(图三)然后出现异常的停止搏动。
1%KCl 后期心肌停止搏动于舒张期(图四)肾上腺素心搏曲线幅度明显增大(图五)更换溶液后恢复正常水平乙酰胆碱心搏曲线振幅急剧下降,最后达基线以下0搏动(实验图另附)由于实验操作上及设备仪器等存在误差,记录曲线有一定偏差。
且由于只记录了部分曲线,蟾蜍心脏有时又会出现异常停搏现象,所以所记录结果未能完整反映出不同溶液对心搏曲线影响情况。
蛙类离体心脏灌流实验

蛙类离体心脏灌流实验蛙类离体心脏灌流实验一、实验目的1、探究不同溶液对心肌特性的影响2、掌握离体心脏灌流的技术二、实验原理(一)两栖类动物无冠状循环两栖类动物无冠状循环,心肌直接从流经心腔的血流中获取营养。
即心室肌直接从心室腔中获得营养。
故用任氏液置换心室中的血液后,心室插管中的灌流液便成为心室肌的细胞外液。
(二)心肌对细胞外离子浓度和体液因素敏感(三)钾、钙和钠离子对心肌特性的影响由于心肌细胞生物电活动和收缩过程与离子密切相关,因此,细胞外液中离子浓度升升高或降低均会影响到心肌的电生理特性和收缩性。
(1)钾离子的影响K+与静息电位的形成有关。
细胞外液K+浓度[K+]0变化对心肌生理特性的影响较为复杂。
高钾:[K+]0轻度或中度增高时,膜内、外K+浓度差减小,静息电位绝对值减小,与阈电位差距缩短,因此,兴奋性增高。
[K+]0显著升高时,由于静息电位绝对值减小过多(膜内达-55mV 左右),Na+通道失活,因而兴奋性降低甚至消失。
另外,还使0期去极化速度和幅度减小,传导性降低,导致兴奋传导减慢,甚至传导阻滞。
此外,[K+]0增高还可提高膜对K+的通透性,加速K+外流,动作电位平台期缩短,因此,不应期缩短。
此外由于平台期缩短,减少了Ca2+的内流,加上细胞外K+与Ca2+在膜上有竞争性抑制作用,导致心肌收缩功能减弱;(2)钙离子的影响细胞外Ca2+在细胞膜上对Na+内流有竞争性抑制作用,称为膜屏障作用。
[Ca2+]0增高时,Na+内流受抑制,细胞0期除极速度与幅度减小,使兴奋性及传导性均降低。
[Ca2+]0增高使Ca2+内流增多,因此慢反应细胞0期去极化加快加强,传导性增高,而快反应细胞平台期缩短,有效不应期缩短,复极加速。
Ca2+内流增多,使心肌收缩能力增强。
[Ca2+]0降低时,所引起的变化与高钙时相反。
(3)钠离子的影响细胞外液中钠浓度差梯度的变化一般对心肌活动影响不明显。
只有当[Na+]0明显增高时,膜内外钠的浓度差梯度增大,因此,快反应细胞Na+内流加快,0期去极速度和幅度均增加,导致传导性和自律性增高。
生理学实验报告蛙心灌流

生理学实验报告-蛙心灌流蛙类离体心脏灌流一、【目的要求】1、学习离体蛙心灌流法。
2、观察Na+,K+,Ca2+及肾上腺素(Adr),乙酰胆碱(ACh),乳酸对离体心脏活动的影响。
二、【原理】将离体蛙心(失去神经支配的蛙心)保持在适宜的环境中,在一定的时间内仍然能够保持节律性收缩,心脏正常的节律性活动需要一个适宜的理化环境,离体心脏也是如此,离体心脏脱离了机体的神经支配和全身体液因素的直接影响,可以通过改变灌流液的某些成分,观察其对心脏活动的作用。
心肌细胞的自律性、兴奋性、传导性及收缩性,都与钠、钾及钙等离子有关。
外源性给予去甲肾上腺素或乙酰胆碱可产生类似心交感神经或迷走神经兴奋时对心脏的作用。
三、【实验仪器】青蛙、常用手术器械、蛙板(或蜡盘)、蛙心夹、计算机采集系统、张力传感器、支架、双凹夹、双针形露丝刺激电极、滴管、培养皿(或小烧杯)、棉线、任氏液。
套管夹、0.65%NaCl、2%CaCl2、1%KCl、1:10000肾上腺素、1:10000乙酰肌碱、3%乳酸。
四、【方法与步骤】1、斯氏蛙心插管法(1)一只青蛙,双毁髓后背位置于蜡盘中,按前面的方法暴露心脏。
仔细识别心脏周围的大血管(见右图)。
在左主动脉下方穿一线,于动脉圆锥处结扎(动物个体小时,结扎位置可靠上些)。
再从左右两主动脉下方穿一线,并打一活结备用。
左手提起主动脉上的结扎线,右手用眼科剪在结扎线下方、沿向心方向将动脉上壁剪一斜口。
选择大小适宜的蛙心套管,然后将盛有少量(套管内2~3 cm高度)任氏液(内加入一滴肝素溶液)的斯氏蛙心套管,山开口处插入动脉圆锥(见右图)。
当套管尖端到达动脉圆锥基部时,应将套管稍稍后退,使尖端向动脉圆锥的背部后下方及心尖方向推进,经主动脉瓣插入心室腔内(于心室收缩时插入,但不可插得过深,以免心室壁堵住套管下口)。
此时可见套管中血液冲人套管,并使液面随心脏搏动而亡下移动,表明操作成功(否则需退回并重新插入)。
离体蛙心灌流实验报告

离体蛙心灌流实验报告离体蛙心灌流实验报告近年来,科学技术的快速发展为人类探索生命奥秘提供了更多的工具和方法。
其中,离体器官实验是一种常见的研究手段,通过将动物器官分离出来进行实验,可以更深入地了解其结构和功能。
本文将介绍一项离体蛙心灌流实验,探究心脏的工作原理和血液循环。
实验开始时,我们首先需要准备实验所需的器材和材料。
实验器材包括显微镜、注射器、导管等,材料则包括新鲜的蛙心和生理盐水。
在实验室的洁净台上,我们小心地将蛙心取出,并用生理盐水清洗,以确保实验的准确性和可靠性。
接下来,我们需要进行灌流的准备工作。
首先,将蛙心放置在显微镜下,用显微镜观察心脏的结构和血管的分布。
通过观察,我们可以清晰地看到心脏的主要组成部分,如心房、心室和动脉、静脉等。
然后,我们将准备好的生理盐水注入注射器中,并连接导管。
在注射器中注入适量的生理盐水,以保持心脏的湿润,并确保血液循环的正常进行。
接下来,将导管插入心脏的主动脉,并将生理盐水缓慢地注入心脏内。
随着生理盐水的注入,我们可以观察到心脏开始跳动,并将血液推送到体内各个组织和器官。
这个过程中,我们可以通过显微镜观察到心脏的收缩和舒张,以及血液在血管中的流动情况。
这一实验过程不仅让我们更加深入地了解了心脏的工作原理,还帮助我们理解了血液循环的过程。
通过实验观察,我们可以发现心脏的跳动是有规律的,每次跳动都是由心房和心室的收缩和舒张所控制。
心脏的收缩将血液推送到动脉中,而心室的舒张则使血液回流到心脏中。
这种有序的跳动和血液流动保证了氧气和养分的输送,维持了身体各个组织和器官的正常功能。
除了观察心脏的跳动和血液流动,我们还可以通过实验进一步研究心脏的特性和功能。
例如,我们可以改变生理盐水的浓度,观察心脏的反应。
我们还可以加入药物,以模拟不同的生理和病理情况,进一步研究心脏的适应性和反应能力。
通过离体蛙心灌流实验,我们不仅可以深入了解心脏的结构和功能,还可以探究血液循环的机制。
离体蛙心灌流实验报告

一、实验目的1. 学习离体器官(蛙心)灌流的方法。
2. 观察理化因素对蛙心活动的影响。
3. 掌握实验操作技巧,提高实验技能。
二、实验原理离体蛙心灌流实验是生理学实验中的一个重要实验,通过人工灌流的方法,使离体蛙心在适宜的生理条件下保持正常节律性收缩和舒张。
实验原理如下:1. 蛙心无营养性血管,离体后采用人工灌流的方法,仍可保持其新陈代谢,心脏仍能有节律的自动收缩、舒张,并维持较长时间。
2. 心肌的营养是通过心脏内膜液体的直接渗透而得。
3. 通过改变灌流液中的离子浓度、pH值等理化因素,可以观察蛙心活动的变化,了解理化因素对心脏活动的影响。
三、实验对象与用品1. 实验对象:蟾蜍2. 实验用品:斯氏蛙心套管、蛙心夹、蛙板、蛙类手术器械、二道仪、任氏液、长滴管、铁支架、生理盐水、KCl溶液、CaCl2溶液、肾上腺素、乙酰胆碱等。
四、实验方法与步骤1. 实验准备:将蟾蜍仰卧固定于蛙板上,用剪刀剪开胸壁,暴露心脏。
用蛙心夹夹住蛙心尖部,固定在蛙板上。
2. 动脉插管:在主动脉分支下预埋一条棉线,结扎主动脉左支,剪一向心斜切口,插入斯氏蛙心套管,送入动脉球。
3. 连接实验装置:将蛙心套管与二道仪相连,记录蛙心活动。
4. 灌流液准备:配制正常灌流液(任氏液)和实验灌流液(分别含有不同离子浓度的生理盐水、KCl溶液、CaCl2溶液、肾上腺素、乙酰胆碱等)。
5. 实验操作:a. 将蛙心置于正常灌流液中,观察蛙心活动,记录心率、收缩幅度等指标。
b. 分别将蛙心置于不同实验灌流液中,观察蛙心活动的变化,记录心率、收缩幅度等指标。
c. 对比分析不同灌流液对蛙心活动的影响。
五、实验结果与分析1. 正常灌流液条件下,蛙心以正常节律收缩和舒张,心率适中,收缩幅度适中。
2. 在0.65%NaCl溶液替换任氏液后,蛙心收缩幅度稍微减小,收缩力稍微减弱。
分析原因:相当于细胞外环境中缺乏Ca2+,动作电位2期Ca2+内流减少,胞浆中Ca2+减少,心肌收缩力降低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验五离体蛙心灌注
目的
学习离体蛙心灌流的方法;观察内环境理化因素的相对恒定对维持心脏正常节律性活动的重要作用;了解肾上腺素、乙酰胆碱等激素、神经递质对心脏活动的调节意义。
原理
动物的离体心脏,用理化特性类似于其血浆的代体液灌流时,在一定的时间内,仍然保持有节律的舒张活动。
改变灌流液的理化特性,这种节律的舒缩活动也随之发生改变,说明内环境理化因素的相对恒定是维持心脏正常节律活动的必要条件。
器材与药品
蛙心陶罐、蛙心夹、常用蛙手术器械、铁架台、双凹夹、滴管、小烧杯、氯化钠溶液(1%NaCl)、氯化钙溶液(2%Ca Cl)、氯化钾溶液(1%KCl)、肾上腺素(1/10000Ad)、乙酰胆碱(1/100000Ach)、任氏液(Ri/lger’s solution新鲜配制)等。
步骤
(1)取一只蟾蜍或蛙,用探针破坏其脑脊髓后仰卧固定于蛙板上,剪开胸前区皮肤,剪去胸骨,暴露心脏。
用眼科镊提起心包膜,再用眼科剪在心脏收缩时将其剪破,使心脏完全暴露出来。
(2)识别心脏的各个部分,包括心房、心室、静脉窦等,并观察心跳。
(3)插蛙心插管,制备离体蛙心。
先在左右主动脉下方穿一线,并打一松结留作固定插管用。
再在左主动脉下穿一线结扎。
用手提起结扎线,用眼科剪在左侧主动脉距分叉3mm处向心脏剪一斜口,右手将盛有少量任氏液的蛙心插管由此口插入,先进入动脉圆锥,然后在心室收缩时,向前略向左推动蛙心插管,使之经主动脉瓣插入心室腔内(注意:为了使蛙心插管顺利插入心室,应使心室与动脉圆锥成一条直线)。
进入心室的标志是随着心室搏动,均有血液喷入插管,插管的液面随着心搏而升降。
结扎插管并将结扎线固定于插管侧面的小钩上,以防止标本滑脱。
注意在蛙心插管插入心室后,用吸管及时吸出管内的血液,更换新鲜任氏液。
提起插管,剪断主动脉左、右侧分支,轻轻提起插管和心脏,在静脉窦下方绕一线,将左右肺静脉及前后腔静脉一起结扎(切勿损伤静脉窦),在结扎线下方剪去所有牵连的组织,将心脏摘出。
用任氏液反复冲洗(10~25滴/min的速度缓慢点滴)任氏液。
至插管内任氏液完全澄清无色为止。
以后做实验注意每次换液时,插管内液面应保持相同的高度。
1、加入2%Ca Cl溶液1~2滴,混匀,观察曲线变化。
2、加入1%KCl溶液1~2滴,混匀,观察曲线变化。
3、加入1/10000Ad溶液1~2滴,混匀,观察曲线变化,待效应明显后,将灌流液全部吸出,换入新鲜任氏液,使心跳恢复正常。
4、加入1/100000Ach溶液1~2滴,混匀,观察曲线变化,待效应明显后,将灌流液全部吸出,换入新鲜任氏液(如果加入Ach后心跳已停止舒张状态,换液后,可用滴管插至插管底部,将灌流液剂入心室,反复数次,将心室内Ach 完全清洗出)。
注意事项
(1)每次换液时,液面均应保持一定的高度。
(2)每次换入灌流液或滴加试剂出现明显效应后,应立即吸出全部灌流液,并以新鲜任氏液换洗2~3次,待心跳恢复正常后,再进行下一步骤。
(3)每次加入试剂后,应立即用滴管轻轻搅匀,使之迅速发挥作用。
(4)加试剂时,每次不宜过多,先加1~2滴,如作用不明显时可再补加。
(5)随时滴加任氏液于心脏表面使之保持湿润状态。
作业与思考题
1、保证记录连续,分析各现象产生的原因。
2、分析有的蛙心标本套管内液面升降不明显的原因并提出相应的对策。
3、实验过程中套管内液面为什么每次都应保持一定的高度?。
