离体蛙心灌流实验
离体蛙心灌流实验
离体蛙⼼灌流实验实验五离体蛙⼼灌流实验⼀实验⽬的1、了解蟾蜍离体⼼脏的灌流的⽅法。
2、观察细胞外液钾离⼦、钙离⼦浓度变化对⼼脏活动的影响。
⼆实验原理⼼脏离体后,如⽤⼈⼯灌流的⽅法,保持其新陈代谢的顺利进⾏,则⼼脏仍能有节律的⾃动收缩和舒张,并可维持较长的时间。
离体⼼脏所需的条件应与动物内环境的理化性质基本相近,因此改变灌流液的理化因素,则可引起⼼脏活动的变化。
1、任⽒液:正常对照含有NaCl、CaCl2、KCl、NaH2PO4、 Na2HPO4和蒸馏⽔,其电解质、晶体渗透压、pH值与蛙的组织液相近。
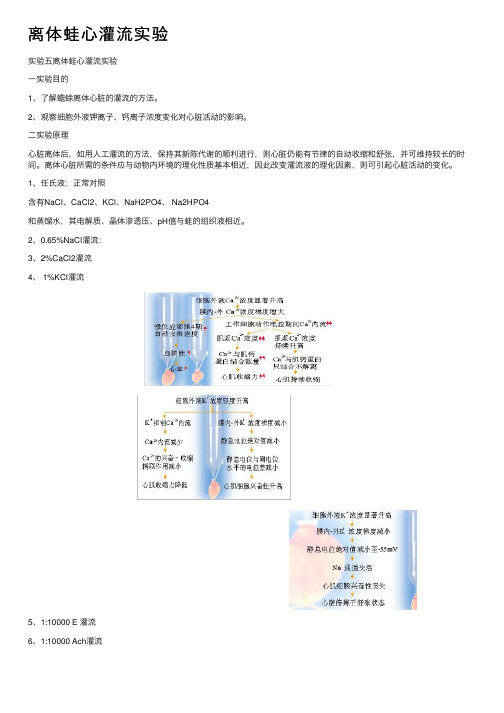
2、0.65%NaCl灌流:3、2%CaCl2灌流4、 1%KCl灌流5、1:10000 E 灌流6、1:10000 Ach灌流7、⼼得安β1受体阻断剂,抑制肾上腺素与β1受体结合,使E不能发挥作⽤。
8.、阿托品M受体阻断剂,抑制Ach减慢⼼率,加速房室传导,增加⼼房收缩⼒。
三实验器材微机⽣物信号处理系统, physiology系统,学校服务器系统,蟾蜍离体蛙⼼,任⽒液,1%KCl,3%CaCl2,65%NaCl,1/10000 E,⼼得安+1/10000,1/10000 Ach,阿托品+1/10000 Ach。
四实验步骤1、标本制备(观看视频)2、仪器及标本的连接3、具体软件操作:1)离⼦试剂:任⽒液→0.65%NaCl溶液→任⽒液清洗→1%KCl溶液→任溶液→任⽒液清洗⽒液清洗→2%CaCl22)药物试剂:肾上腺素(E)→任⽒液清洗→⼼得安→任⽒液清洗→Ach,任⽒液清洗→阿托品→任⽒液清洗。
五实验结果表1 离体蛙⼼灌流数据记录六结果分析此实验说明⼼脏具有⾃律性,兴奋性,传导性,收缩性,离体⼼脏静脉窦还能产⽣兴奋并传导到⼼房和⼼室,引起⼼脏有节律的兴奋和收缩。
体内细胞所直接⽣存的环境较为稳定,内环境的稳态是细胞、器官维持正常⽣存和活动的必要条件,所以改变灌流的溶液,会引起⼼脏收缩的改变。
离体蛙心灌流实验

目的原理观察内环境理化因素相对稳定对维持心脏正常节律性活动的重要作用,了解肾上腺素、乙酰胆碱等激素、神经递质对心脏活动的调节意义。
实验对象与用品大蛙或蟾蜍。
斯氏蛙心套管、蛙心夹、蛙板、蛙类手术器械、二道仪、任氏液、长滴管、铁支架等(试剂见实验项目)。
方法步骤(一)实验准备操作对蛙行双刺毁,仰卧固定于蛙板上,用铁剪刀剪去胸壁,再用眼科剪小心地剪开心包膜,暴露心脏,识别心脏动脉球、静脉窦(背面)等结构(图17-1A、B、C)。
用蛙心夹夹住蛙心尖部,蛙心夹用线固定在蛙板上,松紧以动脉、心房、心室拉直呈水平位为合适。
于主动脉分支下预埋一条棉线做一虚结备用。
把主动脉左支上端结扎,在近动脉球处剪一向心斜切口(注意要剪破血管内膜,每次心缩时有血自切口涌出,但不要把血管剪断。
剪口位置视套管尖端长度与心脏大小而定),左手用眼科镊提起切口缘,右手将注有任氏液的斯氏套管插入动脉干内,然后走手持左侧血管分支上的结扎线向外拉,右手将蛙心套管送入动脉球;把蛙心夹上的连线从固定物上取下,提起心尖,使心室与动脉球约呈100°-200°的钝角,然后当心室缩紧时把套管平直往心室方向推进。
当感觉套管进入心室后再把心尖放平,随即将套管稍向心室推进,调整合适位置,可见套管内液面随心跳而升降。
即将已作虚结之丝线把血管和套管固定起来,余线则扎于套管的玻璃小钩上,以免心脏滑脱。
提起套管,剪断与心脏相连的血管和组织(注意勿损伤静脉窦及两心房),摘出心脏。
用任氏液洗去心内外的余血后,注入新鲜任氏液备用。
可在套管的下1/3处结一线作为标志,每次换任氏液时使液面与此线相平。
接好二道生理仪和机械-电换能器(图17-2)选用适当参数,待记录。
(二)实验项目1.描记正常心跳曲线并分析其疏密、规律性、幅度、顶点及基线的含义。
2.温度的影响:把套管内换成4℃任氏液,同时作好标记,观察曲线变化,待效应明显后,即换入室温任氏液。
待曲线恢复正常后,再进行下一项目。
蛙心生理实验报告(3篇)

第1篇一、实验目的1. 学习离体蛙心灌流的方法。
2. 观察理化因素对蛙心活动的影响。
3. 探究心脏节律性活动的生理机制。
二、实验原理蛙心灌流实验是一种常用的生物学实验方法,通过将蛙心取出并置于人工灌流液中,使其在一定时间内保持节律性收缩。
实验中,通过改变灌流液的成分,可以观察不同理化因素对心脏活动的影响,从而了解心脏生理活动的调节机制。
蛙心无营养性血管,离体后采用人工灌流的方法,仍可保持其新陈代谢,心脏仍能有节律的自动收缩、舒张,并维持较长时间。
心肌细胞的自律性、兴奋性、传导性及收缩性,都与钠、钾及钙等离子有关。
外源性给予去甲肾上腺素或乙酰胆碱可产生类似心交感神经或迷走神经兴奋时对心脏的作用。
三、实验材料与仪器1. 实验动物:青蛙2. 实验器材:蛙心夹、常用手术器械、蛙板(或蜡盘)、任氏液、0.65%NaCl、2%CaCl2、1%KCl、1:10000肾上腺素、1:10000乙酰胆碱、3%乳酸、张力传感器、支架、双凹夹、双针形露丝刺激电极、滴管、培养皿(或小烧杯)、棉线、套管夹。
3. 生理信号采集系统、计算机。
四、实验方法与步骤1. 暴露蛙心:取一只青蛙,双毁髓后背位置于蛙板上,按前面的方法暴露心脏。
仔细识别心脏周围的大血管,在左主动脉下方穿一线,于动脉圆锥处结扎。
2. 插管:用斯氏蛙心插管法,将蛙心夹插入心脏,并通过蛙心夹上的管道与灌流系统连接。
3. 灌流:将蛙心置于任氏液中,开始灌流,调节灌流速度和压力,使心脏保持节律性收缩。
4. 观察与记录:观察心脏的收缩、舒张情况,记录心率和心搏曲线。
5. 改变灌流液成分:分别用0.65%NaCl、2%CaCl2、1%KCl、1:10000肾上腺素、1:10000乙酰胆碱、3%乳酸等灌流液替换任氏液,观察心脏活动的变化。
6. 分析与讨论:分析不同灌流液对心脏活动的影响,讨论心脏生理活动的调节机制。
五、实验结果与分析1. 在正常任氏液中,心脏保持节律性收缩,心率为60-100次/分钟。
蛙心灌流-机能实验

4. 用任氏液换洗,待心搏曲线恢复正常后, 加入2%CaCl21~2滴,观察心搏曲线变化。
2 % CaCl2
5. 用任氏液换洗,待心搏曲线恢复正常后,加 入1:10000 肾上腺素1~2滴,观察心搏曲线变化。
1:10,000 肾上腺素
6. 用任氏液换洗,待心搏曲线恢复正常后,加 入 1:100000 乙酰胆碱1~2滴,观察心搏曲线变化。
实验七
理化物质对离体灌流蛙心的影响
一、实验目的
1. 学习离体蛙心的灌流方法 (离体实验的优势?) 2. 用离体蛙心灌流的方法观察:
① 离子浓度(Na+、K+、Ca2+) ② 酸、碱度 ③肾上腺素(Adr)乙酰胆碱(ACh)
对心脏活动的影响
二、实验原理
正常的蛙心能按静脉窦的节律性自动产生兴奋, 心脏的自动节律性活动,需要有一个合适的理化 环境。
正常心搏曲线
曲线幅度 —— 收缩的强弱 曲线疏密 —— 心率 曲线规律性 —— 心跳的节律性 曲线基线 —— 舒张的程度
2. 完全等量置换0.65%NaCl溶液, 观察心搏曲线变化。
0.65 % NaCl
3. 用任氏液换洗三次,待心搏曲线恢复正常后, 加入1%KCl 1~2滴,观察心搏曲线变化。
心室 心房
白线 静脉窦
静脉窦
4. 将心脏翻回原位置,结扎右侧主 动脉干, 左侧主动脉干远心端结扎并剪口。
剪口
5. 蛙心插管向左后、向下旋转,于心缩期插入心室内。
泵血
6. 将预置线的活结扎死,并固定于插管壁的小钩 上,于各结扎线远端将心脏连同静脉窦一起剪下。
小钩
扎线
泵血
换液
7. 用蛙心夹在心室舒张期夹住心尖,将心脏机 械活动通过换能器转换为电信号输入到电脑 。
实验四离体蛙心灌流

2、插好离体心脏的套管固定在支架上,用蛙心夹夹 住少许心尖部肌肉(不要夹过多,以免因夹破心室而 漏液)。再将蛙心夹上的系线绕过一个滑枪与张力传 感器相连。注:勿便灌流液滴到传感器上。调节记录 仪上的收缩曲线的幅度适中。 3、实验观察(图11) (1)记录正常心搏曲线。 (2)改用0.65% NaCl溶液灌流,并作好加药标记,观 察心搏变化。待曲线出现明显变化时,立即吸去套管 中的灌流液,同时做好冲洗标记,并用新鲜任氏液清 洗2-3次,待心搏恢复正常,注意:换液时切勿碰套 管,以免影响描记曲线的基线,同时保持灌流液面一 致(以下同)。
(3)向套管内加1-2滴2% CaCl2溶液(较细的套管需 少加)溶液,作好加药记号,观察心搏曲线的频率及 振幅变化。当曲线出现明显变化时,应立即吸去套管 中的灌流液,并做好冲洗标记,迅速用新鲜任氏液清 洗2-3次,待心搏恢复正常。 (4)同法向套管内加入1-2滴1% KCl溶液,记录心搏 曲线的变化。当心搏曲线变化时,同法更换灌流液, 待心搏恢复正常公 (5)同法记录套管中加入1-2滴肾上腺素溶液(1/10000) 后心搏曲线的变化。 (7)同法记录套管中加入1-2滴乙酰胆碱溶液(1/10000) 后心搏曲线的变化。
【注意事项】 1、制备离体心脏标本时,勿伤及静脉窦。 2、蛙心夹应在心室舒张期一次性夹住心尖,避免因夹伤心脏而导致漏液。 3、每一观察项目都应先描记一段正常曲线,然后再加药并记录其效应。 加药时应在心跳曲线上予以标记,以便观察分析。 4、各种滴管应分开,不可混用。 5、在实验过程中,插管内灌流液面高度应保持恒定;仪器的各种参数一 经调好,应不再变动。 6、给药后若效果不明显,可再适量滴加,并密切注意药物剂量添加后的 实验结果。给药量必须适度,加药出现变化后,就应立即更换任氏液, 否则会造成不可挽回的后果,尤其是K+稍有过量,即可导致难以恢复的 心脏停跳。 7、标本制备好后,若心脏功能状态不好(不搏动),可向插管内滴加 1~2滴2%CaCl2或1:10000肾上腺素,以促进(起动)心脏搏动。在实 验程序安排上也可考虑促进和抑制心脏搏动的药物交换使用。 8、谨防灌流液沿丝线流入张力传感器内而损坏其电子元件。
离体蛙心实验实验报告(3篇)

第1篇一、实验目的1. 观察离体蛙心的生理特性,了解心脏在离体条件下的收缩和舒张规律。
2. 探讨神经递质、激素等对离体蛙心功能的影响。
3. 掌握离体蛙心灌流实验的操作方法。
二、实验原理离体蛙心灌流实验是研究心脏生理学的重要方法之一。
在实验过程中,通过灌流装置向蛙心提供氧气和营养物质,同时可以观察心脏的收缩和舒张情况。
实验中,可以通过改变灌流液成分、温度、pH值等条件,观察心脏功能的改变,从而了解心脏生理特性及影响因素。
三、实验材料与仪器1. 实验材料:蟾蜍、蛙心套管、蛙心夹、蛙板、蛙类手术器械、二道仪、任氏液、氯化钙、肾上腺素、乙酰胆碱等。
2. 实验仪器:手术显微镜、蛙心灌流装置、注射器、秒表、滴管等。
四、实验方法与步骤1. 准备工作:将蟾蜍置于蛙板上,用手术剪剪开胸腔,暴露心脏。
用蛙心夹固定心脏,并连接灌流装置。
2. 灌流液准备:配制任氏液、氯化钙溶液、肾上腺素溶液、乙酰胆碱溶液等。
3. 实验分组:将实验分为对照组、氯化钙组、肾上腺素组、乙酰胆碱组。
4. 实验步骤:a. 对照组:灌流任氏液,观察心脏的收缩和舒张情况。
b. 氯化钙组:灌流氯化钙溶液,观察心脏功能的改变。
c. 肾上腺素组:灌流肾上腺素溶液,观察心脏功能的改变。
d. 乙酰胆碱组:灌流乙酰胆碱溶液,观察心脏功能的改变。
5. 记录数据:观察心脏的收缩和舒张频率、收缩幅度等,并记录数据。
五、实验结果与分析1. 对照组:心脏呈现规律的收缩和舒张,收缩幅度适中,频率约为60次/分钟。
2. 氯化钙组:心脏收缩幅度明显增大,频率加快,收缩时间延长,舒张时间缩短。
3. 肾上腺素组:心脏收缩幅度增大,频率加快,收缩时间延长,舒张时间缩短。
4. 乙酰胆碱组:心脏收缩幅度减小,频率减慢,收缩时间缩短,舒张时间延长。
六、实验结论1. 离体蛙心在灌流条件下可以维持一定时间的收缩和舒张功能。
2. 氯化钙和肾上腺素可以增强离体蛙心的收缩功能,使收缩幅度增大、频率加快。
离体蛙心灌流
离体蛙心灌流一、实验目的1、学习离体蛙心灌流的方法;2、观察钠、钾、钙三种离子对心脏活动的影响。
3、观察肾上腺素、乙酰胆碱等因素对心脏活动的影响。
二、动物与器材动物:蟾蜍器材:斯氏蛙心套管、套管夹、常用手术器械、任氏液、张力换能器、蛙心夹、0.65%NaCl溶液、5%NaCl溶液、2%CaCl2溶液、1%KCl溶液、1:5000肾上腺素溶液、1:10000乙酰胆碱溶液、300u/ml肝素溶液三、方法与步骤1、离体蛙心的制备:双毁髓→左主动脉结扎→左右两主动脉下方活结备用→剪口,插管(管内盛任氏液与肝素)→结扎备用线(套管+左右主动脉)→剪断动脉→结扎并剪断静脉。
2、固定套管并用任氏液换洗血液;进入RM6240系统。
3、观察并记录正常心搏曲线;4、向套管内分别加入以下溶液(0.65%NaCl溶液2d 、5%NaCl溶液2d、1%KCl溶液1-2d 、2%CaCl2溶液1d 、1:5000肾上腺素溶液1-2d 、1:10000乙酰胆碱溶液1-2d ),观察并记录曲线变化。
四、注意事项制备蛙心标本时,勿伤静脉窦;各溶液作用一旦出现,应立即用新鲜任氏液换洗,以免心肌受损,而且待心跳恢复正常后方能进行下一步实验;蛙心插管内液面应保持恒定;每次更换或滴加溶液必须做标记;五、实验结果:实验项目实验现象0.65%NaCl 加入后心搏曲线振幅变小5%NaCl 心搏曲线振幅下降,达正常曲线振幅一半以下(图二)更换溶液后恢复,(图三)但恢复后曲线振幅减小。
2%CaCl2 心搏曲线振幅首先变大(图三)然后出现异常的停止搏动。
1%KCl 后期心肌停止搏动于舒张期(图四)肾上腺素心搏曲线幅度明显增大(图五)更换溶液后恢复正常水平乙酰胆碱心搏曲线振幅急剧下降,最后达基线以下0搏动(实验图另附)由于实验操作上及设备仪器等存在误差,记录曲线有一定偏差。
且由于只记录了部分曲线,蟾蜍心脏有时又会出现异常停搏现象,所以所记录结果未能完整反映出不同溶液对心搏曲线影响情况。
实验4-4 蛙类离体心脏灌流
实验4-4 蛙类离体心脏灌流引言离体心脏灌流实验是生理学中常用的方法之一。
不同种类的动物可以通过体表切口或开放胸骨来取出其心脏进行灌流。
而离体心脏灌流实验可以帮助研究者了解心脏的解剖学和生理学特征。
本实验将讲解如何进行蛙类离体心脏灌流实验。
实验器材和试剂1.蛙类(建议使用大型蛙类)。
2.离体心脏灌流系统,包括:- 离体心脏灌流装置(含灌流缓冲液、温度控制器等)。
- 稳压泵。
3.灌流缓冲液,常用的为Tyrode's盐溶液。
实验步骤1. 先将离体心脏灌流系统检查一遍,保证各项设备均运转正常。
2. 杀死一只蛙类,立即进行解剖,取出心脏,并将其迅速转移到灌流装置中。
在移植心脏时应注意不损伤其血管和肌肉组织。
在灌流系统中,除了心脏,不能有其他生物组织残留。
3. 确认灌流系统中的灌流缓冲液温度为20~25℃。
在开始灌流之前,要先排除灌流管路中的空气。
4. 打开灌流泵,根据所选择的灌流缓冲液flow rate控制注入速度,一般建议在3~8ml/min。
确保满足心脏需求的氧气和营养物质可以通过灌流液输送到心脏内部。
5. 注入灌流缓冲液的同时,对心脏进行观察,确认心脏速率、收缩波幅度等生理特征。
6. 加入适当的药物来研究心脏对药物的反应性。
此时应读取每个添加药物后的心脏特征和响应(如速率、波幅等)。
7. 在实验结束时,切断灌流管路和心脏连接,灌流系统中的灌流液应该被排除并清洁。
结果和分析离体心脏灌流实验可以观察心脏的生理学特征和对不同药物的反应,这有助于研究者了解心脏的生理学机制。
在进行本实验时,需要注意不仅仅是心脏的特征,还要关注灌流流量和药物导致的生理反应。
在实验的过程中,如果发现心脏节律不齐或收缩波幅度明显下降,这可能是灌流流量不足造成的。
而添加不同的药物,可以帮助研究者了解心脏的调控机制,同时也可以评估药物的疗效。
需要注意的是,不同种类的动物其心脏组织的特征也是不同的,因此需要根据具体的实验目的选择合适的动物进行实验。
离体蛙心灌流实验报告
一、实验目的1. 学习离体器官(蛙心)灌流的方法。
2. 观察理化因素对蛙心活动的影响。
3. 掌握实验操作技巧,提高实验技能。
二、实验原理离体蛙心灌流实验是生理学实验中的一个重要实验,通过人工灌流的方法,使离体蛙心在适宜的生理条件下保持正常节律性收缩和舒张。
实验原理如下:1. 蛙心无营养性血管,离体后采用人工灌流的方法,仍可保持其新陈代谢,心脏仍能有节律的自动收缩、舒张,并维持较长时间。
2. 心肌的营养是通过心脏内膜液体的直接渗透而得。
3. 通过改变灌流液中的离子浓度、pH值等理化因素,可以观察蛙心活动的变化,了解理化因素对心脏活动的影响。
三、实验对象与用品1. 实验对象:蟾蜍2. 实验用品:斯氏蛙心套管、蛙心夹、蛙板、蛙类手术器械、二道仪、任氏液、长滴管、铁支架、生理盐水、KCl溶液、CaCl2溶液、肾上腺素、乙酰胆碱等。
四、实验方法与步骤1. 实验准备:将蟾蜍仰卧固定于蛙板上,用剪刀剪开胸壁,暴露心脏。
用蛙心夹夹住蛙心尖部,固定在蛙板上。
2. 动脉插管:在主动脉分支下预埋一条棉线,结扎主动脉左支,剪一向心斜切口,插入斯氏蛙心套管,送入动脉球。
3. 连接实验装置:将蛙心套管与二道仪相连,记录蛙心活动。
4. 灌流液准备:配制正常灌流液(任氏液)和实验灌流液(分别含有不同离子浓度的生理盐水、KCl溶液、CaCl2溶液、肾上腺素、乙酰胆碱等)。
5. 实验操作:a. 将蛙心置于正常灌流液中,观察蛙心活动,记录心率、收缩幅度等指标。
b. 分别将蛙心置于不同实验灌流液中,观察蛙心活动的变化,记录心率、收缩幅度等指标。
c. 对比分析不同灌流液对蛙心活动的影响。
五、实验结果与分析1. 正常灌流液条件下,蛙心以正常节律收缩和舒张,心率适中,收缩幅度适中。
2. 在0.65%NaCl溶液替换任氏液后,蛙心收缩幅度稍微减小,收缩力稍微减弱。
分析原因:相当于细胞外环境中缺乏Ca2+,动作电位2期Ca2+内流减少,胞浆中Ca2+减少,心肌收缩力降低。
机能学实验---离体蛙心灌流
碳酸氢钠
乳酸
九、结论
离体心脏的活动受环境理化因素的影响。
Thank you!
4.肾上腺素(Adr)
Adr
心肌细胞膜β1受体结合 Ca2+ 与肌钙蛋白亲 和力↓,肌浆网摄 钙速度↑ 复极期肌浆Ca2 + 浓 度降低速度↑ 舒张速度↑ 细胞膜对Ca2+ 通透性↑
肌 浆 网 对 Ca2 + 通透性↑
动作电位期间 Ca2+内流性↑ 收缩力↑
4期自动除极 化速度↑
自律性↑ 心率↑
5. 乙酰胆碱 (Ach) ACh
3.蛙心插收缩时插入心室
A B
4.连接仪器记录蛙心搏动曲线
五、观察项目
(一)描记正常心搏曲线
曲线幅度 —— 收缩的程度 曲线疏密 —— 心率 曲线基线 —— 舒张的程度
(二)观察离子、药物和酸碱的影响
1. 换成无钙任氏液灌注,冲洗(下同) 2. 加入3%氯化钙溶液1~2滴 3. 加入1%氯化钾溶液1~2滴
六、实验结果
观察项目
1.无钙任氏液 2. 2%CaCl2 3. 1%KCl 4.Adr 5.Ach 6. 2.5%NaHCO3 7. 3%乳酸
心率
收缩程度
观察项目 无钙任氏液 3%CaCl2 1%KCl Adr
Ach 2.5%NaHCO3 3%乳酸
心率
↓ ↑ ↓ ↑ ↓ ↑ ↓
收缩幅度(收缩力)
心肌细胞膜M受体结合 细胞膜对K+ 通透性增加
窦房结细胞4期K+ 外流增加、最大复 极电位增大 自律性降低 心率减慢 细 胞 膜 对 Ca2 + 通透性下降 动作电位期间 Ca2+内流减少 抑制钙通道
心肌收缩力降低
6. 2.5%NaHCO3 中和H+,Ca2+与肌钙蛋白结合,心肌收缩力恢复。 7. 3%乳酸 H+与Ca2+竞争肌钙蛋白, Ca2+不能与肌钙蛋白结 合,心肌收缩力↓。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验五离体蛙心灌流实验
一实验目的
1、了解蟾蜍离体心脏的灌流的方法。
2、观察细胞外液钾离子、钙离子浓度变化对心脏活动的影响。
二实验原理
心脏离体后,如用人工灌流的方法,保持其新陈代谢的顺利进行,则心脏仍能有节律的自动收缩和舒张,并可维持较长的时间。
离体心脏所需的条件应与动物内环境的理化性质基本相近,因此改变灌流液的理化因素,则可引起心脏活动的变化。
1、任氏液:正常对照
含有NaCl、CaCl2、KCl、NaH2PO4、 Na2HPO4
和蒸馏水,其电解质、晶体渗透压、pH值与蛙的组织液相近。
2、0.65%NaCl灌流:
3、2%CaCl2灌流
4、 1%KCl灌流
5、1:10000 E 灌流
6、1:10000 Ach灌流
7、心得安
β1受体阻断剂,抑制肾上腺素与β1受体结合,使E不能发挥作用。
8.、阿托品
M受体阻断剂,抑制Ach减慢心率,加速房室传导,增加心房收缩力。
三实验器材
微机生物信号处理系统, physiology系统,学校服务器系统,蟾蜍离体蛙心,任氏液,1%KCl,3%CaCl2,65%NaCl,1/10000 E,心得安+1/10000,1/10000 Ach,阿托品+1/10000 Ach。
四实验步骤
1、标本制备(观看视频)
2、仪器及标本的连接
3、具体软件操作:
1)离子试剂:任氏液→0.65%NaCl溶液→任氏液清洗→1%KCl溶液→任
溶液→任氏液清洗
氏液清洗→2%CaCl
2
2)药物试剂:肾上腺素(E)→任氏液清洗→心得安→任氏液清洗→Ach,任氏液清洗→阿托品→任氏液清洗。
五实验结果
图1 离体蛙心灌流
表1 离体蛙心灌流数据记录
六结果分析
此实验说明心脏具有自律性,兴奋性,传导性,收缩性,离体心脏静脉窦还能产生兴奋并传导到心房和心室,引起心脏有节律的兴奋和收缩。
体内细胞所直接生存的环境较为稳定,内环境的稳态是细胞、器官维持正常生存和活动的必要条件,所以改变灌流的溶液,会引起心脏收缩的改变。
