环境化学-青岛科技大学研究生工作部(处)
环境化学-青岛科技大学研究生院

13.污染物由土壤向植物体内迁移的方式主要包括_____________。
二、解释下列名词(每词4分,共20分)
1.辐射逆温层
2.异体凝聚理论
3.生物转运
4.湿沉降
5.酚酞碱度和总碱度第1页(共2页)
三、简答题(每题5分,共20分)
4.55×10-7;二级电离常数K2为4.69×10-11;计算[HCO3※]、[HCO3-]、[CO32-]、[OH-]的浓度各是多少?(10分)
八、某水体中含有300mg/L的悬浮颗粒物,其中70%为细颗粒﹙d<50μm﹚有机碳含量为10%,其余的粗颗粒有机碳含量为5%。某有机物的Kow为106,试计算该有机物的分配系数。
青岛科技大学
二OO八年硕士研究生入学考试试题
考试科目:环境化学
注意事项:1.本试卷共八道大题(共计27个小题),满分150分;
2.本卷属试题卷,答题另有答题卷,答案一律写在答题卷上,写在该试题卷上或草纸上均无效。要注意试卷清洁,不要在试卷上涂划;
3.必须用蓝、黑钢笔或签字笔答题,其它均无效。
﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡
五、水体中常见的吸附等温线有Henry型、Freundlich和Langmuir型三类,吸附等温式
属于哪一类?如何求得参数k和1/n?它们各自的含义是什么?(20分)
六、以CH3(CH2)nCH=CH2为目标物,写出脂肪酸β-氧化,三羧酸循环到生成CO2和H2O之前的氧化过程.(10分)
七、具有2.00×10-3mol/L碱度的水,已知pH为7.00,[HCO3※]的一级电离常数K1为
青岛科技大学研究生科研量化分要求
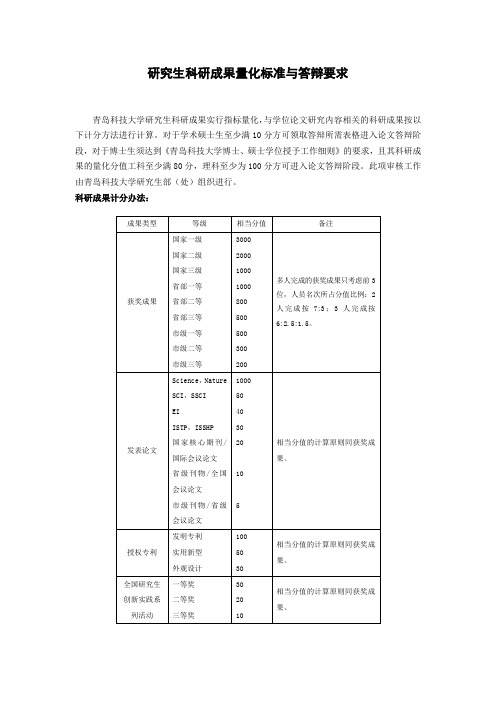
研究生科研成果量化标准与答辩要求
青岛科技大学研究生科研成果实行指标量化,与学位论文研究内容相关的科研成果按以下计分方法进行计算。
对于学术硕士生至少满10分方可领取答辩所需表格进入论文答辩阶段,对于博士生须达到《青岛科技大学博士、硕士学位授予工作细则》的要求,且其科研成果的量化分值工科至少满80分,理科至少为100分方可进入论文答辩阶段。
此项审核工作由青岛科技大学研究生部(处)组织进行。
科研成果计分办法:
科研成果计分办法:
1、对于导师为第一位,学生为第二位的,学生按第一作者计。
2、对于提前毕业申请答辩研究生,除了学分要求以外,量化分值应达到以下要求:
A、博士生:理科≥300分,工科和人文类学科≥240分;
B、硕士(学术型硕士和学制为3年的专硕):理科≥50分,工科和人文类学科≥30分;
3、对于SCI论文,量化分值按影响因子(I f)计算:分值=40+10I f;
4、以上所有成果若以我校为第一单位,均按上述计分办法进行;若外单位为第一单位,我校排第二单位,则量化分值按1/2计算,其它不计分
附:
青岛科技大学硕士毕业生科研量化分要求:。
【研究】青岛科技大学工学院研究生学业奖学金评定细则

【关键字】研究青岛科技大学化工学院研究生学业奖学金评定细则为鼓励研究生在校期间勤奋学习、刻苦钻研、锐意创新、全面发展,根据财政部、教育部印发《研究生学业奖学金管理暂行办法》(财教[2013]219号)精神和《青岛科技大学研究生学业奖学金管理暂行办法》(青科大字[2014]27号)的要求,自2014年秋季学期起学校设立研究生学业奖学金。
为了公平公正进行奖学金评定,化工学院特制订本院研究生学业奖学金评定细则。
一、组织管理学院成立研究生学业奖学金评定委员会,具体如下:主任:武玉民孙立军副主任:王伟文曲斌艳刘仕伟委员:田文德范金石吕志果刘均洪玄光善张恒王家林刘玲宋飞研究生代表1人二、奖学金设置研究生学业奖学金分为新生奖学金和综合奖学金两类,比率及奖励标准见下表,奖学金的金额和比率将跟随相关政策和实际情况适时调整。
三、研究生学业奖学金的基本申请条件1.具有中华人民共和国国籍,纳入全国研究生招生计划研究生(有固定工资收入的除外);2.热爱社会主义祖国,拥护中国共产党的领导;3.遵守宪法和法律,遵守学校规章制度;4.诚实守信,品学兼优;5.积极参与科学研究和社会实践。
四、研究生有一下情况之一者不得参加学业奖学金的评定1. 因考试作弊等违反校纪受到警告以上(包括警告)处分者;2. 学术行为不端者;3. 在科研工作及学习实践中,造成重大责任事故及损失者;4. 参与非法组织及活动者;5. 本学年有学位课程考试不及格者;6. 未通过研究生中期考核者;7.未按时交纳学费者。
五、奖学金评定办法1.第一次奖学金(第一学年的新生奖学金)的评定:按照研究生入学考试的初试成绩或推免生的本科阶段综合测评分数高低来确定奖学金的等级;其中推免生不分专业全院统一排名按比率评定,排名依据为推免生在本科阶段的专业排名(依据综合测评分数高低)和本专业总人数的比值,比值小者排名靠前,若比值相同则英语六级成绩高者排名靠前。
第一志愿考生分专业进行奖学金评定,同一专业按照初试成绩进行排名,初试成绩相同按照公共课成绩高者靠前的原则进行排名,然后各专业分别按照相应的比率进行奖学金的评定。
2021年青岛大学化学科学与工程学院(环境科学与工程学院)834化工原理考研..

特别说明本书根据历年考研大纲要求并结合历年考研真题对该题型进行了整理编写,涵盖了这一考研科目该题型常考试题及重点试题并给出了参考答案,针对性强,考研复习首选资料。
版权声明青岛掌心博阅电子书依法对本书享有专有著作权,同时我们尊重知识产权,对本电子书部分内容参考和引用的市面上已出版或发行图书及来自互联网等资料的文字、图片、表格数据等资料,均要求注明作者和来源。
但由于各种原因,如资料引用时未能联系上作者或者无法确认内容来源等,因而有部分未注明作者或来源,在此对原作者或权利人表示感谢。
若使用过程中对本书有任何异议请直接联系我们,我们会在第一时间与您沟通处理。
因编撰此电子书属于首次,加之作者水平和时间所限,书中错漏之处在所难免,恳切希望广大考生读者批评指正。
重要提示本书由本机构编写组多位高分在读研究生按照考试大纲、真题、指定参考书等公开信息潜心整理编写,仅供考研复习参考,与目标学校及研究生院官方无关,如有侵权请联系我们立即处理。
一、2021年青岛大学化学科学与工程学院(环境科学与工程学院)834化工原理考研核心题库之简答题精编1. 离心分离因数【答案】同一颗粒所受离心力与重力之比,反映离心分离设备性能的重要指标gru g r 22==ωα2. 湿球温度与绝热饱和温度【答案】前者是大量空气与少量水长期接触后水面的温度,后者是气体在绝热条件下增湿至饱和的温度3. 比较单效与多效蒸发之优缺点【答案】单效蒸发生产强度高,设备费用低,经济性低。
多效蒸发经济性高4. 在换热器设计计算时,为什么要限制ψ大于0.8【答案】当ψ≤0.8时,温差推动力损失太大,tm ∆小,所需A 变大,设备费用增加5. 萃取溶剂的必要条件是什么?【答案】与物料中的B 组分不完全互溶;对A 组分具有选择性的溶解度6. 为什么高烟囱比低烟囱拔烟效果好?【答案】由静力学方程可以导出△P=H (ρ冷-ρ热)g ,所以H 增加,压强增加,拔风量大7. 在漫流的条件下,水在垂直直管中向下流动,对同一瞬时沿管长不同位子的速度而言,是否会因重力加速度而使下部的速度大于上部的速度?【答案】因为质量守恒,直管内不同轴向位子的速度是一样的,不会因为重力而加快,重力只体现在压强的变化上。
化工安全与环保智慧树知到课后章节答案2023年下青岛科技大学

化工安全与环保智慧树知到课后章节答案2023年下青岛科技大学青岛科技大学第一章测试1.化工污染不包括( )A:固体废弃物污染B:水污染C:信息污染D:大气污染答案:信息污染2.2013年11月22日上午10点30分许,山东青岛黄岛区沿海河路和斋堂岛路交汇处发生爆燃,同时在入海口被油污染海面上发生爆燃。
截至2013年12月2日,事故最后1名失踪人员遗体已找到并确认身份,此次事故共造成62人遇难。
此次事故属于()事故。
A:一般事故B:较大事故C:重大事故D:特别重大事故答案:特别重大事故3.化工事故中死亡人数从高到低依次是()A:火灾爆炸事故,中毒窒息事故,高空坠落,触电B:触电,火灾爆炸事故,高空坠落,中毒窒息事故C:火灾爆炸事故,高空坠落,触电,中毒窒息事故。
D:中毒窒息事故,火灾爆炸事故,高空坠落,触电答案:火灾爆炸事故,中毒窒息事故,高空坠落,触电4.下面关于化工事故的说法正确的是()A:化工装置运转了一定时间后会进入到故障频发阶段。
B:事故多发生于非正常生产活动期。
C:经常开闭的阀门会发生事故,而常闭的阀门不会。
D:事故主要发生人的操作上,采用自动调节可以避免事故发生。
答案:事故多发生于非正常生产活动期。
5.下面哪个属于设备缺陷的危险因素?()A:有显著危险性和无危险性的工艺装置间的安全距离不够B:风送装置内的粉尘爆炸。
C:支撑物、门、墙等不是防火结构。
D:因选材不当而引起装置腐蚀、损坏。
答案:支撑物、门、墙等不是防火结构。
6.管理上的漏洞原因导致化工生产中发生事故指的是()A:材质选择不当B:违反操作规程C:规章制度不健全D:平面布置不合理答案:规章制度不健全7.化工企业安全生产的特点是高温高压、有毒有害、易燃易爆易腐蚀。
()A:错 B:对答案:对8.化工生产的特点是( )A:安、稳、长、满、优B:连续性,腐蚀性,毒害性,易燃易爆C:连续性,多发性,毒害性,易燃易爆D:火灾爆炸、中毒事故多答案:连续性,腐蚀性,毒害性,易燃易爆9.设备缺陷包括( )A:材料的疲劳,设备不完善,结构上有缺陷,装置基础薄弱B:材料的疲劳,设备不完善,结构上有缺陷,选材不当C:设备不完善,结构上有缺陷,装置基础薄弱,超极限运转D:结构上有缺陷,装置基础薄弱,超极限运转,昂贵设备过于集中答案:材料的疲劳,设备不完善,结构上有缺陷,选材不当10.所有的职业中毒都导致职业病。
2010年青岛科技大学环境化学考研真题研究生入学考试试卷

四、简答题(共35分)
36、为了交通运输的方便,许多沿海城市都沿着海岸建工厂,这种布局是否合理?试阐述理由。(6分)
37、什么是土壤的活性酸度和潜性酸度,两者的关系如何?(8分)
38、为什么脂溶性的物质比非脂溶性的物质容易进入大脑或由母体转运到胎儿体内?(6分)
16、气块在大气中的稳定度与大气垂直递减率和干绝热递减率两者有关,若(),表明大气是稳定的;()大气是不稳定的;()大气处于平衡状态。
A.Γ﹤Γd B.Γ﹥Γd C.Γ=Γd
17、在山谷风盛行时,夜间山坡的温度比山谷的温度(),所以盛行()。
A.高山风B.低山风C.高谷风D.低谷风
18、下列哪个式子是总碱度的表达式()。
A.总碱度=【HCO3-】+2【CO32-】+【OH-】-【H+】
B.总碱度=【HCO3-】+2【CO32-】+【H+】-【OH-】
C.总碱度=【HCO3-】+【CO32-】+【H+】+【OH-】
D.总碱度=【HCO3-】+【CO32-】+【H+】-【OH-】
19、水锰矿吸附水体中低浓度的碱金属离子,若水体中pH在等电点(ZPC)以上时,该吸附作用属于()。
23、有氧氧化中分子氧为直接受氢体的递氢过程中,只有一种酶作用于有机底物。()
24、酚类化合物具有高的水溶性、低辛醇—水分配系数等性质,因此它们大多并不能在沉积物和生物脂肪中富集,主要残留在水中。()
25、腐殖质中的富里酸单位重量含有的含氧官能团数量较多,因而亲水性也较强。()
26、不论雨除或冲刷,对半径为2μ左右的颗粒物都没有明显的去除作用。()
青岛科技大学高密校区专业介绍

青岛科技大学高密校区专业介绍专业名称:国际经济与贸易(本科)培养目标:面对人才国际化和全球竞争的新形势,依托学校工科优势,培养具有全球视野,掌握扎实的国际贸易理论,通晓国际贸易实务和专业技能,了解化工、电工机械等专业相关知识,能熟练运用英语和计算机从事外经贸业务、善于进行国际化经营与管理、具有较强国际竞争力的复合型专门人才。
培养特色:通过理论教学和实践教学,拓宽学生知识面,使学生具有扎实的专业基础,具有工业外贸特长,具有运用现代分析手段解决实际问题的基本技能、国际贸易经营操作技能、英语口语谈判与写作技能、计算机应用技术及良好的沟通能力。
本专业教学具有以下特色:传授知识与培养能力并重,重案例教学,重模拟操作,且注重双语教学。
课程设置:本专业开设的主要专业基础课和专业课有:国际贸易、国际贸易实务、国际市场营销学、国际金融、外贸函电、电子商务、国际商法、国际经济技术合作、国际税收、跨国经营理论与实务、物流管理、货币银行学、会计学、统计学等。
开设的主要基础课有高等数学、大学英语、计算机应用、微观经济学、宏观经济学、国际经济学、化工概论、机械基础、电工电子学等。
此外还开设有大量选修课,涉及经济学、管理学、法学、文学、理学、工学等学科领域。
就业去向:本专业具有学士学位和硕士学位授予权,部分学生毕业后进入研究生学习阶段。
本学院协助学生进行职业生涯设计,本科毕业生除攻读硕士学位和出国留学外,大部分会走上理想的工作岗位,就业去向主要集中在外贸公司、外资公司、涉外机关事业单位、物流系统、金融系统及高新技术企业等。
专业名称:化学工程与工艺(本科)化学工程与工艺专业是一门集化学、物理、数学和工程技术为一身的学科专业。
以化学工业及相关生产过程中所进行的化学、物理过程为研究对象,探究其加工技术中的物质和能量转化与传递过程的规律,研究有关工程因素对过程和装置的影响,解决工艺开发、装置设计、控制操作、综合优化的理论和方法等问题。
高级氧化预处理及生物法联合降解pva的研究

35.马磊聚乙烯醇产品的市场研究[期刊论文]-石油化工技术经济 2003(04)
36.徐竟成,郑涛印染退浆废水中聚乙烯醇的回收与利用[期刊论文]-化工环保 2004(z1)
42.范雪荣,王强,顾蓉英国外纺织浆料的研究与进展[期刊论文]-印染助剂 2003(03)
43.敖利民,唐雯,李向红,王联军水溶性聚乙烯醇纤维在传统纺织领域的应用[期刊论文]-山东纺织科技 2003(01)
44.薛飞燕水溶性维纶的性能与应用[期刊论文]-产业用纺织品 2004(04)
45.张兴,堵国成,陈坚聚乙烯醇降解酶研究进展[期刊论文]-中国生物工程杂志 2003(02)
58.肖良建,肖荔人,刘欣萍,陈庆华聚乙烯醇降解特性研究[期刊论文]-中国塑料 2006(02)
59.李朝,贾省芬,刘志培,刘双江红球菌J-5菌株降解聚乙烯醇的研究[期刊论文]-中国环境科学 2004(02)
60.廖劲松,郭勇,庄桂原生质体融合技术选育高效菌株降解聚乙烯醇[期刊论文]-食品与生物技术学报 2005(02)
40.顾正秋,马远征,高瑾,刘建涛,李永人工髓核材料(半晶聚乙烯醇水凝胶弹性体)的研制[期刊论文]-生物医学工程学杂志 2004(03)
41.倪芳,贾红华,周华,韦萍聚乙烯醇包埋固定Burkholderia cepecia JS-02细胞的研究[期刊论文]-南京工业大学学报(自然科学版) 2004(04)
13.谢冰,徐亚同含PVA退浆废水的处理实践[期刊论文]-环境工程 2002(05)
14.张惠珍,刘白玲,罗荣,吴永忠,雷德松聚乙烯醇的分子量及醇解度对其生物降解性的影响[期刊论文]-中国科学院研究生院学报 2006(05)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
四、下图是我国部分地区降水酸度和主要离子含量,试解释之。
(10分)
五、下面两图都是酶促反应机理表达图,试说明它们的差异,并解释之。
已知其
中一个图的数学表达式为:max
max 1][1)][1(1v S K I v K i m ++=ν;写出另一图的数学表达式(20分)
图1 图2
六、土壤中植物的根系和土壤生物是土壤发生氧化还原的重要参与者,下面是土壤中离子的氧化态,写出其对应的还原态。
(14分)
Fe (III )、Mn (IV )、SO 42-、NO 3-、NO 3-、NO 3-、CO 2
七、一有机化合物排入pH 为6,温度T 为20℃的水体中,52%的有毒物质被悬浮颗粒物吸附,已知酸性水解速率常数K a 为10-2,碱性催化水解速率常数K b 为4.9,中型水解常数K n 为2.2×10-7,试计算该毒物的总水解速率常数K h 。
(10分)
(已知总水解速率常数K h 应为各速率常数与相应离子浓度乘积的加和。
)
八、某河段流量Q = 2160000m 3/d ,流速u 为46km/d ,BOD 5为2mg/L,溶解氧为8.5mg/L,水温为15℃,起始断面排污口排放的废水为1×105m 3/d,水温为26℃,废水中含BOD 5为100mg/L,溶解氧为2.0mg/L,20℃时的耗氧系数k 1 = 1.26d -1, BOD 沉浮系数k 3 = 0.22d -1,求排污口下游6km 处河水的BOD 5和亏氧值。
(假设混合后河水温度不再发生改变,BOD 5随温度的改变量忽略不计,16℃、17℃、18℃、19℃水的饱和溶解氧分别为:9.85、9.65、9.46、9.22mg/L;)
)()()()20201111135.1-=T T k k ;)()()(20203311033.1-=T T k k ;]exp[2156u
x k k BOD BOD km )(+-= (16分)
第 2 页(共 2 页)
.。
