第11章 配位化合物
第十一章:配位化合物介绍

配合物中直接与中心原子结合成键的配位原子的总数目。 单齿配体 配位数等于 配体数 如[Fe(CN)6]3多齿配体 配位数不等于配体数 如[Pt(en)2]2+ 表11-1 常见金属离子的配位数 配 位 数 2 4 离 子 Ag+,Cu+,Au+ Zn2+,Cu2+,Hg2+,Ni2+,Co2+,Pd2+, Si4+,Ba2+ Fe2+,Fe3+,Co2+,Co3+,Cr3+,Pt4+, Pd4+,Al3+,Si4+,Ca2+,Ir3+
26Fe 3+ 2+ +
例如:
[Ar] 3d54s04p0 [Ar] 3d84s24p0 [Ar] 4d105s05p0 [Ar] 3d84s24p0
26Si
4+
[SiF6]2-
27Co 47Ag 28Ni
2 配位体 ( ligand ): 在中心原子周围以一定的空间 构型排列的阴离子或 分子(以配位键结合),它 们能给出孤对电子或电子
[Ni(CO)4]
配合物 [Cu(NH3)4]SO4
内层
[ Cu ( NH 3 ) 4 ] 2+ 中 心 原 子 配配 配 配 位位 位 离 原体 数 子 子 电 荷
外层
S O4 2 外 界 离 子
1 中心原子(central atom )
位于配离子中心的离子或原子 具有空的价电子轨道(通常指(n-1)d,ns,np,nd轨 道)能接受孤对电子 一般是金属离子,大多是过度金属,Ⅷ及其附近副族 元素,少数高氧化值的主族元素离子
配位化合物知识介绍

结果: [Ni(CN)4]2-形成之前和之后, 中心原子的d电子排布发生了
变化,原来由单电子占据、后来腾空了的(n-1)d轨道参与了杂化, 这样一类络合物叫内轨型配合物(Inner orbital complexes), 它们是 指配位体孤对电子填充在(n-1)d轨道和一部分n层轨道上的一类 络合物 。
三氯化五氨•一水合钴(III)
Cu(NH3)4 SO4 硫酸四氨合铜(Ⅱ)
K3 Fe(NCS)6 六异硫氰根合铁(Ⅲ)酸钾
H2 PtCl6 六氯合铂(Ⅳ)酸 Cu(NH3)4 (OH)2 氢氧化四氨合铜(II)
K PtCl5 (NH3) 五氯•氨合铂(Ⅳ)酸钾 先阴离子后中性分子
Zn(OH)(H2O)3 NO3 硝酸一羟基•三水合锌(II)
1.2 配合物的命名
(一) 内外界之间 阴离子前,阳离子后;
(二) 配合单元
配体数目(汉字) + 配体名 + 合 + 中心离子名(氧化态,
(多种配体,以 • 分隔)
用罗马数字)
例:[Cu (NH3)4]SO4 硫酸四氨合铜(II)
[CrCl2 (H2O)4 ]Cl 氯化二氯•四水合铬(III)
配位化合物[CoCl2(H2O)4]Cl的配位体分别是_______;配位原子 分别是______;配位数是_____;命名为_____________。
(三)配体顺序
1.先无机,后有机 : [PtCl3 (C2H4 )] 三氯•乙烯合铂(II) 阴离子
2. 无机配体: 先阴离子,后中性分子,最后阳离子:
K[PtCl3(NH3)] 三氯•氨合铂(II)酸钾
3.同类配体: 按配位原子元素符号的英文字母顺序:
[Co
配位化学

dz2 dx2-y2
eg
3 5
Δo
=6Dq
2 5
Δo
Δo =10Dq
= 4Dq t2g
dxy dxz dyz
八面体场中d轨道能级分裂
24
25
分裂能o
电子成对能(P):两 个电子进入同一轨道 时需要消耗的能量 排布原则:①能量最低原理 ②Hund规则 ③Pauli不相容原理
配位体的电子到底按哪种形式排布决定于分裂能与电子成 对能的大小。电子成对能小些,则电子尽可能排在能量低 的轨道,属于低自旋型,磁矩小,稳定;分裂能小则电子 排在高能量轨道上,属于高自旋型,磁矩大,也不稳定。
[Ni(CN)4]2-的μ = 0,其空间构型为平面正方形
3d
4s 4p
Ni2+
[Ni(CN)4]2-
dsp2杂化 CN- CN- CN-CN-
[NiCl4]2-的μ = 2.83 B.M,空间构型为四面体。
3d
4s
4p
[NiCl4]2-
sp3杂化
Cl- Cl- Cl- Cl17
以Fe(CN)63-为例说明中心离子的杂化轨道 形成配离子 和配合物的配位键形成示意图表示如下:
21
• 形成高自旋配合物的配体有F-、H2O等,其配位原子是电负性 较大的卤素原子和氧原子,不容易给出孤对电子,对中心离子的影 响小,因而不会使中心离子的电子层结构发生改变。 • 反之,如果配位原子电负性小,则容易给出孤对电子,这些 孤对电子影响了中心离子的电子层结构,使(n-1)d轨道上的成单 电子被强行配对,腾出内层能量较低的轨道接受孤对电子,从而形 成低自旋配合物。这类配体主要是CN-(C为配位原子)、-NO2。 • (由CN-形成的配合物一般很稳定,而由F-、H2O 形成的配合物 稳定性差些就是这个原因)
第11章 配位化学基础

N P
O S
F Cl
Ne Ar Kr Xe Rn
Sr Y 配位原子 Ba Lu
Tc Re Bh
Fr Ra Lr Rf Db Sg 配体中与中心金属直接 结合的原子。
Cu Zn Ga Ge As Se Br •Ni 排列在中心金属周围 Ag Cd In Sn Sb Te I •Pd分子或者阴离子 Pt Au Hg Tl Pb Bi Po At • 分为单齿配体与多齿配体
2018/5/31
21
配合物的分类
特殊配合物
1)夹心配合物:
金属原子 M 被夹在两个平行的碳环之间,形成夹心配合物。
2)羰基配合物
以 CO 为配体的配合物称为羰基配合物。
3)原子簇状化合物
有两个或两个以上金属原子以金属 –金属键( M–M)直接结合而 形成的化合物。
4)多核配合物
含两个或两个以上中心金属离子的配合物。
单齿 配体
特点 多齿 配体 举例
有两个或两个以上的配位原子同时与中心金属
结合。可分为二齿、三齿、多齿配体等。
O :O
N N
O H 2C :N CH2 CH 2 N: CH2 C O O: H 2C CH2 C O:
C C O
:O
邻二氮菲 (phen)
乙二胺四乙酸根 (EDTA4-)
配位数
配合物的组成
2018/5/31
11
[Fe(SCN)(H2O)5]2+, [Co(SCN)4(H2O)2]2-, [Cu(NH3)4(H2O)2]2+, [CuBr4]22018/5/31
12
2018/5/31
第11章 配位化合物(10)

第11章配位化合物一.是非题(判断下列各项叙述是否正确,对的在括号中填“√ ”,错的填“×”)。
1.1 复盐和配合物就象离子键和共价键一样,没有严格的界限。
()1.2 Ni(NH3)2Cl2无异构现象,[Co(en)3]Cl3有异构体。
()1.3 配离子 AlF63-的稳定性大于 AlCl63-。
()1.4 已知[CaY]2-的Kθ为6.3×1018,要比[Cu(en)2]2+的Kθ= 4.0×1019小,所以后者更难离解。
()1.5 MX2Y2Z2类型的化合物有 6 种立体异构体。
()1.6 内轨配合物一定比外轨配合物稳定。
()1.7 当CO作为配体与过渡金属配位时,证明存在“反馈π键”的证据之一是CO 的键长介于单键和双键之间。
()1.8 Fe3+和 X-配合物的稳定性随 X-离子半径的增加而降低。
()1.9 HgX4-的稳定性按 F-−−→I-的顺序降低。
()1.10 CuX2-的稳定性按的 Cl-−−→Br-−−→I-−−→CN-顺序增加。
()二.选择题(选择正确答案的题号填入)2. 1 根据晶体场理论,在一个八面体强场中,中心离子d 电子数为()时,晶体场稳定化能最大。
a. 9b. 6c. 5d. 32. 2 下列各配离子中,既不显蓝色有不显紫色的是()a. Cu(H2O)24+b. Cu(NH3)24+c. CuCl24+d. Cu(OH)24+2. 3 下列化合物中,没有反馈π键的是()a. [Pt(C2H4)Cl3]-b. [Co(CN)6]4-c. Fe(CO)5d. [FeF6]3-2. 4 在下列锰的化合物中,锰的氧化数最低的化合物是()a. HMn(CO)5b. Mn(NO)3(CO)c. Mn2(CO)10d. CH3Mn(CO)52. 5 下列离子中配位能力最差的是()a. ClO4-b. SO24-c. PO34-d. NO3-2. 6 M位中心原子,a, b, d 为单齿配体。
第11章 配位化合物
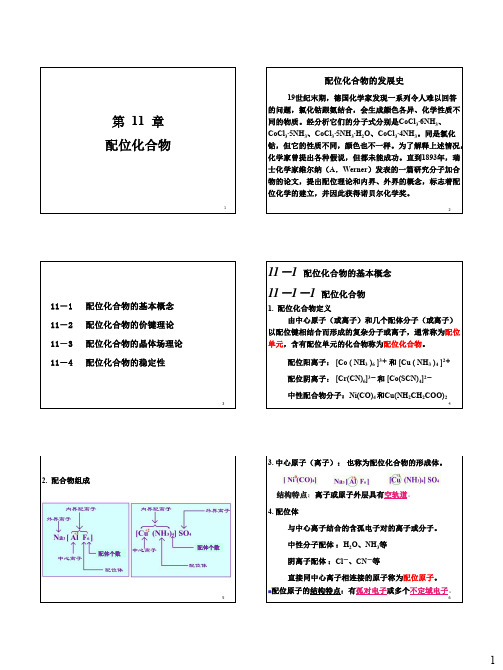
1第 11 章 配位化合物2配位化合物的发展史19世纪末期,德国化学家发现一系列令人难以回答的问题,氯化钴跟氨结合,会生成颜色各异、化学性质不同的物质。
经分析它们的分子式分别是CoCl 3∙6NH 3、CoCl 3∙5NH 3、CoCl 3∙5NH 3∙H 2O 、CoCl 3∙4NH 3。
同是氯化钴,但它的性质不同,颜色也不一样。
为了解释上述情况,化学家曾提出各种假说,但都未能成功。
直到1893年,瑞士化学家维尔纳(A .Werner )发表的一篇研究分子加合物的论文,提出配位理论和内界、外界的概念,标志着配位化学的建立,并因此获得诺贝尔化学奖。
311-1 配位化合物的基本概念11-2 配位化合物的价键理论 11-3 配位化合物的晶体场理论 11-4 配位化合物的稳定性411-1 配位化合物的基本概念 11-1-1 配位化合物1. 配位化合物定义由中心原子(或离子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元,含有配位单元的化合物称为配位化合物。
配位阳离子: [Co ( NH 3 )6 ]3+ 和 [Cu ( NH 3 )4 ]2+ 配位阴离子: [Cr(CN)6]3- 和 [Co(SCN)4]2-中性配合物分子:Ni(CO)4 和Cu(NH 2CH 2COO)252. 配合物组成配体个数配体个数63. 中心原子(离子): 也称为配位化合物的形成体。
4. 配位体与中心离子结合的含孤电子对的离子或分子。
中性分子配体 :H 2O 、NH 3等 阴离子配体 :Cl -、CN -等直接同中心离子相连接的原子称为配位原子。
结构特点:离子或原子外层具有空轨道。
配位原子的结构特点:有孤对电子或多个不定域电子。
75 配位数在配位个体中与一个中心离子(原子)成键的配位原子的总数称为该形成体的配位数。
例如[Cu(NH 3)4]2+中,Cu 2+的配位数为4; [CoCl 3(NH 3)3]中Co 3+的配位数为6。
无机答案第11章 配位化合物

第11章 配位化合物习 题1.给出下列中心金属离子的特征配位数:(a)Cu+;(b)Cu2+;(c)Co3+;(d)Zn2+;(e)Fe2+;(f)Fe3+。
2.按照摩尔导电率的大小将下列配合物排序:(a)K[Co(NH3)2(NO2)4];(b)[Cr(NH3)3(NO2)3];(c)[Cr(NH3)3(NO2)] 3 [Co(NO2)6]2;(d)Mg[Cr(NH3)(NO2)5]。
3.解释为什么EDTA钙盐可作为铅的解毒剂?为什么用EDTA的钙盐而不能用游离的EDTA?4.指出下列配离子中金属元素的氧化态:(1) [Cu(NH3)4]2+;(2) [Cu(CN)2]-;(3) [Cr(NH3)4(CO3)]+;(4) [Co(en)3]2+;(5) [CuCl4]2-;(6) Ni(CO)4.5.命名下列配合物:(1)K3[Co(NO3)6];(2)[Cr(Py)2(H2O)2Cl2];(3)[Cr(H2O)5Cl]Cl2•H2O;(4)K2[Ni(en)3];(5)[Co(NH3)4(NO2)Cl]Cl;(6)K3[Fe(C2O4)3]•3H2O;(7)K2[Cu(C2H2)3];(8)[Pt(Py)4][PtCl4].6.根据下列配合物的名称,写出其化学式:(1)亚硝酸•溴三氨合铂(Ⅱ);(2)一水合二氨•二乙二胺合铬(Ⅲ);(3)溴化硫酸根•五氨合钴(Ⅳ);(4)六氟合铂(Ⅳ)酸钾。
7.画出配离子[Cr(NH3)(OH)2Cl3]2-所有可能的几何异构体。
8.指出下列配合物中配位单元的空间构型并画出它们可能存在的几何异构体:(1)[Pt(NH3)2(NO2)Cl];(2)[Pt(Py)(NH3)ClBr];(3)[Co(NH3)2(OH)2Cl2];(4)K4[Co(NH3)2(NO2)4];(5)[Ni(NH3)3(OH)3];(6)[Ni(NH3)2Cl2].9.配离子[Cr(en)2Cl2]+存在几种几何异构体,哪种异构体可以表现出旋光活性,画出这些异构体。
2020高中化学配位化学的基本概念

了解
无机化学 第11章
4、配离子的电荷: 中心体和配位体总电荷数的代数和。
Al(OH)4-,SiF62-,PF6CdCl64- 、 ZnCl42-、HgCl42PtCl64-和 PtCl42[Cu(NH3)4]2+和 [Cu(NH3)2]+
Fe(3) Fe(4)
N(32)
N(26)
N(31) Ni(3)
O(31) N(25)
O(22)
N(45) O(11) O(42)
Ni(1)
N(11)
N(46)
N(12)
Fe(2) O(21)
N(22) N(16)
Ni(2)
O(12)
N(21) N(15)
Fe(1)
H2N
S
NN
H
H NN
S H2N
(2)配位体的命名 Ⅰ、有多种配位体时,不同配位体间用“·”隔开 。 Ⅱ、配位体的命名顺序
无机化学 第11章
原则: ①先离子→后分子,先无机配体→后有机配体。 如: K[PtCl3NH3] 三氯·氨合铂(II)酸钾
[PtCl4(en)] 四氯·一乙二胺合铂(Ⅳ)
②同类型:按配位原子元素符号英文字母顺序 如:[Co(NH3)5H2O]Cl3 三氯化五氨·一水合钴(III)
无机化学 第11章
配合物 [Ag(NH3)2]Cl
配 配位数 体
NH3
2
配体数 中心体 氧化数
2
+1
配位 原子
N
[Cu(NH3)4]SO4 NH3
4
[Fe(CO)5]
CO 5
[CoCl3(NH3)3] NH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
11-2-2 中心价层轨道的杂化
若中心参与杂化的价层轨道属同一主层,即采取
ns np nd杂化,d轨道在s和p轨道的外侧,形成的配合
物被称为外轨型配合物; 若中心参与杂化的价层轨道不属同一主层,即采 取(n-1)d ns np杂化, d轨道在s和p轨道的内层,形 成的配合物被称为内轨型配合物。
20
2. 立体异构
配位单元的组成和键连关系相同,但配体
相互位置不同或在空间的排列取向不同。
(1)几何异构
四配位的平面正方形 [Ma2b2] 配合物有顺式 (cis-)
和反式(trans-)两种异构体。
21
四配位的平面正方形配合物[Mabc2]也有 顺式 (cis-) 和反式 (trans-) 两种异构体, [Mab3] 无几何
9
2. 配合物的构成
[Cu(NH3)4]SO4 ┌──┴──┐ 内界inner 外界outer 配位单元→ [Cu(NH3)4]2+ SO4 2‾ ┌───┴───┐ 中心(原子)central atom 配体ligand Cu2+ NH3 ↑ 配位原子coordinating atom
10
3. 中心(原子) 中心(原子)又称为配合物的形成体,多是金属阳 离子或中性原子,如FeF63- 或 Ni(CO)4;
cis-[CoCl2(NH3)4]+
trans-[CoCl2(NH3)4]+
23
六配位的八面体 [Ma3b3]型配合物有面式 (fac-)和 经式(mer-)两种异构体。
Cl H2O H2O Ru OH2 Cl Cl
Cl Cl
OH2 Ru OH2
Cl OH2
fac-[RuCl3(H2O)3]
mer-[RuCl3(H2O)3]
8
例如: 配位阳离子 [Co(NH3)6]3+ ,配合物 [Co(NH3)6]Cl3
配位阴离子 [Cr(CN)6]3- ,配合物 K3[Cr(CN)6]
中性配分子 Ni(CO)4,配合物 Ni(CO)4 特例: NH4Cl,K3PO4不是配合物 复盐光卤石KCl· MgCl2· 6H2O的组成是
KCl· [Mg (H2O)6] Cl2 ,也不被看作是配合物
N en N
NH3
N en N Co N N en
26
M(aa)2bc
11-2 配合物的价键理论
杂化轨道理论----配合物的价键理论 其实质是配体中配位原子的孤电子对向中心的空 杂化轨道配位形成配位键,配合物的构型由中心的杂
化方式决定。
11-2-1 配合物的构型 常见配位单元的构型有:直线形,三角形,四面 体,正方形,三角双锥,正八面体。P321表格
解: Pt2+ 5d8 , CN- 为强场配体 重排
dsp2杂化
形成正方形构型的内轨型配合物
33
11-2-3 配位化合物的磁性 化合物中成单电子数和磁性有关。
可以利用磁矩判断配合物中中心原子的单电子数
目,从而确定配合物的成键情况,是内轨或外轨型配
合物。
磁矩 和单电子数n 有如下关系,式中B.M.(B) 为
24
[Ma2b2c2]型
b a c a b a a c c b
M
c
M
b
全反式
b
a
全顺式
a
b
c
a
c
b
a
c
b
c
M
b
c
M
a
c
M
a
b
一反二顺式
25
(2)旋光异构
分子无对称中心,也无对称面,则有旋光异构体。
a a M b c b b c c M b c
a
a
en N
Ma2b2c2
Cl Cl H3N
N Co
Mabcd
生物体中的配位化合物:生物体内各种各样
起特殊催化作用的酶,几乎都与有机金属配合物密切
相关。例如叶绿素是以 Mg2+ 为中心的复杂配合物。 植物固氮酶是铁、钼的蛋白质配合物。血红蛋白是铁 的配合物。
6
11-1 配位化合物的基本概念
11-1-1 配位化合物
实验: 氨水 CuSO4 氨水 NaOH 未能检 出Cu2+
28
1. ns np nd 杂化 例11-1 Fe(H2O)63+ 解:
Fe3+ 3d5 3d 4s 4p 4d
sp3d2杂 化
3d
sp3d2
形成正八面体构型的外轨型配合物(电价配键)
29
例11-2 Ni(CO)4 解:
重排
sp3杂 化
形成正四面体构型的外轨型配合物
sp3 3d10
30
强配体:能使中心的价电子发生重排,如CO, CN–和NO2–等。 弱配体:不能使中心的价电子发生重排,大多数
2
1893年,26岁的瑞士化学家维尔纳提出了配
位键、配位数的概念,主价、副价理论,奠定了 配位化学的基础,他也由此获得了1913年的Nobel化 学奖。 配位化学的研究和应用范围非常广泛。 离子的鉴定:例如丁二酮肟在弱碱性介质中与
பைடு நூலகம்
Ni2+可形成鲜红色难溶的二(丁二酮肟)合镍(Ⅱ)沉淀,
藉此可鉴定Ni2+。再如用KSCN可检验Fe3+的存在。
六氟合硅(IV)酸铜
H2[PtCl6]
[Ag(NH3)2](OH)
六氯合铂(IV)酸
氢氧化二氨合银(I)
15
2 . 配位单元
在配位单元内,先配体后中心。
配体前面用 二、三、四 … … 表示该配体的个
数;几种不同的配体之间加“ · ”号隔开;配体与中
心之间加“合”字;中心后面加 (
表示中心的价态。 例如 [Co(NH3)6]Cl3
1
引言:
配位化学也被称为络合物化学。
据文献记载,1798年法国分析化学家塔赫特发现
亚钴盐在氯化铵和氨水溶液中生成 [Co(NH3)6]Cl3 ,
从而引起了许多化学家对这类化合物的研究兴趣。
文献上最早记载的配合物是 Fe4[Fe(CN)6]3( 普鲁
士蓝 ) ,是 1704 年普鲁士人迪斯巴赫为寻找蓝色染料, 而将兽皮、兽血同碳酸钠在铁锅中强烈煮沸而得到的。
配体都为弱配体,如F–,Cl–,H2O和C2O42–等。
中强配体:对不同的中心,影响结果不同,如en
和NH3等。
31
2 ( n-1)d ns np 杂化
例11-3 Co(CN)63-
解: Co3+ 3d6 , CN- 为强场配体
重排 d2sp3杂化
形成正八面体构型的内轨型配合物(共价配键)
32
例11-4 Pt(CN)42-
蒸发
X射线晶体 蓝色晶体 衍射证明为 [Cu(NH3)4]SO4· H2 O BaCl2 示有 SO427
1. 定义
配合物是由可以给出孤对电子或多个不定域电 子的一定数目的离子或分子(简称配体)和具有接 受孤对电子或多个不定域电子的空位的原子或离子 (统称中心原子)按一定的组成和空间构型所形成 的化合物。 简化:由中心原子(或离子)和几个配体分子 (或离子)以配位键相结合而形成的复杂分子或离 子,通常称为配位单元,含有配位单元的化合物称 为配位化合物。
14
11-1-2 配位化合物的命名
1. 配合物内外界之间的连缀词 在内外界之间先阴离子后阳离子;若外界是简单
阴离子,在内外界间加“化”字;若外界是复杂阴离
子或阳离子,在内外界间加“酸”字。 例: [Co(NH3)6]Cl3 三氯化六氨合钴(III)
[Cu(NH3)4]SO4
Cu2[SiF6]
硫酸四氨合铜(II)
),内用罗马数字
三氯化六氨合钴(III)
16
3. 配体命名顺序:
(1)先无机配体,后有机配体 √
[CoCl2(en)2]Cl
[PtCl2(Ph3P)2]
氯化二氯∙二(乙二胺)合钴(III)
二氯∙二(三苯基磷)合铂(II)
(2)先阴离子类配体,后分子类配体 √
K[PtCl3(NH3)] 三氯∙氨合铂(II)酸钾
配位单元组成相同但键连关系不同。
(1)解离异构
如 [CoBr(NH3)5]SO4 与 [CoSO4(NH3)5]Br
(2)配位异构
如 [Co(NH3)6][Cr(CN)6]与[Cr(NH3)6][Co(CN)6]
(3) 键合异构
如 [Co(NO2)(NH3)5]Cl2与[Co(ONO)(NH3)5]Cl2
有时也以可是金属阴离子,如Na[Co(CO)4];
少数高氧化数的非金属元素也可作中心,如BF4‾ 、
SiF62‾。
11
4. 配位体、配位原子和配位数 配位体简称配体,可以是中性分子如 H2O 、 NH3
等,也可以是阴离子如Cl-、CN-等。
配位原子是指配体中给出孤对电子与中心直接形
成配位键的原子。如配体 NH3 中的 N , H2O 中的 O ,
Ni2+: 3d8 , µ = 3.2,n = 2,配位数等于6,故中心原
子采取sp3d2杂化,属于外轨型配合物。
35
11-2-4 价键理论中的能量问题 内轨型配合物一般比外轨型配合物的键能大, 稳定性好。 究竟形成内轨还是外轨型配合物,是看总的能 量变化(包括键能和电子成对能P)。
第11章
本章教学目标:
配位化学基础
1 .掌握配合物的基本概念,组成和命名原则,掌握
几何异构现象,了解配合物的结构异构和旋光异构。 2 .掌握配合物的价键理论,杂化类型,内轨、外轨, 以及利用磁性判断结构。 3. 掌握配合物的稳定常数和不稳定常数的概念和意义, 掌握配位平衡的有关计算。 4. 掌握影响配合物稳定性的因素,软硬酸碱规则。
