第七章 配位化合物
配位化合物

• 配位反应与氧化还原反应的关系 配位离解平衡与氧化还原平衡的关系,主 要体现在配位化合物的生成对电极电势的影 响。
根据能斯特方程: 若氧化型生成配位化合物,浓度减小,则E减小; 若还原型生成配位化合物,浓度减小,则E增大。
中心原子(阳离子或原子)与一定数目的配体(离子或 中性分子) ,通过配位键结合,并按一定组成和空间 构型形成的复杂离子称为配离子
例如, [Cu(H2O)4] 2+
含有配离子的化合物以及中性配位分子统称为 配合物。 例如, H[AuCl4] 、[Co(NH3)Cl3]
配位键 配体 中心原子
[Cu (NH3)4]SO4 [Cu (NH3)4]2+
• 当配位体接近中心离子时,为了增强成键 的能力,中心离子用能量相近的空轨道进 行杂化,形成数目相同,能量相等的具有 一定方向性的杂化空轨道,以容纳配位体 提供的电子形成配位键。配离子的空间构 型、配位数及稳定性等主要取决于杂化轨 道的数目和类型。 • M :L(L代表配位体)
第三节 配位化合物的离解平衡
中 心 离 子 配 位 配 体 位 原 子 配 位 数 离 子 电 荷
内界(配离子)
外界 SO42-
内界
在配合物化学式中用方括号表示内界。 配合物的内界能稳定地存在于晶体及水溶液中。 它是配合物的特征部分,它的结构和性质与其他离 子不同。 如: [ Cu (NH3) 4 ]2+
外界
不在内界的其他离子,如SO42- 构成配合物的外界。 写在方括号外,
单齿配体:一个配体中只有一个配位原子 例如: Ag+ 与NH3 结合
配位化合物.pptx

为一类具有特征化学结构的化合物,由中心原子(或离子,统称中 心原子)和围绕它的分子或离子(称为配位体/配体)完全或部分 通过配位键结合而形成。
包含由中心原子或离子与几个配体分子或离子以配位键相结合 而形成的复杂分子或离子,通常称为配位单元。凡是含有配位单 元的化合物都称作配位化合物。研究配合物的化学分支称为配位 化学。
配合物是化合物中较大的一个子类别,广泛应用于日常生活、 工业生产及生命科学中,近些年来的发展尤其迅速。它不仅与无 机化合物、有机金属化合物相关连,并且与现今化学前沿的原子 簇化学、配位催化及分子生物学都有很大的重叠
一、配位化合物的概念
配位化合物,简称配合物。是无机化学研究的 主要对象之一,它是一类复杂、特点多样、应 用广泛的化合物。 它与医学有密切关系,生物体内的金属离子大 多以配合物的形式存在,在生命活动中起着极 其重要的作用。
二、配位化合物的组成
• 1.内界和外界 • 配合物一般由内界和外界两部分组成。 • 内界:即配位单元,是配合物的特征部分 • 外界:除内界以外的部分 • 以硫酸四氨合铜(II)为例说明内界和外界
(一)内界 1.中心离子 2.配体和配位数 3.配离子 (二)外界
三、配离子和配合物的命名
1.配离子的命名顺序 配位数目(用一、二、三、四等 +配体+合=中心离子+ 化合价(用罗马数字表示)+离子 如:书P33 2.配合物的命名 原则:阴离子在前,阳离子在后 如:书P33-34
第七章 配位化合物

1 1.73
2 2.83
3 3.87
4 4.90
5 5.92
如:实验测出 [FeF6]3﹣的µ= 5.9 → n = 5 可知它是外轨型配合物 再如: 再如:实验测出 [Fe(CN)6]3﹣的µ= 1.9 → n = 1 可知它是内轨型配合物 外轨型,中心离子电子结构未变, 外轨型,中心离子电子结构未变,单电子数未变 内轨型,中心离子电子结构改变, 内轨型,中心离子电子结构改变,单电子个数改变
配
配
4
7.1.2 配位化合物的组成
[Cu(N 配 [Cu(NH3)4] SO4
中 心 离 子 配 位 原 子 界 位 体
配 离 子 电 荷
2+
配 位 数
外 界
配位化合物
5
中心离子(原子) ① 中心离子(原子):位于配位化合物的中心位置的离子 或原子,是配合物的核心, 或原子,是配合物的核心, 通常是某些金属阳离子或金属原子以及高 氧化态的非金属元素
和中心离子配合的负离子或分子, ② 配位体: 和中心离子配合的负离子或分子,简称配体
③ 配位原子:直接与中心原子配位的原子。配位原子上均 配位原子:直接与中心原子配位的原子。
有孤对电子, 有孤对电子,N、O、S、Cl、C、F、Br、I等 Cl、 Br、 直接与中心离子(或原子) ④配位数:直接与中心离子(或原子)结合成键的配位原子 数目,常见的为2 数目,常见的为2、4、6。
14
§7.2 配合物的化学键理论
中心离子和配位体之间是怎样结合的? 中心离子和配位体之间是怎样结合的? 关于配合物的化学键理论主要有: 关于配合物的化学键理论主要有: 价键理论√ 晶体场理论 配位场理论 分子轨道理论
15
第7章作业题解(配位化合物)

=4
3.2⇒ n=2 p3 正四面体 外轨型
[Mn(CN)6]4-
Mn2+:3d54s2 → 3d5
1.8 ⇒ n=1
d2sp3
正八面体
内轨型
[Co(NH3)6]3+
Co3+:3d74s2
0⇒
d2sp3
正八面体
内轨型
→ 3d64s0
n=0
5. (1) [Cd(NH3)4]2+,正四面体形
Cd2+: 4d105s2 → 4d10 应为sp3杂化,m=0(n=0)。
2 3 2] 3
Ksp, AgBr 2.89 1013 7.7 1013 22.25
x2 x K 22.25, 即 4.717 2 2.0 2 x (2.0 2 x) x 0.9mol dm 3
12.在100 cm3 K[Ag(CN)2]浓度为0.15 mol· -3的溶液中加入0.10 dm mol· 3KI溶液50 cm3,是否有AgI沉淀产生?若在上述混合溶 dm 液中加入0.20 mol· -3KCN溶液50 cm3,是否有AgI沉淀产生? dm 解:(1)已知:K稳,[Ag(CN)2]- = 1.26×1021, Ksp(AgI) = 1.5×10-16 c{[Ag(CN)2]-} = 0.15×100/(100+50) = 0.10 mol· -3 dm c(I-) = 0.10×50/(100+50) = 0.033 mol· -3 dm [Ag(CN)2]- ⇌ Ag+ + 2CN平衡浓度 / mol· -3 dm 0.10-x x 2x c{[ Ag(CN ) 2 ] } 0.10 x K稳 1.26 1021 c( Ag ) c 2 (CN ) x (2 x )2
南昌大学大学化学第七章习题答案
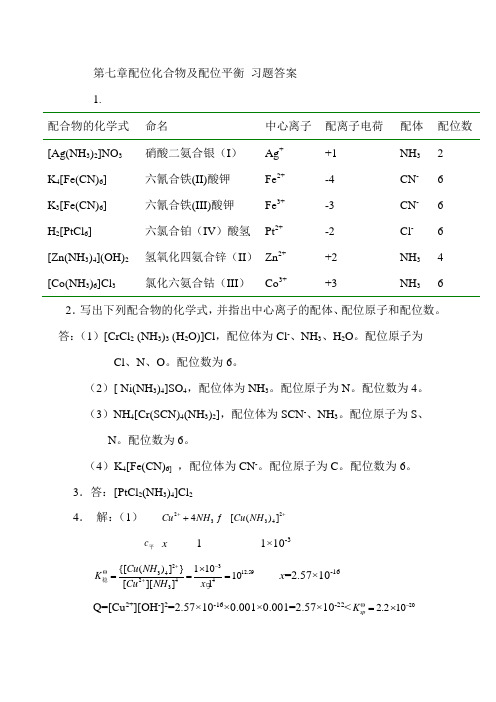
第七章配位化合物及配位平衡 习题答案 1.配合物的化学式 命名 中心离子 配离子电荷 配体 配位数 [Ag(NH 3)2]NO 3 硝酸二氨合银(I ) Ag + +1 NH 3 2 K 4[Fe(CN)6] 六氰合铁(II)酸钾 Fe 2+ -4 CN - 6 K 3[Fe(CN)6] 六氰合铁(III)酸钾Fe 3+-3 CN - 6 H 2[PtCl 6] 六氯合铂(IV )酸氢 Pt 2+ -2 Cl - 6 [Zn(NH 3)4](OH)2 氢氧化四氨合锌(II ) Zn 2+ +2 NH 3 4 [Co(NH 3)6]Cl 3氯化六氨合钴(III )Co 3++3NH 362.写出下列配合物的化学式,并指出中心离子的配体、配位原子和配位数。
答:(1)[CrCl 2 (NH 3)3 (H 2O)]Cl ,配位体为Cl -、NH 3、H 2O 。
配位原子为Cl 、N 、O 。
配位数为6。
(2)[ Ni(NH 3)4]SO 4,配位体为NH 3。
配位原子为N 。
配位数为4。
(3)NH 4[Cr(SCN)4(NH 3)2],配位体为SCN -、NH 3。
配位原子为S 、N 。
配位数为6。
(4)K 4[Fe(CN)6] ,配位体为CN -。
配位原子为C 。
配位数为6。
3.答:[PtCl 2(NH 3)4]Cl 24. 解:(1) 223344[()]Cu NH Cu NH +++ c 平 x 1 1×10-32312.59342443{[()]}11010[][]1Cu NH K Cu NH x +-Θ+⨯=== 稳x =2.57×10-16 Q=[Cu 2+][OH -]2=2.57×10-16×0.001×0.001=2.57×10-22<202.210sp K Θ-=⨯无沉淀。
(2) Q=[Cu 2+][S 2-]=2.57×10-16×0.001=2.57×10-19>366.310sp K Θ-=⨯,有沉淀。
第七章_配位化合物

第七章 配位化合物
•(2)配体命名次序: • 简单负离子-复杂负离子-有机酸根离子-中性分子 (H2O - NH3 -有机分子);不同配体之间用中圆点分开。 例如:H2[PtCl6] 六氯合铂(Ⅳ)酸 [Cr(H2O)4Cl2]Cl 一氯化二氯· 四水合铬(Ⅲ) (3)配体数用中文数字“一、二、三·· ·”表示,标在配体名 · 称之前。 (4)中心离子的电荷数用罗马数字“Ⅰ、Ⅱ 、 Ⅲ 、 Ⅳ” 标明,用圆括号括起来标在中心离子名称之后。
课本220页:表7-2 杂化轨道类型与配合物
–14 –
第七章 配位化合物
第七章 配位化合物
2、d 2sp3杂化:
[Fe(CN)6]3-,Fe3+:3d 5 与CN-配位时,Fe3+采取的是d2sp3杂化。
[Zn(NH3)4]2+, Zn:3d 104s2 →Zn2+:3d 10(4s04p0) 在NH3作用下,Zn2+采取了sp3杂化,形成正四 面体型的杂化空轨道,与配体中NH3中N原子的4对 孤对电子形成四个配位键。空间构型:正四面体 再如: [Ni(NH3)4]2+、 [CoCl4]2-、 [HgI4]2-
夹心配合物示意图
Fe
根据成环原子数目,可以分成四元环、五元环、六元 环、七元环,其中五元环和六元环最稳定,而且,环数 越多越稳定,[Cu(en)2]2+中有两个五元环,[CaY]2-有五 个五元环。 大多数螯合物都有特征颜色,难溶于水,所以分析中 常用EDTA来做配位滴定,其二钠盐易溶于水。
第七章 配位化合物
第七章 配位化合物
第七章
配位化合物 P208
1、掌握配合物的定义、组成及命名
2、掌握配合物价键理论的要点,并能运用杂化轨道理 论解释配离子的空间构型;
大学化学 第七章 配位化合物''
College Chemistry
3.配体类型相同,按配位原子元素符号英文字母顺 序排列;[Co(H2O)(NH3)5]Cl3 三氯化五氨·一水合钴(Ⅲ) 4.配体类型、配原子都相同,原子数少的在前;
[Pt(Py)2(en)2]Cl2 氯化二吡啶·二乙二胺合铂(Ⅱ)
第七章 配位化合物
大 学 化 学
(二)螯合物(chelate)
多齿配体与中心离子形成的具有环状结构的 配合物。 最常见的螯合剂:en,EDTA
第七章 配位化合物
大 学 化 学
College Chemistry
五个五元环
第七章 配位化合物
大 根据成环原子数目,可以分成四元环、五元 学 环、六元环、七元环,其中五元环和六元环最稳 化 定,而且环数越多越稳定。[Cu(en)2]2+中有两个五 学 2-
元环, [CaY] 有五个五元环。分析中常用 EDTA 来做配位滴定。 大多数螯合物都有特征颜色,难溶于水。
College Chemistry
第七章 配位化合物
大 学 化 学
(三)金属有机化合物: 金属原子与有机配体中的C原子结合而形成的 配合物。
1973 年 慕 尼 黑 大 学 的 恩 斯 特 ·奥 托 ·菲舍尔及伦敦帝国学院的杰弗 里 ·威尔金森爵士被授予诺贝尔化 学奖,以表彰他们在有机金属化学 领域的杰出贡献。
2
College Chemistry
反过来,根据配离子的电荷数和配体的电荷 数,也可以推算出中心离子的电荷数。
第七章 配位化合物
大 配合物的种类非常多,主要有两大类: 学 化 (一)简单配合物(complex) 学
单齿配体与中心离子形成的配合物。
三、配合物的类型
College Chemistry
第七章 配位化合物
sp 3d 2杂杂 sp3d 2杂杂杂杂
3d
3d 7
NH3 NH3 NH3 NH 3 NH 3 NH 3
8
外轨型配合物,高自旋 µ = 3.87B.M. 八面体构型
说明 Co(CN)64–不稳定,易被氧化
4d 4p 4s 3d 7
激激 3d6
d 2 sp 杂杂 3d
CN
-
Co(CN)64 –氧化成Co(CN)63–
(3).多核配合物 一个配位原子与二个中心离子结合所成的配合物称多核 配合物,例如:
(4).金属有机配合物 有机基团与金属原子 之间生成碳—金属键 的化合物。A)金属与 碳直接以σ键合的配合 物;B)金属与碳形成 不定域配键的配合物。
7-2 配合物的化学键理论
用来解解释配合物化学键的本质,配合物的结构、稳定性以及一 般特性(如磁性、光譜等)的主要理论有①价键理论、②晶体场理 论、③分子轨道理论。 一,价键理论
4d 4p 4s
4d
CN CN - CN
-
-
CN - CN -
(3).磁性——可通过磁矩来判断内轨型配合物或外轨型的 配合物
形成外轨型的配合物,中心离子电子结构未发生变化,单电子数 与原来自由离子相同; 而形成内轨型的配合物,中心离子的成单电 子数一般会减少,比自由离子的磁矩相应降低,所以可通过磁矩来判 断内、外轨型配合物。. 物质的永磁矩主要是电子的自旋造成的,永磁矩µ与原子或分子中 未成对电子数n有如下关系式:
第七章--配位化合物PPT课件
投入到中心离子的内层空轨道中,所以一般形成外轨型配
合物;CN-、CO等电负性小、变形性大的配位原子,提供
的电子易于投入到内层空轨道中,形成内轨型配合物(螯
合物一般为内轨);NH3、Cl-没有明显的规律;
.
13
• B、配合物的稳定性:指水溶液中的解离程度, 用K不稳或K稳来衡量。价键理论认为(定性): 对同一中心离子或同一配体,配位数相同时,内 轨型配合物较外轨型配合物更稳定,如Co(NH3)62+ + O2 Co(NH3)63+,解释:内轨型配合物极性小, 外轨型配合物极性大,所以外轨型配合物易为水 拆 散 而 解 离 。 例 如 FeF63- ( 外 轨 , 2×1015 ) 、 Fe(CN)63-(内轨1042),FeF63- + 6CN- Fe(CN)63+ 6F-。
.
1
第二节 配合物的基本概念
• 一、配合物的定义
• 它是由形成体(中心体)与配体以配位键结合而成的复杂化合物。
• 二、配合物的组成
• 以[Cu(NH3)4]SO4和K3[Fe(CN)6]为例说明其组成和一些基本概念。 • 1、内、外界:内界(配离子)――[Cu(NH3)42+]、[Fe(CN)6]3-;外界
.
+1
+2
+3
+4
(Ag+、Cu+) (Cu2+、Zn2+、Hg2+) (Fe3+、Co3+) (Si4+、Pt4+)
CN
2
4、6
6、4
6、8
• 6、配离子的电荷:中心离子与配体电荷的代数和,如 [Pt(NH3)4][PtCl4]、[Fe(C2O4)3]3-。
配位化合物
• 第一节 概述
• 自然界中绝大部分的无机化合物(包括盐的水合晶体)都是以配合物的形式存在, 如以配[Cu位(N键H相3)4结]SO合4。的化定合义物:称由配一合个物正。离1子、(日原常子生)活与中一:定蓝数墨目水的渍中、性铁分锈子,或可负以离用子草 酸石油洗化去工,原工因业在:于低草压酸下与聚F合e3成+形低成压了聚F乙e(C烯2O的4)催33-化配剂合是物T。i和叶A绿l的素配为合M物g的;配催合化物剂;生2、 产与生中命的有Pt回关收的研:究人中体的中H输2[氧Pt的Cl4血](红氯素铂―酸―)铁,配专合业物课;程起中血的凝配作合用催的化为原钙理的等配;合3物、; 41C2、uH2[显2FOe(隐;CN5墨、)6水]等定:等影C。剂o2CSl22O溶32液- +(A极gB稀r )A,g(2S[2COo3()H232-;O)66]C鉴l2定粉:红F=e(=NCCSo)6[3C-、oCNl4i](蓝DM色G)2、+
a
5
类别 配离子 配位盐
配位碱 配位酸 配分子
化学式 [Cu(NH3)4]2+ [Ni(CN)4]2K4[Fe(CN)6] [Cu(NH3)2]Cl [Pt(NH3)4][PtCl4] [Ag(NH3)2]OH
H2[SiF6] [Pt(NH3)2Cl2] [Fe(H2O)3(NCS)3]
Fe(CO)5
增加)。
a
7
• 在物质分子中,有一个未成对电子产生的顺磁性远远超过成对电子的
反磁性。顺磁性的大小可用磁矩来衡量,它与未成对电子数有关,可
以通过磁填平来确定。磁矩与未成对电子数有近似公式:m = [x(x + 2)]1/2(B.M.)(玻尔磁子)、x ――未成对(成单)电子数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章 配位化合物一、单项选择题1、 下列物质中不能作为配体的就是 ( B )A 、 NH 3B 、 NH 4+C 、 OH -D 、 NO 2-2、 下列离子或化合物中,具有顺磁性的就是 ( B )A 、 Ni(CN)-24B 、 CoCl -24C 、 Co(NH 3)+36 D 、 Fe(CO)53.在配合物[Co(NH 3)4(H 2O)]2(SO 4)3中,中心离子的配位数为 ( B )A 、 4B 、 5C 、 9D 、 124、 配离子[Co(NH 3)6]2+的空间构型为 ( A ) A 、 八面体 B 、 四方锥形 C 、 四面体 D 、 三角双锥5、 EDTA 就是四元弱酸,当其水溶液pH ≥ 12时,EDTA 的主要存在形式为 ( C ) A 、 H 4Y; B 、 H 3Y -; C 、 Y 4-; D 、 HY 3-6、下列关于价键理论对配合物的说法正确的就是 ( C ) A 、 任何中心离子与任何配体都可形成外轨型化合物; B 、 任何中心离子与任何配体都可形成内轨型化合物;C 、 中心离子用于形成配位键的原子轨道就是经过杂化的等价轨道;D 、 以sp 3d 2与d 2sp 3杂化轨道成键的配合物具有不同的空间构型。
7、下列物质中能被氨水溶解的就是 ( B ) A 、 Al(OH)3 B 、 AgCl C 、 Fe(OH)3 D 、 AgI8、 下面哪一个不属于EDTA 与金属离子形成螯合物的特点 ( B ) A 、 具有环状结构 B 、 稳定性差 C 、 配位比一般为1:1 D 、 易溶于水9、 下列说法欠妥的就是: ( C ) A 、 配合物的形成体(中心原子)大多就是中性原子或带正电荷的离子。
B 、 螯合物以六员环、五员环较稳定。
C 、 配位数就就是配位体的个数。
D 、 二乙二胺合铜(Ⅱ)离子比四氨合铜(Ⅱ)离子稳定。
10、 AgCl 在11mol L -⋅氨水中比在纯水中的溶解度大,其原因就是 ( B ) A 、 盐效应 B 、 配位效应 C 、 酸效应 D 、 同离子效应11、 离子以dsp 2杂化轨道成键而形成的配合物,其空间构型就是 ( A ) A 、 平面正方形 B 、 四面体形 C 、 直线形 D 、 八面体形12、 22Cu(en)+的稳定性比234Cu(NH )+大得多,主要原因就是前者( B )A 、 配体比后者大;B 、 具有螯合效应;C 、 配位数比后者小;D 、 en 的分子量比NH 3大。
13、 Al 3+与EDTA 形成 ( A ) A 、 鳌合物 B 、 聚合物 C 、 非计量化合物 D 、 夹心化合物14、下列说法中错误的就是 ( D ) A 、 配体的配位原子必须具有孤电子对。
B 、 配离子的配位键愈稳定,其稳定常数愈大。
C 、 配合物的颜色最好用晶体场或配位场理论解释。
D、配合物的颜色最好用价键理论来解释。
15、下列几种物质中最稳定的就是( A )A、[Co(en)3]Cl3B、[Co(NH3)6] (NO3)3C、[Co(NH3)6]Cl2D、Co(NO3)316、下列配离子在强酸中能稳定存在的就是( D )A、[Fe(C2O4)]3-B、[AlF6]3-C、[Mn(NH3)6]2+D、[AgCl2]-17、下列叙述中正确的就是(D)A、配合物中的配位键必定就是由金属离子接受电子对形成的B、配合物都有内界与外界C、配位键的强度低于离子键或共价键D、配合物中,中心原子(离子)与配位原子间以配位键结合18、下列水溶液中的反应,其标准平衡常数可作为[FeF6]3-的稳定常数的就是(A)A、[Fe(H2O)6]3+ + 6F- = [FeF6]3- + 6H2OB、[FeF6]3- = Fe3+ + 6F-C、[FeF6]3- + 6H2O = [Fe(H2O)6]3+ + 6F-D、[FeF6]3- + H2O = [FeF5(H2O)]2- + F-19、下列物质中的中心离子磁矩最小的就是( B )A、[Fe(CN)6]3-B、[Co(CN)6]3-C、[Cu(NH3)4]2+D、[FeF6]3-20、配合物K2[Zn(OH)4]的名称就是: ( C )A、氢氧化锌钾B、四氢氧化锌(II)钾C、四羟基合锌(II)酸钾D、四羟基合锌(II)钾21、下列配离子都具有相同的强场配体CN-,其中属于外轨型配合物的就是( A )A 、[Zn(CN)4]2- B、[Fe(CN)6]3-C、[Ni(CN)4]2-D、[Co(CN)6]3-22、下列说法中错误的就是( D )A、一般说来内轨型配合物较外轨型配合物稳定B、在[Cu(en)2]2+中,Cu2+的配位数就是4C、CN-与CO作为配体时力图形成内轨型配合物D、金属原子不能作配合物的形成体23、NH4[Cr(NCS)4(NH3)2]的正确名称就是( B )A、四(硫氰酸根)·二氨合铬(Ⅲ)酸铵B、四(异硫氰酸根)·二氨合铬(Ⅲ)酸铵C、四(异硫氰酸根)·二氨合铬酸铵D、四(硫氰酸)·二氨合铬(Ⅲ)酸铵24、内轨型配离子[Fe(CN)6]3-的磁距等于2、0 B、M、,判断其空间构型与中心离子的杂化轨道分别为( D ) A、四面体形与sp3B、正方形与dsp2C、八面体形与sp3d2D、八面体形与d2sp325、下列配离子中最稳定的离子就是: ( D )A、[AgCl2]-B、[Ag(NH3)2]+C、[Ag(S2O3)2]3-D、[Ag(CN)2]-26、以下表达式中,正确的就是: ( C )A 、 ()()()/MY (MY)M Y =fc K c c Θ B 、 [][][]/f MY M Y =K Θ C 、 [][][]f MY (MY)M Y =K D 、 [][][]f M Y (MY)MY =K27、 利用生成配合物而使难溶电解质溶解时,最有利于沉淀的溶解的条件就是 ( B )A 、 lg K MY 愈大,K sp 愈小B 、 lg K MY 愈大,K sp 愈大C 、 lg K MY 愈小,K sp 愈大D 、 lg K MY >>K sp28、 在[Co(en)2Cl 2]+离子中,钴的氧化数与配位数分别为: ( C )A 、 0与4B 、 +2与4C 、 +3与6D 、 +2与629、 某金属离子生成的两种配合物的磁矩分别为μ=4、90 BM 与μ=0、00 BM,则该金属可能就是: ( B ) A 、 Cr 3+ B 、 Fe 2+ C 、 Mn 2+ D 、 Zn 2+ 30、 配合物K 3[Fe(CN)5CO]的中心离子杂化类型就是: ( C ) A 、 sp 3d 2 B 、 dsp 3 C 、 d 2sp 3 D 、 sp 3d 31、 EDTA 与金属离子形成的配合物的配位比一般为 ( A ) A 、 1﹕1 B 、 1﹕2 C 、 2﹕1 D 、 1﹕3 32、 在0、20 1mol L -⋅ [Ag(NH 3)2]Cl 溶液中,加入等体积的水稀释(忽略离子强度影响),则下列各物质的浓度为原来浓度的21的就是 ( D )A 、 c ([Ag(NH 3)2]Cl)B 、 解离达平衡时c (Ag +)C 、 解离达平衡时c (NH 3·H 2O)D 、 c (Cl -)33、 向 [Cu(NH 3)4]2+水溶液中通入氨气,则 ( D ) A 、 K 稳([Cu(NH 3)4]2+)增大 B 、 [Cu 2+]增大 C 、 K 稳([Cu(NH 3)4]2+)减小 D 、 [Cu 2+]减小34、 对于配合物中心体的配位数,说法不正确的就是 ( A ) A 、 直接与中心体键合的配位体的数目 B 、 直接与中心体键合的配位原子的数目 C 、 中心体接受配位体的孤对电子的对数 D 、 中心体与配位体所形成的配价键数35、 [Ca(EDTA)]2-配离子中,Ca 2+的配位数就是 ( D ) A 、 1 B 、 2 C 、 4 D 、 6 36、 在[Co(en)(C 2O 4)2]配离子中,中心离子的配位数为 ( D ) A 、 3 B 、 4 C 、 5 D 、 637、 在[Ru(NH 3)4Br 2]+中,Ru 的氧化数与配位数分别就是 ( C ) A 、 +2与4 B 、 +2与6 C 、 +3与6 D 、 +3与438、 Fe 的原子序数为26,化合物K 3[FeF 6]的磁矩为5、9 B 、M 、,而 K 3[Fe(CN)6]的磁矩为2、4 B 、M 、,这种差别的原因就是 ( C ) A 、 铁在这两种配合物中有不同的氧化数 B 、 CN -比F -引起的晶体场分裂能更小 C 、 F 比C 或N 具有更大的电负性 D 、 K 3[FeF 6]不就是配位化合物39、 对配位反应的条件稳定常数K 'MY 而言,下列说法正确的就是: ( C ) A 、 K 'MY 就是常数,不受任何条件限制; B 、 K 'MY 的大小完全就是由K MY 决定的;C 、 K 'MY 的大小表示有副反应发生时主反应进行的程度;D 、 K 'MY 的大小只受溶液酸度的影响40、 影响EDTA 滴定反应平衡常数的因素有: ( A ) A 、 温度; B 、 催化剂; C 、 反应物浓度; D 、 反应速率 41、 已知lg K AlY =16、1,pH=10时lg αY(H)=0、5,AlY 的条件稳定常数lg K AlY '就是: ( B )A 、 16、6;B 、 15、6;C 、 15、1;D 、 8、5 42.Fe 3+具有d 5电子构型,在八面体场中要使配合物为高自旋态,则分裂能△与电子成对能P 所要满足的条件就是 ( C ) A. △与P 越大越好 B 、 △> P C. △< P D 、 △= P43、 根据晶体场理论,在八面体场中,由于场强的不同,有可能产生高自旋与低自旋的电子构型就是 ( C ) A 、 d 2 B 、 d 3 C 、 d 4 D 、 d 8 44、 下列说法中正确的就是( D)A 、 配位原子的孤电子对越多,其配位能力就越强B 、 电负性大的元素充当配位原子,其配位能力也强C 、 CH 3-C-OH 配体就是双齿配体D 、 在[Cu(en)2]2+中,Cu 2+的配位数就是4 45、 解释在FeCl 3溶液中滴加KCNS 试剂,溶液变红的原因就是( B) A 、 FeCl 3溶液被稀释放 B 、 生成了[Fe(CNS)6]3- C 、 没有反应 D 、 生成了Fe(CNS)3沉淀 46、 以CN-与CO 作配体时较之以F-与H 2O 作配体时形成的配合物多为内轨型,其原因就是( A)A 、 在CN-与CO 中的C 较之F 与O 更易提供电子对B 、C 比O 与F 的原子半径大,极化率大,易变形,所提供的电子对易进入中心体的内层空轨道C 、 C 的原子量较之F 与O 小D 、 CN-与CO 的式量较之F 与O 的原子量大47、 已知AgI 的Ksp=K1,[Ag(CN)2]-的K 稳=K 2,则下列反应的平衡常数K 为( A)AgI(s)+2CN [Ag(CN)2]-+I -A 、 K1、K2B 、 K2/K1C 、 K1/K2D 、 K1+K2 48、 下面叙述正确的就是 ( D ) A. Fe (H 2O)4(C 2O 4)+的配位数为5B. 产生d-d 跃迁光谱时,Co(CN)63-与Co(NH )363+相比较,前者将吸收波长较长的光C. s 轨道与p 轨道在八面体场中发生分裂D. 在四面体与八面体场中,d 2型离子配合物不存在高低自旋之分 49、 比较下列各对配合物的稳定性,错误的就是 ( B ) A. [Fe (CN)6]3- > [Fe (C2O 4)3]3-B 、 HgCl 42->HgI 42-C. [Al F 6]3- > [Al Br 6]3- D 、 [Al (OH)4]- > [Zn (OH)4]2-50、 影响中心离子(或原子)配位数的主要因素有 ( D ) A 、 中心离子(或原子)能提供的价层空轨道数B.空间效应,即中心离子(或原子)的半径与配位体半径之比越大,配位数越大C.配位数随中心离子(或原子)电荷数增加而增大D.以上三条都就是51、 乙二胺能与金属离子形成下列中的哪种物质?( C )A.复合物B、沉淀物C、螯合物D、聚合物B52、[Co(SCN)4]2-离子中钴的价态与配位数分别就是( )A、-2,4B、+2,4C、+3,2D、+2,1253、当0、01 mol CrCl3·6H2O在水溶液中用过量硝酸银处理时,有0、02 mol氯化银沉淀出来,此样品中配离子的最可能表示式就是( B )A、[Cr(H2O)6]2+B、[CrCl(H2O)5]2+C、[CrCl(H2O)3]2+D、[CrCl2(H2O)4]+二、填空题1、[Fe(CN)6]4-Fe2+以d2sp3杂化轨道与CN-成键,故[Fe(CN)6]4-称为低自旋配合物;[FeCl6]3-中Fe3+以sp3d2杂化轨道与Cl-成键,配离子的稳定性就是[Fe(CN)6]4-大于[FeCl6]3-、2、配合物Fe(CN)63-中心离子的杂化轨道类型就是d2sp3,空间构型: 正八面体。
