强酸制弱酸
强酸制取弱酸的原理及其应用大汇总

强酸制取弱酸的原理及其应⽤⼤汇总呵呵有点⼩偷懒,汇集⼀下有关强酸制取弱酸的原理及其应⽤的好⽂档强酸制取弱酸,指的是较强酸(可以是强酸或弱酸)可⽣成较弱酸。
即:强酸+弱酸盐→弱酸+强酸盐中学化学通常以H 2CO 3、H C O 3-的酸性作为⽐较标准,要求掌握常见弱酸酸性强弱顺序:强酸制弱酸原理的应⽤主要体现在以下⼏个⽅⾯:1. 实验室制取某些弱酸C a C O H C l C a C lH O C O 32222+=++↑ N a S O H S O N a S O H O S O 232424222+=++↑()较浓 F e S H S O F e S O H S +=+↑2442C a P O H S O H P O C a S O 34224344323()()+=+浓 B a O H S O B a S O H O 224422+=↓+2. 解释现象漂⽩粉久置失效的原因:C a C l O C O H O C a C O H C l O ()22232++=↓+ 222H C l O H C l O =+↑建筑⽤的粘合剂⽔玻璃久置会变质:N a S i O C O H O H S i O N a C O 23222323++=↓+3. 产物的判断①向N a A l O 2溶液中通⼊少量的⼆氧化碳232222332AlO CO H O Al OH CO --++=↓+()②向N a A l O 2溶液中通⼊过量的⼆氧化碳A l O C O H O A l O H H C O 222332--++=↓+() ③向N aS i O 23溶液中通⼊少量的⼆氧化碳 S i O C O H O H S i O C O 32222332--++=↓+ ④向N aS i O 23溶液中通⼊过量的⼆氧化碳 S i O C O H O H S i O H C O 3222233222--++=↓+ ⑤向C H O N a 65溶液中通⼊⼆氧化碳 C H O N a C O H O C H O H N a H C O 6522653++=+ 不管CO 2是否过量,都⽣成N a H C O 3。
强酸制弱酸的对角线交叉规律

强酸制弱酸的对角线交叉规律在我们身边,酸酸甜甜的日子总是让人感到新奇。
说到酸,大家可能首先想到的是那些让人皱眉的强酸,比如硫酸、盐酸等等,这些可不是好惹的角色,谁碰上了都得小心翼翼,生怕被它们的威力给吓着。
可是,嘿,今天我们聊聊一种奇妙的现象,强酸可以变成弱酸的对角线交叉规律。
听起来有点高深,但其实很简单,也很有趣!想象一下,你在厨房里,准备做一碗酸汤。
你拿出一些醋,这可是一种常见的弱酸,随便倒几滴就能让汤鲜美无比。
可如果你不小心把强酸也放进去,那可就惨了,汤一瞬间变成了危险的化学武器!所以说,强酸和弱酸之间的平衡可真是微妙得很。
想想强酸,那就是街头的小霸王,威风八面,谁都怕它。
而弱酸嘛,就像是乖乖女,温柔可人,虽然也能带来酸爽的味道,但绝对不会把你搞得满头大汗。
你有没有注意到,强酸和弱酸的“家族”关系?强酸往往在周期表的左边,而弱酸则是乖乖呆在右边。
这就像是家里的长辈和小辈,长辈总是威严,而小辈们却可以撒娇卖萌。
强酸就像那位严格的老师,哪怕只是一句简单的指令,都能让人紧张得不行。
而弱酸则是和蔼可亲的邻居,偶尔来家里聊聊天,带来点儿小惊喜。
对角线交叉规律就像是这两者之间的“交情”。
强酸经过一系列化学反应后,往往会变成弱酸,仿佛是从严厉的老师变成了和蔼的朋友。
这种转变,就像一个人在经历了生活的磨练后,渐渐变得成熟稳重,不再一味张扬。
酸的世界也有它的情感波动,不是所有的酸都那么“咄咄逼人”。
想想看,什么是生活的真谛?就是学会在强与弱之间找到那个微妙的平衡啊。
这种规律不仅在酸的世界中存在,生活中也是如此。
就像那些霸道总裁,总想在商场上呼风唤雨,但有时候需要的是温柔一击,才能真正赢得人心。
强烈的态度有时候不如温柔的包容,更能让人放下戒备。
这个对角线交叉规律,告诉我们,强酸虽然强势,但弱酸也有其独特的魅力。
它们相辅相成,才让这个化学世界变得丰富多彩。
咱们再想想生活中的一些实例,很多时候我们会看到一些人一开始非常强势,但随着时间的推移,他们会逐渐变得柔和起来。
强酸制弱酸的条件

强酸制弱酸的条件
嘿,咱今天就来聊聊“强酸制弱酸的条件”这事儿哈。
你说这强酸制弱酸,就好像是一场力量的较量。
就好比一个大力士和一个小瘦子打架,大力士很容易就把小瘦子给制服啦。
但这其中也是有条件的哦,可不是随随便便就能成功的。
首先呢,这两种酸得能碰到一起呀,要是它们八竿子打不着,那还较量个啥呀!这就像两个要打架的人,得在一个地方才能干起来嘛。
然后呢,强酸得有足够的“霸气”,就是它得够强,不然怎么能镇得住弱酸呢。
要是强酸自己都弱弱的,那还怎么去制弱酸呀,那不就成笑话啦。
还有哦,环境也很重要呢。
就好像打架得找个合适的场地,要是在沼泽地里,说不定大力士自己都陷进去了,还怎么打呀。
这反应的环境也得合适,温度呀、浓度呀等等,都得恰到好处才行。
咱就说,这强酸制弱酸的条件就像是一场游戏的规则,得遵守了才能玩得转。
要是不遵守,那可就乱套啦。
我记得有一次,我在实验室里就想试试强酸制弱酸,结果呢,因为没注意条件,哎呀,那场面,简直不忍直视。
就好像一场闹剧,最后啥也没做成,还搞得一塌糊涂。
从那以后呀,我就知道了,这条件可不能小瞧,得认真对待。
总之呢,强酸制弱酸的条件就像是一个门槛,跨过去了,就能看到精彩的化学反应,跨不过去,就只能在门外干瞪眼啦。
咱可得把这些条件都记住咯,这样才能在化学的世界里玩得尽兴呀!就像那句话说的,“没有规矩,不成方圆”,这强酸制弱酸也得有它的规矩才行呢!哈哈,现在大家是不是对强酸制弱酸的条件有更深刻的理解啦?。
强酸、弱酸常见的七种判断方法
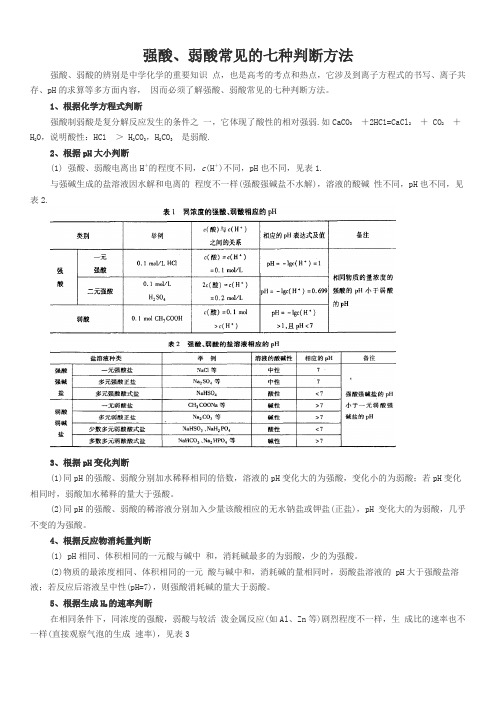
强酸、弱酸常见的七种判断方法强酸、弱酸的辨别是中学化学的重要知识点,也是高考的考点和热点,它涉及到离子方程式的书写、离子共存、pH的求算等多方面内容,因而必须了解强酸、弱酸常见的七种判断方法。
1、根据化学方程式判断强酸制弱酸是复分解反应发生的条件之一,它体现了酸性的相对强弱.如CaCO3+2HC l=CaCl2+ CO2+H2O,说明酸性:HC l> H2CO3,H2CO3是弱酸.2、根据pH大小判断(1) 强酸、弱酸电离出H+的程度不同,c(H+)不同,pH也不同,见表1.与强碱生成的盐溶液因水解和电离的程度不一样(强酸强碱盐不水解),溶液的酸碱性不同,pH也不同,见表2.3、根据pH变化判断(1)同pH的强酸、弱酸分别加水稀释相同的倍数,溶液的pH变化大的为强酸,变化小的为弱酸;若pH变化相同时,弱酸加水稀释的量大于强酸。
(2)同pH的强酸、弱酸的稀溶液分别加入少量该酸相应的无水钠盐或钾盐(正盐),pH 变化大的为弱酸,几乎不变的为强酸。
4、根据反应物消耗量判断(1) pH相同、体积相同的一元酸与碱中和,消耗碱最多的为弱酸,少的为强酸。
(2)物质的最浓度相同、体积相同的一元酸与碱中和,消耗碱的量相同时,弱酸盐溶液的 pH大于强酸盐溶液;若反应后溶液呈中性(pH=7),则强酸消耗碱的量大于弱酸。
5、根据生成H2的速率判断在相同条件下,同浓度的强酸,弱酸与较活泼金属反应(如Al、Zn等)剧烈程度不一样,生成比的速率也不一样(直接观察气泡的生成速率),见表36、根据导电性强弱判断同温度、同物质的量浓度强酸、弱酸溶液,电离出自由移动离子浓度不同(强酸是完全电离,弱酸是部分电离),溶液的导电性也不同,强酸溶液的导电性强于弱酸溶液(可以用电流计测出)。
7、根据中和热大小判断相同条件下,绝大多数弱酸电离时需要吸收大量的热量,因此与强碱中和释放出的热量 (又称中和热)小于强酸(可以用量热计测出)_ 如1 L0. 1 mol/L HC l与CH3COOH稀溶液与同浓度的NaOH溶液中和,测得HC l的中和热所放出的热量为57. 3 KJ/mol,CH3COOH的中和热所放出的热量为56.0 KJ/mol。
强酸制弱酸的原理是什么?

强酸制弱酸的原理是通过酸催化反应中的质子转移来实现的。
具体而言,强酸可以将一个质子(H+离子)转移给一个弱酸分子,使得弱酸分子获得额外的质子而形成其共轭酸形式。
在化学反应中,质子转移是一种常见的反应机制。
酸是指能够释放质子的化合物,而弱酸相对来说释放质子能力较差,因而它的酸性较弱。
但是,强酸具有更强的酸性,能够比较容易地释放质子。
当强酸与弱酸反应时,强酸会将质子转移给弱酸分子,使其成为共轭酸。
这个过程称为质子转移反应。
最常见的例子是强酸硫酸与弱酸乙酸的反应:H2SO4 + CH3COOH -> H3O+ + CH3COO- + HSO4-
在上述反应中,硫酸(H2SO4)是强酸,它能够释放两个质子。
乙酸(CH3COOH)是弱酸,它接受了硫酸释放的一个质子,并形成了共轭酸(乙酰离子CH3COO-)。
反应后,乙酸的酸性得到加强,成为了更强的共轭酸。
总的来说,强酸通过将质子转移给弱酸分子,使其形成共轭酸从而提高了弱酸的酸性。
这种质子转移反应是酸催化反应
的基本原理之一。
强制弱原理

强酸制弱酸的原理是基于酸碱平衡的原理。
在溶液中,酸碱反应是相互中和的,也就是说,强酸和弱酸之间可以相互反应,而产生水和盐。
强酸通常具有很高的离子化能力,能够将弱酸中的酸性离子(H+)离子化,使酸性离子的浓度降低,从而降低酸的强度。
强碱制弱碱的原理也是基于酸碱平衡的原理。
强碱具有很高的碱化能力,能够将弱碱中的碱性离子(OH-)碱化,使碱性离子的浓度降低,从而降低碱的强度。
在实际应用中,强酸或强碱通常会被用来调节酸碱度,来控制反应条件或调节溶液稳定性。
此外,强酸制弱酸和强碱制弱碱还可以用于调节溶液的pH值,比如在化学分析、工业生产、环境保护等领域中都有广泛应用。
在工业生产中,强酸可以用来降低高碱度的水中的碱性离子,使水变成中性或酸性,从而提高水的质量。
强碱可以用来提高低碱度的水中的碱性离子,使水变成中性或碱性,从而提高水的质量。
在环境保护中,强酸和强碱可以用来处理废水和废液,减少对环境的污染。
在化学分析中,强酸和强碱可以用来调整溶液的酸碱度,从而改变反应条件,使分析结果更准确。
总之,强酸制弱酸和强碱制弱碱的原理是基于酸碱平衡的原理,通过调节酸碱度来改变反应条件或提高溶液的稳定性。
强酸制弱酸的例子

强酸制弱酸的例子
1、硫酸:硫酸(H2SO4)作为一种强酸,与乙醇(CH3CH2OH)可以
形成乙醇硫酸盐(CH3CH2OSO3H)。
当电解强酸硫酸时,H+将结合
乙醇,形成像CH3CH2OH+H2O这样的组分,使得弱酸乙醇被分解,
从而可以制取弱酸。
2、硝酸:硝酸(HNO3)也是一种强酸,可以通过与弱酸滴定,使其
电离出H+离子,从而将弱酸分解释放,如将碳酸氢钠(NaHCO3)滴
定与硝酸,可形成碳酸钠(Na2CO3),同时释放出碳酸的H+离子,
达到强酸制弱酸的目的。
3、溴化物:溴化物(例如NaBr)也可以催化弱酸的水解,其原理是
将溴化物放入弱酸溶液中,溴离子会发生反应,当它与弱酸的H+离子
结合时,可以释放出H2O,从而达到将弱酸转换为无机盐的目的。
4、乙醛:乙醛(CH3CHO)也可以作为强酸来制弱酸,乙醛可以通过
催化氧化反应,将任何有机酸(例如,乙酸,其他醛甲烷)转化为无
机盐,同时释放出H+离子,使弱酸分解,从而形成盐。
5、醋酸及醋酸盐:醋酸(CH3COOH)能够与其他弱酸(例如乙酸)
发生缩合反应,从而使弱酸变成醋酸盐(乙酸乙酯CHHHCOOCH3),
从而将弱酸分解,实现强酸制弱酸的目的。
此外,醋酸盐也可以通过滴定与硝酸,使其发生水解,也可以发生强酸制弱酸反应。
强酸制弱酸

强酸制弱酸,指的是较强酸(可以是强酸或弱酸)可生成较弱酸。
所谓的强酸制弱酸,指的是较强酸(可以是强酸或弱酸)可生成较弱酸。
即:
强酸+弱酸盐→弱酸+强酸盐;
较强酸+弱酸盐→较弱酸+弱酸。
强酸制弱酸实质及原理是弱酸根与强酸反应,生成弱酸和强酸根的反应,也就是弱酸根夺取了强酸的氢离子。
强酸制弱酸是复分解反应一条重要规律。
这里的“强酸”、“弱酸”指相对的强弱,甚至能呈现酸性的一些非酸类物质,如酚类、两性氢氧化物、酸式盐等参与的反应也可据其酸性强弱运用上述规律来判断其产物。
强酸制弱酸的注意事项:
强酸是可以自主完全电离的酸,要指高锰酸、盐酸(氢氯酸)、硫酸、硝酸、高氯酸、硒酸、氢溴酸、氢碘酸、氯酸等。
它们都有强烈刺激和腐蚀作用,人体接触会造成严重烧伤,宜用清水冲洗或苏打水冲洗。
弱酸通常是指其电离常数(Ka)小于0.0001(酸度系数pKa大于4)的酸。
是指在溶液中不完全电离的酸。
如用常用HA去表示酸,那在水溶液中除了电离出质子H+外,仍有为数不少的HA在溶液当中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
强酸制弱酸(强强生弱)规律及应用
根据酸碱质子理论,凡能提供质子(H+)的粒子(离子或分子)都是酸(如HCl、HNO3、及酸式根离子HCO3-等),酸失去质子后生成的粒子则为该酸的共轭碱;凡能接受质子(H+)的粒子(离子或分子)都是碱(如NH3、NaOH、Ca(OH)2、及弱酸根离子CO32-等),碱得到质子后生成的粒子则为该碱的共轭酸。
酸和碱反应的实质是质子(H+)的转移。
反应的方向总是朝着生成更难电离的更弱的酸碱的一方进行的,即要符合“强酸制弱酸”或谓“强强生弱”规律,可简记为“左强右弱”。
2CH3COOH + CO32-=2CH3COO-+ H2CO3(CO2+H2O)
酸(强)碱(强) 新碱(弱) 新酸(弱)
[例] 已知下列反应能进行完全:
①Na2CO3 + 2CH3COOH =2CH3COONa + CO2↑+ H2O
②CO2 + H2O + C6H5ONa=C6H5OH + NaHCO3
③CH3COONa + HCl =NaCl + CH3COOH
④C6H5OH + Na2CO3=C6H5ONa + NaHCO3
则根据“左强右弱”规律可得:
失H+减弱,酸性减弱
酸( H+ ) HCl CH3COOH H2CO3C6H5OH HCO3-
碱Cl-CH3COO-HCO3-C6H5O-CO32-(OH-)
得H+增强,碱性增强
例如:已知多元弱酸在水溶液中电离是分步的,且第一步电离远大于第二步电离,第二步电离远大于第三步电离。
今有HA、H2B、H3C 三种弱酸,且已知下列各反应能发生:
①HA + HC2-(少量)=A- + H2C-
②H2B (少量)+ 2A-=B2- + 2HA
③H2B (少量)+ H2C-=HB- + H3C
试回答:
(1)相同条件下,HA、H2B、H3C 三种酸中,酸性由强到弱的顺序为H2B> H3C>HA;
(2)在A-、B2-、C3-、HB-、H2C-、HC2-离子中最易结合质子的是C3-,最难结合质子的是HB- .
(3)完成下列反应的离子方程式:
①H3C + 3OH-(过量)=C3- + 3H2O ;②2HA (过量)+ C3-=2A- + H2C-. [解] 由已知①式得HA>H2C-2B>HA,由③式得H2B>H3
步电离,电离度逐级锐减,可得相关微粒酸碱性强弱顺序表:
失H+减弱,酸性减弱
酸:(H+)> H2B > H3C > HB- > HA > H2C- >HC2-
碱:HB-< H2C-< B-< A-< HC2-< C3-< (OH-)
得H+增强,碱性增强
根据顺序表中上行酸的位置可得第(1)H2B> H3C HA>; 由表中下行碱的
位置可得第(2)题答案为C3- ; HB- .
在表中H3C位于OH-左上,据”左上右下可反应”得(3)①式的反应可以进行完全.据”
强强优先”原则可知随OH-用量的增加,H3C 反应的产物依次是H2C-、HC2-、C3-,因题给OH-为过量,所以H3C反应最后产物是C3-,故第(3)C3- + 3H2O;同理第(3)②题答案是2A- + H2C-.
练习:等物质的量浓度的两种一元弱酸(HA,HB)的钠盐溶液中,分别通入少量CO2后可发生如下反应:
①NaA + CO2 +H2O =HA + NaHCO3
②2NaB + CO2 + H2O =2HB + Na2CO3
试比较HB与HA酸性强弱。
答: HB的酸性比HA 弱
[解法提示] 从①式得: A-只能使H2CO3失去一个H+ 形成HCO3-, 从②式得B-则可使H2CO3失去两个H+ 形成CO32-.换句话,B- 结合H+的能力比A-强,HB电离出H+能力则比HA 弱,即HB酸性比HA弱。
酸性强弱顺序为:H2CO3 > HA > HCO3- > HB。
