植物根系酸性磷酸酶活性测定
实验四酸性磷酸酶Km及Vmax值测定

• 2、制作酶反应时间与产物生成量的关系曲线 • (目的:选取合适的反应时间)
管号
1
磷酸苯二钠 0.5
酶液
0.5
精确反应时间 3
碳酸钠溶液 2
酶液
-
Folin-酚溶液 0.5
加液程序表
2
3
4
5
6
0
0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5
5
10 15
20
根据双倒数法计算出Km及Vmax
Vmax [S]
V=
Km + [S]
三、实验步骤:
• 1、豆芽中的酸性磷酸酶的粗提取 • 2、制作酶反应时间与产物生成量的关系曲线 • 3、制作酚标准曲线 • 4、[S]与V0关系实验 • 5、双倒数作图法计算Vmax和Km
blank
buffer substrate enzyme
25
2
2
2
2
22
-
-
-
-
-
0.5
0.5 0.5
0.5 0.5 0.5 0.5
35℃保温10分钟 Folin-酚溶液已稀释好!
注: 进行酶促反应时,注意预热,使所有的反应在同等条件下开始
• 3、制作酚标准曲线
• (目的:可从酚标准曲线上查出A680nm所相 当的酚含量,并计算出反应速度(用每分钟 产物生成量来表示)
1.5
2.5
1/[S]
A 680
phenol content (酚含量) V0 (μmole phenol per min) 1/ V
0
1、酚含量从酚标准曲线上查得 2、V0 反应初速率( μmol/min)为酚含量除以酶反应时间(15分钟)。 3、双倒数作图法计算Vmax和Km
植物根系酸性磷酸酶活性测定
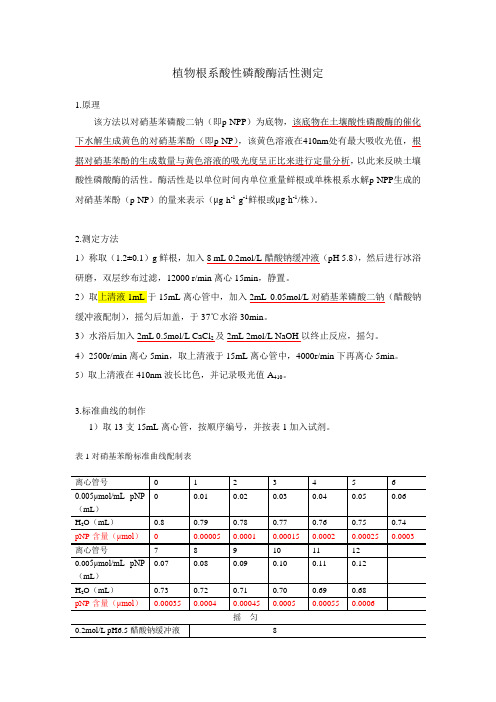
植物根系酸性磷酸酶活性测定1.原理该方法以对硝基苯磷酸二钠(即p-NPP)为底物,该底物在土壤酸性磷酸酶的催化下水解生成黄色的对硝基苯酚(即p-NP),该黄色溶液在410nm处有最大吸收光值,根据对硝基苯酚的生成数量与黄色溶液的吸光度呈正比来进行定量分析,以此来反映土壤酸性磷酸酶的活性。
酶活性是以单位时间内单位重量鲜根或单株根系水解p-NPP生成的对硝基苯酚(p-NP)的量来表示(μg·h-1·g-1鲜根或μg·h-1/株)。
2.测定方法1)称取(1.2±0.1)g鲜根,加入8 mL 0.2mol/L醋酸钠缓冲液(pH 5.8),然后进行冰浴研磨,双层纱布过滤,12000 r/min离心15min,静置。
2)取上清液1mL于15mL离心管中,加入2mL 0.05mol/L对硝基苯磷酸二钠(醋酸钠缓冲液配制),摇匀后加盖,于37℃水浴30min。
3)水浴后加入2mL 0.5mol/L CaCl2及2mL 2mol/L NaOH以终止反应,摇匀。
4)2500r/min离心5min,取上清液于15mL离心管中,4000r/min下再离心5min。
5)取上清液在410nm波长比色,并记录吸光值A410。
3.标准曲线的制作1)取13支15mL离心管,按顺序编号,并按表1加入试剂。
表1对硝基苯酚标准曲线配制表2)混匀后,在2500r/min 下离心5min ,再在4000r/min 下离心5min 以0号作为对照,在410nm 波长下测光吸收值,并记录光吸收值A 410。
3)以吸光值为横坐标、对硝基苯酚的含量为纵坐标计算直线回归方程y=a+bx 及相关系数R ,即对硝基苯酚含量410)(A b a mol n ⨯+=μ。
4.计算方法根系酸性磷酸酶活性是以单位时间内单位重量鲜根或单株根系水解p-NPP 生成的对硝基苯酚(p-NP )的量来表示(μg·h -1·g -1鲜根或μg·h -1/株)。
植物紫色酸性磷酸酶的研究进展

植物紫色酸性磷酸酶的研究进展作者:刘攀道黄睿许文茸罗佳佳陈志坚刘国道来源:《热带作物学报》2019年第02期摘; 要; 酸性磷酸酶(APase)是酸性条件下(pH < 7.0)能催化磷酸单酯或酸酐裂解从而释放无机磷酸根离子的水解酶类。
紫色酸性磷酸酶(Purple acid phosphatase,PAP)是一类特殊的酸性磷酸酶,其具有鲜明的特征,如:酶的提取液呈紫色或粉色、酶活性不受酒石酸盐抑制、氨基酸序列具有5个保守结构域和双金属离子催化中心等。
已有的研究表明,紫色酸性磷酸酶在植物适应低磷胁迫过程中发挥着重要作用。
本文综述了紫色酸性磷酸酶的生化特性、亚细胞定位、生物学功能以及最新研究进展。
关键词; 紫色酸性磷酸酶;有机磷;低磷胁迫;生物学功能中图分类号; Q945.78; ; ;文献标识码; A磷(phosphorus,P)是植物生长发育的限制性营养元素之一,参与植物的多种新陈代谢过程,如光合作用、能量传输、酶活性调节、膜磷脂与核酸的合成等[1]。
无机可溶性磷酸盐(inorganic phosphate,Pi)是植物根系能从土壤中吸收的主要磷形式,但在大多数耕作土壤中,Pi的浓度只有0.1~10 μmol/L,远低于植物最优生长所需的Pi浓度(1 mmol/L)[2]。
全球近70%的耕地存在有效磷缺乏问题,特别在酸性土壤中低磷胁迫尤为严重[3]。
虽然土壤中Pi浓度低,但土壤中存在大量的有机磷,约占土壤全磷含量的30%~65%,主要以植酸磷(肌醇六磷酸)、DNA(脱氧核糖核酸)、ATP(腺嘌呤核苷三磷酸)和糖磷酯等形式存在[4]。
有机磷难于被植物直接利用,只有被酸性磷酸酶降解后释放出的Pi才能被植物根系吸收[5]。
目前,已鉴定的参与植物适应低磷胁迫的酸性磷酸酶,主要属于紫色酸性磷酸酶(Purple acid phosphatase,PAP)家族[6]。
本文将从生化特征、亚细胞定位及生物学功能等方面,系统介绍植物PAP相关研究领域近年来取得的进展。
植物根系分泌有机酸的收集、分离及检测方法探析

植物根系分泌有机酸的收集、分离及检测方法探析摘要:根分泌物主要是以碳为基础的低分子化合物和高分子化合物。
植物分泌的有机酸主要有乙酸、草酸、柠檬酸、苹果酸、酒石酸和琥珀酸等, 它们调节细胞代谢, 为根际和微生物提供营养。
植物根系分泌有机酸的研究对于了解植物的根际效应具有重要的学术意义。
简述了根系分泌物有机酸的收集、分离和检测方法。
关键词:根分泌物; 有机酸; 收集; 分离; 检测;Abstract:Root exudates include low molecular compounds, high molecular compounds, and primarily carbon-based compounds. The organic acids secreted by plants are mainly acetic acid, oxalic acid, citric acid, malic acid, tartaric acid and succinic acid, which regulate cell metabolism and provide nutrients for the rhizosphere and microorganisms. The study of plant root exudates of organic acids has important academic significance for understanding the rhizosphere effects of plants. This paper briefly described the methods of collection, separation and detection of organic acids in root exudates.Keyword:root exudates; organic acid; collection; separation; detection;0、引言根际作为植物、微生物和土壤之间的交互作用区域, 是根-土界面微生态系统的物质基础和核心内容。
【精品】土壤磷酸酶活性的测定

【关键字】精品土壤磷酸酶活性的测定【摘要】在植物的土壤磷素营养中,有机磷化合物占有一定的比例,而有机磷往往要在土壤磷酸酶的酶促作用下,才能转化成为植物可能利用的形态。
所以,土壤磷酸酶的活性直接影响土壤中磷的有效性。
研究土壤的磷酸酶活性,对于弄清土壤中磷的转化过程、方向及强度具有重要意义。
磷酸酶根据PH不同,分为酸性磷酸酶、碱性磷酸酶和中性磷酸酶。
本文主要讲述磷酸酶的活性的测定。
【关键词】土壤磷酸酶活性碱性磷酸酶活性酸性磷酸酶活性中性磷酸酶活性pH5醋酸盐缓冲液pH7柠檬酸盐缓冲液pH9.4硼酸盐缓冲液标准曲线的测定酸性磷酸酶标准曲线的测定碱性磷酸酶标准曲线的测定中性磷酸酶标准曲线的测定【正文】在植物的土壤磷素营养中,有机磷化合物占有一定的比例,而有机磷往往要在土壤磷酸酶的酶促作用下,才能转化成为植物可能利用的形态。
所以,土壤磷酸酶的活性直接影响土壤中磷的有效性。
研究土壤的磷酸酶活性,对于弄清土壤中磷的转化过程、方向及强度具有重要意义。
1.酸性磷酸酶活性的测定(一)实验原理本法基于以磷酸苯二钠为基质,酶解释放出的酚,使其与氯代二溴对苯醌亚胺试剂反应生色。
用比色法测定出游离的酚量,用以表示酸性磷酸酶活性。
(二)试剂配制(1)0.5%磷酸苯二钠(用缓冲液配制);(2)pH5醋酸盐缓冲液;(3)氯代二溴对苯醌亚胺试剂:取0.125g 2,6-二溴苯醌氯酰亚胺,用10mL 96%乙醇溶解,贮于棕色瓶中,存放在冰箱里。
保存的黄色溶液未变褐色之前都可使用;(4)酚的标准溶液:酚原液——取1g重蒸酚溶于蒸馏水中,稀释至1L,贮于棕色瓶中;酚工作液——取10mL 酚原液稀释至1L(每毫升含0.01毫克酚);(5)甲苯;(6)0.3%硫酸铝溶液。
(三)实验步骤(1)标准曲线绘制取1、3、5、7、9、11和13mL酚工作液,置于50mL容量瓶中,每瓶加入5mLpH5醋酸盐缓冲液和4滴氯代二溴对苯醌亚胺试剂,显色后稀释至刻度,即得0.0002、0.0006、0.0010、0.0014、0.0018、0.0022和0.0026mg·g-1浓度的酚标准溶液梯度。
磷胁迫下大豆叶片及根系酸性磷酸酯酶酶谱的研究

一
种复 杂 的化合 物 , 具有 几种 同工 酶 , 常形成 聚合 体
发挥 作 用 。许 多研 究 者都 试 图找 出 A ae 性 与 Ps 活
酶含量在低磷处理 第 l 、0d 3 比对照 高, 0d 2 、0d均 酶谱 染 色 加深 和谱 带条数 的增加 , 明低磷 胁迫 增加该 酶活 性 , 高 说 磷
维普资讯
摹 童
.
。 .
■ 农业技市
磷 胁 迫 下 大 豆 叶 片 及根 系酸 性 磷 酸 酯 酶 酶 谱 的研 究 *
李 志刚 宋书宏 李瑞平 苏 辉
(. 1辽宁省农业科 学院, 阳 106 ; . 沈 1112 内蒙古 民族 大学, 通辽 0 84 ) 202
的生物 有 效性 。植 物 根 系分 泌 A ae 根际 土壤 中 Ps 是 A ae的主要 来 源 。在 低磷 胁 迫 下 , 际 A a Ps 3 根 Ps e的 活性 大大 增强 , 磷 亏缺 量越 多 , 际 A ae 活性 且 根 Ps 的
Ab t a t r 1 a t e h n e a d z mo r m f a i h s h t e sr c :I e ci c a g n y ga o cd p op aa 1 v s
K e r : i h s h ts y gdn y wo ds Acd p o p aae z mo Fl ,Ph s h r ssrs , ̄ y e op ou tes ban
植物酸性磷酸酶的研究进展
成各种 形态上 和生 理上 的适应 性来 获得 土壤 中的磷 叶片酸性 磷酸 酶 活性 进 行 玉 米磷 缺 乏 诊 断 时 发现 ,
素 。其 中高 效 利 用 磷 的生 理 方 面 的适 应 性 变 化 包 磷 缺乏 时 同一 部位 单位 面积 的叶 片酸性 磷酸 酶活性 括 : 系分泌 有机酸 和质 子酸化 土壤 l 、 泌酸性 磷 比磷 充 足时增 加 2 根 4分 ] ~3倍 。庞欣 等 _ 过分 根 处 理 】 通 酸酶水 解有 机磷 化 合 物 等 。酸 性 磷 酸 酶 是植 物 试 验研 究 了黄瓜部 分根 系供 磷对 根系 酸性磷 酸酶 活 结 分 体 和 土壤 中一 种 重要 的水 解 酶 , 它不 仅 在 植 物碳 水 性 的影 响 , 果表 明 : 根处 理后 不供磷 根 系 的酸 性
小分 子 、 无机 到有机 的转化 过程 。在 这一 过程 中 , 根
用 [ 。因此 , 入研 究 植 物及 土 壤 中的 酸性 磷 酸 酶 3 ] 深 世 界性 的缺磷 危机具 有重 要意 义 。
1 植 物体 内的酸 性 磷 酸 酶
酸性 磷酸 酶是 一 种 诱 导 酶 , 活性 受 植 物供 磷 其 植 物体 内的酸性磷 酸 酶 活 性 , 活性 增加 是 植 物 对 其
实验四 酸性磷酸酶Km及Vmax值测定
• 2、制作酶反应时间与产物生成量的关系曲线 • (目的:选取合适的反应时间)
管号
1
磷酸苯二钠
0.5
酶液
0.5
精确反应时间 3
碳酸钠溶液 2
酶液
-
Folin-酚溶液 0.5
加液程序表
2
3
4
5
6
0
0.5 0.5 0.5 0.5 0.5 0.5
Certain Time
Stop the reaction
Color developed
• 生化实验课老师:于晓虹 • 实验报告请交到讲台上来 • 酶液稀释 取上清液300微升,稀释
30倍,用大试管装
• 科代表 李博恒
1、磷酸酶原液的制备:
称取5g绿豆芽茎(去头去根),加入pH5.6的 HAC缓冲液2ml研磨成浆并静置30分钟。纱布过滤, 取1.8ml滤液,以6000rpm,离心20min,取上清。
Folin-phenol reagent
加液程序表
01 2 3 4 5 6 7 8 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 1 0.9 0.8 0.7 0.6 0.5 0.4 0.3 0.2 22 2 2 2 2 2 2 2 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5
实验四 酸性磷酸酶Km及 Vmax值测定
一、概述
酸性磷酸酶:
催化磷酸单酯的水解反应 存在于人的肝脏,前列腺等处 植物中以发芽的种子中含量最为丰富。
是生物体中重要的一种酶类,为某些疾病的检测 指标。
二、实验原理
磷酸苯二钠
酶液
苯酚 + 磷酸氢二钠
植物根系活力测定
实验三植物根系活力测定植物根系的作用主要有:(1)对地上部分支持和固定(2)物质的贮藏(3)对水分和无机盐类的吸收(4)合成氨基酸、激素等物质。
因此,根系活力是植物生长的重要生理指标之一,其测定方法主要有a-萘胺氧化法和氯化三苯基四氮唑(TTC)法。
实验目的:了解根系活力的生理意义;掌握a-萘胺氧化法,测定根系活力的原理与方法;实验原理:植物的根系可通过过氧化物酶氧化吸附在根表面的a-萘胺,生成红色的α-羟基-1-萘胺,沉淀于有强氧化力的根表面,使这部分根染成红色,该反应如右图。
根对α-萘胺的氧化力与其呼吸强度有密切关系。
据认为α-萘胺氧化过程是在过氧化物酶的催化下进行的,该酶的活力愈强,对α-萘胺的氧化力就愈强,染色也就越深。
所以可根据染色深浅半定量地判断根系活力大小。
如需对根活力进行定量测定,可根据α-萘胺溶液与根系接触一定时间后,α-萘胺的减少量来确定。
Α-萘胺在酸性环境中与对氨基苯磺酸和亚硝酸盐作用生成红色的偶氮染料,可用比色法测定α-萘胺含量,其反应如图。
在520nm波长处测定所生成的染料的吸光度值,即可求出a-萘胺的含量。
求出与根接触前后a-萘胺的含量,就可以求出根系对a-萘胺的氧化活力,从而测定出植物根系的氧化活力大小。
实验内容:1.定性观察(不做)从田间挖取水稻植株,用水冲洗根部所附着的泥土,洗净后再用滤纸吸去附在水稻根上的水分。
然后将植株根系浸人盛有25 μg/mL的a-萘胺溶液的容器中,容器外用黑纸包裹,静置24~36 h后观察水稻根系着色状况。
着色深者,其根系活力越大。
2.定量测定(1)a-萘胺的氧化挖出水稻植株,并用水洗净根系上的泥土,剪下它的根系,再用水洗,待洗净后用滤纸吸去根表面的水分,称2 g根放在100 ml三角烧瓶中。
然后加50 μg/ml的a-萘胺溶液与PBS(pH 7.0)等量混合液50 ml,轻轻振荡,并用玻璃棒将根全部浸入溶液中,静置10分钟,吸取2 ml溶液,测定α-萘胺含量[测定方法见下面(2)],作为试验开始时的数值。
土壤微生物量及土壤酶活性测定方法
2 土壤微生物量测定土壤微生物量(MB)是指土壤中体积小于5x103叩3的生物总量,但活的植物体如植物根系等不包括在内]。
它通过调控土壤中能量和养分循环以及有机物转化,来反映土壤同化和矿化能力。
土壤微生物生物量包括土壤微生物生物量碳、土壤微生物生物量氮、土壤微生物生物量磷和土壤微生物生物量硫,但一般情况下土壤微生物生物量的大小以土壤微生物生物量碳来表示。
2.1熏蒸浸提法2.1.1原理利用不同的浸提剂,通过氧化滴定法来测定土壤浸提液中有机C、N和P提取的可溶性有机碳含量和微生物量C之间存在较稳定的比例关系。
2.1.2则定步骤1.根据土壤样品含水量,调节土壤含水量为田间持水量的50%,25 ℃下密封培养10 d,以保持土壤均匀和不同地方所得结果的可比性。
2.氯仿熏蒸24 h后,用真空泵反复抽气,直到土壤闻不到氯仿气味为止。
根据所测对象不同选择不同的提取剂浸提,振荡浸提30 min后,立即分析浸提液中所测对象的含量或放入-15 ℃下保存。
表1指出氯仿熏蒸浸提法测定不同土壤微生物量所选用的浸提剂及其条件。
表1姓熏薪髓喉土就生帽条件Table I F'E fcrdieneasuirm aitcondiocnsof soilm riobialbmass土情即鄢Detemiia血cfhdicaMr Eitatnt土觥生醯K(=D,3S 或D.45土觥物1小K国加士躺蜘M恻般注®拓牖腌雄魂航觥刎楠融脑机装痴螭定雕耐帕帆小麒眼3 土壤酶活性测定土壤酶活性均用风干土壤。
土壤转化酶活性和过氧化氢酶活性、脲酶活性、磷酸酶活性依次用硫代硫酸钠滴定法、高锰酸钾滴定法、靛酚蓝比色法和磷酸苯二钠比色法测定(关松荫,1986)3.1脲酶一一靛酚蓝比色法脲酶的活性可以用来表示土壤供氮能力(一)方法原理土壤中脲酶活性的测定是以尿素为基质,酶促水解生成的氨与酚类化合物起反应生成蓝色的靛酚,颜色深度与氨含量相关,因而用于脲酶活性的测定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
植物根系酸性磷酸酶活性测定
1原理
该方法以对硝基苯磷酸二钠(即P-NPP)为底物,该底物在土壤酸性磷酸酶的催化
下水解生成黄色的对硝基苯酚(即p-NP),该黄色溶液在410nm处有最大吸收光值,根_
据对硝基苯酚的生成数量与黄色溶液的吸光度呈正比来进行定量分析,以此来反映土壤
酸性磷酸酶的活性。
酶活性是以单位时间内单位重量鲜根或单株根系水解p-NPP生成的
对硝基苯酚(p-NP)的量来表示(⑷h-1 g-1鲜根或口 g -1/i株)。
2•测定方法
1)称取(1.2 ±.1) g鲜根,加入8mL 0.2mol/L醋酸钠缓冲液(pH 5.8),然后进行冰浴研磨,双层纱布过滤,12000 r/min离心15min,静置。
2)取上清液1mL于15mL离心管中,加入 2mL 0.05mol/L对硝基苯磷酸二钠(醋酸钠缓冲液配制),摇匀后加盖,于 37C水浴30min。
3)水浴后加入 2mL 0.5mol/L CaCI 2及2mL 2mol/L NaOH 以终止反应,摇匀。
4) 2500r/min离心5min,取上清液于15mL离心管中,4000r/min下再离心5min。
5)取上清液在410nm波长比色,并记录吸光值 A410。
3•标准曲线的制作
1 )取13支15mL离心管,按顺序编号,并按表 1加入试剂
表1对硝基苯酚标准曲线配制表
2)混匀后,在2500r/min下离心5min ,再在4000r/min下离心5min以0号作为对照,
在410nm波长下测光吸收值,并记录光吸收值A410。
3)以吸光值为横坐标、对硝基苯酚的含量为纵坐标计算直线回归方程y=a+bx及相关系数R,即对硝基苯酚含量n( mol) a b A410。
4•计算方法
根系酸性磷酸酶活性是以单位时间内单位重量鲜根或单株根系水解p-NPP生成的对
硝基苯酚(p-NP)的量来表示(° h-1 g-1鲜根或口 g心株)。
即根系酸性磷酸酶活性(g h 1 g 1鲜根)n M 稀释倍数/(W t)
式中:n—标准曲线上查得样品中对硝基苯酚的浓度(卩mo);
M —对硝基苯酚的相对分子质量(139.11g/mol);
t —反应时间(h);
W—样品鲜重(g)。
稀释倍数一8
a.醋酸盐缓冲液(pH=5.0 )
A: 0.2mol/L 醋酸溶液(11.5mL,稀释至1000mL )
B: 0.2mol/L 醋酸钠溶液(16.4g C z H s O z Na 或27.2g C z H s O z Na - 3出0 定容至1000mL )
14.8ml A + 35.2ml B 混合即得。
