两种测定青霉素酰化酶活性的两种方法的比较
酶活性的测定方法

酶活性的测定方法
酶活性的测定方法有多种。
以下列举了常见的几种方法:
1. 酶动力学法:通过测定酶催化底物转化为产物的速率,来确定酶活性。
常用的酶动力学方法有初始速率法、双重倒数法、利用酶反应速率与底物浓度的关系等。
2. 比色法:利用酶与底物反应后产生的色素变化进行酶活性测定。
例如,过氧化物酶活性可通过测量其催化产生的有色产物浓度的变化来确定。
3. 荧光法:利用酶与底物反应后产生的荧光变化进行酶活性测定。
荧光法的灵敏度高,操作简便。
例如,酯酶活性可通过测量底物转化为产物后产生的荧光强度的变化来确定。
4. 放射性同位素法:将放射性同位素标记在底物上,通过测量酶催化底物与同位素的结合来确定酶活性。
例如,放射性同位素法可用于测定DNA聚合酶活性。
5. 电化学法:利用酶与底物反应后产生的电流变化进行酶活性测定。
常用的电化学方法包括循环伏安法和电化学阻抗法。
例如,葡萄糖氧化酶活性可通过测量产生的电流与葡萄糖浓度之间的关系来确定。
值得注意的是,不同酶具有不同的理化性质和催化机制,因此需要根据具体酶的
特性选择适合的测定方法。
羟胺法测定青霉素酶酶活的研究

数 据 重 复 性 好 、 操 作 过 程 简便 、 操 作 体 系 小 f 有 只
5 ) mL ,因此 比碘 量法 更有 优势 。
方法的原理是:青霉素在青霉素酶作用下降解 ,降 1 材料 与 方法 解产 物 青 霉 噻 唑酸 能 与碘 发 生 反 应 ,根 据 青霉 素 酶 11 试 验材料 .
图 1 青 霉 素 与 羟胺 反应 原 理
Fi . M e h n s o a t n b t e e ii i n g 1 cai m f e c i e r o we n p n cl n a d l h d o ya n y r x lmi e
吴 芝 清 【等 人 又 改 进 了羟 胺 法 ,增 加 了显 色 的稳 定 】 性 。青 霉素 酶 能够 分解 青 霉素 ,如 果青 霉 素 酶 的分
分解 青 霉 素 前后 消 耗 碘量 的差 值 ,计 算 出单位 时 间 内青 霉 素 降解量 ,进 而折 算 出青 霉素 酶 的 活性 。但
是碘 量 法 经 常受 到 其 他 因素 的 影 响 ,例 如 反应 过 程 02 mo/ 盐 酸羟 胺 :取 盐酸 羟 胺 17 7 , 以水 .5 l L .3 g
中图分类号:R 7 . 1 9 81
文献标识码:A
青霉 素酶属 于 B内酰胺 酶 ,可水解 青霉 素类 的1 . 3 . 内酰胺环 ,使 抗生 素失效 [。 目前 ,青霉 素酶 常用于 ”
解 产 物 既 不影 响 羟胺 与青 霉 素 的反 应 ,也不 影 响羟
肟 酸 与 三价 铁 离 子进 一 步 反 应 ,则 可 根 据单 位 时 间 内青 霉 素 酶反 应 前 后羟 胺 法 测 得 的青 霉 素含 量 的 差
36 l
紫外分光光度法用于青霉素酶活力测定的研究

紫外分光光度法用于青霉素酶活力测定的研究马韦钰1,马仕洪2*(1.烟台大学,烟台264000;2.中国食品药品检定研究院,北京100050)摘要 目的:建立紫外分光光度法测定青霉素酶活力,并研究中国药典青霉素酶活力单位与国际单位之间的关系。
方法:利用青霉素与青霉噻唑酸在232 nm处的吸光系数不同,分别在30 ℃和37 ℃下,于232 nm 处用紫外分光光度计监控青霉素酶与一定量青霉素的反应过程,通过反应时间计算青霉素酶的活力;同时用中国药典的碘量法进行测定。
结果:本文所用的紫外分光光度法测定结果与中国药典规定的碘量法相比无显著性差异(P=0.302>0.05)。
中国药典青霉素酶活力单位(U)与国际单位(IU)的换算关系为:1 U=4.4×107 IU+2.6×105。
结论:紫外分光光度法测定青霉素酶活力方法重复性好,操作简单,快速。
建立的中国药典青霉素酶活力单位与国际单位之间的关系使两者具有可比性。
关键词:青霉素酶;灭活剂;酶活力;国际单位;紫外分光光度法;药典方法中图分类号:R 917 文献标识码:A 文章编号:0254-1793(2017)06-1142-04doi:10.16155/j.0254-1793.2017.06.29Determination of penicillinase activity by UV spectrophotometryMA Wei-yu1,MA Shi-hong2*(1.Yantai University,Yantai 264000,China;2.National Institutes for Food and Drug Control,Beijing 100050,China)Abstract Objective: To establish a measuring method of penicillinase activity by UV spectrophotometry and to explore the relationship between penicillinase activity unit in Chinese pharmacopoeia and that in international standard.Methods:Since the absorbances of penicillinaces and penicillanic acid were different at 232 nm, the reaction between penicillinace and penicillinase was able to be monitored by ultraviolet spectrophotometer at 30 ℃ and 37 ℃.The value of penicillinase activity was calculated through the reaction time, and then compared with that of iodometric assay in ChP.Results: The results of UV spectrophotometry and iodimetric method had no significant difference (P=0.302>0.05).The relationship of Chinese pharmacopoeia unit of penicillinase activity (U)and international unit (IU) was 1 U=4.4×107 IU+2.6×105.Conclusion:The UV spectrophotometric method was simple, repeatable and rapid.It was comparable between penicillinase activity unit in Chinese pharmacopoeia and that in international standard.Keywords:penicillinase; inactivator;enzyme activity; international unit; UV spectrophotometry; pharmacopoeia method * 通信作者 Tel:(010)67095990;E-mail:mash@ 第一作者 Tel:185********;E-mail:mwyaq1002@青霉素酶在自然界的多细菌中广泛存在,能够水解青霉素类抗生素,是临床致病菌最重要的耐药机制之一[1]。
生化检验辅导:酶活性测定方法

20世纪50年代以前大都使用固定时间法。
这种方法是以酶催化反应的平均速度来计算酶的活性,现多已不用。
50年代中期开始采用连续监测法。
这种方法用自动生化分析仪上完成,可以测酶反应的初速度,其结果远比固定时间法准确,在高浓度标本尤为明显,但本法也受到反应时间,反应温度,试剂等的影响,应加以注意。
(1)定时法:(两点法)通过测定酶反应开始后某一时间段内(t1到t2)产物或底物浓度的总变化量来求取酶反应初速度的方法。
其中t1往往取反应开始的时间。
酶与底物在一定温度下作用一段固定的时间,通过加入强酸、强碱、蛋白沉淀剂等,使反应完全停止(也叫中止反应法)。
加入试剂进入化学反应呈色测出底物和产物的变化。
该法最基本的一点是停止反应后才测定底物或物的变化。
优点:简单易行,对试剂要求不高。
缺点:难保证测定结果的真实性。
难以确定反应时间段酶促反应是否处于线性期。
随着保温时间的延续,酶变性失活加速。
(2)连续监测法:又称为动力学法或速率法、连续反应法。
在酶反应过程中,用仪器监测某一反应产物或底物浓度随时间的变化所发生的改变,通过计算求出酶反应初速度。
连续监测法根据连续测得的数据,可选择线性期的底物或产物变化速率用于计算酶活力。
因此连续监测法测定酶活性比定时法更准确。
实际工作中,采用工具酶的酶偶联法已经成为应用最广、最频繁测酶活性浓度的方法。
(3)平衡法:通过测定酶反应开始至反应达到平衡时产物或底物浓度总变化量来求出酶活力的方法,又叫终点法。
2.按检测方法分类法:①分光光度法;②旋光法;③荧光法;④电化学方法;⑤化学反应法;⑥核素测定法;⑦量热法。
碱滴定法测定发酵液中青霉素酰化酶酶活

青霉素酰化酶除了在医药工业上 用于大规 模生产 - 内 酰胺类抗生素中间体和半合成 - 内 酰胺类 抗生素 之外 , 还 有其他的一些潜在应用 , 对青霉素酰化酶 的研究一 直吸引着 各国科 。公 式 : 酶活 ( IU / mL ) = ( ( V5 - V0 ) ∀ M ∀ 1000) / ( 5 ∀ V) , 式中 V 5: 样 品消耗 氢氧化 钠溶 液的毫 升 数 ( mL) ; V 0: 空白消耗氢氧化钠溶液的毫升数 ( mL) ; M : 氢氧化 钠溶液浓度 ( mol/ L) ; 5: 反应时间( min) ; V: 取样体积 ( mL) 。 2 4 线性范围 分别精密量取发酵液 ( 发 酵 30 h 样品 ) 1, 2, 3, 4, 5 mL 按照 上述方法进行检 测 , 结 果见表 1。 以取样 体积 与消耗氢氧化钠溶液 的量做 线型图 , 结果 表明所 取样品 酶活 量在 20~ 100 IU 范围内呈 良好线性 , 相关系数 0. 999 。 表1
线性实验结果
2 mL 0. 03 2. 01 1. 98 3 mL 0. 03 3. 08 3. 05 4mL 0. 02 4. 12 4. 10
mL
5 mL 0. 04 5. 06 5. 02
Y = ( 1. 02X - 0. 034R ) / 0. 999
2 5 重 复性
取发酵液 ( 发酵 30 h) 照 上述 方法重 复检 测 5 表 2 重复性实验结 果
NaOH V0 V5 V 5- V 0 线性方程 1 mL 0. 02 1. 00 0. 98
。在发酵 过程中 , 发酵 液的酶 活单位
是控制发酵 液质量的重要 指标 , 笔者发 现采用 碱液滴 定进行 酶活检测是行之有效的方法。 1 仪器和试剂 719S 型电位滴定仪 ( 带玻璃 pH 计 , 5 mL 滴定管 , 瑞士万 通公司产 ) ; 电子 恒 温水 浴 锅 ( 控温 25 , 上 海 电 子 水浴 锅 厂) ; 离心机 ( 北 京医 用离 心机 厂 ) ; 电动 搅拌 浆 ( 瑞 士万 通公 司) ; 二水合 磷酸氢二钠 ( 分析纯 , 天津市永大化学试剂公司 ) ; 氢氧化钠 ( 分析 纯 , 天津市 永大 化学 试剂公 司 ) , 青霉 素 G 钾 盐( 纯度 2 2 1 2 1 1 99. 0% , 中润公司生 产) ; 磷酸 ( 分析纯 , 天津市永大 化学试剂公司 ) 。 方法与结果 试剂溶液的配制 50 mmol/ L、 pH 7. 8 磷 酸 钠 缓 冲 液 将 17. 8 g
测定酶活性浓度的两大类方法
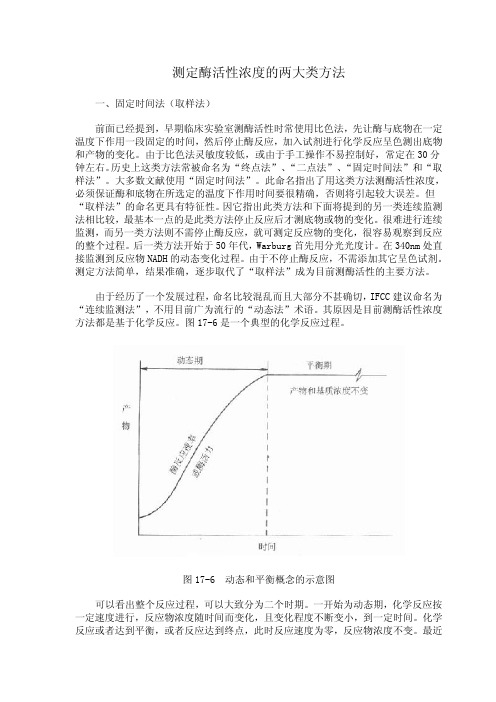
连续监测法具有众多的优点,随着科学技术的发展,自动生化仪的使用,正在逐 步取代“固定时间法”,发达国家从 50 年代到 70 年代末用了约 20 余年的时间,我 国从 80 年代初开始使用连续监测法,虽然发展很快,但至少仍有不少地区医院实验 室仍使用老的方法,就是已使用新法的实验室,也不一定掌握得很好,本节将比较详 细地从分类,酶偶联反应,测定注意事项等方面对连续监测法加以介绍。
当测定酶的反应速度明显大于指示酶,此时 A 很快转变为 B,由于指示酶反应慢, 中间产物 B 大量推积,最终产物产生速度明显慢于底物 A 的消失速度。
当指示酶速度加大后,中间产物 B 堆积减小,指示酶反应速率偏差程度也变小。 只有当指示酶大量 达到高峰后的时期),C 和 A 的变化速度非常一致。 也就是只有在些情况下,才是测定酶浓度的理想条件。
⒉间接连续监测法直接法试剂简单,操作方便,可惜的是只有当底物与产物之间, 在光学性质或其它理化性质有显著差异时,才有可能使用此法。到目前为止,大部分 酶都无法用直接法测定。
科学家还曾设法在原来反应体系中添加一些试剂,这些试剂必须不与酶作用也不 影响酶活性,同时又能与酶反应物迅速作用,产生可以被直接测定的物质,典型的例 子是 Ellman 的胆碱酯酶测定法,底物为硫代乙酰胆碱,酶水解产物硫代胆碱与添加 的二硫代硝基苯甲酸(DTNB)作用立刻生成黄色化合物,可在 412nm 用分光光度法连 续监测。
从理论上说,用酶偶联反应测酶活性浓度时,最好条件应是测定酶反应为限速反 应。动力学上为零级反应,而指示酶为一级反应,酶反应速度与指示酶底物浓度相关。
(二)指示酶、辅助酶的种类和浓度
指示酶、辅助酶的种类:常规化验中常用的酶偶联法中,多以脱氢酶为指示酶, 在常规化验中的自动分析仪几乎无一例外都有 340nm 波长,通过 NAD(P)H 系统可以很 方便地监测到指示酶反应。但从理论上说,往往可以有不止一种偶联方法,只要设法 使偶联反应中最后一个是指示酶反应,前面已提到测 CK 可以正向逆向二个方向建立 二种不同酶偶联的反应。又如在丙氨酸转氨基酶(ALT)测定法中,正向反应后产生 丙酮酸和谷氨酶,目前最常用的是用乳酸脱氢酶与丙酮酸偶联反应,伴有 NADH 下降。 但也可以用谷氨酸脱氢酶与谷氨酸作用,伴有 NADH 生成。
青霉素酰化酶的固定技术分析

青霉素酰化酶的固定技术分析作者:高磊来源:《中国科技博览》2014年第11期论文摘要:文章讨论了不同固定化技术的特点和固定化酶在非水相体系中的催化作用,并展望了固定化青霉素酰化酶的发展前景。
一、青霉素酰化酶的固定化方法固定方法的选择是酶与载体固定过程的关键步骤。
载体固定通常有吸附法、包埋法和共价偶联法;无载体固定法常用无载体交联酶和交联酶聚集体两种。
1 、载体固定法吸附法通过载体表面与酶表面次级键互相作用固定,可分为物理吸附和离子吸附。
物理吸附要求载体表面对蛋白质有高吸附性。
离子吸附是利用酶解离状态2、无载体固定法(1)交联酶晶体(CLECs)晶体晶格中蛋白质浓度接近理论极限,浓缩的蛋白形成晶体,通过戊二醛等多功能试剂将酶永久交联,分子中静电反应和疏水反应数量增加,明显增强了蛋白质的稳定性。
交联酶晶体可用于多肽合成、酶传感器、化妆品和洗涤剂等需要高稳定性和高活性蛋白质的领域,应用前景广泛。
(2)交联酶聚集体(CLEAs) CLEAs的活性和稳定性可与CLECs相媲美。
在CLEAs制备中,浓缩的酶蛋白会发生物理聚集而形成超分子结构,加入无机盐、有机溶剂或其他大分子试剂可使其聚集体沉淀析出,能保持酶的三维构象和活性。
再用多功能交联剂将该酶聚集体交联捆绑形成CLEAs。
CLEAs催化的高效转化率和高效可循环再利用的特点,有利于实现固定化青霉素酰化酶的工业应用价值。
二、不同菌属青霉素酰化酶的固定化条件不同菌属所产青霉素酰化酶可能对应不同的固定化条件。
大规模生产青霉素G酰化酶的菌种有巨大芽孢杆菌(Bacillus megaterium)、埃希菌属大肠埃希菌(Escherichia coli)、雷氏普罗威登菌(Providencia rettgeri)和粪产碱杆菌(Alcaligenes faecalis)等,尤以前两种最常见。
产青霉素V酰化酶的菌种多为淡紫链霉菌(Streptomyces lavendulae)、尖孢镰刀菌(Fusarium oxysporum)、球形杆菌(Bacillus sphaericus)和气单胞菌属(Aeromonas)等。
青霉素酰化酶的固定化与应用新进展

青霉素酰化酶的固定化与应用新进展在如今医疗体系发展的过程中,青霉素酰化酶已经被广泛的使用到了抗生素制备体系中,以及一些多肽合成体系中。
高效的青霉素酰化酶使用,能够最大限度的提升酶本身在PH值、溶剂极性、温度等各个方面适用效果大幅度提高,这实际上已经成为了青霉素酰化酶在如今工业体系中应用的关键。
本篇文章着重针对青霉素酰化酶的固定化以及应用进展进行了全面详细的探讨。
标签:青霉素酰化酶;载体;固定化;反应介质;固定化酶的应用青霉素酰化酶本身在实际使用的过程中,呈现出了良好的溶剂记性使用想以及反复使用的多方面稳定效果,由于这一特性的存在,使得青霉素酰化酶已经成为了工业体系的关键梭子啊。
下文主要是从载体选择固化以及应用的进展上来进行了全面详细的探讨。
1、载体形式1. 1有机高分子载体有机载体本身在实际使用的过程中,实际上具备了极为优秀的机械性强度,同时也完全可以通过产业化形式进行生产,天然性质的高分子载体在实际运行的过程过程中,表现出了极为优秀的传质性能、无毒性,被广泛使用到了壳聚糖、甲壳素之中。
由于其本身呈现出的有机分子有着较高的强度,但是在传质性能较差的情况下,例如聚丙烯酰胺、聚乙烯醇等一列的物质。
而从相关的研究结果来看,在针对高密度环氧结构体系下的载体固定,使用青霉素酰化酶执行了相应的处理之后又,催化活力所表现出的相关游离酶在这一过程中大幅度的提高,并且呈现出的重复使用稳定性也极强。
1.2无机分子载体在如今材料学持续发展的过程中,已经涌现出了孔分子筛形式的载体,其本身能够有效的对于高稳定的固化酶进行制备处理。
在使用了无机载体执行表面修饰以及酶固定的相关措施之后,其本身所表现出的相关性能实际上必然能够有较大幅度的提升。
某小组在进行课题研究的过程中,曾直接使用表面氨基形式的介孔二氧化硅材料,来针对青霉素酰化酶加以固定处理,其中呈现出的活力实际上直接达到了90%及以上,特别是在循环使用10次的催化处理之后,其中所表现出的活力实际上依然是维持在94%的水平上。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验方法和步骤
• NIPAB测定法
测定方法:含酶样品250ul加入在37℃恒温水浴锅内 预热的NIPAB溶液500ul中,反应4分钟,取出立即加入 95%乙醇500ul停止酶反应,反应液读OD405,记录消光 值。设空白对照
具体步骤
• 1 考察反应体系对酶活的影响:在温度、pH值不变的情况 下,改变反应体系,分别取5个NIPAB的浓度:0.18mg/mL、 0.36mg/mL、0.54mg/mL、0.72mg/mL、0.9mg/mL,测定不 同反应体系对NIPAB法测定青霉素酰化酶方法的影响。 • 2 考察温度对酶活的影响:在反应体系、pH值不变的情况 下,改变温度,分别取27℃、32℃、37℃、42℃、47℃、 52℃、57℃和62℃测定不同温度对NIPAB法测定青霉素酰 化酶方法的影响。 • 3 考察pH值对酶活的影响:在温度、反应体系不变的情况 下,改变pH值,分别取6.3、6.8、7.3、7.8、8.3、8.8测 定不同pH值对NIPAB法测定青霉素酰化酶方法的影响。
谢谢
何玲时操作比较繁琐,在计时的 同时还要滴加氢氧化钠溶液观察pH计上显示的pH值要维 持在8.0,实验操作需两个人相互协助进行,注意力需要很 集中,在稀释的时候也存在一定的误差,但是用碱滴定测 定青霉素酰化酶活性较NIPAB法更稳定,得到的数据较精 确,误差小。
中国计量学院现代科技学院
具体步骤
• 1 考察反应体系对酶活的影响:在温度、pH值不变的情况 下,改变反应体系,分别取5个PG的浓度:0.02mg/mL、 0.04mg/mL、0.06mg/mL、0.08mg/mL、0.1mg/mL和 0.2mg/mL测定不同反应体系对NIPAB法测定青霉素酰化 酶方法的影响。 • 2 考察温度对酶活的影响:在反应体系、pH值不变的情况 下,改变温度,测定25℃、30℃、35℃、40℃、45℃、 50℃和55℃时的酶活力的大小。 • 3 考察pH值对酶活的影响:在温度、反应体系不变的情况 下,改变pH值,分别取6.3、6.8、7.3、7.8、8.3、8.8测 定不同pH值对NIPAB法测定青霉素酰化酶方法的影响。
酶活力计算
• 酶活力定义为:在上述条件下,单位体积的游离青霉素酰 化酶在单位时间内催化底物PGK水解产生1µmol的6-APA 所需的酶量为1个酶活力单位U。 酶活力(U/L)=(VNaOH×MNaOH)/( V1×t)。 其中:VNaOH为NaOH消耗的体积数,mL MNaOH 为NaOH的物质量浓度,mol/L t 为测定时间,min V1游离酶的体积数,mL
实验数据和分析
NIPAB测定青霉素酰化酶活性时反应体系对酶活的影响
当NIPAB浓度等于0.54mg/mL时,活力达到最大即 4424U
pH值对青霉素酰化酶活性的影响
当pH值等于7.3时,活力达到最大即4984.U
温度对青霉素酰化酶活性的影响
当温度达到57℃时,酶的活力达到7945U
碱滴定测定青霉素酰化酶活性时反应体系对酶活的影响
中国计量学院现代科技学院
两种测定青霉素酰化酶 活性的方法的比较研究
姓名:何玲燕 班级:生工072 学号:0730551221 导师:朱丽云
主要内容
• • • • 1.青霉素酰化酶的研究概述 2.青霉素酰化酶的研究意义 3.实验方法和步骤 4.实验数据和分析
青霉素酰化酶的研究概述
• 国内外研究概况
当PG浓度达到0.1mg/mL时,酶的活力达到7293U
温度对青霉素酰化酶活性的影响
当温度达到55℃时,酶的活力达到7571U
pH值对青霉素酰化酶活性的影响
当pH值等于7.5时,活力达到最大即6538U
两种方法的比较分析
• 1 NIPAB法操作简便,反应迅速,灵敏,但是在测定过程 中,首个步骤的稀释过程中存在很大误差,由于菌液中的 菌体不溶于菌液,会沉淀下来,振荡器并不能完全使其振 荡开来,所以在稀释后取250uL的溶液到EP管中时的误差 很大;反应过程中菌液中含有未离心掉的菌体细胞,会影 响测定结果;反应完毕后加乙醇终止反应时,乙醇并不能 使反应完全的终止,反应可能还在继续,结果不稳定,所 以测定出来的结果也存在误差。
碱滴定测定法
将盛有20mL样品稀释液的反应器放入37℃水浴中待 用,加5mL pH 7.8的PB,开始搅拌,用0.1 mol/L氢氧化钠调 pH值至8.0后,开始滴定并用秒表计时,维持pH为8.0,记录 11 min消耗氢氧化钠溶液的毫升数(V11)。加入25 mL已预 先调pH值7·8、温度为37.0℃、10%青霉素G钾盐溶液,开 始滴定并计时,调整电位滴定仪参数使pH维持在8.0,记录11 min消耗氢氧化钠的毫升数(V11)。
青霉素酰化酶的物理性质
• 青霉素G酰化酶(简称PGA)是β-内酰胺类抗生素工业中最为 关键的酶。在偏碱性环境下,PGA能够催化青霉素G水解产生 。 6-氨基青霉烷酸(6-APA),6-APA是半合成青霉素的关键中间 体。在酸性或中性环境下,PGA则可以催化β-内酰胺抗生素母 核6-APA、7-ADCA或7-氨基头孢烷酸和苯乙酸类似的酰基供体 发生酰基化反应,制备半合成抗生素。 • 根据它们各自催化水解反应时对底物的优先性不同,将它们分 为主要的三大类: 1. 青霉素G酰化酶(PGA) 2. 青霉素V酰化酶(PVA) 3. 苄基青霉素酰化酶(APCA)
青霉素酰化酶的应用
• 1在催化水解中的应用 • 2在合成β-内酰胺类抗生素中的应用 • 3在对映体拆分中的应用 • 4在多肽合成中的应用
青霉素酰化酶研究意义
监测青霉素酰化酶的方法多种多样。到目前为止,仍 然没有一种既准确又快速地检测青霉素酰化酶活性的方法。 本论文将采用滴定法和NIPAB法比较研究粪产碱青霉 素酰化酶的性质及其影响因素,包括温度、pH值以及有反 应体系的影响等,试图寻找每种方法的优势和注意点,为 监测青霉素酰化酶提供一点帮助。
酶活力计算
酶活(IU/mL)=((V11-V1)×M×1000)/(10×V) 式中: V11 V11:样品第十一分钟消耗氢氧化钠溶液的毫升数(mL); (mL); V1:第一分钟消耗氢氧化钠溶液的毫升数(mL); M:氢氧化钠溶液浓度(mol/L); 10:反应时间(min); V:取样体积(mL)。
我国从七十年代开展了青霉素酸化酶的研究和生产。 大多数采用NIPAB法(3一苯乙酞胺基一6一硝基苯甲酸法) 和碱滴定法测定酶活性。目前世界上许多国家在青霉素酞 化酶的活性测定中还使用PDAB法(对一二甲胺基苯甲醛法)。 由于测定方法不同。国内外酶活性水平很难比较。本文叙 述碱滴定法和NIPAB检测法测定酶活性。
