最新临床试验项目培训
2024年药物临床试验培训资料

05
药物临床试验质量控制与 风险管理
质量控制体系建设及运行机制
建立完善的组织架构
设立专门的质量管理部门,明确各部 门职责,确保临床试验全过程的质量 控制。
制定详细的管理制度
制定临床试验质量管理制度和操作规 程,确保各项工作有章可循、有据可 查。
强化人员培训
对参与临床试验的人员进行系统的培 训和考核,提高其专业素养和操作技 能。
的确定提供依据。
III期临床试验
治疗作用确证阶段。其 目的是进一步验证药物 对目标适应症患者的治 疗作用和安全性,评价 利益与风险关系,最终 为药物注册申请的审查
提供充分的依据。
IV期临床试验
新药上市后应用研究阶 段。其目的是考察在广 泛使用条件下的药物的 疗效和不良反应,评价 在普通或者特殊人群中 使用的利益与风险关系 以及改进给药剂量等。
试验设计和实施技能
培训内容包括试验设计、样本量计算、数据收集 和处理等,通过理论讲解、实践操作等方式进行 培训。
数据管理和分析技能
培训内容包括数据管理、统计分析、结果解读等 ,通过软件操作演示、实例分析等方式进行培训 。
团队协作和沟通能力提升
团队协作意识培养
通过团队建设活动、角色扮演等 方式,增强团队成员之间的协作
遵守国家相关法律法规和伦理规范,如《 药物临床试验质量管理规范》、《涉及人 的生物医学研究伦理审查办法》等。
受试者权益保护
知情同意
确保受试者在参与临床试验前 充分了解试验的目的、方法、 风险和潜在益处,并自愿签署
知情同意书。
隐私保护
严格保护受试者的个人隐私和 试验数据,确保受试者的个人 信息不被泄露或滥用。
安全保障
确保受试者在临床试验过程中 的安全得到保障,采取必要的 措施预防和处理试验相关的不 良事件。
2024年临床试验管理培训资料

数据收集方法与标准操作规程
标准操作规程(SOP) 制定详细的数据收集SOP,包括数据收集、录入、核对和存储等步骤。
定期审查和更新SOP,确保其与实际工作流程相符。
数据处理流程和质量保证措施
数据清洗
检查数据完整性、一致性和合理性,处理缺失值和异常值。
数据转换
根据分析需求,对数据进行适当的转换和编码。
伦理委员会审查流程
提交申请
研究者向伦理委员会提交临床试验申 请,包括试验方案、知情同意书等。
02
审查准备
伦理委员会对申请进行初步审查,确 定是否需要补充材料或进行现场核查 。
01
持续监督
对已经批准的临床试验进行持续监督 ,确保试验过程符合伦理和法规要求 。
05
03
会议审查
召开伦理委员会会议,对申请进行深 入讨论和审查,评估试验的伦理合理 性和法规符合性。
THANKS
感谢观看
内部审核和外部监管要求
内部审核
建立内部审核机制,对临床试验全过程进行定期或不定期 的审核,确保试验过程符合相关法规和指导原则,及时发 现并纠正问题。
外部监管
接受药品监督管理部门等外部机构的监管和检查,配合提 供必要的文件和资料,确保临床试验的合规性和真实性。
与外部机构沟通合作
积极与药品监督管理部门、伦理委员会等外部机构沟通合 作,及时了解政策法规变化和要求,确保临床试验的顺利 进行。
临床试验管理重要性
01
02
03
保障受试者权益
通过规范的管理,确保受 试者的安全和权益得到充 分保障,避免或减少不良 事件的发生。
提高试验质量
通过统一的标准和流程, 提高临床试验的规范性和 科学性,保证试验数据的 真实、可靠和可重复性。
药物临床试验 医学培训

药物临床试验医学培训
药物临床试验是一种医学研究方法,旨在评估新药或新疗法的安全性和有效性。
在进行药物临床试验之前,研究人员需要对参与试验的医生和研究人员进行医学培训。
医学培训的内容通常包括以下方面:
1. 临床试验的伦理和法律要求:医生和研究人员需要了解临床试验的伦理和法律要求,包括知情同意、隐私保护、数据安全等。
2. 药物的药理学和毒理学:医生和研究人员需要了解试验药物的药理学和毒理学,包括药物的作用机制、药代动力学、毒副作用等。
3. 试验设计和方法:医生和研究人员需要了解试验的设计和方法,包括试验的目的、纳入和排除标准、随机分组、盲法设计等。
4. 临床试验的质量控制:医生和研究人员需要了解临床试验的质量控制,包括试验数据的收集、整理、分析和报告等。
5. 不良事件的报告和处理:医生和研究人员需要了解不良事件的报告和处理程序,包括不良事件的定义、报告的时限、处理的原则等。
通过医学培训,医生和研究人员可以更好地理解药物临床试验的要求和流程,提高试验的质量和安全性,保障受试者的权益。
2024年gcp培训计划

2024年gcp培训计划一、背景介绍随着全球医药行业的发展,临床试验在新药研发过程中的重要性日益凸显,良好的临床试验实践(GCP)已经成为医药研发领域不可或缺的一部分。
GCP是指在进行临床试验时,按照一定的标准和规范,保证试验数据的真实、完整和可靠,从而保障试验结果的准确性和科学性。
因此,对临床试验相关人员进行GCP培训是十分重要的,可以提高临床试验的质量和效率,促进医药研发的进步。
二、培训目标1.了解临床试验的基本概念和原则,掌握GCP的相关要求和规范;2.熟悉相关法规和指导文件,了解临床试验的伦理和合规要求;3.掌握临床试验实践中的各项操作流程和技能;4.提高临床试验相关人员的专业素养和责任意识,确保试验数据的真实性和可靠性。
三、培训内容1.临床试验概述(1)临床试验的定义和分类;(2)临床试验的伦理与合规要求;(3)临床试验的过程和流程。
2.GCP基础知识(1)GCP的基本原则;(2)试验药品的管理;(3)试验数据的收集和记录;(4)试验材料的储存和运输。
3.试验人员培训(1)试验人员的资质要求;(2)试验人员的责任及分工;(3)试验人员的专业素养和技能培养。
4.临床试验监管(1)监督机构的角色和职责;(2)临床试验的监督和审核。
5.案例分析培训结束前进行一些真实案例的分析和讨论,让学员更好地理解GCP的要求和应用。
四、培训方式1.理论讲授通过专家讲解、讨论、研讨等形式,传授基本概念、原则和要求。
2.实践操作通过模拟实验和实际操作,提高试验人员的实际操作能力。
3.专题讲座邀请医药研发领域的专家,就临床试验相关热点问题进行专题讲座。
4.考核评估对培训学员进行期末考试和评估,确定培训效果。
五、培训师资本次培训将邀请具有丰富临床试验实践经验的专家学者和行业精英进行讲授,确保培训质量和效果。
六、培训对象1.临床试验专业人员2.医药研发相关从业人员3.临床试验监管人员4.医疗机构管理人员七、培训时间和地点本次培训将于2024年下半年举行,具体时间和地点将视实际情况而定。
临床试验项目培训计划

临床试验项目培训计划一、前言临床试验是一项十分重要的医学研究活动,它涉及到人体健康和安全,因此在临床试验项目中最高的程度上要求的是严谨和规范。
为了确保临床试验项目的顺利进行以及研究结果的准确性和可靠性,建立一个完善的培训计划至关重要。
本文将详细介绍临床试验项目的培训计划,以期为临床试验项目的参与者提供全面的指导和支持。
二、培训目的1.了解临床试验项目的背景和意义,增强参与者的责任感和使命感;2.掌握临床实验项目的基本知识和流程,提高参与者的工作效率和质量;3.加强参与者对临床试验项目的规范性和可靠性的重视,降低试验风险。
三、培训内容1.临床试验项目基本知识(1)临床试验项目的定义和分类(2)临床试验项目的背景和意义2.临床试验项目流程(1)临床试验项目的立项与规划(2)临床试验项目的实施与监督(3)临床试验项目的数据收集与分析(4)临床试验项目的结果报告与申报3.临床试验项目的质量管理(1)临床试验项目的监督和审核(2)临床试验项目的数据管理(3)临床试验项目的风险评估和控制4.临床试验项目的伦理道德(1)临床试验项目的伦理标准(2)临床试验项目的保护措施(3)临床试验项目的数据安全与隐私保护四、培训方式1.集中培训集中培训主要是通过课堂式教学,由资深专家和学者进行授课,参与者可以在课堂上直接与讲师进行互动交流,加深对临床试验项目知识的理解。
集中培训通常可以举办一次或多次,以满足不同参与者的培训需求。
2.视频培训视频培训是通过录制视频教学内容,让参与者可以在合适的时间和地点进行学习。
视频培训可以随时随地进行学习,特别适合长期或异地参与的人员。
3.现场实践现场实践是指将参与者直接引入临床试验项目的实际工作环境中,由项目组成员亲自指导和辅导,让参与者通过观摩和参与实际操作进行学习。
五、培训评估为了评估培训效果,可以采取以下几种方式:1.知识测试在培训结束后,可以对参与者进行临床试验项目知识的考核,以检验其是否掌握了培训内容。
临床项目培训计划方案

临床项目培训计划方案1. 培训目标本次临床项目培训计划的目标是培养临床项目管理人员的综合素质,包括临床试验管理、团队协作能力、沟通能力等,提高其在临床项目管理中的能力和水平。
通过培训,使员工掌握项目管理的基本理论和技能,提高临床项目管理的水平和效率,为公司临床项目的推进提供有力保障。
2. 培训内容本次培训的内容涵盖临床项目管理的基本知识和技能,包括但不限于以下内容:•临床试验概述•临床项目管理原则和方法•临床项目管理软件的应用•临床试验风险管理•团队管理和协作能力培养•临床试验监督与质量保证•沟通技巧和危机处理能力•临床试验伦理和法律法规3. 培训方式本次培训将采取多种方式相结合的形式进行,包括但不限于以下方式:•理论课堂培训•案例分析•角色扮演•实地参观•讲座•互动讨论•小组讨论4. 培训时间和地点培训时间暂定为一周,具体时间安排视参训员工的实际情况而定。
地点可选择公司内部培训室或外部专业培训机构。
5. 培训师资培训师资力量将由公司内部临床项目管理领域的专家和资深从业者,以及外部专业培训机构的专业人士组成,确保培训内容的质量和有效性。
6. 培训评估为确保培训效果,将进行多种形式的培训评估,包括但不限于以下方式:•课后作业•期末考试•培训效果跟踪•员工反馈问卷7. 培训后跟踪培训结束后,将建立员工的档案,定期开展专业培训,加强对临床项目管理知识和技能的巩固和更新,促进员工的职业发展和公司业务的发展。
8. 预算安排本次培训的预算主要包括以下方面的支出:•培训场地租赁•培训师资费用•培训教材费用•培训设备费用•员工交通、食宿费用•其他杂费9. 安全保障为确保培训期间的安全与健康,公司将做好培训场地的安全检查,制定灾难应急预案,提供必要的急救设备和医务保障。
10. 总结临床项目的管理对于公司的发展非常重要,因此,培训计划的制定和实施对于公司的未来发展具有重要的意义。
通过本次培训,我们相信员工的临床项目管理能力会得到显著提升,为公司的临床项目管理工作打下坚实的基础。
2024年度医疗器械临床试验质量管理规范培训

2024/2/2
1
目录
2024/2/2
• 临床试验质量管理规范概述 • 医疗器械临床试验前准备 • 医疗器械临床试验过程管理 • 医疗器械临床试验质量控制方法 • 医疗器械临床试验结果评价与报告撰写 • 医疗器械临床试验法规政策解读
2
01
临床试验质量管理规 范概述
6
02
医疗器械临床试验前 准备
2024/2/2
7
临床试验计划制定
01
02
03
04
确定试验目的、设计类 型、样本量及评价指标
2024/2/2
制定详细的试验流程和 时间表
评估可能的风险和制定 应对措施
明确数据管理和统计分 析方法
8
研究团队组建与培训
01
02
03
04
选拔具备相关专业背景和资质 的研究人员
12
试验数据采集、记录与保存要求
数据采集
确保数据采集的准确性和 完整性,采用规范的数据 采集工具和方法。
2024/2/2
数据记录
对试验过程中的所有数据 进行详细记录,包括受试 者信息、试验操作、试验 结果等。
数据保存
建立规范的数据保存制度 ,确保数据的安全性和可 追溯性。
13
安全性监测及不良事件处理流程
2024/2/2
26
THANKS
感谢观看
2024/2/2
27
22
06
医疗器械临床试验法 规政策解读
2024/2/2
23
国内外相关法规政策概述
国内医疗器械临床试验相关法规
包括《医疗器械监督管理条例》、《医疗器械临床试验质量管理规范》等,对 医疗器械临床试验的各个环节进行了详细规定。
临床试验项目管理培训课件
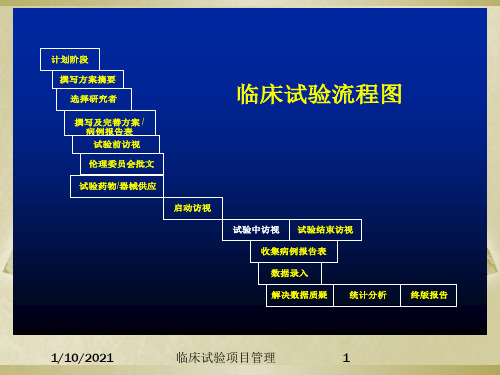
1/10/2021
临床试验1项3 目管理
文件管理(3)
试验结束阶段
试验用药的回收和销毁 CRF的回收及数据的质疑 试验文件完整性的确认 伦理委员会的通报 临床试验的报告
1/10/2021
临床试验1项4 目管理
临床试验项目管理要素
文件管理
进度管理
质量管理 风险管理 1/10/2021
临床试验1项5 目管理
Have blood pressure and heart/pulse rate been taken at this visit?
No
Yes
Please record the results in the Vital Signs Log at the
end
of the CRF.
Is there any clinically significant abnormality?
病史(患病时间等) 目前身体状况、伴随疾病和用药 近期停止用药时间(满足方案要求) 受试者参加临床试验号/签署知情同意书 访视日期 实验室/X-线等结果 试验用药数量及伴随治疗记录
1/10/2021
临床试验9项目管理
1/10/2021
临床试验1项0 目管理
Protocol 265805/249
批文(CFDA批文、伦理委员会批件及其成员) 签字合同(研究者合同、财务规定) 试验器械药品器械接收单和检测报告 实验室文件(正常值范围、质控证明) 研究者简历、研究者授权表及相关文件
1/10/2021
临床试验5项目管理
临床试验方案:
方案的形成过程中需申办者 与研究者讨论,并严格遵守 中国注册法规要求。
计划阶段 撰写方案摘要 选择研究者
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医学的进步是以研究为基础的,这些研究在一定程度上
最终有赖于以人作为受试者的试验 。
--《赫尔辛基宣言》
相关国际法规的发展历程-6
1947 年的纽伦堡审判
骇人听闻的纳粹实验暴露给公众 23 名纳粹医生 受到了战争罪行的审判
一名波兰证人在法庭展示了气性坏 疽实验给腿部留下的伤疤
1974 年,美国国会任命了一个国家委员会,以保护参加临 床研究的受试者
审核临床研究的伦理原则 :
自主性 受益性 公正性
相关国际法规的发展历程-13
WHO 生物医学研究国际伦理指导原则
日内瓦, 1993 年
15 项指导原则 ,涉及广泛,包括 :
受试者知情同意 选择研究对象 资料的保密 意外伤害的补偿 伦理委员会的工作程序 申办者及所在国的义务
我国新药管理与GCP发展概况
我国新药管理与GCP发展概况-1
1963年卫生部、化工部、商业部《关于药政管理的若干规定》
是我国最早关于药品临床试验的规定;
1965年卫生部、化工部《药品新产品管理暂行规定》; 1978年国务院《药政管理条例》; 1979年卫生部《新药管理办法》; 1985年《中华人民共和国药品管理法》; 1985年卫生部《新药审批办法》标志我国的新药管理进入法制
纳粹医生 Karl Brandt 被 判处死刑
相关国际法规的发展历程-7
1948 年颁布了纽伦堡法典
目的是为了防止纳粹实验这类暴行的再现; 受试者的参加必须出于自愿 ( 知情同意 ); 实验的进行必须有强有力的科学依据; 不允许对受试者造成肉体或精神上的损害或伤害 (do no
harm ); 在试验进行中的任何时间受试者有权退出 。
相关国际法规的发展历程-11
在美国科学研究的不当行为案例
Willowbrook 州立学校:患有智力发育迟缓的儿童被接种了 肝炎病毒 (1957)
犹太慢性病医院:终末期的患者给予活癌细胞 接种 (1963) Tuskegee 试验:阿拉巴马的一组美国黑人患了梅毒后多年
未予以治疗 (1930–1970)
过去 50 年中,在伦理上和科学上提高了临床研究的质量 减少了科学研究中的不当行为; 统一了相关的法规,从而促进了临床研究的全球化进程; 促进了许许多多治疗人类疾病的新药的开发,延长了寿命并
提高了生活质量 。
青霉素 Alexander Fleming 1941
阿司匹林 Felix Hoffman 1900
草我国GCP;
1993年至今卫生部修改并颁布了28类药物的临床试
其制定考虑到了不同组织和地区的现行标准,包括欧盟、日 本、美国、澳大利亚、北欧国家和世界卫生组织 (WHO)
ICH-GCP 涵盖了以下三个方面的内容 :
保护受试者 试验的科学性 数据完整真实性
相关国际法规的发展历程-15
在人体中使用研究药物的管理规定
相关国际法规的发展历程-16
国际管理法规对临床研究的影响
相关国际法规的发展历程-17
总结
在 1906 年以前对药品没有相关法规; 纳粹所做的实验警示了科学界需注意不符合伦理 道德的研究; 纽伦堡法典确立了人体研究需有受试者知情同意 的概念; 赫尔辛基宣言提出了研究方案获得独立的伦理委 员会批准的概
念; FDA 提出了临床试验质量管理规范的概念; ICH 提供了临床研究中的全球性指导原则。
最著名的生物医学研究的国际管理规范; 规定了在人体进行研究的基本原则和依据; 提出了以下概念:
研究方案由独立的伦理委员会批准; 研究者应对受试者的医疗照顾负责; 书面知情同意。
1975 年在东京,1983 年在意大利,1989 年在香
港 ,1996 年在南非,2001 年在爱丁堡曾对内容做 了多次修订。
来自不同国家的 150 名代表审核了这份文件(包括卫生部长、
科学家、医生、伦理学家、哲学家、律师等)
为发展中国家如何进行临床研究提出建议
相关国际法规的发展历程-14
国际协调会议 (ICH) – 1996 年
临床试验规范的国际性指导原则为欧盟、日本 和美国的临床 研究提供了统一的标准,以促进相互间接受临床研究的结果
相关国际法规的发展历程-8
反应停的悲剧
1950 ~ 1960 年间,在欧洲、加拿大和拉丁美洲的数千名 儿童出生时患先天发育异常;
他们的母亲在妊娠时服用了酞胺哌啶酮(反应停); 在 300 个人中进行了上市前研究,研究者并未发现毒性作用; 消费者对此事件的关注影响到美国国会,在 1962年颁布了
化时期;
1988年卫生部《关于新药审批管理若干补充规定》,同时颁发
了15类药物的临床试验指导原则;
1992年卫生部《关于药品审批管理若干问题的通知》。
我国新药管理与GCP发展概况-2
1983年、1986年和1990年,卫生部先后分三批批准
了35个临床药理基地,包括114个专业科室。
1998年对原有的临床药理基地进行评估后,重新确认
一项新法律, Kefarver-Harris 修正案,对新药物的批准制 订了更严格的安全与疗效方面的要求。
相关国际法规的发展历程-9
反应停的悲剧
反应停 (酞胺哌啶酮 )在1954年 WHO做为催眠药物注册
由于在妊娠期服用酞胺哌啶酮导致 的先天畸形
相关国际法规的发展历程-10Байду номын сангаас
世界医学协会赫尔辛基宣言 1964 年,芬兰
和批准了临床药理基地(化学药)83个,包括379个 专业科室;先后批准了中药药理基地32个,包括164 个专业科室。总计115个临床药理基地,543个专业科 室。
2004年对药物临床试验机构重新进行资格认定 。
我国新药管理与GCP发展概况-3
1992年我国派员参加WHO组织GCP定稿会并酝酿起
相关国际法规的发展历程-12
1977 年,美国 FDA 颁布了联邦管理法典
针对在美国进行的临床研究的管理法规 提出了 " 临床试验质量管理规范 (GCP) " 和 " 数据 完整性 "
的概念
1978 年 , Belmont 报告(美国国家委员会为保护参加生物医学和
行为学研究的人体实验对象而制定的道德原则和准则)
