物质的量一对一讲义
物质的量高考复习讲义
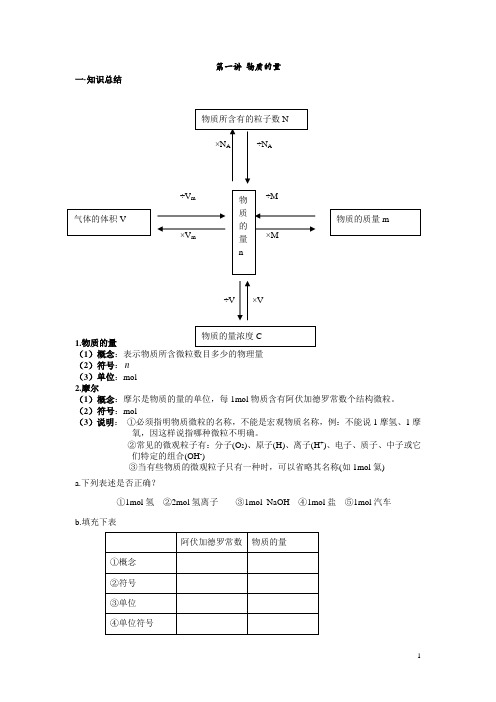
第一讲物质的量一·知识总结÷V m×V m÷V ×V1.物质的量(1)概念:表示物质所含微粒数目多少的物理量(2)符号:n(3)单位:mol2.摩尔(1)概念:摩尔是物质的量的单位,每1mol物质含有阿伏加德罗常数个结构微粒。
(2)符号:mol(3)说明:①必须指明物质微粒的名称,不能是宏观物质名称,例:不能说1摩氢、1摩氧,因这样说指哪种微粒不明确。
②常见的微观粒子有:分子(O2)、原子(H)、离子(H+)、电子、质子、中子或它们特定的组合(OH-)③当有些物质的微观粒子只有一种时,可以省略其名称(如1mol氦)a.下列表述是否正确?①1mol氢②2mol氢离子③1mol NaOH④1mol盐⑤1mol汽车b.填充下表c.比较0.5molO 2与6.02×1022个O 2分子所含分子数的多少。
3.阿伏加德罗常数(1)含义:实验测定0.012kg 12C 中所含碳原子的个数 (2)符号:N A (3)单位:个/mol(4)说明:①N A 的基准是12g 碳-12中的原子个数②12C 不仅是摩尔的基准对象,而且还是相对原子质量的基准 ③N A④要注意N A 与6.02×1023的区别(5)公式:n=ANN1mol 任何粒子的粒子数(对应的微粒)叫做阿伏加德罗常数,约为6.02×1023个。
1摩尔 氧原子 1N A 约为6.02×102个 1摩尔 水分子 1N A 约为6.02×102个 1摩尔 氯离子1N A 约为6.02×102个0.1 mol H 2中,含有 mol H mol 电子。
2 mol CH 4中,含有 mol C , mol H , mol 共价键。
3.01×1023个H 2O 中,含有 mol H , mol O , 电子。
0.1 mol Na 作还原剂时,失去的电子数是 个。
物质的量一对一辅导

1.物质的量物质的量是国际单位制中七个基本物理量之一。
1971年,由71个国家派代表参加的第14届国际计量大会上,正式通过国际单位制的7个基本物理量。
物质的量就是其中之一,物质的量的单位是摩尔,符号是mol,简称摩。
物质的量跟长度、质量、时间等一样,是一个物理量名词。
它包括4个字,是一个整体,不能分割,也不能简化,更不能按字面的意思去理解和解释。
正如长度不等于长和度两个字的字意之和。
我们在读写使用物质的量时,不能在4个字中间停顿,否则将失去原有意义。
我们不能这样问:物质的量是物质的什么量,是质量还是数量?2.摩尔摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒。
【要点分析】(1)摩尔它表示物质的量的单位。
(2)物质的量它是国际单位制中七个基本物理量之一。
(3)每摩尔物质它指1mol任何物质。
(4)阿伏加德罗常数个它指1mol物质中含有的微粒数目。
(5)微粒它指分子、原子、离子、质子、电子、中子等微观粒子。
3.阿伏加德罗常数(用NA表示)规定:1mol粒子集体所含的粒子数与0.012kg12C中所含的碳原子数相同,约为6.02×1023 。
把1mol任何粒子的粒子数叫做阿伏伽德罗常数,用NA表示,常用6.02×1023mol-1表示。
碳-12或12C就是指原子核里有6个质子和6个中子的那种碳原子。
12g碳-12中所含的原子数叫阿伏加德罗常数。
阿伏加德罗常数是实验测定值,近似表示为N A=6.0220943×1023mol-1。
在中学阶段可以近似取用6.02×1023mol-1这个数值,所以我们在阐述摩尔概念时,用阿伏加德罗常数定义而不选用具体数值。
科学家确定以阿伏加德罗常数个微粒作为一个集合数,确定一个物理量——物质的量。
它像一座桥梁,把单个肉眼看不见的微粒跟极大数量(阿伏加德罗常数个)的微粒集体、可称量的物质之间建立联系。
故由此得到,n=N/NA【举例】阿伏加德罗常数是一个多大的数值?6.02×1023粒稻谷的质量是多少千克?把它们平均分给12亿人,每人可得多少千克?(据估算,每千克稻谷有4万粒。
高一化学必修一物质的量、阿伏伽德罗常数辅导讲义

高一化学必修一物质的量、阿伏伽德罗常数辅导讲义授课主题化学计量在试验中的应用教学目的1、相识摩尔是物质的量的基本单位,了解物质的量与微观粒子之间的关系,了解摩尔质量的概念,懂得阿伏加德罗常数的涵义。
2、了解物质的量、摩尔质量、物质的质量之间的关系,能用于进行简洁的化学计算。
教学重难点物质的量及单位;摩尔质量的概念和有关摩尔质量的计算教学内容一、本节学问点讲解学问点一物质的量1.物质的量的概念表示含有肯定数目粒子的集合体,符号为n,物质的量是一个整体,不能说成“物质量”或“物质的质量”。
2.物质的量的单位——摩尔①物质的量作为一个物理量,同其他物理量一样,也有其单位。
物质的量的单位是摩尔,简称摩,符号是mol。
②“摩尔”的标准:假如在肯定量的粒子集合体中所含的粒子数与0.012 kg 12C中所含的碳原子数相同,该粒子的物质的量就是1 mol。
③1 mol 任何粒子所含有的粒子数都相等。
科学试验表明,在0.012 kg 12C中所含有的碳原子数约为6.02×1023。
因此,我们经常表述为1 mol O 中约含有6.02×1023个O;1 mol H2O中约含有6.02×1023个H2O;1 mol NO3-中约含有6.02×1023个NO3-等。
即1 mol 粒子集体都约含6.02×1023个粒子。
⑴运用物质的量时,表述要准确,指代须明确。
一般用数量+单位+粒子(一般用适当的符号或化学式)来表示详细微粒的物质的量。
如1 mol H表示1mol 氢原子,1 mol H2表示1 mol 氢分子(或氢气),1 mol H+ 表示1 mol 氢离子,但是假如说“1 mol 氢”则错误。
⑵摩尔作为物质的量的单位,可以计量全部的微观粒子(包括原子、分子、离子、质子、中子、电子、原子团等),但不能表示宏观物质,例如,不能说“1 mol 小米”、“1 mol 乒乓球”等。
(完整版)物质的量讲义

一. For personal use only in study and research; not for commercial use二.三. 知识梳理1.物质的量概念:物质的量是一个物理量,表示含有 的集合体。
符号为n 。
2.单位: 。
3. 阿伏加德罗常数概念:国际上规定,1mol 粒子集体所含有的粒子数与0.012kg 12C 中所含有的碳原子数相同,约为6.02×1023,所以6.02×1023mol-1叫做阿伏加德罗常数。
4.注:(1)我们把含有 个粒子数的任何粒子集合体都称为1mol 。
物质的量(n ),阿伏加德罗常数与粒子数(N )之间的关系为:n=N NA5.摩尔质量的概念:单位物质的量的物质所具有的质量叫摩尔质量。
6.定义式:摩尔质量(M )=物质的质量(m )物质的量(n ),即M=m n 7.气体的摩尔体积: 叫做气体摩尔体积。
符号Vm 单位为L/mol8.定义式:Vm=V n9.物质的量浓度的概念:单位体积溶液里所含溶质B 的物质的量,也称为 。
9.定义式:CB=nB V 单位为mol/L10.阿伏加德罗定律:同温同压下,相同体积的任何气体都含有相同数目的分子。
注:(1)阿伏加德罗定律仅适用于气体,可以是单一的气体,也可以为混合气体。
(2)阿伏加德罗定律的条件是三个“同”,只有在同温、同压、同体积的条件下,才有分子数目相等这一结论。
11. 阿伏加德罗定律推论(1)同温同压下,气体的体积之比等于其物质的量之比。
(2)同温同体积下,气体的压强之比等于其物质的量之比。
(3)同温同压下,相同体积的任何气体的质量之比,等于其摩尔质量之比。
(4)同温同压下,任何气体的密度之比等于其摩尔质量之比。
(5)同温同物质的量的气体,压强之比等于体积的反比。
11.物质的量浓度和溶质的质量分数的换算:设溶液体积为1L,溶液的密度为pg/ml ,溶质的质量分数为w(1) 溶质的质量m=1L ×1000ml/L ×pg/ml=1000pw g(2) 溶质的物质的量n=m M =1000PW M mol(3) 溶质的物质的量浓度:C= n V =1000pw M 1L =1000pw M mol/L12.标准状况下气体摩尔体积的计算(1)摩尔质量与气体摩尔体积的关系:M=Vm ·p g/L=22.4P g/mol(2)物质的量与气体摩尔体积的关系:n=V L 22.4L/mol =V 22.4mol(3)气体质量与气体摩尔体积的关系:m=n ·M=V Vm ·M(4)气体分子数与气体摩尔体积的关系:N=n ·NA=V Vm ·NA二.课前热身1.(08四川卷)下列说法中不正确的是( )。
物质的量(高一化学1对1参考教案)经典

安吉博方——全方位教学辅导教案数值上等于气体的平均摩尔质量;若是两种组分,可以根据平均相对分子质量和各组分气体的相对分子质量,利用交叉法求得体积比。
课堂检测(一)1.设N A表示阿伏加德罗常数的值,下列说法正确的是( )。
A.N A个氢分子与N A个氧分子的质量比为1:1B.1mol氢气的质量与N A个氢分子的质量和相等C.16g氧气中含有的氧分子数为N AD.44g CO2与28g CO所含有的分子数均为N A2.4℃时,若20滴水恰好1mL,那么1滴水中所含的水分子数约为(N A表示阿伏加德罗常数的值)( )。
A. 20N A B..N A/360 C..9N A/10 D..360/N A3.设N A表示阿伏加德罗常数,下列说法中正确的是( )A.1molNH2-所含的质子数为9N A个,电子数为10N A个 B.N A个微粒就是6.02×1023个微粒C.0.1mol硫酸分子包含的原子总数为0.7N A个 D.28g一氧化碳所含电子数是28N A个4.在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1. 6gX与Y完全反应后,生成4.4gR。
则在此反应中Y和M的质量之比为 ( )A.16:9 B.23:9 C.32:9 D.46:9 5.下列关于摩尔质量的叙述正确的是()A.摩尔质量是1 mol物质的质量B.以g·mol-1为单位时,在数值上摩尔质量与相对分子质量或相对原子质量相等C.水的摩尔质量等于N A个水分子的相对分子质量之和D.单位物质的量的物质所具有的质量叫摩尔质量6.amolH2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为()A.a/4bmol-1 B.b/amol-1 C.a/bmol-1 D.b/4amol-17.两份体积相同的某植物营养液,其配方如下图:则两份营养液的成分( )。
A.n(K+)相同 B.n(Cl-)相同 C.完全相同 D.完全不同8.下列物质中,物质的量最大的是,含分子个数最多的是,含原子个数最多的是,质量最大的是。
物质的量讲义

校训: 给自己希望, 给别人希望!
1
夏之星教育
标准讲义-教师版
量 ③摩尔质量 M、物质的量 n 及质量 m 之间的关系:n=m/M (4)气体摩尔体积 ①定义: 单位物质的量的气体所占的体积叫做气体摩尔体积。 符号:Vm 单位:L/mol 计算公式:Vm=V/n 在标准状况下,气体的摩尔体积约为 22.4L/mol. ②注意:a、适用对象:气体(纯净的气体或混合气体) b、只有在标准状况下 Vm=22.4L/mol (5)物质的量浓度 ①定义:单位体积溶液中所含溶质 B 的物质的量 。 符号:CB 单位:mol/L 计算公式:CB=n/V 液 ②注意:V 为溶液的体积 2、 有关物质的量计算的六种类型 物质所含的粒子数 目 (N) (N) ÷NA ×M 物 ÷Vm 质 的 ×H 反应热 E (kJ) ÷H 量 ÷96500 ×96500 电量 Q(c) ÷M 质量 m(g)
校训: 给自己希望, 给别人希望!
3
夏之星教育
标准讲义-教师版
根据密度公式 p=m/v,的 m=pv.则 m(X o2 )+m(Y o2 )=0.672L×2.56gg/L=1.72g 由于 m( o2 )=n( o2 )×M( o2 )= 根据质量守恒定律得 m(X Y2 )= m(X o2 )+m(Y o2 )- m( o2 ) =1.72g-0.960=0.76g (2) n( o2 )=
三、 能力拔高训练 1、 守恒法
求反应中某气体的式量是时,根据质量守恒定律,先求出反应中气体的质量,再求出 反应中气体的质量,再用公式求气体的摩尔质量,其式量在数值上等于摩尔质量。 例1、 一定质量的液态化合物 XY2 在一定量的氧气中恰好完全燃烧,化学方程式为: XY2(l)+3O2=====XO2(g)+2YO2(g) 冷却后,在标准状况下测得生成物的体积为 672mL,密 度为 2.56g/L,则 (1)反应前 O2 体积是 ,XY2 的质量是 。 (2) 、化合物 XY2 的摩尔质量是 (3) 、若 XY2 分子中 X、Y 俩元素的质量比为 3:16,则 X、Y 俩元素分别是 和 。 解析 (1)由化学方程式知,反应前后气体的化学计量数之和都是 3,则反应前后气 体的体积,即 O2 的体积等于生成物的体积,为 672mL。
121物质的量(教师版)-2022-2023学年高一化学讲义(苏教2019)

第二单元物质的化学计量第1课时物质的量课程标准课标解读1.知道物质的量、摩尔质量的单位及含义。
2.理解物质的量的基准——阿伏加德罗常数的含义。
3.能进行物质的质量、微粒数目与物质的量之间的换算。
1.利用物质的量将宏观的物理量(质量)与微观中微粒的个数相联系,能量从宏观和微观相结合的角度分析与解决实际问题。
(宏观辨识与微观探析)2.能进行物质的质量、物质的量、微粒个数间的转换。
(变化观念与平衡思想)3.能通过物质的量、摩尔质量的公式定量说明物质的组成及其变化过程。
(变化观念与平衡思想)4.通过对物质的量的学习,培养严谨求实的科学态度,形成探索未知、崇尚真理的意识,能参与有关化学问题的实践活动,树立终身学习的意识。
(科学态度与社会责任)知识点01 物质的量1.概念:物质的量是七大基本物理量之一,是表示一定数目的微粒的集合体的物理量,用符号n表示,常用单位是mol。
2.意义:它可以把物质的质量、体积等宏观量与原子、分子或离子等微观粒子的数量联系起来。
3.计量对象物质的量计量对象是分子、原子、离子、质子、中子、电子等微观粒子及它们的特定组合。
【即学即练1】下列关于物质的量的说法中正确的是()A.物质的量就是物质的质量B.物质的量是指物质中所含微粒的个数C.阿伏加德罗常数个微粒就是1molD.物质的量只能计量微观粒子答案:D目标导航解析:A.物质的量和物质的质量都是七大基本物理量之一,是两个不同的概念,国务;B。
物质的量是表示一定数目的微粒集合体,不是微粒的个数,错误;C. 阿伏加德罗常数个微粒是指微粒的数目,1mol表示微粒的集合体,两者表示的对象不一样,错误;D.物质的量只能计量微观粒子(分子、原子、离子、质子、中子、电子及它们的特定组合),正确。
故选D。
【即学即练2】下列关于物质的量的表示正确的有__________A.1mol质子B.1mol原子C.1mol小米D.1molNaCl E.1mol氧元素F.1molNa+答案:ADF解析:物质的量只能计量微观粒子(分子、原子、离子、质子、中子、电子)及它们的特定组合,在计量原子、离子和分子及它们的组合时,要指明具体微粒。
《物质的量及单位——摩尔》 讲义

《物质的量及单位——摩尔》讲义一、什么是物质的量在化学的世界里,我们常常需要处理各种各样的物质,而要对这些物质进行定量的研究和描述,就引入了一个非常重要的概念——物质的量。
物质的量,它就像是一个神奇的“桥梁”,把微观世界的粒子(如原子、分子、离子等)和宏观世界的可测量的量联系了起来。
举个简单的例子,我们说一堆苹果,通常会用“个”来表示数量;而对于一堆沙子,可能会用“斤”或者“千克”来衡量。
但是在化学中,对于原子、分子这样极其微小的粒子,用“个”来计数就太麻烦了,因为它们的数量实在是太多了!这时候,物质的量就派上了用场。
物质的量是用来表示含有一定数目粒子的集合体的物理量。
它的符号是“n”。
二、物质的量的单位——摩尔既然有了物质的量这个概念,那总得有个单位来衡量它吧?这个单位就是摩尔(mol)。
摩尔就像是一个“大箱子”,规定这个“箱子”里装的粒子数目是固定的。
具体来说,1 摩尔任何粒子所含的粒子数均为阿伏加德罗常数个。
阿伏加德罗常数是一个非常重要的常数,通常用“NA”表示,其数值约为 602×10²³。
这意味着,1 摩尔的氢原子,就含有约 602×10²³个氢原子;1 摩尔的水分子,就含有约 602×10²³个水分子。
为了更好地理解摩尔,我们可以想象一下:如果把 602×10²³个乒乓球堆在一起,那会是一个多么巨大的数量!而这仅仅是1 摩尔的粒子。
三、如何理解物质的量和摩尔的关系可以把物质的量类比为我们日常生活中的“打”,比如说“一打鸡蛋”,一打就是 12 个;而摩尔就类似于“打”这个单位。
当我们说“2 摩尔氧气”时,就相当于说有 2 倍的 602×10²³个氧气分子。
再举个例子,假如我们要数操场上的学生人数,如果一个一个数会很麻烦,那我们可以规定,每 50 个人为一组,这“一组”就相当于“摩尔”,而“几组”就相当于“物质的量”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
龙文教育学科教师辅导讲义学生:谢雯婷教师:闫晓华科目:化学2010、10、28--29 课题物质的量及其浓度考试要点1.溶液物质的量浓度的概念的建立。
2.溶液体积、物质的量浓度和溶质的物质的量之间的关系。
考试要求及学法指导1.抓住概念的理解与深化,掌握基本题型2.总结知识点间的联系与区别。
3.多思、多练、多总结。
教学内容物质的量单元知识点复习小结一、有关概念:1、物质的量(n)①物质的量是国际单位制中七个基本物理量之一。
②用物质的量可以衡量组成该物质的基本单元(即微观粒子群)的数目的多少,它的单位是摩尔,即一个微观粒子群为1摩尔。
③摩尔是物质的量的单位。
摩尔是国际单位制中七个基本单位之一,它的符号是mol。
④ “物质的量”是以摩尔为单位来计量物质所含结构微粒数的物理量。
⑤摩尔的量度对象是构成物质的基本微粒(如分子、原子、离子、质子、中子、电子等)或它们的特定组合。
如1molCaCl2可以说含1molCa2+,2molCl-或3mol阴阳离子,或含54mol质子,54mol电子。
摩尔不能量度宏观物质,如果说“1mol氢”就违反了使用准则,因为氢是元素名称,不是微粒名称,也不是微粒的符号或化学式。
⑥使用摩尔时必须指明物质微粒的名称或符号或化学式或符号的特定组合。
2.阿伏加德罗常数(N A):①定义值(标准):以0.012kg(即12克)碳-12原子的数目为标准;1摩任何物质的指定微粒所含的指定微粒数目都是阿伏加德罗常数个。
②近似值(测定值):经过科学测定,阿伏加德罗常数的近似值一般取6.02×1023,单位是mol-1,用符号N A表示。
3、摩尔质量(M):①定义:1mol某微粒的质量②定义公式:,③摩尔质量的单位:克/摩。
④数值:某物质的摩尔质量在数值上等于该物质的原子量、分子量或化学式式量。
⑤注意:摩尔质量有单位,是克/摩,而原子量、分子量或化学式的式量无单位。
4.气体摩尔体积(V m)①定义:在标准状况下(0℃,101kPa时),1摩尔气体所占的体积叫做气体摩尔体积。
②定义公式为:③数值:气体的摩尔体积约为22.4升/摩(L/mol)。
④注意:对于气体摩尔体积,在使用时一定注意如下几个方面:一个条件(标准状况,符号SPT),一个对象(只限于气体,不管是纯净气体还是混合气体都可),两个数据(“1摩”、“约22.4升”)。
如“1mol氧气为22.4升”、“标准状况下1摩水的体积约为22.4升”、“标准状况下NO2的体积约为22.4升”都是不正确的。
⑤理解:我们可以认为22.4升/摩是特定温度和压强(0℃,101kPa)下的气体摩尔体积。
当温度和压强发生变化时,气体摩尔体积的数值一般也会发生相应的变化,如273℃,101kPa时,气体的摩尔体积为44.8升/摩。
5.阿伏加德罗定律①决定物质体积的三因素:物质的体积由物质的微粒数、微粒本身体积、微粒间的距离三者决定。
气体体积主要取决于分子数的多少和分子间的距离;同温同压下气体分子间距离基本相等,故有阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
反之也成立。
②阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
③阿伏加德罗定律及推论适用的前提和对象:可适用于同温、同压的任何气体。
6.阿伏加德罗定律的有关推论:(其中V、n 、p、ρ、M分别代表气体的体积、物质的量、压强、密度和摩尔质量。
)①同温同压下:;②同温同体积:。
7.标准状况下气体密度的计算根据初中所学知识,密度=质量÷体积,下面我们取标准状况下1mol某气体,则该气体的质量在数值上等于摩尔质量,体积在数值上等于摩尔体积,所以可得如下计算公式:标况下气体的密度(g·L-1)=气体的摩尔质量(g·mol-1)÷标况下气体的摩尔体积(L·mol-1)。
8.物质的量浓度浓度是指一定温度、压强下,一定量溶液中所含溶质的量的多少。
常见的浓度有溶液中溶质的质量分数,溶液中溶质的体积分数,以及物质的量浓度。
①定义:物质的量浓度是以单位体积(1升)溶液里所含溶质B的物质的量来表示溶液组成的物理量。
②定义公式为:③单位:常用mol/L④注意:溶液体积的计算及单位9.溶液的物质的量浓度与溶液中溶质质量分数ω及溶液密度ρ(g·cm-3)之间的关系:10.易混淆的概念辨析①物质的量与摩尔:“物质的量”是用来计量物质所含结构微粒数的物理量;摩尔是物质的量的单位。
②摩尔质量与相对分子质量或相对原子质量:摩尔质量是指单位物质的量的物质所具有的质量,它是一个有单位的量,单位为g·mol-1;相对原子质量或相对分子质量是一个相对质量,没有单位。
摩尔质量与其相对原子质量或相对分子质量数值相同。
③质量与摩尔质量:质量是SI制中7个基本物理量之一,其单位是kg;摩尔质量是1摩尔物质的质量,其单位是g·mol-1;二者可通过物质的量建立联系。
总结为:四个定义公式和一个定律多个推论摩尔口诀:一(摩尔)微粒有几多?常数“阿佛加德罗”;摩尔质量是几何?分子(原子)量值单位克每摩;一摩气体“升”多少?二二点四标准况;摩尔计算变化多,质量、体积、微粒数。
二、物质的量的有关计算1、关于物质的量浓度的计算。
计算时运用的基本公式是:溶质的质量分数与物质的量浓度两浓度基本公式的换算关系:溶质的质量分数物质的量浓度定义用溶质的质量占溶液质量的百分比表示的浓度以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
表达式特点溶液的质量相同,溶质的质量分数也相同的任何溶液里,含有溶质的质量都相同,但是溶质的物质的量不相同。
溶液体积相同,物质的量浓度也相同的任何溶液里,含有溶质的物质的量都相同,但是溶质的质量不同。
实例某溶液的浓度为10%,指在100g溶液中,含有溶质10g。
某溶液物质的量浓度为10mol/L,指在1L溶液中,含有溶质10mol。
换算关系3、一定物质的量浓度的稀释计算。
浓、稀溶液运算的基本公式是:4.以物质的量为核心的换算关系(1)N A、M 、V m、C 四个定义式的含义及相互换算关系:(2)与物质的量有关的物理量知识总结四个定义公式和一个定律多个推论一、四个定义公式:1、N A=N(B)÷n(B)例1、m 克NH3含有a 个氢原子,求阿佛加德罗常数2、M(B)=m(B) ÷ n(B)例2、m 克Na2RO3含有a 个钠原子,求Na2RO3的摩尔质量3、V m=V(气体) ÷n(分子)例3、在标准状况下,m克H2R气体中含有a 个氢原子,求H2R的摩尔质量和体积4、C(B)=n(B) ÷V(溶液)例4、m 克Na2CO3溶于V升水中,所得溶液的密度为1.2g/ml。
求所得溶液的质量分数和物质的量浓度例5、在标准状况下,500mlHCl气体溶于V升水中,所得溶液的密度为ρ g/ml。
求所得溶液的质量分数和物质的量浓度二、一个定律多个推论:1、阿佛加德罗定律:同温同压下,相同体积的任何气体,含有的分子数相同。
2、阿佛加德罗定律的推论:(1)同温同压下,气体的体积之比等于气体的分子数之比,也等于气体分子的物质的量之比(2)同温同压下,气体的密度之比等于气体的摩尔质量之比(即相对密度)(3)同温同体积下,气体的压强之比等于气体的分子数之比,也等于气体分子的物质的量之比3、对同一种物质:物质的质量之比=物质的量之比=物质的分子数之比 4、同温同压下,对同一种气体物质:物质的质量之比=物质的量之比=物质的分子数之比=气体的体积之比 5、对混合物的计算:(1)M(混)=m(混) ÷ n(混) n(混)=m(混) ÷M(混)例6: N 2和H 2气按体积比为1:2混合,求该混合气体的平均摩尔质量 (2)V m =V(混气体) ÷n(混分子总数) V(混气体) = n(混分子总数).V m例7: 在标准状况下,N 2和H 2混合气体的密度为0.67g/L 。
求该混合气体中N 2和H 2的体积比例8. 在标准状况下,烧瓶内充满HCl 气体,将此烧瓶倒扣在盛水的水槽内,当液面上升到烧瓶容积的53时,此时烧瓶内溶液的物质的量浓度为( )A . 0.74 mol / LB . 0.045 mol / LC . 0.037 mol / LD . 0.025 mol / L 解析:烧瓶中充有任何溶于水的气体,当气体溶于水后,其溶液的物质的量浓度皆是1224. mol / L 或0.045 mol / L 。
(无论该气体是否充满容器;无论是否混有不反应、且不溶于水的气体。
) 若烧瓶容积为V L ,即.422V mol ,若气体全部溶于水,溶液体积为V L ,相除得到1224. mol / L ;若液面上升到烧瓶容积的53时,气体的物质的量为.422V mol ×53,溶液的体积也是53 V L ,相除依然是1224. mol / L 。
选 B。
