蛋白质检验原始记录 表格模板 格式
蛋白质检验原始记录单

0.0140:氮原子的摩尔质量,gF:氮换算成粗蛋白的系数(一般食物为6.25;纯乳与纯乳制品为6.38;)
编号
样品名称
批次
样品质量m,g或mL
样液定容体积,mL
空白消耗标准溶液毫升数v0,mL
蛋白质检验原始记录单
编号:TQM(R)72-1006-0
天平编号:□□定氮仪编号:
检验依据:
环境条件: ℃ %
滴定管规格及编号:
标准溶液浓度:□(1/2)硫酸 ( )mol/L□盐酸( )mol/L
计算公式
蛋白质 y(g/100 g)=(V1-V0)×c×0.0140×F×100/m系数:□6.38 □6.25
样液消耗标准溶液毫升数v1,mL
(V1-V0)温度补偿后消耗标准溶液体积,mL
结果y,g/100 g
报出值
g/100 g
备注
检测人
检测日期校核人校源自日期
容量法测定 蛋白质 原始记录

容量法测定蛋白质原始记录页检测项目蛋白质检测开始时间年月日检测依据GB 5009.5-2016第一法检测结束时间年月日检测方法凯氏定氮法温度及相对湿度℃%仪器名称及型号ME204E 电子天平仪器编号××/××-004 SKD-2082 红外智能消化炉××/××-033 SKD-800 自动定氮仪××/××-032滴定管××-086检出限/ 标准滴定溶液浓度C HCL= mol/L 空白消耗量V2= mL标准滴定溶液来源附BZRY:GB/T601-2016 4.2 盐酸标准滴定溶液1.取9.00mLGR盐酸加入预先放有100mL纯水的250mL烧杯中,放置室温后用纯水定容于1000.0容量瓶。
2.标定:称取于290℃高温炉中灼烧至恒量的工作基准试剂无水碳酸钠0.2000g,溶于50.00mL水中,加10滴溴甲酚绿-甲基红指示液,用配制的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2.00min,加盖具钠石灰管的橡胶塞,冷却,继续滴定至溶液再呈暗红色即为终点。
同时做空白试验。
样品处理情况称取充分混匀试样1g左右精确至0.0001g,加浓硫酸(GR)10ml,加硫酸铜与硫酸钾比例为:1:9的混合试剂5克左右,于消化炉进行消化(依SKD-2082红外智能消化炉操作规程)。
当消化炉温度达到420℃之后,继续消化1h,此时消化管中的液体呈绿色透明状,取出冷却后,于自动凯氏定氮仪(依SKD-800 自动定氮仪操作规程)进行测定。
同时做试剂空白。
计算公式检测人:校核人:审核人:容量法测定蛋白质原始记录第 2 页共 2 页检测人:校核人:审核人:。
蛋白质检测原始数据记录表

产品名称 生产日期 抽样日期 检验日期 检验所用仪 器和设备 检验所用试 剂 检测依据 生产班组 抽样人员 检验人员 (以实际使用为准) 生产批次 抽样基数 取样数数量
(以实际配制的浓度为准)
1、试验用样品重量
g。 (空白实验与样品保持一致)
2、消化样品:T1 阶段温度为 ℃消化时间为 h;T2 阶段温度 为 ℃;时间为 h。 (空白实验与样品保持一致) 3、蒸馏:加酸量 ml,加碱量 ml。 (空白实验与样品保持一致) 4、滴定:样品所消耗盐酸体积 V1 为 V2 为 ml。 ml;空白试剂所消耗的盐酸体积
检测结果 报告
备注:
审核: 日期:
过 程 数 据 记 录
(V1 V2 ) N 0.014 F 100 10 m 100 5、数据处理:蛋白 V1—样品消耗硫酸或盐酸标准液的体积,ml; V2—试剂空白消耗硫酸或盐酸标准液的体积,ml; N—硫酸或盐酸标准溶液当量浓度; 0.014—1N 硫酸或盐酸标准溶液 1ml 相当于氮克数; m—样品的质量(体积) ,g(ml) ; F—蛋白质系数,按 16%计算乘以 6.25 即为蛋白质。 (空白测定:用与样品等量的蒸馏水作空白测定)
检验原始记录【范本模板】
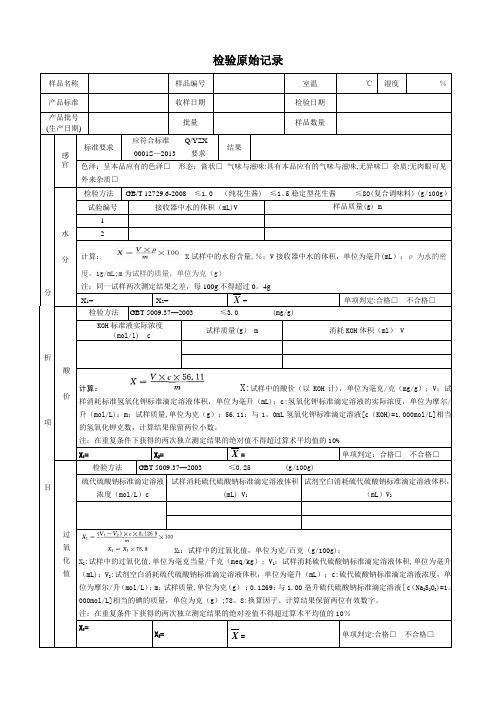
样品名称样品编号室温℃湿度%产品标准收样日期检验日期产品批号(生产日期)批量样品数量分析项目感官标准要求应符合标准Q/YZX0001S—2013 要求结果色泽:呈本品应有的色泽□形态:膏状□气味与滋味:具有本品应有的气味与滋味,无异味□杂质:无肉眼可见外来杂质□水分检验方法GB/T 12729.6-2008 ≤1.0 (纯花生酱) ≤1。
5稳定型花生酱≤80(复合调味料) (g/100g)试验编号接收器中水的体积(mL)V 样品质量(g) m12计算: X试样中的水份含量,%;V接收器中水的体积,单位为毫升(mL);ρ为水的密度,1g/mL;m为试样的质量,单位为克(g)注:同一试样两次测定结果之差,每100g不得超过0。
4gX1= X2= X= 单项判定:合格□不合格□酸价检验方法GBT 5009.37—2003 ≤3.0 (mg/g)KOH标准液实际浓度(mol/l) c试样质量(g) m 消耗KOH体积(ml) V计算:X:试样中的酸价(以KOH计),单位为毫克/克(mg/g);V:试样消耗标准氢氧化钾标准滴定溶液体积,单位为毫升(mL);c:氢氧化钾标准滴定溶液的实际浓度,单位为摩尔/升(mol/L);m:试样质量,单位为克(g);56.11:与1。
0mL氢氧化钾标准滴定溶液[c(KOH)=1.000mol/L]相当的氢氧化钾克数,计算结果保留两位小数。
注:在重复条件下获得的两次独立测定结果的绝对值不得超过算术平均值的10%X1= X2= X= 单项判定:合格□不合格□过氧化值检验方法GBT 5009.37—2003 ≤0.25 (g/100g)硫代硫酸钠标准滴定溶液浓度(mol/L)c试样消耗硫代硫酸钠标准滴定溶液体积(mL) V1试剂空白消耗硫代硫酸钠标准滴定溶液体积,(mL)V2X1:试样中的过氧化值,单位为克/百克(g/100g);X2:试样中的过氧化值,单位为毫克当量/千克(meq/kg);V1:试样消耗硫代硫酸钠标准滴定溶液体积,单位为毫升(mL);V2:试剂空白消耗硫代硫酸钠标准滴定溶液体积,单位为毫升(mL);c:硫代硫酸钠标准滴定溶液浓度,单位为摩尔/升(mol/L);m:试样质量,单位为克(g);0.1269:与1.00亳升硫代硫酸钠标准滴定溶液[c(Na2S2O3)=1。
蛋白质检测原始记录

F ——注意:(1)蛋白质含量≥1g/100g时,结果保留三位有效数字;蛋白质含量<1g/100g时, 结果保留两位有效数字。
(2)在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
样品
m
1#
2#
V1
V2
V3
X
差值 允差 平均值
C
V1 ——试样消耗硫酸或盐酸标准滴定液的体积,单位为毫升(ml); V2 ——试剂空白消耗硫酸或盐酸标准滴定液的体积,单位为毫升(ml); V3 ——吸取消化液的体积,单位为毫升(ml);
C ——硫酸或盐酸标准滴定溶液的浓度,单位为摩尔每升(mol/l); 0.0140——1.0ml硫酸【c(1/2H2SO4)=1.000mol/l】或盐酸【c(HCL)=1.000mol/l 】标准滴定溶液相当的氮的质量,单位为克(g); m ——试样的质量,单位为克(g);
F
报出结果
备注:
检验员:
审核:
年月日
编号: 样品名称:
蛋白质检测原始记录
批次:
1、检验依据:GB/T5009.5-2016(凯式定氮法)
2、范围:适用于各种食品中蛋白质的测定
3、使用主要仪器:①定氮蒸馏装置
②分析天平
4、计算公式:
式中:
X (V1 V 2)C 0.0140 F 100 mV 3 /100
X ——试样中蛋白质含量,单位为克每百克(g/100g);
蛋白检验(凯氏定氮)记录
5%三氯醋酸溶液
1∕3mo1∕1硫酸溶液
35%氢氯化钠溶液
分析纯硫酸
消化剂
材料名称
规格
数量
清洗有效期
校验有效期
消化管
IOOm1
N/A
锻子
16cm
N/A
移液器
5m1
N/A
移液器
Im1
N/A
移液器吸头
1-5m1
N/A
N/A
可调加液器
2-10m1
N/A
大试管
25mm
1
N/A
烧杯
25m1
1
N/A
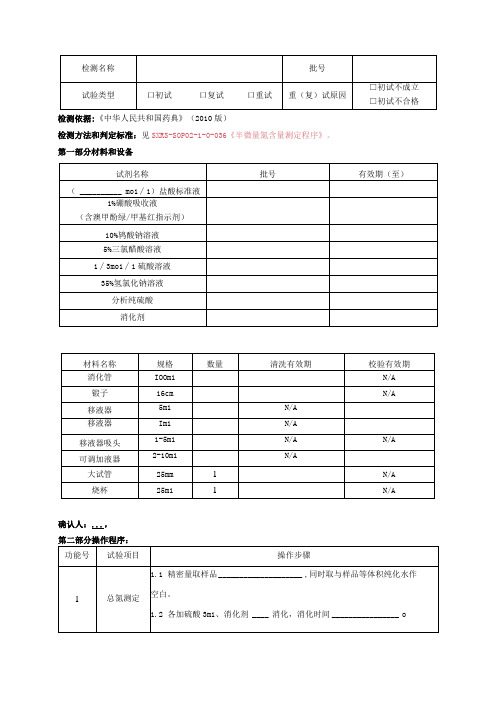
检测名称
批号
试验类型
口初试口复试口重试
重(复)试原因
□初试不成立
□初试不合格
检测依据:《中华人民共和国药典》(2010版)
检测方法和判定标准:见SXRS-SOP02-1-0-036《半微量氮含量测定程序》。
第一部分材料和设备
试剂名称
批号
有效期(至)
(mo1∕1)盐酸标准液
1%硼酸吸收液
(含澳甲酚绿/甲基红指示剂)
总氮量TN=蛋白氮量PN=总氮量TN一非蛋白氮NPN
试验日期:年月日
操作者:复核者:
确认人:...,
第二部分操作程序:
功能号
试验项目
操作步骤
1
总氮测定
1.1精密量取样加硫酸3m1、消化剂消化,消化时间o
1.3然后用KDNO5A凯氏定氮仪测定,一式两份。
TN1;TN2;
平均TNo
2
□非氮测
定
□精密量取样品InI1加5%三氯醋酸9m1,于沸水浴煮沸5分钟,冷却至室
温。
蛋白质原始记录表
蛋白质原始记录表
蛋白质原始检验记录
产品名称
检测方法:
称取0.0995g±0.1005g样品于100ml容量瓶,用纯化水定容,溶解,精密量取1.0ml供试品溶液于10ml具塞刻度管,加5ml碱性铜,摇匀,室温放置10分钟,快速加入0.5ml酚试剂,摇匀,室温放置30分钟。
用分光光度计检测。
检测温度:20℃。
计算公式:平均值=(检测值A+检测值B+检测值C)÷3 蛋白含量=吸光度/稀释倍数(100)/标准曲线斜率(0.2023)/称样量批号检验号日期称样量g 检测值蛋白含量备注检测人:复核人:批号检验号日期称样量g 检测值蛋白含量备注检测人:复核人:。
蛋白质检验原始记录表格模板、doc格式)
编号№ 第 页,共 页
检验结果与记录:
样 品 名 称
收样日期
样品编号
样品状态描述
检验日期
样品数量
检 验项 目
检 验依据
检验环境条件
温度℃相对湿度%大气压KPa
检验地点
检验仪器名称、型号及编号
仪器பைடு நூலகம்用前
□正常□异常
仪 器 使 用 后
□正常□异常
1、蛋白质:按照GB/T5009.5—2003食品中蛋白质的测定方法操作:
量取平行样品二份(1) ml、(2) ml,依法消化,消化完全后,将此消化液依法定容至 100mL容量瓶中。取10.0mL样品消化稀释液,依法进行蒸馏操作。收集馏出液滴定,盐酸标准滴定溶液的浓度C=mol/L, 样品消耗盐酸标准滴定溶液的体积 V(1)=mL, V(2)=mL空白消耗的体积V0=mL,F= 。
计算公式:
(V-V0)×C×0.0140
X(%)=───────────×F×100
m×10/100
检验人: 复核人:
年 月 日 年 月日
食品QS食品理化检验原始记录
备注:
m1*100 m2:空坩埚的质量
m3:灰化后坩埚+样品质量
备注:
乳糖检验原始记录
执行标准
GB/T5413-1997
使用仪器
分析天平、电炉子
样品名称
样品编号
检测日期
样品质量m,g
滴定消耗滤液量V1,ml
费林氏液乳糖较正值f1
由消耗样液的毫升数查表所得乳糖数F1,mg
乳糖含量%
检验人员
复核人员
允许差:不应超过结果平均值的:≤1.5%
由V2查得转化糖数,mgF3
检验人员
复核人员
转化前转化糖质量分数% = F2*f2*0.25*100转化后转化糖质量分数%= F3*f2*0.25*100
V2*m V1*m
样品中蔗糖含量(g/100g)=(转化后转化糖的质量分数—转化前转化糖的质量分数)×0.95
备注:
亚硝酸盐检验原始记录
执行标准
GB/T5413-1997
备注:
硝酸盐检验原始记录
执行标准
GB/T5413-1997
使用仪器
分析天平、还原反应柱、分光光度计
样品名称
样品编号
检测日期
样品质量m,g
洗提液的体积V2,ml
根据洗提液的吸光度,从标准曲线上读取的亚硝酸根离子浓度C2,μg/100mL
硝酸盐含量mg/kg
检验人员
复核人员
样品中硝酸根含量mg/kg,样品中以硝酸钠计的硝酸盐含量,mg/ml
使用仪器
分析天平、还原反应柱、分光光度计
蛋白质检验原始记录
15s,蒸馏 420s,吸废液 10s,清洗 45s,如果是手动加硼酸,加酸时间为 0s,结束后仪器自动
停止,将三角瓶取下。
(7) 同时做两分空白。
4 标准溶液的配制:
0.05mol/L 的盐酸:4.2ml 盐酸容于 1000ml 蒸馏水,并用碳酸钠发标定。
标定后盐酸浓度
5 结果分析
蛋白%= (V1-V2)×C×0.0893
(4) 每个样品再加入 15ml 硫酸。
(5) 消化:【01】(250 10)-【02】(280 5)
【03】(310 10)-【04】(350 10)
【05】(390 5)-【06】(420 90)
(6) 蒸馏:样品管放冷后,加 20ml 水混匀,三角瓶加入 20ml 硼酸和 3-5 滴指示剂;系统设置加碱
蛋白质含量测定
本方法适用于原料乳和乳制品中蛋白质的检测,方法结合国标 GB5009.12-2010 中凯氏定氮法。 1、原理:蛋白质是含氮的有机化合物。样品与硫酸和催化剂一同加热消化,使氮分解,分解的
氮与硫酸结合生产硫酸铵,然后碱化蒸馏使氨游离,用硼酸吸收,再用已知摩尔浓度盐酸标准溶液滴 定,根据酸的消耗量乘以换算系9.12-2010,水为 GB/T6682 规定的一级水。
仪器名称:定氮仪全自动蒸馏装置、智能消化炉;仪器型号 KND-812、HPY-314;
检定有效期 年 月 日
; 检验日期:
年
月日
样品名称:
样品批号:
称样量及编号:
样品来源:
样品名称:
样品批号:
称样量及编号:
样品来源:
样品名称:
样品批号:
称样量及编号:
样品来源:
3 样品前处理:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
编号№ 第 页,共 页
检验结果与记录:
样 品 名 称
收样日期
样品编号
样品状态描述
检验日期
样品数量
检 验项 目
检 验依据
检验环境条件
温度℃相对湿度%大气压KPa
检验地点
检验仪器名称、型号及编号
仪器使用前
□正常□异常
仪 器ห้องสมุดไป่ตู้使 用 后
□正常□异常
1、蛋白质:按照GB/T5009.5—2003食品中蛋白质的测定方法操作:
计算公式:
(V-V0)×C×0.0140
X(%)=───────────×F×100
m×10/100
检验人: 复核人:
年 月 日 年 月日
量取平行样品二份(1) ml、(2) ml,依法消化,消化完全后,将此消化液依法定容至 100mL容量瓶中。取10.0mL样品消化稀释液,依法进行蒸馏操作。收集馏出液滴定,盐酸标准滴定溶液的浓度C=mol/L, 样品消耗盐酸标准滴定溶液的体积 V(1)=mL, V(2)=mL空白消耗的体积V0=mL,F= 。
