第二节 糖类结构
第二节 二糖和多糖

糖类: 从结构上看,一般是多羟基醛或多
羟基酮,以及水解生成它们的物质。
单糖 不能再水解的更简单的糖。
糖的分类 二糖 能水解,可产生2mol单糖。
多糖 可水解产生许多单糖。
二糖
一、蔗糖: 分子式: C12H22O11
1、物理性质: 无色晶体,易溶于水(冰糖、 白砂糖样品),较难溶于乙醇. 存在: 甘蔗、甜菜含量较多.
(C6H10O5)n + nH2O nC6H12O6 水浴加热 纤维素 葡萄糖
催化剂
3、用途: ①酯化反应:制造纤维素硝酸酯。
[C6H7O2(OH)3]n 浓硫酸 [(C6H7O2)(OH)3]n + 3nHO-NO2
[(C6H7O2)(O-NO2)3]n + 3nH2O 纤维素三硝酸酯
纤维素一般不容易完全酯化生成三硝酸酯 (含N: 14.14%). N%: 12.5--13.8% 火棉 ——无烟火药 N%: 10.5--12% 胶棉 ——制喷漆、赛璐珞
②制造纤维素乙酸酯 又名醋酸纤维
[(C6H7O2)(OH)3]n + 3n(CH3CO)2O
浓硫酸
[(C6H7O2)(O-COCH3)3]n + 3nCH3COOH
醋酸纤维
用途: 电影胶片的片基(不易着火)
③粘胶纤维
把纤维素依次用氢氧化钠浓溶液和二硫 化碳处理, 再把生成物溶解于氢氧化钠 稀溶液即形成粘胶液. 把黏胶液经过细 孔压入稀酸溶液中,重新生成纤维素, 即粘胶纤维.
二、麦芽糖:
分子式: C12H22O11(与蔗糖同分异构体)。 1、物理性质: 白色晶体(常见的麦芽糖是 没有结晶的糖膏), 易溶于水,有甜味(不 及蔗糖). 存在: 发芽的谷粒和麦芽
糖类的总结和归纳图解

糖类的总结和归纳图解糖类是一类重要的有机化合物,广泛存在于自然界中,是生物体必不可少的能量来源。
糖类的种类繁多,具有多样的化学结构和功能。
本文将对糖类进行总结和归纳,并通过图解形式展示其结构和分类。
1. 糖类的定义与分类糖类指的是由碳、氢和氧组成的有机化合物,一般分为单糖、双糖和多糖三类。
单糖是最简单的糖类,不能被水解,包括葡萄糖、果糖、半乳糖等。
双糖由两个单糖分子通过糖苷键连接而成,如蔗糖、乳糖和麦芽糖。
多糖则由多个单糖分子组成,如淀粉、纤维素和肝醣。
2. 单糖的结构和功能单糖是糖类的基本单位,通式为(CH2O)n,其中n为3、4、5、6等不同的数值。
单糖以直链或环状的形式存在,其中以环状结构最为常见。
单糖在生物体内起着重要的能量供应和物质合成的作用,如葡萄糖是人体主要的能量来源。
3. 双糖的结构和功能双糖是由两个单糖分子通过糖苷键连接而成的糖类,常见的双糖有蔗糖、乳糖和麦芽糖。
蔗糖由葡萄糖和果糖连接而成,是人们日常食用的主要糖类来源。
乳糖由葡萄糖和半乳糖连接而成,存在于乳制品中。
麦芽糖由两个葡萄糖分子连接而成,常见于麦芽中。
双糖在人体内需要酶的作用才能被分解吸收。
4. 多糖的结构和功能多糖是由多个单糖分子通过糖苷键连接而成的糖类,常见的多糖有淀粉、纤维素和肝醣。
淀粉是植物的主要能量储存形式,由α-葡萄糖分子连接而成,可以被人体消化酶分解为葡萄糖。
纤维素是植物细胞壁的主要成分,由β-葡萄糖分子连接而成,人体无法消化吸收。
肝醣是由半乳糖分子通过β-(1→4)糖苷键连接而成,存在于牛奶中,具有调节肠道菌群的作用。
5. 糖类的生物功能糖类在生物体内具有丰富的生物功能,主要包括能量供应、结构支持和信息传递等方面。
作为能量供应的主要来源,糖类参与细胞内的糖酵解和呼吸作用,释放出丰富的化学能。
糖类还能被用于构建细胞膜和细胞壁等结构物质,维持细胞的结构完整和稳定。
此外,糖类在生物体内还承担信息传递、免疫应答和细胞识别等重要生物功能。
第四章 第二节 糖类

第二节糖类[核心素养发展目标] 1.宏观辨识与微观探析:从糖类的官能团微观探析糖类的结构特点,了解糖类的分类、化学性质,掌握糖类的某些特殊性质和鉴别。
2.科学态度与社会责任:了解糖类在生理、医药、生活、食品加工、生物质能源开发等方面的作用,认识到化学从生活中来到生活中去的真谛。
一、糖类的组成与分类1.结构与组成从分子结构上看,糖类可定义为多羟基醛、多羟基酮和它们的脱水缩合物。
其组成大多以通式C m(H2O)n表示,过去曾称其为碳水化合物。
2.分类根据糖类能否水解以及水解后的产物,糖类可分为(1)单糖:凡是不能水解的糖称为单糖。
如葡萄糖、果糖、核糖及脱氧核糖等。
(2)低聚糖:1 mol糖水解后能产生2~10 mol单糖。
若水解生成2 mol单糖,则称为二糖,重要的二糖有麦芽糖、乳糖和蔗糖等。
(3)多糖:1 mol糖水解后能产生很多摩尔单糖,如淀粉、纤维素等。
下列说法中正确的是()A.糖类物质的分子通式都可用C m(H2O)n来表示B.凡能溶于水且具有甜味的物质都属于糖类C.糖类都能发生水解反应D.糖类是多羟基醛或多羟基酮以及水解能生成它们的化合物答案 D解析 有些符合通式C m (H 2O)n 的物质不属于糖类,如乙酸(CH 3COOH)、甲酸甲酯(HCOOCH 3)等,有些不符合通式C m (H 2O)n 的物质却属于糖类,如脱氧核糖C 5H 10O 4;糖类不一定都具有甜味,有甜味的物质也不一定是糖类,如淀粉属于糖类但无甜味,糖精有甜味但不属于糖类;多糖能最终水解生成多分子的单糖,而单糖却是不能水解的糖类;糖类从分子结构上看,一般是多羟基醛或多羟基酮以及水解能生成它们的化合物。
(1)有甜味的不一定是糖,如甘油、木糖醇等;没有甜味的也可能是糖,如淀粉、纤维素等。
(2)符合C m (H 2O)n 通式的物质不一定都是糖类化合物,如甲醛(CH 2O)、乙酸(C 2H 4O 2)等;有些糖的分子式并不符合C m (H 2O)n ,如脱氧核糖(C 5H 10O 4)。
人教版高中化学选修5 第四章第二节 糖类--葡萄糖果糖麦芽糖蔗糖的结构和转化
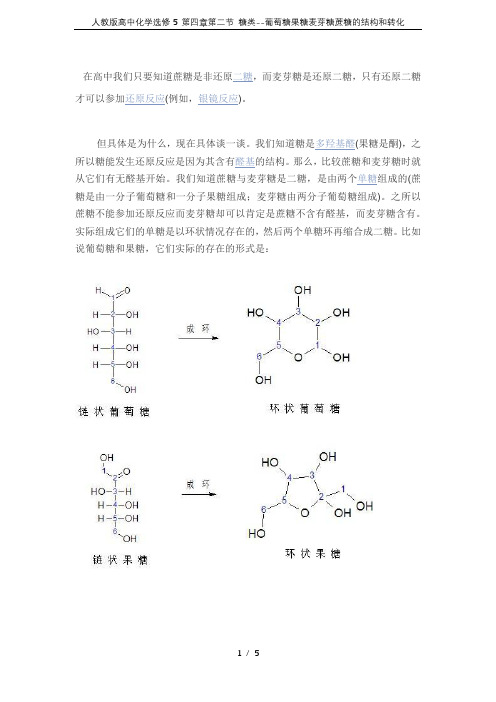
才可以参加还原反应(例如,银镜反应)。
但具体是为什么,现在具体谈一谈。
我们知道糖是多羟基醛(果糖是酮),之所以糖能发生还原反应是因为其含有醛基的结构。
那么,比较蔗糖和麦芽糖时就从它们有无醛基开始。
我们知道蔗糖与麦芽糖是二糖,是由两个单糖组成的(蔗糖是由一分子葡萄糖和一分子果糖组成;麦芽糖由两分子葡萄糖组成)。
之所以蔗糖不能参加还原反应而麦芽糖却可以肯定是蔗糖不含有醛基,而麦芽糖含有。
实际组成它们的单糖是以环状情况存在的,然后两个单糖环再缩合成二糖。
比如说葡萄糖和果糖,它们实际的存在的形式是:在环状的单糖的结构中,只要和环上的氧原子相邻最近碳上连有羟基,那么该糖就含有还原性,就像所举的例子中环状葡萄糖1号碳上有羟基,果糖2号碳上有羟基,所以它们都是还原糖,都可以发生还原反应。
现在,开始解释蔗糖和麦芽糖的还原性问题。
实际蔗糖和麦芽糖的结构如下:我们发现,麦芽糖的两个含氧环中有一个环的离环上氧最近的碳(即1号碳)上有羟基,所以它有还原性可以参加还原反应;而蔗糖的两个环中找不到这样的羟基,所以它没有还原性,不能参加还原反应。
补充:环状的糖中如果有上述像麦芽糖中1号碳这样的羟基,或者葡萄糖1号碳和果糖2号碳上的羟基的话,就会解离出醛基,那么就会有还原性了。
如果你是高中生,那么能理解到这里就可以了。
下面我解释的是高中以外的内容,可以试着理解一下。
链状的糖是怎么形成环状的?其实是它反生了半缩醛(酮)反应,反应式如下:上述反应中,如果R1和R2中至少有一个为H时,产物就为半缩醛,如果都为烃基那么就称为半缩酮~其实链状单糖就是反生了这个反应才成环的。
比如说链状葡萄糖中(如上述图),1号的醛基碳就与5号碳的羟基缩合成了半缩醛而成环的。
通过观察半缩醛(酮)反应,发现该反应是可逆反应,也就是说在反应过程中环状的糖是可以再变回链状的糖,从而会产生游离的醛基(或酮基)产生还原性从而可以参加还原反应。
观察半缩醛或半缩酮发现,它们的结构特点是两个氧原子夹着一个碳原子(两个氧原子必须直接连在所夹的碳原子上),其中一个氧原子必须得连着H原子,另一个必须连着非H原子(一般为烃基)。
人教版高中化学选修5 第四章第二节 糖类--葡萄糖果糖麦芽糖蔗糖的结构和转化

才可以参加还原反应(例如,银镜反应)。
但具体是为什么,现在具体谈一谈。
我们知道糖是多羟基醛(果糖是酮),之所以糖能发生还原反应是因为其含有醛基的结构。
那么,比较蔗糖和麦芽糖时就从它们有无醛基开始。
我们知道蔗糖与麦芽糖是二糖,是由两个单糖组成的(蔗糖是由一分子葡萄糖和一分子果糖组成;麦芽糖由两分子葡萄糖组成)。
之所以蔗糖不能参加还原反应而麦芽糖却可以肯定是蔗糖不含有醛基,而麦芽糖含有。
实际组成它们的单糖是以环状情况存在的,然后两个单糖环再缩合成二糖。
比如说葡萄糖和果糖,它们实际的存在的形式是:在环状的单糖的结构中,只要和环上的氧原子相邻最近碳上连有羟基,那么该糖就含有还原性,就像所举的例子中环状葡萄糖1号碳上有羟基,果糖2号碳上有羟基,所以它们都是还原糖,都可以发生还原反应。
现在,开始解释蔗糖和麦芽糖的还原性问题。
实际蔗糖和麦芽糖的结构如下:我们发现,麦芽糖的两个含氧环中有一个环的离环上氧最近的碳(即1号碳)上有羟基,所以它有还原性可以参加还原反应;而蔗糖的两个环中找不到这样的羟基,所以它没有还原性,不能参加还原反应。
补充:环状的糖中如果有上述像麦芽糖中1号碳这样的羟基,或者葡萄糖1号碳和果糖2号碳上的羟基的话,就会解离出醛基,那么就会有还原性了。
如果你是高中生,那么能理解到这里就可以了。
下面我解释的是高中以外的内容,可以试着理解一下。
链状的糖是怎么形成环状的?其实是它反生了半缩醛(酮)反应,反应式如下:上述反应中,如果R1和R2中至少有一个为H时,产物就为半缩醛,如果都为烃基那么就称为半缩酮~其实链状单糖就是反生了这个反应才成环的。
比如说链状葡萄糖中(如上述图),1号的醛基碳就与5号碳的羟基缩合成了半缩醛而成环的。
通过观察半缩醛(酮)反应,发现该反应是可逆反应,也就是说在反应过程中环状的糖是可以再变回链状的糖,从而会产生游离的醛基(或酮基)产生还原性从而可以参加还原反应。
观察半缩醛或半缩酮发现,它们的结构特点是两个氧原子夹着一个碳原子(两个氧原子必须直接连在所夹的碳原子上),其中一个氧原子必须得连着H原子,另一个必须连着非H原子(一般为烃基)。
高中化学第四章第2节 糖类知识点

第二节糖类一、糖的组成和分类1.定义:从分子结构上看,糖类可定义为多羟基醛、多羟基酮和它们的脱水缩合物。
根据能否水解以及水解后的产物,糖类可分为单糖、低聚糖和多糖。
2、糖的组成:糖类是由C、H、O三种元素组成的一类有机化合物。
糖类的组成通常用通式Cm(H2O)n表示,因而又称为碳水化合物。
3、糖的分类根据糖能否水解及水解产物的多少,可分为:单糖:不能再水解成更简单的糖,如葡萄糖、果糖二糖:每摩尔二糖可水解成两摩尔单糖,如蔗糖、麦芽糖多糖:每摩尔多糖可水解成多摩尔单糖,如淀粉、纤维素二、葡萄糖与果糖1、结构(1)葡萄糖葡萄糖是自然界中分布最广的单糖,因最初是从葡萄汁中分离得到而得名。
葡萄糖的分子式为C6H12O6,是白色晶体,熔点为146℃,有甜味,但甜度不如蔗糖,易溶于水,稍溶于乙醇,不溶于乙醚。
分子式:C6H12O6结构简式:CH2OH(CHOH)4CHO实验式:CH2O官能团:醛基(—CHO)、羟基(—OH)葡萄糖是一种多羟基醛,属醛糖。
(2)果糖果糖是最甜的糖,广泛分布于植物中,在水果和蜂蜜中含量较高。
纯净的果糖为无色晶体,熔点为103~105℃,它不易结晶,通常为黏稠性液体,易溶于水、乙醇和乙醚。
分子式:C6H12O6结构简式:CH2OH(CHOH)3COCH2OH官能团:酮基(CO)、羟基(—OH)果糖是一种多羟基酮,属酮糖。
总结:葡萄糖与果糖互为同分异构体。
2、化学性质(1)葡萄糖与氢气反应CH2OH(CHOH)4CHO+H2 → CH2OH(CHOH)4CH2OH(己六醇)。
(2)葡萄糖与银氨溶液反应CH2OH(CHOH)4CHO+2Ag(NH3)2OH →CH2OH(CHOH)4COONH4+2Ag↓+H2O+3NH3。
(3)葡萄糖与氢氧化铜悬浊液反应CH2OH(CHOH)4CHO+2Cu(OH)2 → CH2OH(CHOH)4COOH+Cu2O↓+2H2O3、用途(1)葡萄糖是一种重要的营养物质,它在人体组织中,在酶的催化下可直接被人体吸收。
第二节 糖类和脂质 课件 (44张PPT)

为尽快补充能量,应 该选择以下哪类食品 呢?
黄瓜
巧克力
水
说一说,生活中都有哪些糖
一 糖类是细胞的主要能源物质
1、元素组成:
只有C、H、O
因大多数糖类分子中H:O为2:1,类似水分子,即Cn ( H2O)m。,故糖类 又被称为碳水化合物。但糖的H比O不全为2:1,H与O比为2:1的化合物也不 全是糖。故“碳水化合物”仅仅只是一种俗称,不是严格意义上糖类的称谓。
生物大分子以碳链为骨架 第一课时
CONTENTS
目录
1 糖类的种类和作用 3 蛋白质的结构和功能
2 脂质的种类和作用 4 核酸的种类及功能
5 检测生物组织中的油脂、糖类、蛋白质
1 碳骨架
碳骨架
碳元素存在于所有的生物体内,是生命系 统中的核心元素。
要使碳原子最外层成为具有8个电子的稳 定结构,需要别的原子提供4个电子使碳 原子与别的原子共用电子形成共价键。
给家畜、家禽提供富含糖类的饲料,使它们肥育,就是因 为糖类在它们体内转变成了脂肪。而食物中的脂肪被消化 吸收后,可以在皮下结缔组织等处以脂肪组织的形式储存 起来。
但是糖类和脂肪之间的转化程度是有明显差异的。例如, 糖类在供应充足的情况下,可以大量转化为脂肪;而脂肪一 般只在糖类代谢发生障碍,引起供能不足时,才会分解供 能,而且不能大量转化为糖类。
主要是 A、补充水分
C
B、提供各种营养
C、满足能量需要 D、稀释血液
感谢您的观看
碳骨架
碳骨架
碳原子间可以共用电子形成共价键,从而由很多碳原子串起长长的直链结构、支链结构或环状结 构,共同形成碳骨架。骨架中的碳还可以与其他原子,如H、O、N、S、P等通过共用电子相连 接。
化学初三下糖类知识点归纳总结

化学初三下糖类知识点归纳总结糖类是一类重要的有机化合物,广泛存在于自然界中,是人类生活中不可或缺的能量来源。
在化学初三下学期的学习中,我们系统地学习了糖类的结构、分类、性质以及相关实验。
下面,将对这一部分的知识点进行归纳总结。
一、糖类的基本结构糖类是由碳、氢和氧组成的有机化合物,通式为(CH2O)n。
糖类分为单糖、双糖和多糖三类。
单糖是由3至7个碳原子构成的糖类,如葡萄糖、果糖等;双糖由两个单糖分子通过缩合反应形成,如蔗糖、麦芽糖等;多糖则由许多单糖分子缩合而成,如淀粉、纤维素等。
二、糖类的分类1. 单糖:根据单糖的化学式和结构,可以将单糖分为三类,即三碳糖、五碳糖和六碳糖。
常见的三碳糖有甘露糖,五碳糖有核糖和脱氧核糖,六碳糖中的葡萄糖、果糖最为常见。
2. 双糖:根据缩合的单糖种类以及缩合方式,双糖可分为苷糖和异糖两类。
苷糖是由脱氧核糖和脱氧核糖的苷闻基缩合而成的,如蔗糖、乳糖等;异糖常见的有麦芽糖。
3. 多糖:多糖是由多个单糖分子缩合而成的。
根据缩合方式和组成结构,多糖分为淀粉、糖原、纤维素和壳聚糖等。
淀粉和糖原是由α-葡聚糖分子缩合而成的,纤维素和壳聚糖则是由β-葡聚糖分子缩合而成的。
三、糖类的性质1. 糖类的溶解性:大多数单糖和双糖在水中具有良好的溶解性,而多糖则需要经过水解反应后才能溶解。
2. 醇类性质:糖类具有醇类和醛酮类的性质。
例如,单糖可以发生还原反应,还原性强的单糖又称为还原糖。
3. 甘甜性:糖类具有甘甜的味道,不同的糖类具有不同的甘甜程度。
4. 沸点和燃点:糖类的沸点较高,而燃点较低。
在燃烧过程中,糖类会失去水分,产生焦炭。
5. 餐前血糖:人体食用含糖食物后,血液中的葡萄糖浓度会升高,形成餐前血糖。
血糖过高或过低都会对身体造成不良影响。
四、实验示例1. 确定糖的类型:利用苏丹红胺的染色反应,蔗糖呈现红橙色,麦芽糖呈现深红色,葡萄糖和果糖则不发生着色反应。
2. 测定还原糖的含量:利用费林试剂,可以将还原糖氧化成蓝色溶液,并通过比色计测定吸光度,进而推算还原糖的含量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H3CCO2
还可与无机酸生成如硝酸酯、硫酸酯、磷酸酯。
O 5、苷的生成 C H CH2OH CH2OH OH O HO HO O HO OH HO HO OH OH OH OH OH CH2OH H2O CH3OH H2O CH3OH + 干HCl + H 干 HCl H 糖苷 CH2OH CH2OH O HO HO O HO HO OCH3 OH OH 配基 OCH
提出——环状半缩醛结构 HO * H C
苷原子 1 O C
苷羟基
H
OH
HO H H H O OH
2 OH H 动态平衡 HO 3 H H H 4 OH 5 OH
H * OH C
OH
HO H O
H
H
OH
6 CH2OH CH2OH CH2OH α-D-(+)葡萄糖 开链式 β -D-(+)-葡萄糖 ~36% β-D-(+)~64% 葡萄糖 0.01% α-D-(+)葡萄糖 0 0 [α]D=+112 平衡混合的比旋光度=+52.7[β]D=+19
HO
CHO OH
断裂1个C-C键,消耗一个HIO4
最甜的糖醇,其代谢不需胰岛素,加入糖尿病 人的食品中作为甜味剂(可减肥,口感好。)
3、脎 的 生 成
单糖与苯肼→苯腙;苯肼过量→不溶于水的黄色晶体 说明; 1、还原糖才 能成脎; 2、只发生在 C1~C2上 (确定构型)
CHO
3PhNHNH2
பைடு நூலகம்
CH=NNHPh NNHPh
第二节 糖类的结构与性质
一、单糖的结构与性质
二、低聚糖
三、多糖
四、糖类的测定方法
复习
碳水化合物也叫糖类(天然有机物) 维持动植物 的生命
nCO2 + nH2O + 太阳能
纺织、造纸、食品 工业部门的重要原料
叶绿素 Cn(H2O)m +nO2
糖在生物体内的代谢——逆过程(生命的能源) “万物生长靠太阳!” 通式Cm(H2O)n,因而取名为碳水化合物。 1、定义:是一类多羟基醛或多羟基酮以及水解可 生成多羟基醛或多羟基酮的化合物。
+Cu2O↓
COOH
酮糖和醛糖在稀碱下的互变: CH=O 醛糖 CHOH CH—OH C—OH
酮糖也可以被费林试剂 或托伦试剂氧化。
CH2OH C=O 酮糖
烯二醇
还原糖: 能还原费林试剂或托伦试剂的糖 非还原糖: 不能…. 与溴水反应: 区别醛糖和酮糖! CHO COOH O
Br2/H2O
Br2/H2O
相对密度法 折光法 旋光法
还原糖法
直接滴定法 (改良的兰—爱农法) 高锰酸钾法 萨氏法 3,5—二硝基水杨酸 酚—硫酸法 蒽酮法 半胱氨酸—咔唑法
化学法
碘量法
比色法
二、还原糖的测定
• 还原糖概念:具有还原性的糖。 • 所有的单糖都是还原糖; • 低聚糖中的乳糖、麦芽糖是还原糖。 • • 低聚糖中的蔗糖是非还原糖,多糖也是非还原 糖。但蔗糖、多糖都可以水解成还原糖。通过测定 水解后的还原糖来测定蔗糖或多糖。 • • 所以说:还原糖的测定是糖类定量的基础。
α-1,4苷键
C6H12O6 + C6H12O6 葡萄糖 葡萄糖
2、蔗糖 ①主要通过提炼甘蔗汁、甜菜汁制得。 ②是非还原糖,无银镜、斐林反应,无变旋光现象。 ③是人们不可缺少的食用糖。 α-1,2-苷键
C12H22O11 蔗糖 + H2 O 水解 酶 C6H12O6 + C6H12O6 果糖 葡萄糖
•
第三十五讲——总结
一、掌握单糖——葡萄糖、果糖的结构(开链/哈武斯/ 构象式)和化学性质。 1、羰基:氧化、还原,可与HCN、H2NOH、苯肼
2、羟基:可以成醚和酯,苷羟基还具有特殊性质。
二、会用化学方法鉴别还原糖与非还原糖(葡萄糖、 果糖、麦芽糖、蔗糖、淀粉、纤维素) 1、葡萄糖、果糖——用溴水 2、还原糖、非还原糖——托伦试剂/斐林试剂 3、淀粉——碘
H HO H H
O CH2OH C H O OH 葡萄糖 果糖 HO H H H OH OH 分子式:C6H12O6 H OH OH CH2OH CH2OH 单糖——不能水解的最简单的糖 溶于水,有甜味。 低聚糖——每分子可水解为2~10个单糖分子 多数不溶于水,无甜味。 多糖——能水解产生大量的单糖分子
甜味:果糖 > 蔗糖 > 麦芽糖 > 葡萄糖
三 多糖(简介)
是一类天然高分子化合物,分子量极大,水解 后可得到大量单糖。 其中主要的是——淀粉和纤维素
1、淀粉:白色无定形粉末,存在于植物的根和种子中。
(C6H10O5)n 完全水解 葡萄糖 酶
C2H5OH + CO2
非还原糖,不发生银镜和斐林反应。
(C6H10O5)n 酒化酶
工业上利用淀粉为原料可制酒精
2、纤维素 ①植物细胞壁的主要成分 完全水解 ②分子量比淀粉大 (C6H10O5)n 葡萄糖 纤维酶 ③无银镜和斐林反应 ④主要用于造纸和纺织工业
思考:如何鉴别葡萄糖\果糖\蔗糖\淀粉?
① 物理法 ② 化学法 物理法
③ 色谱法
④酶 法 ⑤ 发酵法 ⑥ 重量法
HIO4氧化:邻二醇结构的碳链处及羰基与羰基α-C链 CHO 处均发生断裂得到醛及酸。 CHOH + 2HIO4 CH2OH HCHO +2HCOOH
OH + 5HIO4 HCHO + 5HCOOH OH CH2OH 2、还原反应 化学还原剂(如LiAlH4,NaBH4等)还原,催化加氢, ———变成对应的糖醇。 CHO CH2OH D-木糖 NaBH4 D-木糖醇
结论:直链、一个醛基、五个羟基
——链型的醛式的碳架结构 2、构型的确定 德国化学家费舍尔(E.Fischer)通过一系列化学反应 确定了4个手性碳的构型。(1902年获诺贝尔奖) D-(+)-葡萄糖——开链式的表示(菲舍尔投影式)
O CHO △ CHO C H OH H * OH HO HO * H OH H * OH OH H * OH CH2OH CH2OH CH2OH 单糖的构型 : 以甘油醛为标准来确定 —— 或L葡萄糖 天然葡萄糖也可称为 : (2R, 3S, 4R, 5R) -D (+) CHO CHO D-(+)-甘油醛 L-(-)-甘油醛 OH HO CHO OH CHO HO HO OH H HO OH HO H OH
★ ★“氧环式”结构的表达——哈武斯环状透视结构式 O OH H H H C H 顺时针 CHO OH 转成水平 HOCH2 H H HO HO OH H OH H H OH H 5 CH2 OH 变曲成 H OH OH CHO 环状形式 4 CH2OH H OH
H CH2 OH
H OH H
HO
1
含有Cu2+的试剂是:菲林试剂:
• 斐林试剂:由碱性酒石酸铜甲、乙两液配制而成。 • 斐林试剂中酒石酸钾钠铜是一种氧化剂,反应的终 点可用次甲基蓝作指示剂,在碱性、沸腾环境下还
原呈无色。根据斐林试剂完全还原所需的还原糖量
,计算出样品还原糖量。
斐林试剂
• 斐林试剂是德国化学家斐林(Hermann von Fehling, 1812年--1885年)在1849年发明的。它是由氢氧化钠的质量 分数为0.1 g/mL的溶液和硫酸铜的质量分数为0.05 g/mL的溶 液,还有酒石酸钾钠配制而成的。 它与可溶性的还原性糖(葡萄糖)、果糖和麦芽糖)在加热 的条件下,能够生成砖红色的氧化亚铜沉淀。因此,斐林试 剂常用于鉴定可溶性的还原性糖的存在与否。
2、分类:按是否水解及水解产物不同分为三大类 碳水 化合物
单糖是构成低聚糖和多糖的基本单位
丙糖 丁糖 醛糖 按所含羰基的类型 按含碳原子的数目 戊糖 酮糖 己糖 一)、单糖的结构和命名 CHO 1、命名 H OH H HO CHO H CHO CHO (2R,3S,4R,5R)-2,3,4,5,6五羟基己醛 OH CHO H OH H OH HO H H OH OH DH ( + )葡萄糖 CH OH HO OH H H 2 OH CH H OH H OH 2 H O OH H OH CH2OH CH2OH HO H CH2OH (3S,4R,5R)-1,3,4,5,6CH2OH 五羟基-2-己酮 H OH D木糖 核糖 D-苏阿糖 D-赤藓糖 H D-OH D(-)果糖 CH2OH
H OH H
O H
1 2
H
2
O OH
HO
3
OH
HO
H OH H
H
H
OH
O
H
OH
练习:写出D-(+)-吡喃葡萄糖的开链式、哈武斯式 CH2OH △ CH OH
2
H
O H CHOH OH H
HO
O OH OH OH
HO H OH
★ ★ “氧环式”结构的表达——“构象式”
H
4 5
CH2 OH
H OH H
O OH
3
2
H
OH
HO
H
H
旋转C4-C5键
CH2OH
OH
H
4
5
CH2 OH
H OH H
O H
1 2
β-D-(+)-葡萄糖
H
HO
OH
3
OH
HO
H OH H
CH=O
α-D-(+)-葡萄糖
H
OH
H
OH
练习:写出α-D-(+)-葡萄糖、β- D-(+)-葡萄糖的 哈武斯结构式 CH OH
H
4 5
CH2 OH
3
