2020届高考化学二轮复习专题五化学能与热能(3)专项测试(含解析)
2020届高考化学人教版第二轮专题复习选择题强化训练:新型化学能源(含解析)

2020届高考化学人教版第二轮专题复习选择题强化训练新型化学能源1、液体燃料电池相比于气体燃料电池具有体积小等优点。
一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。
下列关于该电池的叙述正确的是( )A.b极发生氧化反应B.a极的反应式:N2H4+4OH--4e-===N2↑+4H2OC.放电时,电流从a极经过负载流向b极D.其中的离子交换膜需选用阳离子交换膜答案:B解析:燃料电池燃料(N2H4)在负极(a极)发生氧化反应:N2H4+4OH --4e-===N4H2O,O2在正极(b极)发生还原反应:O2+4e-+2↑+2H2O===4OH-,总反应为N2H4+O2===N2+2H2O,A项错误,B项正确;放电时电流由正极流向负极,C项错误;OH-在正极生成,移向负极消耗,所以离子交换膜应让OH-通过,故选用阴离子交换膜,D项错误。
2、如图是一种酸性燃料电池酒精检测仪,具有自动吹气流量监测与控制的功能,下列有关说法正确的是( )A.电流由呼气所在的铂电极流出B.H+通过质子交换膜流向氧气所在的铂电极C.电路中流过2mol电子时,消耗11.2 LO2D.该电池的负极反应为CH3CH2OH+3H2O-12e-===2CO2↑+12H+答案:B解析:呼气所在电极发生乙醇转化为醋酸的反应,故为负极,而电流由正极流出,A项错误;H+通过质子交换膜流向正极(氧气所在的铂电极),B项正确;正极反应为O2+4e-+4H+===2H2O,电路中流过2 mol电子时,消耗0.5 mol O2,在标准状况下体积为11.2 L,但题中未指明是否为标准状况,C项错误;该电池的负极反应为CH3CH2OH+H2O-4e-===CH3COOH+4H+,D项错误。
3.用FeS2纳米材料制成的高容量锂电池,电极分别是二硫化亚铁和金属锂,电解液是含锂盐的有机溶剂。
下列说法错误的是( ) A.金属锂作电池的负极B.电池正极反应为FeS2+4Li++4e-===Fe+2Li2SC.放电时,Li+向负极迁移D.电池总反应为FeS2+4Li===Fe+2Li2S解析:该电池中金属锂为负极,二硫化亚铁为正极,A项正确;电池正极上FeS2发生还原反应,且电解液中Li+向正极移动参与反应,电极反应式为FeS2+4Li++4e-===Fe+2Li2S,B项正确,C项错误;电池负极反应为Li-e-===Li+,则电池总反应为FeS2+4Li===Fe+2Li2S,D项正确。
2020届高考化学二轮复习专题十五化学能与热能(含解析)

专题十五化学能与热能1、在研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化所引起的化学键及能量的变化,据此判断以下叙述错误的是( )A.化学反应中物质变化的实质是旧化学键断裂和新化学键生成B.物质的燃烧过程可看成“储存”在物质内部的能量(化学能)转化为热能释放出来的过程C.在化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是吸热反应D.需要在高温条件下才能发生的反应一定是吸收能量的反应2、2016年诺贝尔化学奖授予在合成分子机器领域做出贡献的三位科学家。
分子机器是一种特殊的超分子体系,当体系受到外在刺激(如pH 变化、吸收光子、电子得失等)时,分子组分间原有作用被破坏,各组分间发生类似于机械运动的某种热运动。
下列说法不正确...的是( )A.驱动分子机器时,需要对体系输入一定的能量B.分子状态的改变会伴随能量变化,属于化学变化C.氧化还原反应有可能是刺激分子机器体系的因素之一D.光照有可能使分子产生类似于机械运动的某种热运动3、化学与社会、科学、技术、环境密切相关。
下列说法不正确的是( )A.T-碳是一种新型三维碳结构晶体,与C60互为同素异形体B.推广利用CO2合成聚碳酸酯可降解塑料符合低碳经济理念C.将金属钛、铝混合后在空气中熔化可制得强度较大的钛合金材料D.为汽车安装尾气催化转化装置,可将尾气中的部分CO和NO转化为无毒气体4、下列说法正确的是( )A.凡是放热反应都是自发的,因为吸热反应都是非自发的B.自发反应的熵一定增大,非自发反应的熵一定减小C.常温下,反应C(s)+CO2(g)2CO(g)不能自发进行, 则该反应的ΔΗ>0D.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的ΔΗ>05、H2与ICl的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法不正确的是()A.反应② 比① 要容易发生是因为反应② 活化能大B.反应① 和② 均为放热反应C.H2(g)+2ICl(g)= I2(g)+2HCl(g) ∆H= -218 kJ·molˉ1D.反应① 和② 均为氧化还原反应6、甲烷与氯气光照条件下取代反应的部分反应历程和能量变化如下:第一步:Cl2(g) 2C1•(g) △H1 = +242.7 kJ • mol-1第二步:CH4(g) + Cl • (g) CH3• (g) + HCl(g) △H2 = + 7.4 kJ • mol-1第三步:CH3• (g)+Cl2(g) CH3Cl(g)+Cl • (g) △H3 = -112. 9 kJ • mol-1……中(其中Cl •表示氯原子,CH3 •表示甲基)下列说法不正确的是( )A.由题可知,甲烷和氯气在室温暗处较难反应B. CH4(g)+Cl2(g)CH3Cl(g) + HCl(g) △H=–105.4 kJ • mol-1C.形成1 mol CH3Cl中C—Cl键放出的能量比拆开1 mol Cl2中化学键吸收的能量多D.若是甲烷与Br2发生取代反应,则第二步反应△H < + 7.4 kJ • mol-17、已知:① S(g)+O2(g)=SO2(g) ΔH1;② S(s)+O2(g)=SO2(g) ΔH2;③ 2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH3;④ 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH4;⑤ SO2(g)+2H2S(g)=3S(s)+2H2O(l) ΔH5下列关于上述反应焓变的判断不正确的是()A.ΔH1<ΔH2B.ΔH3<ΔH4C.ΔH5=ΔH3-ΔH2D.2ΔH5=3ΔH3-ΔH48、中国研究人员研制一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示下列说法不正确的是( )A.整个过程实现了光能向化学能的转化B.过程Ⅱ放出能量并生成了O-O 键C.总反应2H 2O2H 2+O 2D.过程Ⅲ属于分解反应也是吸热反应9、已知化学反应22A (g)+B (g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是(2A 和2B 的结构式分别为A-A 、B-B)( )A.每生成2分子AB 吸收b kJ 热量B.该反应的反应热-1()kJ mol H a b ∆=+-⋅C.该反应中反应物的总能量高于生成物的总能量D.断裂1mol A —A 键和1mol B —B 键,放出a kJ 能量10、研究表明CO 与N 2O 在Fe 作用下发生反应的能量变化及反应历程如图所示,两步反应分別为: ①②N 2O+Fe +=N 2+FeO +(慢):②FeO ++CO=CO 2+Fe +(快)。
2020(届)高考(人教)化学:化学能与热能二轮练习题附答案

2020(届)高考(人教)化学:化学能与热能二轮练习题附答案专题:化学能与热能一、选择题1、下列依据热化学方程式得出的结论正确的是()A.已知2H2(g)+O2(g)===2H2O(g)ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量C.已知2C(s)+2O2(g)===2CO2(g)ΔH=a2C(s)+O2(g)===2CO(g)ΔH=b,则a>bD.已知P(白磷,s)===P(红磷,s)ΔH<0,则白磷比红磷稳定【答案】B2、已知:①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)ΔH1;②C(s)+O2(g)===CO2(g)ΔH2;③2H2(g)+O2(g)===2H2O(l)ΔH3;④2CO2(g)+4H2(g)===CH3COOH(l)+2H2O(l)ΔH4;⑤2C(s)+2H2(g)+O2(g)===CH3COOH(l)ΔH5。
下列关于上述反应的焓变的判断正确的是()A.ΔH1>0,ΔH2<0B.ΔH5=2ΔH2+ΔH3-ΔH1C.ΔH3>0,ΔH5<0D.ΔH4=ΔH1-2ΔH3【参考答案及解析】B[根据题给热化学方程式知,反应①、反应②和反应③都是放热反应,故ΔH1<0,ΔH2<0,ΔH3<0,A、C项错误;由②×2+③-①得反应⑤,故ΔH5=2ΔH2+ΔH3-ΔH1,B项正确;由③×2-①可得反应④,则ΔH4=2ΔH3-ΔH1,D项错误。
]3、同主族元素形成的同一类型化合物,其结构和性质往往相似。
PH4I是一种白色晶体,下列对PH4I的叙述正确的是()。
2020年高考课标版高考化学 5_专题五 化学能与热能
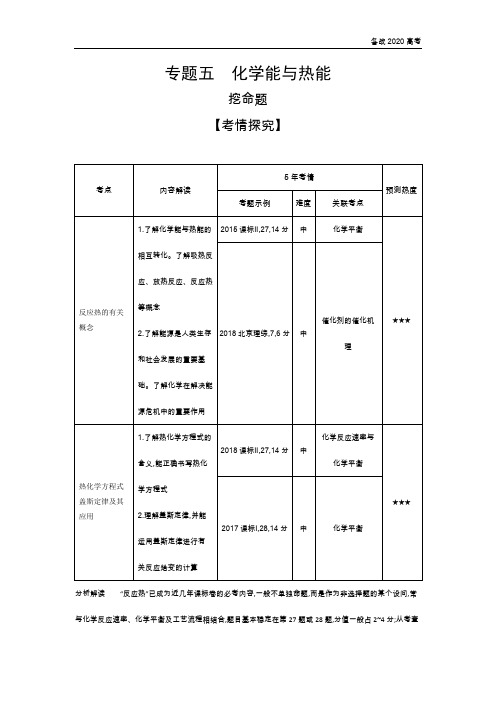
专题五化学能与热能挖命题【考情探究】分析解读“反应热”已成为近几年课标卷的必考内容,一般不单独命题,而是作为非选择题的某个设问,常与化学反应速率、化学平衡及工艺流程相结合,题目基本稳定在第27题或28题,分值一般占2~4分;从考查的内容上看,均与盖斯定律有关,试题整体难度虽然较大,但涉及本专题的内容都比较容易。
随着能源问题的日益突出,对本专题的考查仍将维持较高的热度。
【真题典例】破考点【考点集训】考点一反应热的有关概念1.(2018北京石景山一模,6)2017年3月,中国成功开采可燃冰(主要成分为甲烷)。
直接从自然界得到的能源为一次能源,下列不属于一次能源的是( )A.石油B.氢能C.太阳能D.煤答案B2.(2019届河南焦作定位考试,12)下列说法正确的是( )A.已知C(石墨,s)C(金刚石,s) ΔH>0,则金刚石比石墨稳定B.已知H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1,则稀硫酸溶液和稀Ba(OH)2溶液反应的反应热ΔH=-114.6 kJ·mol-1C.常温下,反应C(s)+CO2(g)2CO(g)不能自发进行,则该反应的ΔH<0D.已知H2(g)+Cl2(g)2HCl(g) ΔH1=-a kJ·mol-1,H2(g)+Cl2(g)2HCl(l) ΔH2=-b kJ·mol-1,则a<b答案D3.(2019届四川成都摸底,14)下列说法正确的是( )A.锂电池使用时,能量只存在由化学能到电能的转化B.已知P4(白磷,s)4P(红磷,s) ΔH=-18.4 kJ·mol-1,故白磷比红磷稳定C.H2在Cl2中燃烧:H2(g)+Cl2(g)2HCl(g) ΔH=-184.6 kJ·mol-1,则H2的燃烧热ΔH=-184.6 kJ·mol-1D.测定中和反应的反应热时,其他不变,用醋酸代替盐酸测得的反应热ΔH偏大答案D4.(2017河南中原名校联盟三联,13)已知:C(s)+H2O(g)CO(g)+H2(g) ΔH=+130 kJ·mol-1;2C(s)+O2(g)2CO(g) ΔH=-220 kJ·mol-1。
2020年高三化学第二轮复习《化学能与热能》能力提升24题(含答案和解析)

2020年高三化学第二轮复习《化学能与热能》能力提升24题一、单选题(本大题共20小题,共40分)1、炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。
活化过程的能量变化模拟计算结果如图所示。
活化氧可以快速氧化二氧化硫。
下列说法不正确的是()A. 每活化一个氧分子放出的能量B. 水可使氧分子活化反应的活化能降低C. 该过程反应速率主要取决于第一步D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂2、已知反应:,其反应机理如下:快慢下列有关该反应的说法正确的是()A. 该反应的速率主要取决于的快慢B. 是该反应的催化剂C. 正反应的活化能比逆反应的活化能小D. 增大浓度能增大单位体积内活化分子百分数,加快反应速率3、下列热化学方程式及有关应用的叙述中,正确的是()A. 甲烷的燃烧热为,则甲烷燃烧的热化学方程式可表示为:B. 取和进行中和热的测定实验,用温度计测定起始温度后,直接测定的温度,会使中和热偏小C. 、30MPa下,将和置于密闭的容器中充分反应生成,放热,其热化学方程式为:D. 已知、101KPa条件下:,,则比稳定4、和的能量关系如图所示、:下列说法正确的是()A.B.C.D. 对于和,5、下列图示与对应叙述相符的是()A. 图1表示向氯水中逐滴加入醋酸溶液,溶液导电性随加入酸溶液体积的变化B. 图2表示酸性介质原电池反应过程中的电流强度的变化,T时可能加入了C. 图3表示与反应过程中的能量变化,其中D. 图4表示在饱和溶液中逐步加固体后,溶液中的浓度变化6、下列说法正确的是()A. 中和热测定实验中需要的玻璃仪器有:烧杯、量筒、温度计、环形玻璃搅拌棒B. 乙烯的燃烧热为,则乙烯燃烧的热化学方程式为:C. 用石墨电极电解溶液,若反应产生,则向原溶液中加入能恢复至原浓度D. 用pH试纸分别测定氯水和盐酸的pH,比较两溶液的酸性强弱7、下列有关热化学方程式的叙述中,正确的是()A. 已知,,则B. 已知石墨,金刚石,,则金刚石比石墨稳定C. 已知,则的燃烧热为D. 含的稀溶液与稀盐酸完全中和,放出的热量,则表示该反应中和热的热化学方程式为8、已知:下列说法正确的是()A.B. HCl和HBr的键能差可以表示为C.D. 升温时,丙烷与反应速率加快,与反应速率降低9、下列热化学方程式及有关应用的叙述中,正确的是()A. 甲烷的燃烧热为,则甲烷燃烧的热化学方程式可表示为:B. 取和进行中和热的测定实验,用温度计测定起始温度后,直接测定的温度,会使中和热偏小C. 、30MPa下,将和置于密闭的容器中充分反应生成,放热,其热化学方程式为:D. 已知、101KPa条件下:,O,则O比O稳定10、下列说法不正确的是()【电离度a是指达电离平衡时以电离的电解质分子数占原来总分子数的百分比】A. 甲烷的标准燃烧热为,则甲烷燃烧的热化学方程式可表示为:B. 已知冰的熔化热为,冰中氢键键能为,假设1mol冰中有2mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中的氢键C. 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,电离常数。
2020高中化学第二章化学反应与能量第一节化学能与热能练习(含解析)新人教版必修2

第一节化学能与热能一、选择题1.有关能源的下列说法不正确的是( )A.煤、石油、天然气均为化石能源B.化石能源是非再生能源C.氢能是可再生能源D.氢能、核能均是无污染的高效能源解析:化石能源是非再生能源;氢能是可再生能源(可通过分解水得到氢气),且是无污染的高效能源;核能利用的是核反应过程中释放的巨大能量,虽然高效,但会产生放射性物质,有一定的污染性,不过人们可以采用技术控制这种污染。
答案: D2.下列选项中说明乙醇作为燃料的优点是( )①燃烧时发生氧化反应②燃烧时放出大量的热量③充分燃烧的产物不污染环境④乙醇是一种可再生能源A.①②③ B.①②④C.①③④ D.②③④解析:所有的燃烧均为氧化反应,这并不是乙醇作为燃料的优点。
答案: D3.下列变化过程需要吸收能量的是( )解析:A选项中氢气球发生爆炸时发生了氢气与氧气的反应,是燃烧反应,为放热反应;B选项中向河水中投放生石灰时发生了CaO+H2O===Ca(OH)2,是放热反应;C选项中两个氯原子之间结合成氯气分子,原子之间形成了共价键,对外释放能量;因此,A、B、C三个过程均是释放能量的变化过程。
D选项中一个氢气分子分解生成了两个氢原子,破坏氢气分子中的化学键要吸收能量。
所以正确答案为D。
答案: D4.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。
反应过程的示意图如下:下列说法正确的是( )A.CO和O生成CO2是吸热反应B.在该过程中,CO断键形成C和OC.CO和O形成了具有极性共价键的CO2D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程解析:A.状态Ⅰ总能量为反应物总能量,状态Ⅲ总能量为生成物总能量,由图示知反应物的总能量大于生成物的总能量,故该反应为放热反应。
B.从状态Ⅰ、Ⅱ、Ⅲ的图示可以看出,反应中CO并未断裂成C和O,C、O原子间一直有化学键。
C.由图示可以看出,CO 和O生成了CO2,CO2分子中C与O形成极性共价键。
高三化学二轮复习化学反应与热能
1.反应热的定义及计算依据
2.从两种角度理解化学反应热 反应热图示
微观
宏观
a表示断裂旧化学 图像分析 键吸收的能量;
b表示生成新化学 键放出的能量; c表示反应热
SiHCl3的电子式为
的反应方向。满足目标方程式各物质的位置要求,注意方程式方向改变ΔH _________________。
则25 ℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为_________
符号随之改变。 ______________________。
B.现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 A.YW3分子的空间构型为平面三角形 B.W2Z的键角小于YW3 燃烧热ΔH(kJ·mol-1)
从能量角度分析,铁触媒的作用是______________________。 若反应①为慢反应,下列示意图中能体现上述反应能量变化的是________(填标号),判断的理由是_______
(1)调方向:根据目标方程式反应物、生成物的位置,调整已知方程式 ___________________________________________________。
钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成 VOSO4(s)和V2O4(s)的热化学方程式为____________________________。
1.书写热化学方程式的常规方法
(2)细看变化,仔细分析各段反应 Si(s)+3HCl(g)
高考化学二轮复习专题突破练习:化学能与热能 (解析版)
1 / 26 化学能与热能1.(2020·河北衡水中学高三月考)肼(H 2N —NH 2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1 mol 化学键所需的能量(kJ):N ≡N 键为942、O =O 键为500、N —N 键为154,则断裂1 mol N —H 键所需的能量(kJ)是( )A .194B .391C .516D .658【答案】B 【解析】根据图中内容,可以看出N 2H 4(g)+O 2(g)=2N(g)+4H(g)+2O(g),△H 3=2752 kJ/mol -534 kJ/mol=2218 kJ/mol ,化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新键生成释放能量,设断裂1 mol N ―H 键所需的能量为X ,旧键断裂吸收的能量:154+4X+500=2218,解得X=391,故选项B 正确。
2.(2020·甘肃省岷县第二中学月考)已知:CH 4(g)+2O 2(g)=CO 2(g)+2H 2O(l) ΔH 1=-890.3 kJ ·mol -1;H 2(g)+12O 2(g)=H 2O(l) ΔH 2=-285.8 kJ ·mol -1。
CO 2与H 2反应生成甲烷与液态水的热化学方程式为CO 2(g)+4H 2(g)=CH 4(g)+2H 2O(l) ΔH 3,则ΔH 3=()A.-252.9 kJ·mol-1B.+252.9 kJ·mol-1C.-604.5 kJ·mol-1D.+604.5 kJ·mol-1【答案】A【解析】已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol-1;O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1②H2(g)+12根据盖斯定律,由4×②-①可得所求热化学方程式CO2(g)+4H2(g)=CH4(g)+2H2O(l),则ΔH3=4ΔH2-ΔH1=-252.9 kJ·mol-1。
2023年高考化学第二轮专项复习真题仿真—化学反应的热效应(含答案)
2023届高考化学第二轮专题复习真题试卷模拟——化学反应的热效应一、单选题A .铝片与稀24H SO 反应B .()22Ba OH 8H O ⋅与4NH ClC .氢气在2O 中的燃烧反应A .A 2(g)+B 2(g)=2AB(g)是一个放热反应B .A 2(g)与B 2(g)每生成2molAB(g)时吸收C .该反应中反应物的总能量低于生成物的总能量D .断裂1molA -A 键和1molB -B 键时放出3.(2023·全国·高三专题练习)由金属单质和氯气反应得到所示(M=Ca 、Ba)。
下列说法不正确的是A .∆H 1+∆H 3<0B .∆H 4>∆H 5C .∆H 2(Ba)<∆H 2(Ca)D .∆H 1+∆H 2+∆H 3+∆H 4+∆H 5+∆H 6=∆H4.(2023春·湖北武汉·高三校联考期中)如图是金属镁和卤素单质2X 反应的能量变化示意图。
下列说法正确的是A .2MgX 中热稳定性最好的是2MgIB .由2MgCl 制取Mg 是放热过程C .金属镁和卤素单质()2X g 的反应都是放热反应D .此温度下四种2MgX 中,()2MgI s 所含化学键的键能最大5.(2023·全国·高三专题练习)已知几种物质之间的能量关系如图所示,下列说法中不正确的是()A .使用合适催化剂,不能减小反应的焓变B .(g)+H 2(g)=()g 中,热能转化为产物内部的能量C .(g)+H 2(g)=(g)28.7kJ /molH ∆=+.(g)=((2023春高三宁南中学校考阶段练习)下列图示与对应的叙述相符的是A .(a)图表示反应物断键吸收的能量小于生成物成键放出的能量B .(b)图是金刚石与石墨分别被氧化生成2CO 的能量关系曲线,说明石墨转化为金刚石为吸热反应C .由(c)图可知,-13222SO (g)2SO (g)+O (g)ΔH=(b-a)kJ mol ⋅ D .(d)图是某反应:A→C(由两步反应A→B→C 完成,B 为中间产物)的能量曲线量),整个反应中4123ΔH=E -E -E -E 7.(2023春·河北邢台·高三河北南宫中学校考阶段练习)已知甲烷、氢气、一氧化碳的燃烧热H ∆依次为1kJ mol a --⋅、1kJ mol b --⋅、1kJ mol c --⋅(a 、b 、c 均大于0)。
2020年高中会考化学专题训练:化学能与热能
2020年高中会考化学专题训练:化学能与热能考标:1.知道化学键的断裂和形成是化学反应中能量变化的主要原因2.通过实例了解化学能与热能的转化3.举例说明化学能与电能的转化关系及其应用一.能量总述:1.从宏观的角度看,任何物质都储存有一定的能量,不同的物质所储存的能不同。
2.化学反应的特点是有新物质生成,新物质和反应物总能量不同,而反应中能量守恒,所以一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于。
(1)反应物总能量生成物总能量,则化学反应为吸收能量;(2)反应物总能量生成物总能量,则化学反应为放出能量;3.化学反应从微观的角度即从化学键的角度分析,化学反应的本质是过程。
断键和成键都伴随着能量的变化:断键——能量;成键——能量,所以是化学反应中能量变化的主要原因。
二.化学能与热能(关键熟记哪些类型的反应吸热或放热)1.任何化学反应都伴随着能量的变化,化学反应能量变化主要以能表现出来即吸热或者放热。
2.常见的放热反应:①②③;④⑤。
3.常见的吸热反应:①②③;④⑤。
注意:有热量放出的过程一定是化学反应吗?未必是放热反应,放热反应和吸热反应必须是化学变化。
某些常见的热效应:a、放热:①浓硫酸溶于水②NaOH溶于水③CaO溶于水,其中属于放热反应的是b、吸热:铵盐溶于水反应条件与热量变化没有必然的关系,既需要点燃或加热的反应是吸热反应。
4、中和热:。
5、能源的分类:[思考]一般说来,大多数化合反应是放热反应,大多数分解反应是吸热反应,放热反应都不需要加热,吸热反应都需要加热,这种说法对吗?试举例说明。
例1:下列说法正确的是()A. 物质发生化学反应都伴随着能量变化 B.伴有能量变化的物质变化都是化学变化C.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量D. 放热反应的发生无需任何条件例2:下列反应中,即属于氧化还原反应同时又是吸热反应的是()A. Ba(OH)2.8H2O与NH4Cl反应B. 铝与稀盐酸C. 灼热的炭与CO2反应D. 甲烷与O2的燃烧反应例3:燃烧相同质量的氢气,生成液态水放出热量Q1,生成气体水放出热量为Q2,则Q1和Q2的关系是()A. 相等B. 大于C. 小于D. 无法确定例4:在H2燃烧的反应中,破坏1mol H2的化学键消耗的能量为Q1kJ, 破坏1mol O2的化学键消耗的能量为Q2kJ,形成1mol H2O的化学键释放的能量为Q3kJ,下列关系式正确的是A.Q1+Q2>Q3 B.2Q1+Q2>4Q3C.Q1+Q2<Q3D.2Q1+Q2<4Q3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精品文档,欢迎下载如果你喜欢这份文档,欢迎下载,另祝您成绩进步,学习愉快!化学能与热能(3)1、已知298 K,101 kPa时,2SO2(g)+O2(g)2SO3(g) ΔH=-197 kJ·mol-1。
在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2 和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )A.Q2<Q1<197 kJ·mol-1B.Q2=Q1=197 kJ·mol-1C.Q1<Q2<197 kJ·mol-1D.Q2=Q1<197 kJ·mol-12、分析图中的能量变化情况,下列表示方法中正确的是( )A.2A+B2C ΔH<0B.2C2A+B ΔH<0C.2A(g)+B(g)2C(g) ΔH>0D.2A(g)+B(g)2C(g) ΔH<03、下列有关实验装置正确的是( )A.用图1装置制取少量乙酸乙酯B.用图2装置分离苯和溴苯C.用图3装置制取并收集乙炔气体D.用图4装置测定中和热 4、已知热化学方程式:2A(g)+B(g)2C(g) ΔH=-QkJ·mol -1(Q>0)。
下列说法正确的是( )A.相同条件下,2molA(g)和1molB(g)所具有的总能量小于2mol C(g)所具有的能量B.增大压强或升高温度,该平衡都向逆反应方向移动C.将2molA(g)和1molB(g)置于一密闭容器中充分反应后,放出热量为QkJD.如将一定量A(g)和B(g)置于某密闭容器中充分反应放热Q kJ,则此过程中有2molA(g)被消耗5、反应()0A B C H +→∆<,该反应分两步进行:①()0A B X H +→∆>;②()0X C H →∆<。
下列示意图能正确表示总反应过程中能量变化的是( )A.B.C.D.6、已知:①()()2CO g H O g +()()22CO g H g + 1141.2H kJ mol -∆=-⋅ ②()()42CH g CO g +()()222CO g H g + 12247.3H kJ mol -∆=+⋅ ③()()42CH g H O g +()()23CO g H g + 3H ∆若反应③在1L 的密闭容器中进行,测得4CH 的物质的量浓度随反应时间的变化如图所示。
下列有关叙述错误的是( )A. 13206.1H kJ mol -∆=+⋅B.反应③进行到10min 时,改变的外界条件可能是升高温度C.反应③进行的过程中,0~5min 这段时间共吸收的热量为103.05kJD.当反应③平衡后,向容器中通入4CH ,平衡向正反应方向移动, 4CH 的转化率将增大 7、已知的燃烧热为,CO 的燃烧热为。
现有和组成的混合气体 (标准状况),充分燃烧后,放出热量 ,并生成液态水。
下列说法正确的是 ( )。
A. 燃烧的热化学方程式为B.燃烧的热化学方程式为C.燃烧前的混合气体中,的体积分数为40%D.混合气体燃烧后与足量的过氧化钠反应,转移电子8、SF 6是一种优良的绝缘气体,分子结构中存在S ﹣F 键.已知断裂1molF ﹣F.S ﹣F 键需吸收的能量分别为160kJ 、330kJ.反应S(s)+3F 2(g) SF 6(g) △H 1=-1220kJ/mol ,下列正确的是( )A.1molS(s)转化为气态硫原子吸收能量280kJB.S(s)S(g) △H=-220kJ/molC.S(g)+3F 2(g)SF 6(g) △H 2 △H 2>△H 1D.由液态SF 6变为气体需要吸收的能量分别为1980kJ 9、目前,消除氮氧化物污染有多种方法。
用CH 4催化还原氮氧化物可以消除氮氧化物的污染。
已知: ①CH 4(g)+4NO 2(g)4NO(g)+CO 2(g)+2H 2O(g) ΔH=-574 kJ·mol -1②CH 4(g)+4NO(g)2N 2(g)+CO 2(g)+2H 2O(g) ΔH=-1160 kJ·mol-1③H 2O(g)H 2O(l) ΔH=-44.0 kJ·mol -1写出CH 4(g)与NO 2(g)反应生成N 2(g)、CO 2(g)和H 2O(l)的热化学方程式__________ 10、红磷()P s 和()2Cl g 发生反应生成()3PCl g 和()5 PCl g 。
反应过程和能量关系如下图所示(图中的H ∆表示生成1 mol 产物的数据)。
根据上图回答下列问题:1. P 和2Cl 反应生成3PCl 的热化学方程式是______________________________。
2. 5PCl 分解成3PCl 和2Cl 的热化学方程式是____________________________。
3. P 和2Cl 分两步反应生成1 mol 5PCl 的3 H ∆=__________,P 和2Cl 一步反应生成1mol 5PCl 的4H ∆__________3H ∆ (填“大于”、“小于”或“等于”)。
11、完成下列小题。
1.中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、__________、__________。
2.量取反应物时,取50mL 0.501mol L -⋅的盐酸,还需加入的试剂是________。
A.50mL 0.501mol L -⋅ NaOH 溶液 B.50mL 0.55 1mol L -⋅ NaOH 溶液C.1.0g NaOH 固体3.实验时大烧杯上若不盖硬纸板,求得的中和热数值__________(填偏大、偏小、无影响)4.由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如下表所示。
反应物起始温度t1/℃终了温度t2/℃ 中和热/ kJ·mol -1A.1.0 /mol L HCl 溶液50 mL 、1.1/mol L NaOH 溶液50mL13.019.8℃1H ∆B.1.0 /mol L HCl 溶液50 mL 、1.1/mol L 32NH H O ⋅溶液50 mL13.019.3 ℃2H ∆①设充分反应后溶液的比热容 4.18?c J =/(g ·℃) ,忽略实验仪器的比热容及溶液体积的变化,则1H ∆=__________;2H ∆=__________。
(已知溶液密度均为13/g cm ) ②12H H ∆≠∆原因是__________。
12、煤气中主要的含硫杂质有H 2S 以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO 2从而引起大气污染,因此煤气中H 2S 的脱出程度已成为煤气洁净度的一个重要指标。
请回答下列问题:1.H 2S 在水溶液中的电离方程式为__________。
2. 脱除煤气中COS 的方法有Br 2的KOH 溶液氧化法、H 2还原法、水解法等。
①COS 的分子结构与CO 2相似,COS 的结构式为___________。
②Br 2的KOH 溶液将COS 氧化为硫酸盐的离子方程式为______________。
③已知:H 2、COS 、H 2S 、CO 的燃烧热依次为285kJ/mol 、299kJ/mol 、586kJ/mol 、283kJ/mol;H 2还原COS 发生的反应为H 2(g)+COS(g)=H 2S(g)+CO(g),该反应的ΔH=_________kJ/mol。
④用活性α-Al 2O 3催化COS 水解反应为COS(g)+H 2O(g)CO 2(g)+H 2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS 的转化率(未达到平衡)如图1所示;某温度下,COS 的平衡转化率与n(H 2O)/n(COS)的关系如图2所示。
由图1可知,催化剂活性最大时对应的温度约为__________,COS的转化率在后期下降的原因是__________。
由图2可知,P点时平衡常数K=__________(保留2位有效数字)。
Q 点转化率高于P点的原因是__________。
13、甲烷以天然气和可燃冰两种主要形式存在与地球上,储量巨大,充分利用甲烷对人类未来的发展有重要意义。
1.乙炔(CH≡CH)是一种重要的化工原料。
工业用甲烷裂解法制乙炔,反应为:2CH4(g)C2H2(g)+3H2(g)在反应过程中甲烷裂解时还会发生副反应:2CH4(g)C2H4(g)+2H2(g)。
甲烷裂解时,几种气体平衡时分压(Pa)的对数值即lgP与温度(℃)之间的关系如图1所示。
①根据图1判断,2CH4(g)C2H2(g)+3H2(g) △H__________0(填“>”或“<”);A、B两点的化学反应速率,V A__________V B(填“>”或“<”)为提高甲烷制乙炔的产率,除改变温度外,还可以采取的措施是__________(写出一条即可)。
②1725℃时,若H2的lgP=5,则反应2CH4(g)C2H2(g)+3H2(g)的平衡常数Kp=__________(用平衡分压Pa代替平衡浓度计算)2.工业上用甲烷和水蒸气在高温和催化剂存在的条件下制得合成气(CO、H2),发生反应为:2CH4(g)+H2O(g)CO(g)+3H2(g) △H>0图2中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷含量曲线,其中表示1MPa的是__________(填字母)。
在实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑实际生产,说明选择该反应条件的主要原因是__________。
3.利用CH4、CO2在一定条件下重整的技术可得到富含CO的气体,在能源和环境上具有双重重大意义。
重整过程中的催化转化原题如图所示:则:①过程Ⅱ中第二步反应的化学方程式为__________②已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ/molCH4(g)+2H2O(g)= CO2(g)+4H2(g) △H=+158.6kJ/mol该技术总反应的热化学方程式为__________。
答案以及解析1答案及解析:答案:A解析:2答案及解析:答案:C解析:由图可知,生成物[2C(g)]具有的总能量大于反应物[2A(g)+B(g)]具有的总能量,故该反应为吸热反应,ΔH>0。
ΔH的大小与物质的状态有关,选项A、B错误。
