湖南大学课程考试试卷.doc
湖南大学课程考试试卷5

一、选择题(每题2 分,共10分)1.以下叙述中正确的是( )A) 构成C程序的基本单位是函数B) 可以在一个函数中定义另一个函数C) main()函数必须放在其它函数之前D) 所有被调用的函数一定要在调用之前进行定义2.设a和b均为double型变量,且a=5.5、b=2.5,则表达式(int)a+b/b的值是( ) A)6.500000 B)6 C) 5.500000 D) 6.0000003.已知i、j、k为int型变量,若从键盘输入:1,2,3<回车>,使i的值为1、j的值为 2、k的值为3,以下选项中正确的输入语句是( )A) scanf(“%2d%2d%2d”,&i,&j,&k);B) scanf(“%d %d %d”,&i,&j,&k);C) scanf(“%d,%d,%d”,&i,&j,&k);D) scanf(“i=%d,j=%d,k=%d”,&i,&j,&k);4.若x 为unsigned int 型变量,则执行下列语句后x值为()x = 65535;printf(“%d\n”,x);A)65535 B)1 C)无定值 D)-15.定义全局变量时,若变量的的存储类别缺省,则默认的存储类型是()。
A)auto B) registerC)extern D) static二、判断题(每题 1 分,共10分)1、C程序中的函数不能嵌套调用,但可嵌套定义。
()。
2、当形式参数为指针变量名时,实际参数可为指针变量名、数组名或其它类型变量的首地址()。
3、若有说明:static int a[3][4];,则数组a中各数组元素可在程序的编译阶段得到初值0()。
4、若用数组名作为函数调用时的实参,则实际上传递给形参数组的是数组的第一个元素的值()。
5、共用体变量的地址和它的各成员的地址都是同一起始地址。
湖南大学课程考试试卷(开卷)答案

湖南大学课程考试试卷(开卷)答案一、填空题〔每题3分,共15分〕一、通过数据文件共享方式开发;通过对通用CAD系统的用户化开发;通过通用CAD系统提供的嵌入式语言开发。
二、交、并、差3、256 10 1 804、用N+1维来表示N维空间的一种表示方式。
五、陈述格式;GPA符号格式;EDA符号格式。
二、选择题〔每题2分,共10分〕一、C二、B3、D4、C五、B六、C三、简答题〔每题6分,共18分〕〔略〕四、计算题〔14分〕T=总1000010000101l m n⎡⎤⎢⎥⎢⎥⎢⎥⎢⎥---⎣⎦.cos sin00sin cos0000100001αααα-⎡⎤⎢⎥⎢⎥⎢⎥⎢⎥⎣⎦.cos0sin00100sin0cos00001ββββ⎡⎤⎢⎥⎢⎥⎢⎥-⎢⎥⎣⎦.cos sin00sin cos0000100001θθθθ⎡⎤⎢⎥-⎢⎥⎢⎥⎢⎥⎣⎦.cos0sin00100sin0cos00001ββββ-⎡⎤⎢⎥⎢⎥⎢⎥⎢⎥⎣⎦.cos sin00sin cos0000100001αααα⎡⎤⎢⎥-⎢⎥⎢⎥⎢⎥⎣⎦.1000010000101l m n⎡⎤⎢⎥⎢⎥⎢⎥⎢⎥⎣⎦五、程序分析题〔每题12分,共24分〕一、二、ENTITY/ln(4),pt(4),txt1,suf1 ……………………………………pt1点未概念NUMBER/x,y,zpt(1)=POINT/0,0pt(2)=POINT/3,0pt(3)=POINT/3,2pt(4)=POINT/0,2ln(1)=LINE/pt(1),pt(2)ln(2)=LINE/pt(2),pt(3)ln(3)=LINE/pt(3),pt(4)ln(4)=LINE/pt(4),pt(1)suf1=RLDSRF/ln(2),pt(2),ln(4),pt(1)l10 …………………………………………………………格式错误,未加“:〞PARAM/ 'X',x,'Y',y,'Z',z,rsp $$在屏幕上指定一点JUMP/l10,hal:,,,,rsp ………………………………………“l10”应改成“l10:〞pt1=POINT/x,y,zCRTWRT/'Congratulations!',x,y,z, TXT1=NOTE/2,-2,'VIEW A'MASK/26 $$只有尺寸实体可选DELETE/pt1,pt(1..4)………………………………………………………语句缺失,缺“hal:〞HALT六、编程题〔15分〕ENTITY/ln(4),obj(3)NUMBER/mat1(12),mat2(12),mat3(12)ln(1)=line/0,0,0,10ln(2)=line/0,10,-20,10ln(3)=line/-20,10,-20,0ln(4)=line/0,0,-20,0mat1=matrix/xyrot,-135mat2=matrix/transl,20,20,0 mat3=matrix/mat1,mat2obj(1)=transf/mat3,ln(1..4) halt七、附加题〔略〕。
湖南大学课程考试试卷

湖 南 大 学 教 务 处 考 试 中 心
第 3 页(共 4 页)
第 4 页(共 4 页)
(4)
湖
用最速下降法和牛顿法分别最小化函数 f (x1, x2 ) = x12 + 4x22 ,初始点为
南
(2 2)T ,比较并讨论二者的效率。
大
学
课
程
考
试
卷
(
装 订 线
答 案 不 得 超 过 此 线 )
湖 南 大 学 教 务 处 考 试 中 心
湖 南
x
=
⎧ ⎨ ⎩
x1 x2
⎫ ⎬ ⎭
=
⎧3⎫ ⎩⎨6⎭⎬
处的搜索方向。
大
(a)利用步长为 0.1 的向前有限差分法,目标函数的导数可以通过数值微分方法获
学
得,目标函数的值如下表所示:
课
程
f (x)
x2
考
5.9
6.0
6.1
试
x1 2.9 47.71 44.27
40.96
卷
3.0 71.27 67.00 62.87
南
过改变参数ω (25 到 45 之间)和 t(16 到 24 之间),他收集到如下一组 f 的数
大
据。
学
课
f
ω
程
25
30
35
40
45
考
16
10.7
10.0
9.5
8.8
9.2
试
t 18
10.2
9.3
8.6
7.8
8.1
卷
20
9.7
8.8
7.8
6.9
7.2
22
(完整)湖南大学离散数学考试试卷
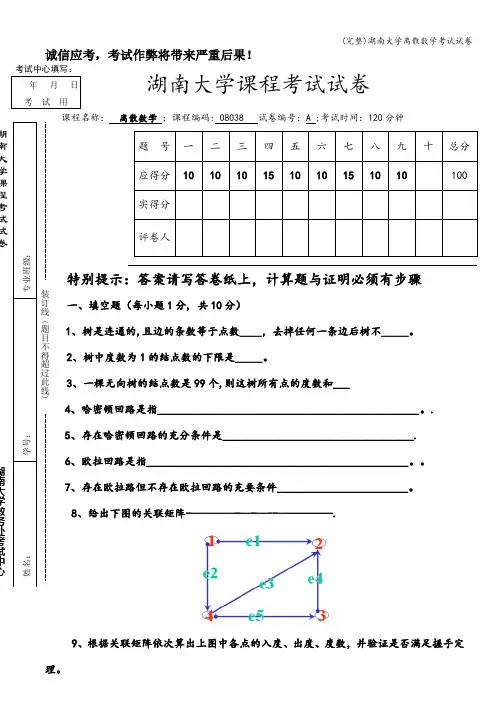
(完整)湖南大学离散数学考试试卷诚信应考,考试作弊将带来严重后果!湖南大学课程考试试卷课程名称: 离散数学 ;课程编码: 08038 试卷编号:A ;考试时间:120分钟题 号 一 二 三 四 五 六 七 八 九 十总分 应得分 10 1010151010151010100实得分 评卷人特别提示:答案请写答卷纸上,计算题与证明必须有步骤一、填空题(每小题1分, 共10分)1、树是连通的,且边的条数等于点数____,去掉任何一条边后树不_____。
2、树中度数为1的结点数的下限是_____。
3、一棵无向树的结点数是99个,则这树所有点的度数和___4、哈密顿回路是指________________________________________________。
.5、存在哈密顿回路的充分条件是___________________________________.6、欧拉回路是指________________________________________________。
7、存在欧拉路但不存在欧拉回路的充要条件________________________。
8、给出下图的关联矩阵-————-—-—--—————.9、根据关联矩阵依次算出上图中各点的入度、出度、度数,并验证是否满足握手定理。
____年___月___日考 试 用 专业班级:学号:姓名: 装订线(题目不得超过此线)湖南大学课程考试试卷湖南大学教务处考试中心(完整)湖南大学离散数学考试试卷10、关系R是集合A上的等价关系,那么关系R的_____是集合一个划分,给定义集合A的一个划分,如何构造出集合A上的等价关系__________。
二、(10分) 黄、李、肖预测德国A、乌拉圭B、西班牙C、荷兰D的名次,黄说“德国冠军,乌拉圭亚军”,李说“荷兰亚军,西班牙第4名”,肖说“德国亚军,乌拉圭第四名”,结果三人预测的结果都只对了一个,请问最后的名次是什么。
湖南大学课程考试试卷(开卷)

湖南大学课程考试试卷(开卷)课程编号: ;课程名称: 机械CAD 技术 ;试卷编号: B ;考试时间:120分钟2、以下说法不.正确的是……………………………………………( ) A 、模型是信息的载体,信息完备的设计模型是现代CAD 技术的核心B 、组合变换由多个基本变换复合而成,复合变换矩阵为各个基本变换矩阵的乘积,且与相乘的顺序无关。
C 、特征类是对特征的所有相同性质或属性的抽象概括,特征对象是特征类的一个实例。
D 、B-rep 模型是基于图的,所有的几何拓扑信息显示地表达在面-边-顶点图中。
3、 如果要把图(a )所示坐标系通过旋转变为图(b )所示坐标系,应采取的操作是(是右手坐标系吗?)………………………………………………( )A 、+ZC 轴:XC →YC 角度90度B 、-ZC 轴:XC →YC 角度90度 C 、+YC 轴:XC →ZC 角度90度D 、-YC 轴:XC →ZC 角度90度4、下列不是..GRIP 语言中主词的是…………………………( ) A 、LINE B 、MATRIX C 、TRANSL D 、SOLSPH5、在语句NUMBER/B (2,2,2),DATA/B ,1,2,3,4,5,6,7,8中,数组B 中列2行1深1的值为……………………………………( )A 、3B 、5C 、6D 、76.下面哪种装配方法不是..UG 中创建装配体的方法?…………………( ) A 、自上向下装配 B 、自底向上装配C 、自前向后装配D 、混合装配题号 一 二 三 四 五 六 附加题 总分应得分 15 18 18 10 24 15 20 100+20实得分评分:评卷人第1页(共8页)第2页(共8页)考试中心填写: 年 月 日 考 试 用湖南大学课程考试卷 湖南大学教务处考试中心专业班级:学号 姓名:装订线(答案不得超过此线) 一、填空题(每题3分,共15分)1、通过CAD 软件系统的二次开发工作,主要可以分为三种方式,分别为:2、布尔运算操作用于UG 建模时确定多个体(片体或实体)之间的组合关系分别是 共3种。
(精品)湖南大学课程考试试卷3(08级)
湖南大学课程考试试卷A ) 实参可以将数据传给形参;B ) 实参和形参是不同的变量;C ) 形参可以将数据传给实参;D ) 实参和形参必须个数相等,类型一致。
9、C 语言中,变量和函数具有两个属性是( )。
A )作用域和生存期B )类型和存储类别C )作用域和类型D )作用域和存储类别10、定义函数时,若函数的类型缺省,则函数的默认类型是( )。
A )charB ) voidC )floatD )int 11、当调用函数时,实参是一个数组名,则向函数传送的是( )。
A) 数组的长度 B) 数组的首地址C) 数组每一个元素的地址 D) 数组每个元素中的值 12、设有以下说明语句 struct ex{ int x ; float y; char z ;} example; 则下面的叙述中不正确的是( )。
A) struct 结构体类型的关键字 B) example 是结构体类型名C) x,y,z 都是结构体成员名 D) struct ex 是结构体类型 13、设在程序中,a 、b 、c 均被定义为整型 ,并且已经赋大于1的值,则下列能表示代数式abc1的表达式是( )。
A) 1/a*b*c B) 1/(a*b*c) C) 1/a/b/(float)c D) 1.0/a/b/c14、在下列的表达式中,能正确表示“x>=10或x<=0”的是( )。
A) x>=10 || x<=0 B) x>=10 | x<=0 C) x>=10 or x<=0 D) x>=10 && x<=015、设有a=5, b=6 , c=17 , d=28 , m=13 , n=24 , 执行 (m=a>b)&&(n=c>d) 后,n 的值应该是( )。
A) 0 B) 1 C) 24 D) 316、若有宏定义 #define fun(x) x*x ;则当b=3时,执行fun(b-2)的结果为( )。
湖南大学课程考试试卷-电工技术
一、单项选择题:(本大题共8个小题,每小题2分,共16分) 1、图示电路中,输出功率的是(A 、恒压源B 、恒流源C 、恒压源和恒流源1Ω2、在RLC 电路中,电阻消耗的有功功率为30W ,电感和电容的无功功率分别为70var 和30var ,则电路的视在功率为( )。
A 130VAB 50VAC 70VA3、某三角形联接的三相对称负载,接入三相对称电源,则电路的线电流与相电流之比为( )。
A 3B 2C 1 4、采用自藕变压器降压起动时,起动转矩降为直接起动时的( )。
A 、1/kB 、1/3C 、1/k 25、变压器原副绕组匝数为N1=1200匝,N2=400匝,副边接上R L =9Ω的电阻,则原边等效电阻LR '=( )。
A :1Ω B :27Ω C :81Ω6、能够起到过载保护的控制电器为( )。
A 、熔断器B 、热继电器C 、交流接触器 7、 在电动机的继电器接触器控制电路中,零压保护的功能是( ) 。
A 、防止电源电压降低烧坏电动机B 、防止停电后恢复供电时电动机自行起动C 、实现短路保护8、 在中性点接地的三相四线制低压供电系统中,为了防止触电事故,对电气设备应采取( )措施。
A :保护接地B :保护接零C :工作接地二、如图所示电路中,30S =U V ,2S =I A ,31=R Ω,62=R Ω,23=R Ω,34=R Ω,试用叠加定理计算恒流源I S 两端的电压U 。
(要求画出各电源单独作用的电路,标出各支路电流、电压的参考方向)。
(本大题14分)-三、(1)求图所示电路中a 、b 两点之间的电压。
(2)若在a 、b 之间接一个1L R Ω的电阻,问通过该电阻的电流I 为多少?(用戴维南定理计算,要求画出求开路电压、求等效电源内阻及在等效电路中求I 的电路)(本大题14分)SU四、在图示电路中,已知总电流相量为10 I 0°A ,求:(1)电流相量1I 、2I 和电压相量U; (2)电路的有功功率P 、无功功率Q 、视在功率S 。
湖南大学课程考试试卷
诚信应考,考试作弊将带来严重后果!湖南大学课程考试试卷课程名称:运筹学与最优化;课程编码:MA05006试卷编号:A;考试时间:120分钟4、双人博弈即矩阵对策中,局中人采用的是什么决策准则?5、动态规划是具有 性质的多阶段决策问题.6、已知()f x 是n R 中的连续可微的凸函数,则在满足 条件下,*x 是无约束问题min ()f x 的全局最优解。
7、在求解无约束优化问题的牛顿法中,若牛顿方向)()(12k k N k x f x f d ∇-∇=-不是下降方向,你可以采取的策略主要有(至少2个) 8、若在x D ∈处 成立,则(,)(,)SFD x D LFD x D =.9、采用精确线性搜索的共轭梯度算法求解n R 空间中凸二次函数极小化问题1min ()2T T f x x Qx q x =+,则算法最多经过 次迭代达到问题的最优解。
10、下列约束优化问题221213123min ()s.t. 1f x x x x x x x x =-+-+=的增广拉格朗日函数是 . 二、(10分)设:n f R R →是连续可微的凸函数,证明:n d R ∈是f 在x 处的下降方向的充要条件是()0T f x d ∇<.三、(12分)已知 ,,n m n m n x R A R b R c R ⨯∈∈∈∈,,考虑下面的线性规划问题(P ):mins.t. 0T z c x Ax b x ==⎧⎨≥⎩(1)写出该线性规划的KKT 条件;(5分) (2)写出该线性规划的对偶问题(D );(5分)(3)说明线性规划问题(P )的解和它的对偶问题(D )的解有何关系?(2分)四、(13分)已知二次函数c x b Qx x x f T T++=21)(,其中Q 为n 阶对称正定矩阵,n R b ∈.现在从任意初始点0x 出发,使用精确搜索的Newton 法求解极小化问题)(min x f nRx ∈, (1)证明: 最多经一次迭代即可达到f 的最小值点.(8分)(2)该问题如果采用最速下降法或共轭梯度法,计算速度如何?请根据你的数值计算经验和相关理论加以分析比较。
湖南大学课程考试试卷(闭卷) 课程名称:弹性力学; 试卷编号:A ;考试
湖南大学课程考试试卷(闭卷)一、填空题(每空2分,共40分)1、弹性力学边值问题中第一类边值问题又称为( )。
对于该类边值问题,作用在其边界上的集中力应转换为( ),集中力偶应转换为( )。
第二类边值问题又称为( )。
第三类边值问题又称为( )。
对于该类边值问题,如果物体的表面S 的一部分S σ上作用面力,在另一部分S u 上给定位移,则S 、S σ、S u 之间的关系应该满足( )。
2、已知平面应力状态下,板的应力函数为ϕ =x 3+2x 2y +y 3,如果不计体积力,则应力分量为σx =( )、σy =( )、τxy =( )。
对应的应变分量为(已知弹性常数E 和)εx =( )、εz =( )、γxy =()。
3、在直角坐标系下,平面应力问题的基本未知量包括应力分量( )、应变分量( )和位移分量()。
此外有非零不独立量()。
平面应变问题的基本未知量与平面应力问题( )( 填相同或不同 )。
其非零不独立量有( )。
、如图所示曲梁受集中力P 和弯矩M 的作用,则在r=a , b 处应该满足的边界条件为( );在θ =0处,由圣维南原理,应满足的边界条件为( )。
考试中心填写 姓名:学号:专业班级:二、计算题(共60分)1、一闭口薄壁杆如图所示,承受扭矩T作用,若杆件的壁厚均为 ,试求管壁中的最大剪应力及单位长度扭转角。
(10分)ϕ=+,试求对如图所示正方形板的面力(以表面的法向和切向2、已知应力函数为32A x xy()力表示),并画出面力分布图。
(10分)3、将一弹性立方体放在同样大小的刚性盒内,如图所示。
在弹性体的上表面受均布压力q作用,弹性体的E、 为已知。
试求刚体盒内侧面所受的压力、弹性体的体积应变和弹性体中的最大剪应力。
(10分)4、如图所示为一在集中力P、力偶M和均布载荷q共同作用下的矩形截面悬臂梁。
(1) 试根据材料力学写出σx和τxy公式;(2) 然后验证该公式是否满足平衡方程和边界条件,并导出σy的表达式;(3) 所得到的应力解是不是弹性力学的精确解?为什么?(15分)q5、如图所示矩形截面悬臂梁受均匀分布载荷作用。
湖南大学课程考试试卷1
word 格式支持编辑,如有帮助欢迎下载支持。
湖南大学课程考试试卷课程名称:《计算机操作实践》 试卷编号: 1 考试时间:60分钟 一. Windows 操作(10分) 在考生文件夹下新建文件夹kaoshi 在桌面上建立指向此文件夹的快捷方式 将考生文件夹下win 文件夹下的所有bmp 图像文件拷贝到kaoshi 文件夹下 将win 文件夹下的a1.txt 改名为x.txt 将wind 文件夹下的a2.txt 设为只读和隐藏属性 二. Word 操作(30分) 建立文档《从鸟声中醒来》,保存到kaoshi 文件夹下(2分) 插入word 文件夹下的文件《word 素材1》(3分) 插入竖排文本框,输入文字“从鸟声中醒来”,设置字体为华文彩云,字号为一号字,字形为加粗,字体颜色为红色,间距加宽为3磅,居中。
(5分) 设置文本框版式为四周型,线条颜色为无,设置高为8.25厘米,宽度为1.91厘米(5分) 选中全文,设字体为宋体,字号为四号,2倍行距。
将一、二段首行缩进2个字符。
(5分) 插入word 文件夹下图片《鸟》,设置版式为衬于文字下方,亮度为85%,对比度为15%(3分) 将诗“一庐临水曲,野树抱山来。
仿佛幽人意,琴声几度回”设为居中。
(2分) 选中最后一段,将其分为两栏,中间有分隔线。
(3分) 在文档页眉处输入:美文欣赏。
(2分) 三. Excel 操作(25分) 建立工作簿《成绩表》,保存到kaoshi 文件夹下。
(2分) 将SHEET1表改名为“期末成绩”,将excel 文件夹下的文件《excel 素材1》中A1:G16区域的数据复制过来。
(4分) 将A1:G1的单元格合并,使单元格的文本居中(2分) 为表格加实线边框,外边框粗线,内部细线(2分) 设置A2:G2区域字形加粗,字体颜色为白色,底纹颜色为蓝色。
(2分) 将第二行的行高设为25,第A 列的列宽设为12,在二行一列的单元格中设置斜线表头文档从互联网中收集,已重新修正排版,word格式支持编辑,如有帮助欢迎下载支持。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(A )0.1 mol·kg -1CuSO 4 (B )0.1 mol·kg -1Na 2SO 4 (C )0.1 mol·kg -1Na 2S (D )0.1 mol·kg -1氨水5. 298K 时,电池Zn|ZnCl 2(m = 0.5 mol·kg -1)|AgCl(s) |Ag 的电动势E = 1.015 V ,其温度系数为- 4.92×10-3 V·K -1,若电池以可逆方式输出2法拉第的电量,则电池反应的Δr H m (单位:kJ·mol -1)应为 ( D )(A )– 198 (B )198 (C )239 (D )–2396. 298K 时,溶液中有Ag +(a = 1),Ni 2+(a = 1)和H +(a = 0.001)离子,已知氢在Ag 、Ni 的超电势分别为0.20V 和0.24V ,φ (Ag/Ag +) = 0.799 V ,φ (Ni/Ni 2+) = -0.250 V ,电解时外加电压从零开始逐步增加,则在阴极上析出物质的顺序是( A ) (A )Ag 、Ni 、H 2 (B ) Ni 、Ag 、H 2 (C )Ag 、H 2、Ni (D )Ni 、H 2、Ag7. 在海上航行的轮船,常将锌块镶嵌于船底四周,这样船身可减轻腐蚀,此种方称为( A )(A )阴极保护牺牲阳极法 (B )阳极保护法(C )金属保护层法 (D )电化学保护法8. LiCl 的无限稀释摩尔电导率为 115.03×10-4 S·m 2·mol -1,在 298 K 时,测得 LiCl 稀溶液中 Li + 的迁移数为 0.3364,则 Cl - 离子的摩尔电导率为:( A ) (A )76.33×10-4 S·m 2·mol -1 (B )113.03×10-4 S·m 2·mol -1 (C )38.70×10-4 S·m 2·mol -1 (D )76.33×102 S·m 2·mol -19. 在温度 T 时,实验测得某化合物在溶液中分解的数据如下:考试中心填写装订钱(答案不得超过此线)湖南大学课程考试试卷湖南大学教务处考试中 半衰期 4280 885 174则该化合物分解反应的级数为: ( D ) (A )零级(B )一级反应 (C )二级反应 (D )三级反应10. 2M → P 为二级反应,若 M 的起始浓度为1 mol·dm -3,反应1 h 后 ,M 的浓 度减少 1/2,则反应 2 h 后 ,M 的浓度是: ( B ) (A )1/4 mol·dm -3 (B )1/3 mol·dm -3(C )1/6 mol·dm -3 (D )缺少k 值无法求 二. 简答题(32分,每题8分) 1. Zn 和Ag 插在HCl 溶液中所构成的原电池是否是可逆电池?为什么? 答:不是可逆电池。
因为电池充、放电时,电池反应是不可逆的。
放电反应:Zn + 2H + → Zn 2+ + H 2 充电反应:2Ag + 2H + → 2Ag + + H 22. 298 K 时, 某钢铁容器内盛 pH = 4.0 的溶液,试通过计算说明此时钢铁容器是否会被腐蚀?假定容器内 Fe2+浓度超过 10-6 mol·dm -3 时,则认为容器已被腐蚀。
已知:ϕ (Fe 2+/Fe) = -0.4402 V ,H 2在铁上析出时的超电势为 0.40 V 。
答: ϕ(H +/H 2) = (- 0.05916 pH -0.40)V = -0.6366 V ϕ(Fe 2+/Fe) = -0.6177 Vϕ (Fe 2+/Fe) > ϕ(H +/H 2), Fe 2+ 易还原为 Fe ,H 2 被氧化为 H + , 故容器不被腐蚀。
3. 化学动力学和化学热力学所解决的问题有何不同? 举例说明。
答:化学热力学解决某一反应在一定条件能否会自发进行的判据,进行到什么程度为止(化学平衡态),而动力学却要解决反应进行得快慢与反应机理,计算某一反应在一定温度下经过一段时间转化率为多少?热力学解决可能性,动力学解决现实性。
例如:合成NH 3反应,H 2与O 2点燃反应。
4. 在一定温度和外加电压下,在希托夫管中用两个银电极电解AgNO 3水溶液。
通电一定时间后,测得阳极区AgNO 3的物质的量的增量为 n (AgNO 3),阳极上Ag 减少的物质的量为n (Ag)。
(1)试写出AgNO 3的正、负离子迁移数的计算式;(2)在相同温度下,用上述同一设备测定同样浓度的AgNO 3溶液正、负离子的迁移数,通电时间相同,但外加电压增加,n (AgNO 3),n (Ag) 及迁移数是否发生变化? 答:(1)电解时任一电极反应的物质的量在数值上等于通过溶液总电量的法拉第数;阳极区AgNO 3增加的物质的量等于NO 3- 迁出阴极区的物质的量,等于NO 3-传导电量的法拉第数,所以:NO 3- 的迁移数: t (NO 3-) = n (AgNO 3)/n (Ag)Ag +的迁移数: t (Ag + ) = 1- t (NO 3-)(2) 当外加电压增加时,n (AgNO 3)及n (Ag)将以相等的倍数增加,正、负离 子运动速度增加的倍数也必然相等,故t (Ag +)及t (NO 3-)皆不变。
三.计算题(共48分)1. (14分)298 K ,101325 Pa 时,以Pt 为阴极,石墨为阳极,电解含有FeCl 2 (0.01 mol·dm -3)和CuCl 2 (0.02 mol·dm -3)的水溶液,若电解过程中不断搅拌,并设超电势均可忽略不计,活度系数为1。
问(1)何种金属先析出?(2)第二种金属析出时,至少需加多装订钱(答案不得超过此线)湖南大学课程考试试卷湖南大学教务处考试中[φ (Fe) = -0.44021 V ;φ (O 2/H +) = 1.229 V ;φ (Cu) = 0.337 V ;φ (Cl 2) = 1.360 V] 解:(1) φ(Fe) = φ (Fe) + RT/2Fln a (Fe 2+) = -0.4994 Vφ(Cu) = φ(Cu) + RT/2Fln a (Cu 2+) = 0.287 V 故铜先析出(2) 阳极反应:H 2O→ O 2 + 2H + + 2e 故铜全析出后H + 增加0.04 mol·dm -3 φ(O 2) = φ(O 2) + RT/Fln(10-7+0.04) = 1.146 Vφ(Fe) = φ (Fe) + RT/2Fln a (Fe 2+) = -0.499 V E = φ(O 2) - φ(Fe) = 1.146 – (-0.499) = 1.645 V(3) Fe 析出时φ(Fe) = φ(Cu) = φ (Cu) + RT/2Fln a (Cu 2+) = 0.287 V -0.499 = 0.337 + (0.05915/2)lg a (Cu 2+), lg a (Cu 2+) = -28.2671 [Cu 2+] = 5.4×10-29 mol·dm -32. (14分)在298K 时,用铜电极电解铜氨溶液,已知溶液中每1000 g 水中含CuSO 4 15.96 g , NH 3 17.0 g ,当有0.01 mol 电子的电量通过以后,在103.66 g 阳极溶液中含有2.091 g CuSO 4,1.571 g NH 3,试求: (1) [Cu(NH 3)x ]2+离子中的x 值。
(2) 该络合物离子的迁移数。
3. (20分)今有电池:Pt ⎪H 2(g,100kPa)⎪H 2SO 4(b )⎪Ag 2SO 4(s)⎪Ag(s),己知在298.15 K 下,上述电池的标准电动势E = 0.653 V ,E Ag+/Ag = 0.7996 V 。
(1) 写出上述电池的电极反应与电池反应,计算反应的mG ∆和K 。
(2) 在298.15 K 下实验测得H 2SO 4在浓度为b 时,上述电池的电动势E = 0.623 V ,已知H 2S04浓度为b 时的离子平均活度系数γ± = 0.7,问此条件下溶液中H 2S04的质量摩尔浓度b 为多少? (3) 计算Ag 2SO 4(s)的溶度积sp K 解:(1)阳极反应:2H (100kPa)H 2H ()2e a ++-+阴极反应:Ag 2SO 4(s) + 2e - 2Ag(s)+SO 42-(a SO42-)电池反应: ()224H (100kPa) Ag SO s +2424H SO 2H ()+2 Ag(s)SO a a +-+-+m 12964850.653126.01 kJ mol G zE F -∆==-⨯⨯=-⋅-3m 126.010ln 50.8608.314298G K RT ∆⨯=-=-=⨯221.22510K =⨯ (2) 根据能斯特方程:24ln (H SO )RTE E a zF=- 242()296485(0.6530.623)ln (H SO ) 2.3358.314298.15F E E a RT -⨯⨯-===⨯24(H SO )10.334a =2433H SO (/)a a b b γ±±±==()1/313124(H SO)10.3340.7 3.112 mol kg b a bγ-±±===⋅而: {}+241/3213213H SO ()(2)4b b b b b b -±=⋅=⨯=所以:1/31/31/4 3.112/4 1.960mol kg b b -±===⋅ (3)由题设知:24(Ag SO /Ag)0.623V E E ==装订钱(答案不得超过此线)湖南大学课程考试试卷湖南大学教务处考试中 24sp 0.05916(Ag SO /Ag)=(Ag /Ag)+lg 2E E K + {}+sp 24lg 2(Ag SO /Ag Ag /Ag)/0.05926 4.956K E E ==-)-(求得:5sp 1.10610K -⨯=。
