阳离子聚合
阳离子聚合

汇报结束
谢谢大家! 请各位批评指正
4、 阳离子聚合反应的机理
阳离子聚合反应历程为链引发、链增长和链终止等三个步骤。 1).链引发
2).链增长
3).链终止 • 有很多种反应能够导致正离子聚合反应中生长链的终止。但是,终止反应是否发生动力学链的 终止是一个重要的差别。
9.3 丁基橡胶聚合工艺
1、 生产丁基橡胶的原料、规格
合成丁基橡胶的主要原料: 单体:异丁烯及异戊二烯; 溶剂: 氯甲烷,质量分数为74%~39%; 催化剂: AlCl3,0.2~0.3%(以单体为准); 共引发剂:水,0.002%(AlCl3为基准); 相对分子量调节剂:乙烯或丙烯。
6、 生产控制因索
1).杂质
• 按照其作用原理,杂质可以分为给电子体和烯烃两类。 • 当给电子体杂质含量极少时,与AlCl3生成的络合物可以离解成为活性催化剂;但是,若杂质与AlCl3反 应生成物活性不高,会导致转化率降低。 • 烯烃类杂质:正丁烯的存在可以加剧链转移反应,使分子量降低;而系统内存在二异丁烯时,只有当 催化剂对二异丁烯的比例达到一定的程度之后,聚合才能开始。
阳离子聚合
❖ 共价键均相断裂产生两个自由基,非均相断裂则产生离子。 ❖ 单体类型:乙烯基单体、二烯烃单体以及一些杂环化合物。 ❖ 同样具有链引发、链增长、链转移、链终止等基元反应。 ❖ 不同之处:
▪ 在自由基聚合过程中引发剂种类对链增长反应无影响,但在离子聚合过程中由于对应离子的存在所 以其种类的不同会明显影响增长链末端的性质;
2).单体浓度和配料比
• 单体浓度过高,反应温度升高很快,反应过于激烈难以控制,容易导致结块,甚至催化剂还未加足 量就被迫停止反应。 • 单体浓度过低时,结冰现象严重,(一氯化碳冰点为 -97.7℃)也不能获得较高的转化率。
阳离子聚合
胺:形成稳定的季铵盐 无引发活性
HMnM (CR) + XA ktr,s HMnMA + X (CR)
苯醌:自由基聚合的阻聚剂, 对阳离子聚合起阻聚作用,将质子转移给苯醌分子, 形成稳定的二价阳离子而终止。
2 HMnM (CR) + O
O
2 HMnM + HO
2
OH
(CR)2
自由基聚合:苯醌的阻聚作用机理
丁基橡胶:氯甲烷为溶剂 -100℃以下,主要向单体转移; -100℃以上,主要向溶剂转移。
拐点
1/T
6.3.5 影响阳离子聚合的因素 (1)溶剂的影响
AB
AB
AB
A +B
共价键
紧密离子对 被溶剂隔开的离子对 平衡离子对(松对)
自由离子
大多数聚合活性种处于平衡离子对和自由离子状态 kp(+) :自由离子增长速率常数 kp(±) :离子对增长速率常数 kp(+) > kp(±) 1~3个数量级
因此,阳离子聚合引发体系较少离解成自由离子
(2)反离子
z 反离子对阳离子聚合影响很大。 z 反离子的亲核性
亲核性过强,易与碳阳离子结合,使链终止。
z 反离子的体积 体积大,离子对疏松,聚合速率大。
(3)聚合温度
对聚合速率的影响
kR =
ki kp kt
kR =
Ai Ap At
e-(Ei
+
Ep
-
Et)
丁二烯、异戊二烯等,π电子流动性很大,易诱导
极化,能按上述三种机理进行聚合。
(3)溶剂
自由基聚合
9 影响引发剂的诱导分解和链转移反应。
9 向溶剂链转移,降低分子量 9 笼蔽效应,降低引发剂效率 f 9 溶剂加入,减小了[M],降低了Rp 9 水也可作介质而进行悬浮、乳液聚合等
4.2 阳离子聚合解析
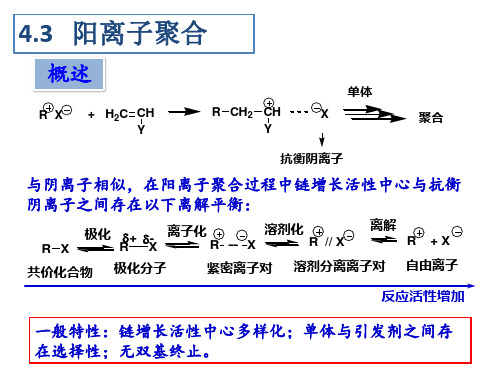
概述
单体 R X + H2C CH Y R CH2 CH Y X 聚合
抗衡阴离子
与阴离子相似,在阳离子聚合过程中链增长活性中心与抗衡 阴离子之间存在以下离解平衡:
R X 极化 + - 离子化 R R X 极化分子 溶剂化 X R // X 溶剂分离离子对 离解 R +X 自由离子
能否聚合成高聚物,还要求:
阳离子对碳-碳双键有较强的亲合力 增长反应比其它副反应快,即生成的碳阳离子有适 当的稳定性
• 对单体种类进行讨论 (可由单体与质子的亲和力相应 的热焓-△H判断):
(1) -烯烃
CH2 CH2
-△H( kJ/mol) 640 无取代基,不易极化, 对质子亲和力小,不 能发生阳离子聚合
CH2
CH OR
p- 共轭
诱导效应使双键电子云密度降低,氧的电负性较大 共轭效应使双键电子云密度增加,占主导地位 共振结构使形成的碳阳离子上的正电荷分散而稳定:
H CH2 C O R CH2 H C O R
因此能够进行阳离子聚合
(3)共轭烯烃
如;St,-MeSt,B,I
电子的活动性强,易诱导极化,既能阳离子聚合, 又能阴离子聚合;但聚合活性远不如异丁烯、乙烯 烷基醚,工业很少进行这类单体的阳离子聚合 另外,环内双键也可进行阳离子聚合。
BF3 + H2O
CH3 CH2 C + H (BF3OH) CH3
H (BF3OH)
CH3 CH3
引发剂-共引 发剂络合物
C (BF3OH) CH3
引发剂和共引发剂的不同组合,得到不同的引发 活性。
主引发剂:与其接受电子的能力及其酸性强弱有关。
阳离子聚合

❖生成的聚合物能成为细小颗粒分散于溶剂中形成淤浆状,这 样可减少传热阻力,快速聚合,从而可提高生产能力。
第七章 阳离子聚合原理及其合成工艺
❖ 7.2.2 聚合体系各组分及作用 ❖ 一、聚合单体
❖ 异丁烯,无色气体,熔点-140.3℃, 沸点-6.9℃,易聚合,可 爆炸极限1.7%-9.0%(体积分数)。异丁烯具有窒息、弱麻醉和弱 刺激性质。
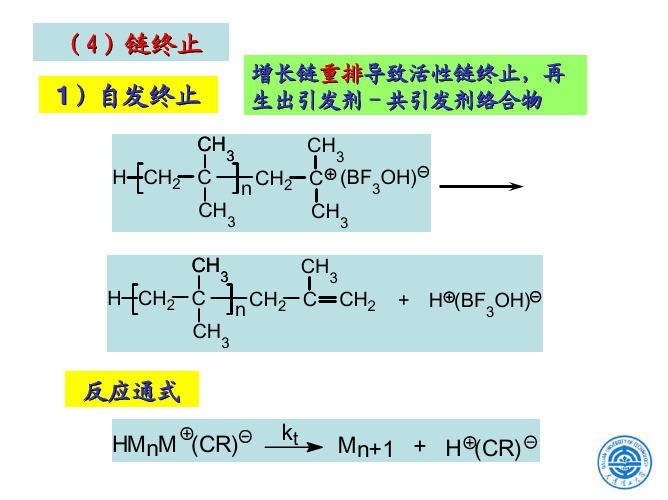
(1) 向反离子转移(自发终止或向反离子转移终止)
CH3 ~CH2-C|+[BF3OH]- →
|
CH3
CH2
||
~CH2-C + H+[BF3OH]-
|
CH3
第七章 阳离子聚合原理及其合成工艺
链转移
(2)向溶剂的链转移
CH2 CH2 X + Ph
+H2C CH Ph
CH2 CH Ph
+ CH3 CH2X Ph
❖ 异丁烯与少量异戊二烯(1~5%)的共聚物。 ❖ 粘均分子量20-40万,分布指数为 2.5-3 。
第七章 阳离子聚合原理及其合成工艺
❖ 透气性是烃类橡胶中最低的,作为内胎及电绝缘层。
❖ 由于异戊二烯量少,使硫化速度降低,妨碍了丁基橡胶 与轮胎常用的高不饱和橡胶的共硫化。
第七章 阳离子聚合原理及其合成工艺
引发剂的配制有常温配制法和低温配制法两种常 用方法。
第七章 阳离子聚合原理及其合成工艺
二、聚合
冷却至-100℃左右的单体溶液和催化剂溶液分别送 入聚合反应釜,开动搅拌,聚合反应开始,迅速生成聚 合产物,聚合物在氯甲烷中析出形成颗粒状悬浮浆液。 反应热由通入反应釜内冷却列管液态乙烯带出。
2.2.3.2阳离子聚合1.阳离子聚合单体3.阳离子聚合机理(精)

HMnM (CR) + XA
ktr,s
HMnMA + X (CR)
阳离子聚合机理的特点: 快引发,快增长,易转移,难终止
12
离子聚合与自由基聚合特征区别
引发剂种类
偶氮类 过氧类 氧化还原体系
自由基聚合: 采用受热易产生自由基的物质作为引发剂
引发剂的性质只影响引发反应,用量影响 Rp和 离子聚合 采用容易产生活性离子的物质作为引发剂 阳离子聚合:亲电试剂,主要是Lewis酸,需共引发剂 阴离子聚合:亲核试剂,主要是碱金属及金属有机化合物
引发剂生成阳离子; 引发单体生成碳阳离子;
电荷转移引发,即引发剂和单体先形成电荷转移络合 物而后引发
4
质子酸引发
质子酸包括: H2SO4,H3PO4,HClO4, CF3COOH,CCl3COOH
质子酸先电离产生H+,然后与单体加成形成 引发活性中心 活性单体离子对
HA
H A
H A
CH X CH3 CH A X
+ CH2
条件Leabharlann 酸要有足够的强度产生H+,故弱酸不行 酸根的亲核性不能太强,否则会与活性中心结合成 共价键而终止
5
Lewis酸引发
各种金属卤化物,都是电子的接受体,称Lewis酸 从工业角度看,是阳离子聚合最重要的引发剂
Lewis酸包括: 金属卤化物: BF3 , AlCl3, SnCl4 , TiCl4, SbCl5, PCl5, ZnCl2 金属卤氧化物: POCl3,CrO2Cl,SOCl2,VOCl3
14
溶剂的影响
自由基聚合
向溶剂链转移,降低分子量 笼蔽效应,降低引发剂效率 f 溶剂加入,降低了[M],Rp略有降低 水也可作溶剂,进行悬浮、乳液聚合 溶剂的极性和溶剂化能力,对活性种的形态有较 大影响:离子对、自由离子
阳离子聚合、阴离子聚合、自由基聚合

阳离子聚合、阴离子聚合、自由基聚合阳离子聚合阳离子聚合,又称正离子聚合,是指由正离子发生的一种聚合反应。
阳离子聚合的特点是当正离子和水分子发生交互作用时,它们之间会发生强烈的相互作用,形成由水分子和正离子组成的非常紧密的三角形结构,由此而形成的物质称为“阳离子聚合”。
阳离子聚合的反应机理可以通过图示来描述:在正离子和水分子之间发生交互作用时,水分子会在其中形成一个吸引力场,正离子就会被吸引到水分子的表面,并形成一个三角形结构,其中正离子占据两个顶点,水分子占据第三个顶点。
此时,在正离子和水分子之间形成了一种强烈的化学键。
由于水分子和正离子之间的相互作用强烈,因此,当水分子和正离子之间发生聚合反应时,会形成非常紧密的三角形结构,这就是所谓的“阳离子聚合”。
阳离子聚合反应不但能够使不同的正离子结合起来,也能使正离子和脂肪盐、酸盐、碱盐等离子结合起来,从而形成更大的高分子结构。
阴离子聚合阴离子聚合,又称负离子聚合,是指由负离子发生的一种聚合反应。
阴离子聚合的特点是负离子和水分子发生交互作用时,形成的结构是一个具有非常强亲合力的"四方锥"形,由此而形成的物质称为“阴离子聚合”。
阴离子聚合的反应机理可以通过图示来描述:在负离子和水分子之间发生交互作用时,水分子会在其中形成一个吸引力场,负离子就会被吸引到水分子的表面,并形成一个四方锥形结构,其中负离子占据三个顶点,水分子占据第四个顶点。
此时,在负离子和水分子之间形成了一种强烈的化学键。
由于水分子和负离子之间的相互作用强烈,因此,当水分子和负离子之间发生聚合反应时,会形成非常紧密的四方锥形结构,这就是所谓的“阴离子聚合”。
阴离子聚合反应不但能够使不同的负离子结合起来,也能使负离子和脂肪盐、酸盐、碱盐等离子结合起来,从而形成更大的高分子结构。
自由基聚合自由基聚合是指由自由基发生的一种聚合反应,是最重要的一类聚合反应。
自由基聚合的特点是当自由基和另一个物质发生反应时,会形成新的物质,这种物质称为“聚合物”,而原来的自由基则被称为“聚合剂”。
第二章 第三节阳离子聚合反应
3.4 阳离子聚合反应机理 阳离子聚合由链引发、链增长、链终止及链转移四个 主要基元反应所组成。其特点为:快引发、快增长、易转 移、难终止。 3.4.1 链引发 阳离子聚合引发速率很快,活化能Ei=8.4~21kJ/mol, 远低于自由基聚合引发(Ed=105~125kJ/mol)。
3.4.2 链增长 链增长是通过把单体分子连续地插入单体的活性中心 的正负离子间而发生。 1. 单体的反应活性 双键上取代基的给电子性越强,双键电子云密度越高, 越易受亲电试剂进攻,单体活性越高; 但一旦生成链碳阳离子后,给电子取代基分散碳阳离 子的电正性,降低链碳阳离子的活性,起稳定链碳阳离子 的作用,即单体的反应活性与其形成的增长链活性相反。
c. 立体规整度以及立体规整性(全同立构亦 或间同立构)随溶剂极性不同而改变 非极性溶剂有利于立体规整度的提高。 非极性溶剂有利于全同立构的生成,而 极性溶剂有利于间同立构的生成。
4. 阳离子聚合中的异构化反应 碳阳离子可进行重排形成更稳定的碳阳离子, 在阳离子聚合中也存在这种重排反应,如: 3-甲基-1-丁烯的阳离子聚合:
3.5.3 添加某些链转移剂或终止剂(往往是主要终止 方式)
HMnM+(CR)- + XA → HMnMA + XCR
除碳阳离子外,通常硫、氧阳离子活性都较 低,添加水、醇、酸、酐、酯、醚等,实际上都 能使链终止。 在阳离子聚合中,真正的动力学链终止反应 比较稀少,但又不像阴离子聚合,很难生成活的 聚合物,主要原因在于体系难以做到完全除尽上 述杂质。
ii/ 酸根的亲核性 酸根的亲核性过强,与碳阳离子的离解程度较小,则 不利于单体向离子对插入增长。 如卤化氢的X-亲核性非常强,与碳阳离子之间可以形 成稳定的共价键,所以不能作为阳离子聚合的引发剂使用。 超强酸由于酸性极强,离解常数大,活性高,引发速 率快,且生成的抗衡阴离子亲核性弱,难以与增长链活性 中心成共价键而使反应终止。
第四章2阳离子聚合
C
H
稳定正离子的方法
G
C+
G
C+
吸电基团使正 离子不稳定
推电基团使 正离子稳定
2.历史回顾 初步试验
A. 1789年,Bishop R. Watsons, 松节油在酸催化下 生成树脂状聚合物。 B. 1839年,Deville,Friedel-Crafts试剂使苯乙烯聚 合。 C. 1854年,Cannizaro完成了苯甲醇聚合。
(2) IIR聚合工艺流程
无水 AlCl3 浓 AlCl3
T℃
反应釜 -100
PMPa
0.3
闪蒸塔
70
0.14
0.03 CH3Cl及未 反应单体
溶剂 CH3Cl 异丁烯 异戊二烯
真空脱气塔 50- 60
AlCl3配 制釜
冷 剂 蒸 汽 反应器 闪蒸塔 真空脱 气塔
胶 液
去 分 离
混合罐
丙烯压 缩冷却
*
OCH2CH2
n
*
CH2Cl
OCH2CH2 CH2Cl
CO
n
OCH2CH2
m
ECO
OCH2CHn 2 OCH2CH m CH2Cl OCH2CH CH2
GCO
4 石油树脂 C5树脂; C9树脂 广泛应用于热溶胶、涂料、橡胶添加剂、油漆 等 5聚苯:
AlCl3-H2O-CuCl2
n
6 聚乙烯基醚
2 聚异丁烯
低分子量聚合物 高分子量聚合物
应用:
低分子量和中分子量聚异丁烯可以用作油品添 加剂、胶黏剂、密封剂、涂料、润滑剂、增塑 剂和电缆浸渍剂等 高分子量聚异丁烯可用作塑料、生胶、热塑性 弹性体的添加剂
阳离子聚合名词解释
阳离子聚合名词解释阳离子聚合是指一种物理现象,在水溶液中,溶质的阳离子会与另一种溶质的负离子结合,形成一种新的物质。
阳离子聚合的物理和化学现象是物质化合物的基本机理。
首先,阳离子聚合是一种物理现象,它特别适用于识别水溶液中的复合物。
在水溶液中,溶质的阳离子会与另一种溶质的负离子结合,形成一种新的物质,这就是阳离子聚合。
这一现象是由势场力引起的,可以被定义为:当其中一种离子被另一种离子吸引,它们就会聚合在一起,形成一种新的物质。
如果这些离子是正离子(如硫酸根离子)和负离子(如氯离子),那么当它们聚合时,就会形成一种新的化合物,这就是阳离子聚合。
其次,阳离子聚合的化学现象是原子间的相互作用,有时也被称为“表面结合”,是原子或分子之间结合反应的基本机理。
这一反应是由一种称为“氢键”的相互作用引起的,它是由一种电离力(如硝酸根和氢离子)和两个原子之间的相异氢原子引起的。
氢键是一种不可割裂的强结合,是由原子之间的相异氢原子引起的,可以使分子形成较小的阳离子聚合物。
最后,阳离子聚合在催化剂的作用下,可以促进一种叫做水解反应的化学反应,从而使溶液中的某些物质发生变化。
在水解反应中,催化剂促进某种特定的化学反应,使反应物发生分解。
例如,硫酸根和氢离子可以在水解反应中被分解,形成质子和硫酸根离子。
在这种情况下,硝酸根离子就是一种阳离子,因此,在水解反应中,它可以与另一种负离子结合,形成一种新的物质,这就是阳离子聚合。
总之,阳离子聚合是一种物理现象,它特别适用于识别水溶液中的复合物。
它的化学现象是原子间的相互作用,有时也被称为“表面结合”,是原子或分子之间结合反应的基本机理。
它还可以在催化剂的作用下促进一种叫做水解反应的化学反应,使某些物质发生变化。
因此,阳离子聚合是一种重要的物理现象,也是化合物形成的基本机理。
高分子化学-7(阳离子聚合)
体积大,离子对疏松,聚合速率大。
25º C, S聚合(CH2Cl)2溶剂 Initiator or coinitiator I2 SnCl4-H2O HClO4 kp(L/mol. S) 0.003 0.42 17.0
3. 聚合温度的影响 ER=Ei+Ep-Et
E Xn E p Etr
ER=-21-41.8KJ/mol 易出现低温加速
阳离子:C m=10-2-10-4
自由基 C m=10-4-10-5
低温有利于控制链转移 (或从单体到增长中心负氢离子转移)
H-[-CH2C(CH3)2-]n-CH2C+(CH3)2(BF3OH)-+ CH2=C(CH3)2 CH2=C(CH3)-CH2+ BF3OH-+H-[CH2C(CH3)2]n-CH2CH(CH3)2
CH2=CH-OR + 2I2 ICH2-CHI OR
I2
ICH2-CHI3 OR
+
-
or
I2 + CH2=CH-OR
I CH=CH + HI OR
在HI中加Lewis酸: HI + ZnX2(SnX2)或HI+I2
CH-I R
I2
ZnI2
CH I3 R CH2=CH R + CH I ZnI2 R CH2=CH R
(CH3)3C+(AlCl4)-
(CH3)3C+(AlCl4)- +фCH=CH2→ (CH3)3C CH2CH+ф(AlCl4)-
a. (C6H5)3CCl+SbCl5→(C6H5)3C+SbCl6Cl + SbCl5
+
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氢卤酸(e.g:HCl、HBr)的酸根亲核性太强,一般 不作为阳离子聚合引发剂;
HSO4-、H2PO4-的亲核性稍差,可得到低聚体;
HClO4,CF3COOH,CCl3COOH的酸根亲核性较
弱,可生成高聚物
a
6
(2)Lewis酸
常见的lewis酸有AlCl3、 AlBr3、 AlEtCl2、 AlEt2Cl、 TiCl4、 SnCl4、 ZnCl2、 SbCl6、 BF3等.
活性的配合物
~CH2CXY+(BF3OH) +H2O ~ CH2CXYOH + H +(BF3OH) -
a
9
引发剂与共引发剂用量最佳比
——聚合速率最快、分子量最高。
▪共引发剂过少,活性不足, ▪共引发剂过多将终止反应。
如SnCl4-H2O引发苯乙烯聚合,以CCl4为溶剂 时,最大速率在[H2O]/[SnCl4]≈0.002,
活性次序: BF3>AlCl3>TiCl4>SnCl4 AlCl3>AlRCl2>AlR2Cl>AlR3
➢ 共引发剂:活性次序一般也即酸根强弱次序。
a
8
水的作用:
• 微量水属共引发剂
• 过量水存在时,将使阳离子聚合活性降低;
BF3 + H2O H+(BF3OH)- 水 (H3O)+(BF3OH)• 可以发生向水分子的终止反应,形成没有
1) “Lewis酸-质子酸”引发体系 常见的助引发剂(质子酸)有: H2O, HCl, HF 及 CCl3COOH
a
7
引发过程:
S nC 4+R l lC
X R(Sln5)C +CH 2=C
Y
R(Sl5 n ) C
X RH C 2 C(Sln5)C
Y
引发活性取决于向单体提供质子或R+的能力。 ➢ 主引发剂:与其接受电子的能力和酸性强弱有关。
➢ 增长反应是离子与分子间的反应,速度快,活化能低 ;
➢ 中心阳离子与反离子形成离子对。其紧密程度与溶剂 、反离子性质、温度等有关,并影响聚合速率与分子 量;
➢ 增长过程中伴有分子内重排反应。---这是阳离子最
大特点。
a
13
异构化聚合:增长离子的重复单元发生碳阳 离子的重排反应,引起聚合物分子的异构 化,这种聚合称异构化聚合(氢转移聚合)
e.g:3-甲基-1-丁烯的阳离子聚合产物有两 种结构单元
a
14
CH2 CH CH CH3 CH3
AlCl3 EtCl
EtCH2—C+H(AlCl4)CH
H3C
CH3
CH2—CH
H (AlCl4) C
负氢转移
H3C
CH3
a
(CH2—CH)n CH
H3C
CH3
Ⅰ
15
CH3 C H 2 — C H 2 — C +(A lC l4)-
CH3 1 ,3 聚 合
温度下降,kp降低,
重排机会增加,Ⅱ成
份也增加。
温度/℃
Ⅱ%
0
83
-80
86
-130
100
CH3
C H 2— C H 2— C — n
Ⅱ
CH3
a
16
3、链终止和链转移 阳离子聚合通常为链转移终止或单基终止
1、链转移终止: (1)向单体转移:活性中心向单体分子转 移,生成的大分子含有不饱和端基,同时 再生出能引发的离子对,动力学链不终止
一、阳离子聚合研究现况
1、对阳离子聚合的认识还不很深入,原因: ①阳离子活性很高,极易发生各种副反应,
很难获得高分子量的聚合物 ②碳阳离子易发生和碱性物质的结合、转
移、异构化等副反应——构成了阳离子 聚合的特点 ③引发过程十分复杂,至今未能完全确定
a
1
2、目前唯一采用阳离子聚合并大规模工业化 的产品——丁基橡胶、聚异丁烯。
a
17
k tr ,m
H M n M (C+ R M )
M n ++ 1H M (CR
a
18
特点: ① 向单体转移是阳离子聚合最主要的链终止方式之
一; ② 向单体转移常数CM,约为10-2~10-4,比自由
a
4
三. 阳离子聚合引发体系及引发作用
• 引发方式: • 由引发剂生成阳离子,再与单体加成,生成
碳阳离子实现引发;
(1)质子酸(在溶液中解离出H+)
引发过程:质子酸先电离产生H+,然后与单体加成形成引发 活性中心-活性单体离子对
a
5
• 成功引发聚合反应的条件:
①酸要有足够的强度产生质子H+,故弱酸不行 ②酸根的亲核性不能太强,否则会与活性中心结合成共价键 而终止
以30%硝基苯~70% CCl4为溶剂时,则 [H2O]/[SnCl4]≈1.0,聚合速率最大。
a
10
四. 阳离子聚合机理
链引发、链增长、链终止、链转移等基元反应。
1 . 链引发:由连续两步反应组成: ➢ 引发体系反应,产生活性中心; ➢ 与单体双键加成形成单体碳阳离子。
C+RH
H (CR) C:引发剂
CH3 CH2 C +
CH2
CH3 C CH CH2
CH3
97% r1=2.5
3% r2=0.4
A lC l3 +H 2O 引 发
CHCl3溶剂
-100℃
CH3
CH2 C n *CH2 CH3
98.5%
CH3 C CH CH2 m
1.5%
a
2
3、 反应通式:
A B + M
M A M B
M n
A A B 是阳离子聚合的引发剂,其中
RH:共引发剂
H(C+ R M )k i
M:单体。
H M (CR)
特点:
引发速率快,引发活化能低(Ei=8.4~21KJ/mol)
a
11
2、 链增长:
链增长反应是单体分子不断插入到C+与反离子形成的离 子对中间,进行增长反应。
CH3
CH3 C+ BF3OH -
CH3
M
CH3 + CH2 C
CH3
CH3
活性中心
为引发剂的
紧靠活性中心的引发剂碎片,与活性中心所带电荷相反, 称反合的单体一般有三类 : ①取代基有足够供电性的烯类单体:
②含有有孤对电子的杂原子的不饱和化合物与
环状化合物,如:
O
,CH2O 等
③共轭烯烃
CH3 CH2=C CH=CH2
N
电子的活动性强,易诱导极化, 既能阳离子聚合,又能阴离子聚合 。但聚合活性远不如前两类。
CH3
CH3 C CH2 C+ BF3OH -
CH3
CH3
CH3 CH3 C+
CH3
CH2
CH3 CH3 C CH2
CH3
CH3
C n *CH2 CH3
CH3
C+ BF3OH -
CH3
-
BF3OH
CH3
+
C CH3
a
12
链增长通式
k p
H M n(C+ R M )
特点:
H M n M (CR)
➢ 增长反应是插入反应,单体插入碳阳离子与反离子, 之间进行增长。
