中考化学专项训练:溶液的浓度培优复习测试题附答案
中考化学专项训练:溶液的浓度检测题附答案

中考化学专项训练:溶液的浓度检测题附答案一、初中化学溶液的浓度选择题1.如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是()A.t1℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲B.t2℃时,20 g丙溶解于50 g水中能形成70 g溶液C.分别将三种物质的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙D.若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法【来源】2016年初中毕业升学考试(山东泰安卷)化学(带解析)2.下图是A、B、C三种物质的溶解度曲线,下列分析不正确的是()A.50℃时A、B、C三种物质的溶解度由大到小的顺序是A>B>CB.50℃时把50gA放入50g水中能得到A的饱和溶液,其中溶质与溶剂的质量比为1:2 C.将C的饱和溶液变为不饱和溶液,采用降温的方法D.将50℃时A、B、C三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是B>A=C【来源】2013年初中毕业升学考试(湖北孝感卷)化学(带解析)3.右图是a、b、c 三种物质的溶解度曲线,下列分析不正确的是A.t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>cB.t2℃时,将50ga物质放入100g水中充分溶解恰好得到a的饱和溶液(a物质不含结晶水) C.将t2℃时a、b、c三种物质的饱和溶液降温至t1℃时,所得溶液的溶质质量分数关系b >c=aD.将c的饱和溶液变为不饱和溶液,可采用降温的方法【来源】[首发]山东省枣庄市薛城区2017届九年级中考模拟(5月)化学试题4.下图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是A.P点表示甲、丙两种物质的饱和溶液质量相等B.t1℃时,乙物质的饱和溶液,升温至t2℃时仍是饱和溶液C.t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1∶4D.将三种物质的溶液从t2℃降至t1℃,溶质质量分数最小的一定是丙物质【来源】江苏省徐州市2017年中考信息卷化学试题5.下列叙述正确的是()A.温度升高时,物质的溶解度增大B.凡是均一、透明的液体就是溶液C.浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液D.20℃时36g氯化钠溶于100g水中,恰好达到饱和,此溶液中溶质的质量分数是36%【来源】2019年内蒙古呼伦贝尔市三岔河中学中考化学模拟试卷(4月份)6.T1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后观象如图一所示。
中考化学化学溶液的浓度(大题培优)附详细答案

中考化学化学溶液的浓度(大题培优)附详细答案一、初中化学溶液的浓度1.如图为甲、乙两种盐的溶解度曲线,下列说法正确的是A.甲、乙两种物质的溶解度都不相等B.将接近饱和的甲溶液变为饱和溶液,可采用蒸发或降温的方法C.t1℃时,甲、乙两种物质的饱和溶液中,溶质的质量分数均为15%D.t2℃时,将30克乙物质放入100克水中,所得溶液的质量为130克【来源】2016届江苏省盐城市滨海县八巨初级中学九年级下学期开学考试化学试卷(带解析)【答案】B【解析】【分析】【详解】A、溶解度大小比较需要指明具体的温度,故A错误;B、甲的溶解度随温度升高而增大,故甲的不饱和溶液变为饱和溶液可以用蒸发或降温,故B正确;C、t1℃时,甲、乙两种物质的溶解度相同,所以它们的饱和溶液中,溶质的质量分数均为15g×100%<15%,故C错误;100g+15gD、t2℃时,乙物质的溶解度小于30g,此温度下,将30克乙物质放入100克水中,所得溶液的质量小于为130克,故D错误。
故选B。
2.T1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后观象如图一所示。
硝酸钾和氯化钾的溶解变曲线如图二所示。
下列说法错误的是A.烧杯乙中上层清液是饱和溶液B.烧杯甲中溶解的溶质是氯化钾C.烧杯甲溶液中溶质的质量分数大于烧杯乙溶液中溶质的质量分数D.将温度由T1℃升高到T2℃,充分搅拌,烧杯乙中固体不一定全部溶解【来源】湖北省黄石市2018年中考理综化学部分试题【答案】D【解析】根据所学知识和题中信息知,A、烧杯乙中上层清液一定是饱和溶液,有未溶解晶体,故A 正确;B、烧杯甲中溶解的溶质是氯化钾,T1℃时氯化钾溶解度大于硝酸钾,故B正确;C、烧杯甲溶液中溶质的质量分数大于烧杯乙溶液中溶质的质量分数,由于等质量的硝酸钾和氯化钾分别加入到100g水中,甲中全部溶解,乙中部分溶解,故C正确;D、将温度由T1℃升高到T2℃,充分搅拌,烧杯乙中固体一定全部容解,硝酸钾溶解度随温度的升高而增大,由于等质量的硝酸钾和氯化钾分别加入到100g水中,T1℃时氯化钾溶解度大于硝酸钾,氯化钾已全部溶解,T2℃时硝酸钾溶解度大于氯化钾,硝酸钾也一定会全部溶解,故D错误点睛∶溶解度曲线的意义①表示同一种物质在不同温度时的溶解度或溶解度随温度变化的情况;②表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小。
中考化学专项训练:溶液的浓度培优测试题附答案
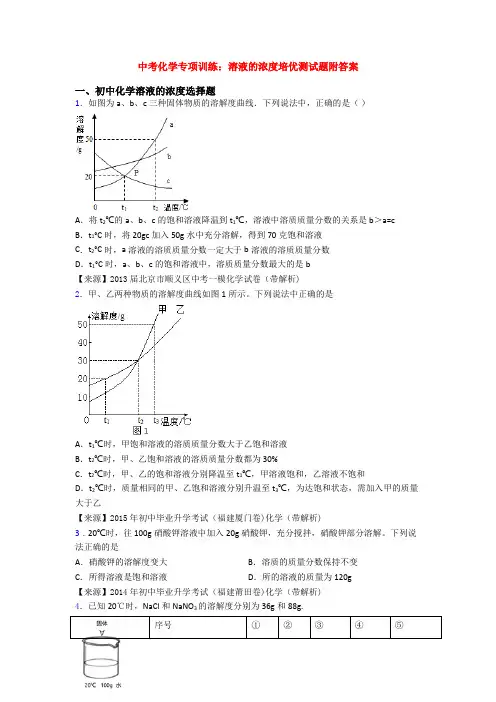
中考化学专项训练:溶液的浓度培优测试题附答案一、初中化学溶液的浓度选择题1.如图为a、b、c三种固体物质的溶解度曲线.下列说法中,正确的是()A.将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a=cB.t1°C时,将20gc加入50g水中充分溶解,得到70克饱和溶液C.t2°C时,a溶液的溶质质量分数一定大于b溶液的溶质质量分数D.t1°C时,a、b、c的饱和溶液中,溶质质量分数最大的是b【来源】2013届北京市顺义区中考一模化学试卷(带解析)2.甲、乙两种物质的溶解度曲线如图1所示。
下列说法中正确的是A.t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液B.t2℃时,甲、乙饱和溶液的溶质质量分数都为30%C.t2℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和D.t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙【来源】2015年初中毕业升学考试(福建厦门卷)化学(带解析)3.20℃时,往100g硝酸钾溶液中加入20g硝酸钾,充分搅拌,硝酸钾部分溶解。
下列说法正确的是A.硝酸钾的溶解度变大B.溶质的质量分数保持不变C.所得溶液是饱和溶液D.所的溶液的质量为120g【来源】2014年初中毕业升学考试(福建莆田卷)化学(带解析)4.已知20℃时,NaCl和NaNO3的溶解度分别为36g和88g.序号①②③④⑤固体种类NaCl NaCl NaNO3NaNO3NaNO3固体的质量/g3060306090水的质量/g100100100100100下列关于①-⑤实验操作所得溶液说法不正确的是A.溶质质量:①<②B.溶液质量:②<④C.溶质质量分数:①=③D.⑤中溶液质量:190g【来源】【市级联考】山东省齐河市2019届九年级下学期第一次练兵考试化学试题5.T1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后观象如图一所示。
中考化学 化学溶液的浓度 培优练习(含答案)含详细答案

中考化学化学溶液的浓度培优练习(含答案)含详细答案一、初中化学溶液的浓度1.关于溶液有如下说法:①溶质只能是固体;②溶剂一定是水;③一种溶液中只含一种溶质;④溶质一定是以离子的形式存在于溶剂中;⑤5g某溶质溶解在100g溶剂中,所得溶液溶质的质量分数为5%。
其中错误的是( )A.①③④⑤ B.①②③⑤ C.①②③④ D.①②③④⑤【来源】广东省珠海市紫荆中学2018届九年级第三次模拟考试化学试题【答案】D【解析】①气体、固体、液体都可以作溶质,错误;②水是常用的溶剂,除水外,酒精、汽油也可作溶剂,错误;③溶液中可以有多种溶质,错误;④溶质是以分子或离子的形式存在于溶剂中,错误;⑤5g某溶质溶解在100g溶剂中,所得溶液溶质的质量分数=×100%=4.76%,错误。
①②③④⑤错误,故选D。
2.下列物质中属于溶液的是A.碘酒B.牛奶C.米粥D.豆浆【来源】辽宁省大连市第八十中学2019届化学模拟【答案】A【解析】【分析】溶液是均一、稳定的混合物;溶液的本质特征是均一性、稳定性,属于混合物;据此结合物质的组成进行分析判断【详解】A、碘酒是碘溶于酒精形成的,是均一、稳定的混合物,属于溶液;B、牛奶是不溶性的小液滴等分散到液体中形成的,不均一、不稳定,不属于溶液;C、米粥不是均一、稳定的混合物,不属于溶液;D、豆浆中的营养物质有的溶于水,有的不溶于水,豆浆不是均一、稳定的混合物,不属于溶液。
故选:A。
3.如图是A、B、C三种物质的溶解度曲线,下列叙述正确的是()A.t1℃时,A的饱和溶液中溶质质量分数为30%B.t2℃时,A、B的溶液蒸发掉等质量的水,A析出的晶体多C.将C的饱和溶液从t2℃降低到t1℃,其溶质的质量分数不变D.从B的溶液中得到B,通常采用降温结晶的方法【来源】河南省商丘市2019届九年级上学期期末化学试卷【答案】C【解析】【详解】A、t1℃时,A物质的溶解度是30g,所以饱和溶液中溶质质量分数为:30g×100%≈23.1%,故A错误;100g30gB、t2℃时,A、B的溶解度相等,所以等质量的A、B饱和溶液蒸发掉等质量的水,析出的晶体相等,故B错误;C、C物质的溶解度随温度的降低而增大,所以将C的饱和溶液从t2℃降低到t1℃,其溶质的质量分数不变,故C正确;D、B物质的溶解度受温度影响较小,所以从B的溶液中得到B,通常采用蒸发溶剂的方法,故D错误。
中考化学专项训练:溶液的浓度训练题含答案
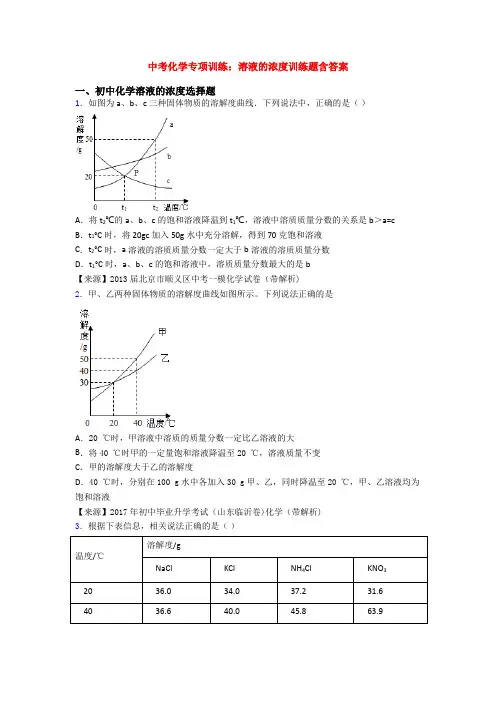
中考化学专项训练:溶液的浓度训练题含答案一、初中化学溶液的浓度选择题1.如图为a、b、c三种固体物质的溶解度曲线.下列说法中,正确的是()A.将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a=cB.t1°C时,将20gc加入50g水中充分溶解,得到70克饱和溶液C.t2°C时,a溶液的溶质质量分数一定大于b溶液的溶质质量分数D.t1°C时,a、b、c的饱和溶液中,溶质质量分数最大的是b【来源】2013届北京市顺义区中考一模化学试卷(带解析)2.甲、乙两种固体物质的溶解度曲线如图所示。
下列说法正确的是A.20 ℃时,甲溶液中溶质的质量分数一定比乙溶液的大B.将40 ℃时甲的一定量饱和溶液降温至20 ℃,溶液质量不变C.甲的溶解度大于乙的溶解度D.40 ℃时,分别在100 g水中各加入30 g甲、乙,同时降温至20 ℃,甲、乙溶液均为饱和溶液【来源】2017年初中毕业升学考试(山东临沂卷)化学(带解析)3.根据下表信息,相关说法正确的是()溶解度/g温度/℃NaCl KCl NH4Cl KNO32036.034.037.231.64036.640.045.863.96037.345.555.2110A.20℃时,NaCl 的溶液度为 36.0B.40℃时,KCl 饱和溶液的溶质质量分数为 40%C.40℃时,向 100g 水中加入 50gNH4Cl 充分溶解,溶液质量为 145.8gD.60℃时降温到 20℃时,KNO3和 KCl 的饱和溶液析出晶体较多的是 KNO3【来源】2017年初中毕业升学考试(四川成都卷)化学(带解析)4.将100g 质量分数为20%的硝酸钾溶液稀释为5%的硝酸钾溶液,需要加水的质量为()A.100g B.200g C.300g D.400g【来源】2016届广东省广州市南沙区九年级一模化学试卷(带解析)5.20℃时,往100g硝酸钾溶液中加入20g硝酸钾,充分搅拌,硝酸钾部分溶解。
中考化学专项训练:溶液的浓度培优基础卷含答案解析

中考化学专项训练:溶液的浓度培优基础卷含答案解析一、初中化学溶液的浓度选择题1.物质a、b的溶解度曲线如图所示,下列判断正确的是( )A.60℃时,a、b的溶解度相等,此时由a、b所配制溶液的溶质质量分数也相等B.80℃时a溶液的溶质质量分数大于60℃时a溶液的溶质质量分数C.在37℃时,将30g的a物质投入50g水中,得到的溶液是饱和溶液D.将80℃的等质量的a、b两种物质的饱和溶液分别冷却到60℃得到的晶体质量相等【来源】2019年河南省天一大联考中考化学一模试卷2.硝酸钾和氯化钠的溶解度曲线如下图所示。
30℃时,分别将30g硝酸钾和氯化钠放入100 g水中,充分溶解。
下列结论中,不正确的是A.两种溶液中溶质的质量分数相等B.通常情况下,采取降温的方法能将两种溶液都变成饱和溶液C.若将硝酸钾溶液降温到20℃,溶液中溶质和溶剂的质量比为3∶10D.若将硝酸钾溶液变为10℃时的饱和溶液,溶液中溶质的质量分数一定减小【来源】2013年初中毕业升学考试(湖北咸宁卷)化学(带解析)3.甲、乙两种固体物质的溶解度曲线如图所示。
下列说法正确的是A.20 ℃时,甲溶液中溶质的质量分数一定比乙溶液的大B.将40 ℃时甲的一定量饱和溶液降温至20 ℃,溶液质量不变C.甲的溶解度大于乙的溶解度D.40 ℃时,分别在100 g水中各加入30 g甲、乙,同时降温至20 ℃,甲、乙溶液均为饱和溶液【来源】2017年初中毕业升学考试(山东临沂卷)化学(带解析)4.右图是a、b、c 三种物质的溶解度曲线,下列分析不正确的是A.t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>cB.t2℃时,将50ga物质放入100g水中充分溶解恰好得到a的饱和溶液(a物质不含结晶水) C.将t2℃时a、b、c三种物质的饱和溶液降温至t1℃时,所得溶液的溶质质量分数关系b >c=aD.将c的饱和溶液变为不饱和溶液,可采用降温的方法【来源】[首发]山东省枣庄市薛城区2017届九年级中考模拟(5月)化学试题5.下图是A、B、C三种物质的溶解度曲线,下列分析不正确的是()A.50℃时,A、B、C三种物质的溶解度由大到小的顺序是A>B>CB.50℃时,把50 g A放入50 g水中能得到A的饱和溶液,其中溶质与溶液质量比为1∶3 C.将50℃时,A、B、C三种物质的饱和溶液降温度20℃时,这三种溶液的溶质质量分数的大小关系是B>C=AD.将C的饱和溶液变为不饱和溶液,可采用降温的方法【来源】2013届北京市海淀区中考一模化学试卷(带解析)6.T1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后观象如图一所示。
中考化学专项训练:溶液的浓度培优单元综合检测题含答案解析
中考化学专项训练:溶液的浓度培优单元综合检测题含答案解析一、初中化学溶液的浓度选择题1.向t℃时饱和的Na2CO3溶液中加入ng无水Na2CO3,会析出mgNa2CO3·10H2O,则(m-n)的值为()A.饱和溶液失去水的质量B.饱和溶液失去溶质的质量C.饱和溶液失去水和溶质的质量之和D.其数值为0,即溶液质量不变【来源】广西贺州市莲塘镇第一初级中学2019年第一次适应性训练化学试题2.a、b两种固体物质(均不含结晶水)的溶解度曲线如图所示,在t1℃时,将a、b两种物质各60g分别加入100水中,充分溶解后,下列有关叙述不正确的是()A.t1℃时,得到的两种溶液均为饱和溶液B.将所配制的a、b两种溶液从t1℃同步降温,a析出的晶体比b多C.t2℃时a的溶解度比b大D.将所得的两种溶液温度升高到t2℃时,a溶液的溶质质量分数大于b溶液的溶质质量分数【来源】哈尔滨市道外区2017—2018学年度上学期九年级期末调研测试化学试卷3.如图是甲乙两种物质的溶解度曲线,下列说法正确的是()A.甲的溶解度大于乙的溶解度B.t℃时,甲乙饱和溶液中溶质的质量分数相等C.升高温度能使接近饱和的甲溶液变为饱和溶液D.10℃时,分别用100g水配制甲乙的饱和溶液,所需甲的质量大于乙的质量【来源】2012年江苏省泰州市初三5月适应性考试化学试题(带解析)4.有关溶液的下列说法中正确的是()A.氯化钠和植物油都能溶于水形成溶液B.将20%的硝酸钾溶液均分成两份,每份溶质质量分数为10%C.氯化钠饱和溶液一定比不饱和溶液含的溶质质量多D.溶解和乳化都能使物质混合得更为均匀【来源】2018年山东省济南市市中区化学三模试题-2018.65.T1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后观象如图一所示。
硝酸钾和氯化钾的溶解变曲线如图二所示。
下列说法错误的是A.烧杯乙中上层清液是饱和溶液B.烧杯甲中溶解的溶质是氯化钾C.烧杯甲溶液中溶质的质量分数大于烧杯乙溶液中溶质的质量分数D.将温度由T1℃升高到T2℃,充分搅拌,烧杯乙中固体不一定全部溶解【来源】湖北省黄石市2018年中考理综化学部分试题6.20℃时,取甲、乙、丙、丁四种纯净物各20g,分别加入到四只各盛有50g水的烧杯中,充分溶解后的情况如下表所示,该温度下有关说法正确的是物质甲乙丙丁未溶解固体的质量/g 4.2209.2A.所得四杯溶液都是饱和溶液B.丁溶液的溶质质量分数最大C.20℃时四种物质溶解度的关系为:丁>甲>乙>丙D.所得溶液的质量关系为:丙>乙>甲>丁【来源】宁夏银川九中英才学校2019届九年级下学期第一次模拟考试化学试题7.如图是三种固体物质a、b、c的溶解度曲线,则以下说法不正确的是()A.t1℃时三种物质溶解度的大小为b>a=cB.将t2℃时a的饱和溶液150g降温到t1℃时,析出溶质30gC.t2℃时,将1ga物质加入到2g水中不断搅拌,能形成3g不饱和溶液D.要从含有少量c的a溶液中得到较多的a晶体,通常采用降温结晶的方法【来源】2013届安徽省芜湖市芜湖县保沙中学九年级下学期六校联考(二)化学试题(带解析)8.海水晒盐提取食盐晶体后留下的母液叫卤水,卤水中除含NaCl外,还含有MgCl2、MgSO4等物质。
中考化学 化学溶液的浓度 培优练习(含答案)附详细答案
中考化学化学溶液的浓度培优练习(含答案)附详细答案一、初中化学溶液的浓度1.下图是甲、乙两种物质的溶解度曲线。
下列说法正确的是( )A.t1℃时,甲、乙饱和溶液中溶质质量相等B.t2℃时,向15 g 甲中加入50 g 水,形成饱和溶液C.t2℃时,甲饱和溶液中溶质的质量分数为30%D.乙物质常用冷却结晶法从溶液中获得晶体逐滴加入稀盐酸至过量【来源】【全国市级联考】福建省莆田市2018届九年级下学期质量检查(一模)化学试题【答案】B【解析】A、由溶解度曲线可知,t1℃时,甲、乙的溶解度相等。
但t1℃时,甲、乙饱和溶液的质量不确定,溶质质量不一定相等,错误;B、由溶解度曲线可知,t2℃时,甲的溶解度为30g。
故 t2℃时,向15 g 甲中加入50 g 水,形成饱和溶液,正确;C、t2℃时,甲饱和溶液中溶质的质量分数=30g30g100g×100%=23.1%,错误;D、由溶解度曲线可知,乙物质的溶解度受温度的影响变化较小,应采用蒸发结晶法从溶液中获得晶体,错误。
故选B。
2.如图为甲、乙两种固体物质在水中的溶解度曲线,下列说法正确的是( )A.降温和蒸发均可使乙物质从其饱和溶液中结晶出来B.N点和M点表示的甲的溶液中溶质的质量分数相等C.甲、乙饱和溶液从t1℃升温至t2℃,其浓度均保持不变D.t1℃时,甲、乙饱和溶液中溶质和溶液的质量比均为1:4【来源】安徽省庐江县汤池镇初级中学2019届中考化学三模试卷【答案】B【解析】【详解】A、乙的溶解度随温度升高而减小,所以降温不能得到其晶体,故错误;B、N点和M点表示溶液中溶质、溶剂的质量相等,则溶质的质量分数相等,正确;C、甲、乙饱和溶液从t1℃升温至t2℃,甲的溶解度变大,溶质、溶剂质量不变,则其浓度保持不变,乙的溶解度减小,析出晶体,浓度减小,故错误;D、溶液具有均一性,所以t1℃时饱和溶液的组成是相同的,该温度下二者的溶解度相等,均为25g,所以甲、乙饱和溶液中溶质和溶液的质量比均为25g:125g=1:5,故错误;故选:B。
中考化学专项训练:溶液的浓度培优复习提高测试题及解析
中考化学专项训练:溶液的浓度培优复习提高测试题及解析一、初中化学溶液的浓度选择题1.20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。
下列说法正确的是( )A.所得溶液可能都是饱和溶液B.20℃时,乙溶液的溶质质量最小C.溶液溶质的质量分数:甲>丙>乙D.升高温度,溶液溶质的质量分数一定变大【来源】浙江省金华市、丽水市2018年中考化学试题2.甲、乙两种物质的溶解度曲线如图1所示。
下列说法中正确的是A.t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液B.t2℃时,甲、乙饱和溶液的溶质质量分数都为30%C.t2℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和D.t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙【来源】2015年初中毕业升学考试(福建厦门卷)化学(带解析)3.下图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是A.P点表示甲、丙两种物质的饱和溶液质量相等B.t1℃时,乙物质的饱和溶液,升温至t2℃时仍是饱和溶液C.t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1∶4D.将三种物质的溶液从t2℃降至t1℃,溶质质量分数最小的一定是丙物质【来源】江苏省徐州市2017年中考信息卷化学试题4.下列关于溶液的说法错误的是()A.固体、液体、气体都可以做溶质B.NH4NO3溶解过程中吸热,溶液温度降低C.欲使100克KNO3溶液的质量分数由5%变成10%,可向其中加入5克KNO3固体D.25℃时,将某KNO3溶液蒸发10克水析出a克晶体,再蒸发10克水析出b克晶体,a 与b的质量不一定相等【来源】2016年初中毕业升学考试(湖南湘潭卷)化学(带解析)5.已知20℃时,NaCl和NaNO3的溶解度分别为36g和88g.序号①②③④⑤固体种类NaCl NaCl NaNO3NaNO3NaNO3固体的质量/g3060306090水的质量/g100100100100100下列关于①-⑤实验操作所得溶液说法不正确的是A.溶质质量:①<②B.溶液质量:②<④C.溶质质量分数:①=③D.⑤中溶液质量:190g【来源】【市级联考】山东省齐河市2019届九年级下学期第一次练兵考试化学试题6.化学与生活密切相关,下列饮品中属于溶液的是A.牛奶B.白酒C.豆浆D.咖啡【来源】【区级联考】江苏省无锡市惠山区2019届九年级一模化学试题7.配制一定溶质量分数的氯化钠溶液,可导致所配制的溶液浓度一定偏小的操作是()A.用固体氯化钠配制6%的氯化钠溶液,量水时俯视刻度B.用固体氯化钠配制6%的氯化钠溶液,称量时右盘忘记放纸片C.用固体氯化钠配制6%的氯化钠溶液,搅拌溶解时有液体溅出D.用6%的氯化钠溶液稀释为3%的氯化钠溶液,量6%氯化钠溶液时仰视刻度【来源】【市级联考】河南省郑州市2019届九年级下学期中考二模化学试题8.固体物质W在水、乙醇两种溶剂中的溶解度随温度变化的曲线如右图所示。
中考化学专项训练:溶液的浓度培优复习课 课时练习含答案
中考化学专项训练:溶液的浓度培优复习课课时练习含答案一、初中化学溶液的浓度选择题1.如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是()A.t1℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲B.t2℃时,20 g丙溶解于50 g水中能形成70 g溶液C.分别将三种物质的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙D.若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法【来源】2016年初中毕业升学考试(山东泰安卷)化学(带解析)2.a,b两种物质的溶解度曲线如下图所示.下列说法不正确的是A .将℃时b的饱和溶液加水可变为不饱和溶液B.将℃时a的饱和溶液降温至℃,溶液质量不变C.℃时,两种物质的饱和溶液中溶质质量分数a bD.将℃时a、b的饱和溶液分别降温至℃,两溶液的溶质质量分数相等【来源】2015年初中毕业升学考试(北京卷)化学(带解析)3.右图是a、b、c 三种物质的溶解度曲线,下列分析不正确的是A.t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>cB.t2℃时,将50ga物质放入100g水中充分溶解恰好得到a的饱和溶液(a物质不含结晶水) C.将t2℃时a、b、c三种物质的饱和溶液降温至t1℃时,所得溶液的溶质质量分数关系b >c=aD.将c的饱和溶液变为不饱和溶液,可采用降温的方法【来源】[首发]山东省枣庄市薛城区2017届九年级中考模拟(5月)化学试题4.下图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是A.P点表示甲、丙两种物质的饱和溶液质量相等B.t1℃时,乙物质的饱和溶液,升温至t2℃时仍是饱和溶液C.t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1∶4D.将三种物质的溶液从t2℃降至t1℃,溶质质量分数最小的一定是丙物质【来源】江苏省徐州市2017年中考信息卷化学试题5.已知20℃时,NaCl和NaNO3的溶解度分别为36g和88g.序号①②③④⑤固体种类NaCl NaCl NaNO3NaNO3NaNO3固体的质量/g3060306090水的质量/g100100100100100下列关于①-⑤实验操作所得溶液说法不正确的是A.溶质质量:①<②B.溶液质量:②<④C.溶质质量分数:①=③D.⑤中溶液质量:190g【来源】【市级联考】山东省齐河市2019届九年级下学期第一次练兵考试化学试题6.20℃时,取甲、乙、丙、丁四种纯净物各20g,分别加入到四只各盛有50g水的烧杯中,充分溶解后的情况如下表所示,该温度下有关说法正确的是物质甲乙丙丁未溶解固体的质量/g 4.2209.2A.所得四杯溶液都是饱和溶液B.丁溶液的溶质质量分数最大C.20℃时四种物质溶解度的关系为:丁>甲>乙>丙D.所得溶液的质量关系为:丙>乙>甲>丁【来源】宁夏银川九中英才学校2019届九年级下学期第一次模拟考试化学试题7.a、b两种物质的溶解度曲线如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中考化学专项训练:溶液的浓度培优复习测试题附答案一、初中化学溶液的浓度选择题1.如图是甲、乙两种物质(不含结晶水)的溶解度曲线,根据图象及相关知识判断,下列说法中正确的是( )A.t2℃时,甲溶液溶质质量分数一定大于乙溶液溶质质量分数B.甲物质的溶解度一定大于乙物质的溶解度C.t1℃时,甲、乙两种物质的饱和溶液,升温到t2℃时,所得溶液溶质质量分数相等D.t2℃时,甲、乙两种物质的饱和溶液,降温到t1℃时,甲析出的晶体比乙多【来源】【区级联考】黑龙江省哈尔滨市南岗区2019届九年级下学期中考二模化学试题2.a、b两种固体物质(均不含结晶水)的溶解度曲线如图所示,在t1℃时,将a、b两种物质各60g分别加入100水中,充分溶解后,下列有关叙述不正确的是()A.t1℃时,得到的两种溶液均为饱和溶液B.将所配制的a、b两种溶液从t1℃同步降温,a析出的晶体比b多C.t2℃时a的溶解度比b大D.将所得的两种溶液温度升高到t2℃时,a溶液的溶质质量分数大于b溶液的溶质质量分数【来源】哈尔滨市道外区2017—2018学年度上学期九年级期末调研测试化学试卷3.甲、乙两种物质的溶解度曲线如图1所示。
下列说法中正确的是A.t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液B.t2℃时,甲、乙饱和溶液的溶质质量分数都为30%C.t2℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和D.t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙【来源】2015年初中毕业升学考试(福建厦门卷)化学(带解析)4.氯化铵和硝酸钾溶解度曲线如图所示,下列叙述正确的是( )A.50℃时,氯化铵的溶解度大于硝酸钾B.a℃时,氯化铵与硝酸钾溶液的质量分数相等C.将60℃的硝酸钾饱和溶液降温会变为不饱和溶液D.40℃时,50g水中加入50g硝酸钾,充分搅拌,得到质量分数约为39%的硝酸钾溶液【来源】2015届山东省枣庄市薛城舜耕中学九年级学业水平模拟化学试卷(带解析) 5.20℃时,往100g硝酸钾溶液中加入20g硝酸钾,充分搅拌,硝酸钾部分溶解。
下列说法正确的是A.硝酸钾的溶解度变大B.溶质的质量分数保持不变C.所得溶液是饱和溶液D.所的溶液的质量为120g【来源】2014年初中毕业升学考试(福建莆田卷)化学(带解析)6.已知20℃时,NaCl和NaNO3的溶解度分别为36g和88g.序号①②③④⑤固体种类NaCl NaCl NaNO3NaNO3NaNO3固体的质量/g3060306090水的质量/g100100100100100下列关于①-⑤实验操作所得溶液说法不正确的是A.溶质质量:①<②B.溶液质量:②<④C.溶质质量分数:①=③D.⑤中溶液质量:190g【来源】【市级联考】山东省齐河市2019届九年级下学期第一次练兵考试化学试题7.甲、乙两种物质的溶解度曲线如图所示。
下列说法正确的是A.甲的溶解度大于乙的溶解度B.两种物质的溶解度都随温度升高而增大C.将乙的饱和溶液从t1 ℃升温到t3 ℃的过程中不会析出晶体D.t3 ℃时,甲、乙溶液的溶质质量分数相等【来源】【全国市级联考】安徽省合肥市2018届九年级中考模拟冲刺试卷化学试题8.有w 克溶质质量分数为10%的硝酸钾溶液,若要将其溶质质量分数变为20%,可以采用的方法是A.蒸发掉溶剂的1/2 B.加入3w/20克的硝酸钾C.蒸发掉w/2克溶剂D.加入3w/14克的硝酸钾【来源】宁夏银川九中英才学校2019届九年级下学期第一次模拟考试化学试题9.氯化钠和硝酸钾两种固体的溶解度曲线如图所示,下列说法正确的是()A.硝酸钾的溶解度大于氯化钠的溶解度B.要除去氯化钠溶液中含有的少量硝酸钾,常用降温结晶法C.40℃时,将35 g硝酸钾晶体放入50 g水中,充分搅拌后,所得溶液的溶质质量分数为39.0%D.将20℃的硝酸钾饱和溶液升温至60℃,溶液的溶质质量分数增大(忽略水分蒸发)【来源】【市级联考】黑龙江省牡丹江市2019届中考化学二模试卷10.a、b两种物质的溶解度曲线如图所示。
下列说法不正确的是A.t1℃时,两种饱和溶液质量相等B.将t2℃时a的饱和溶液降温至t1℃,溶液质量变小C.t2℃时,两种物质的饱和溶液中溶质质量分数a>bD.将t2℃时相同质量两种饱和溶液分别降温至t1℃,溶质质量a<b【来源】2016届北京市怀柔区中考一模化学试卷(带解析)11.如图是三种固体物质a、b、c的溶解度曲线,则以下说法不正确的是()A.t1℃时三种物质溶解度的大小为b>a=cB.将t2℃时a的饱和溶液150g降温到t1℃时,析出溶质30gC.t2℃时,将1ga物质加入到2g水中不断搅拌,能形成3g不饱和溶液D.要从含有少量c的a溶液中得到较多的a晶体,通常采用降温结晶的方法【来源】2013届安徽省芜湖市芜湖县保沙中学九年级下学期六校联考(二)化学试题(带解析)12.下列物质中属于溶液的是A.碘酒B.牛奶C.米粥D.豆浆【来源】辽宁省大连市第八十中学2019届化学模拟13.在t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中, 充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示。
下列说法正确的A.烧杯②中溶液的溶质是氯化钾B.烧杯①中溶液一定是不饱和溶液C.烧杯②中溶液的溶质质量分数为25%D.将温度升高到t2℃,两烧杯中的溶液溶质质量分数相等【来源】【区级联考】山东省青岛市李沧区2019届九年级二模化学试题14.右图是A、B、C三种物质的溶解度曲线。
下列说法错误的是A.C的溶解度随温度的升高而减小B.t2℃时A、B、C的溶解度大小为A=B>CC.t2℃A、B、C的饱和溶液降温到t1℃时,A、C两溶液中溶质的质量分数相等D.t1℃时,A的饱和溶液中溶质质量分数为20%【来源】2016届江苏省扬州市邗江区九年级第一次模拟考试化学试卷(带解析)15.在某温度下,分别向盛有等质量蒸馏水的两烧杯中逐渐加入固体溶质甲、乙,图中 x 表示所加固体的质量,y 表示溶液中溶质与水的质量比。
下列有关说法正确的是A.甲物质的溶解度比乙物质的溶解度大B.a 点之前,该温度下两溶液均为不饱和溶液C.该温度时,乙饱和溶液的溶质质量分数为 25%D.该温度时,甲物质的溶解度为 50g【来源】四川省成都市武侯区2019届中考化学一诊试卷16.下图是A、B、C三种物质的溶解度曲线。
现将等质量的A、B、C三种物质的饱和溶液,从t1℃升温到t2℃。
下列有关t2℃时的溶液说法正确的是( )A.溶液中C所含的溶剂最多B.三种溶液都是饱和溶液C.A溶液中溶质的质量分数最大D.t2℃时B的溶解度最大【来源】2012年黑龙江省哈尔滨市中考化学模拟试卷317.如图是a、b、c三种物质的溶解度曲线,根据图象及相关知识判断,下列说法中正确的是()A.在t2℃时,a物质的饱和溶液的溶质质量分数等于c物质溶液的溶质质量分数B.a、b两种物质的饱和溶液,从t1℃升高到t2℃时,所得物质溶液溶质的质量分数a>b C.t1℃时,100g a、c两物质的溶液中,含a、c的质量相等D.t2℃时,等质量a、b、c三种物质的饱和溶液,温度降低到0℃时,所得溶液中溶剂质量最多的是c【来源】黑龙江省哈尔滨市南岗区2019届中考化学一模试卷18.如图为晶体M(不含结晶水)的溶解度曲线,a、b两点分别表示M物质的溶液。
下列有关说法或a、b间的转化方法错误的是()A.t2℃时,a是饱和溶液,b是不饱和溶液B.将两份溶液温度降到t1℃时,a、b中都有晶体析出C.从a→b:先将a降温到t1℃,过滤后将滤液升温到t2℃D.从b→a:在b中加入M至刚好饱和【来源】2013届江苏省南京市江宁区中考一模化学试卷(带解析)19.如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是()A.t1℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲B.t2℃时,20 g丙溶解于50 g水中能形成70 g溶液C.分别将三种物质的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙D.若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法【来源】2016年初中毕业升学考试(山东泰安卷)化学(带解析)20.如图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述一定正确的是A.甲的溶解度大于乙的溶解度B.10℃时甲、乙两溶液的质量分数相等C.30℃时甲的饱和溶液的质量分数为60%D.降低温度可使接近饱和的甲溶液变成饱和溶液【来源】2011年初中毕业升学考试(重庆卷)化学21.如图是不含结晶水的a、b、c 三种物质的溶解度曲线,下列说法正确的是()A.t2℃时,将50g a 物质加入到50g 水中充分搅拌,得到100g a的饱和溶液B.用等质量的a、b、c 三种固体配制成t2℃时的饱和溶液,所得溶液质量的大小关系是:c溶液 > b溶液 > a溶液C.将t1℃时三种物质的饱和溶液升温到t2℃时,所得溶液中溶质的质量分数的大小关系是: b > a = cD.将t2℃时a、b 两种物质的饱和溶液降温到t1℃时,析出晶体的质量: a > b【来源】2016年初中毕业升学考试(云南曲靖卷)化学(带解析)22.甲、乙两种固体物质的溶解度曲线如右图所示。
下列叙述正确的是A.甲的溶解度大于乙的溶解度B.将等质量的甲和乙的饱和溶液从t2℃降温到t1℃,析出晶体的质量甲大于乙C.将甲、乙的饱和溶液从t1℃升温至t2℃,甲溶液中溶质的质量分数比乙大D.t1℃时,甲和乙溶液中溶质的质量分数一定相等【来源】2016届北京市丰台区九年级中考一模化学试卷(带解析)23.甲、乙两种物质的溶解度曲线如图所示。
下列叙述正确的是( )A.依据溶解度曲线可判断,甲的溶解度比乙的大B.将甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量大C.t1℃时,甲和乙的饱和溶液各100g,其溶质的质量一定相等D.将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温或加水的方法【来源】2019江苏省南通市如皋初级中学二模化学试题(,)24.甲、乙两种固体纯净物的溶解度曲线如图A所示。
在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里(图B).下列说法正确的是()A.乙溶液中溶质的质量分数增大B.装甲溶液的试管中剩余的固体减少C.试管里甲、乙物质的溶解度都增大D.两支试管里剩余的固体都增多【来源】2016届安徽省桐城市三校九年级中考模拟化学试题(带解析)25.甲、乙的溶解度曲线如图所示。
下列有关说法不正确的是()A.t2℃时,甲的饱和溶液中溶质和溶剂的质量之比为2:5B.乙的饱和溶液从t2℃降温到t1℃,溶液仍饱和C.t1℃时,甲、乙两种饱和溶液中溶质的质量相等D.甲、乙的饱和溶液分别从t2℃降温到t1℃,两溶液中溶质质量分数相等【来源】2016年初中毕业升学考试(北京卷)化学(带解析)26.如图为甲、乙两种固体物质在水中的溶解度曲线.下列说法错误的是()A.甲物质的溶解度随温度的升高而增大B.在t1℃时,甲、乙两物质的溶解度相等C.在t2℃时,N点表示甲物质的不饱和溶液D.在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g【来源】2013年初中毕业升学考试(甘肃张掖卷)化学(带解析)27.下图是甲、乙两种固体的溶解度曲线。
