常见离子的检验离子共存.pdf
离子反应离子共存及检验
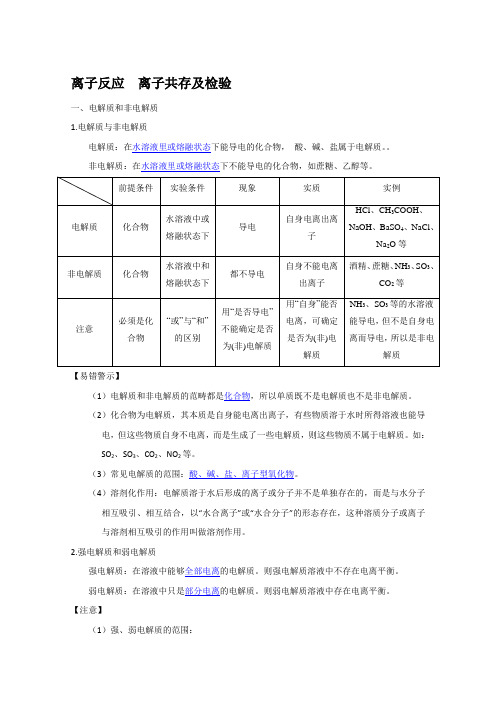
离子反应离子共存及检验一、电解质和非电解质1.电解质与非电解质电解质:在水溶液里或熔融状态下能导电的化合物,酸、碱、盐属于电解质。
非电解质:在水溶液里或熔融状态下不能导电的化合物,如蔗糖、乙醇等。
【易错警示】(1)电解质和非电解质的范畴都是化合物,所以单质既不是电解质也不是非电解质。
(2)化合物为电解质,其本质是自身能电离出离子,有些物质溶于水时所得溶液也能导电,但这些物质自身不电离,而是生成了一些电解质,则这些物质不属于电解质。
如:SO2、SO3、CO2、NO2等。
(3)常见电解质的范围:酸、碱、盐、离子型氧化物。
(4)溶剂化作用:电解质溶于水后形成的离子或分子并不是单独存在的,而是与水分子相互吸引、相互结合,以“水合离子”或“水合分子”的形态存在,这种溶质分子或离子与溶剂相互吸引的作用叫做溶剂作用。
2.强电解质和弱电解质强电解质:在溶液中能够全部电离的电解质。
则强电解质溶液中不存在电离平衡。
弱电解质:在溶液中只是部分电离的电解质。
则弱电解质溶液中存在电离平衡。
【注意】(1)强、弱电解质的范围:强电解质:强酸、强碱、绝大多数盐弱电解质:弱酸、弱碱、水(2)强、弱电解质与溶解性的关系:电解质的强弱取决于电解质在水溶液中是否完全电离,与溶解度的大小无关。
一些难溶的电解质,但溶解的部分能全部电离,则仍属强电解质。
如:BaSO4、BaCO3等。
(3)强、弱电解质与溶液导电性的关系:溶液的导电性强弱与溶液中的离子浓度大小有关。
强电解质溶液的导电性不一定强,如很稀的强电解质溶液,其离子浓度很小,导电性很弱。
而弱电解质溶液的导电性不一定弱,如较浓的弱电解质溶液,其电离出的离子浓度可以较大,导电性可以较强。
(4)强、弱电解质与物质结构的关系:强电解质一般为离子化合物和一些含强极性键的共价化合物,弱电解质一般为含弱极性键的化合物。
(5)强、弱电解质在熔融态的导电性:离子型的强电解质由离子构成,在熔融态时产生自由移动的离子,可以导电。
基础课3 离子共存离子的检验和推断

基础课3 离子共存离子的检验和推断【明确考纲】1.掌握常见离子的检验方法。
2.了解离子反应发生的条件,正确判断常见离子在溶液中能否大量共存。
【理清主干】考点一、离子共存1.离子共存的本质所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
23加水稀释,c+c-减小某溶液的lg c+c-=12【判一判】(1)OH-不能和_____________________________大量共存(填具体离子,下同)。
(2)H+不能和________________________________________________大量共存。
(3)CO2-3不能和________________________________________________大量共存。
(4)SO2-3不能和____________________________________________大量共存。
(5)Fe3+不能和____________________________________________大量共存。
(6)Al3+不能和_______________________________________________大量共存。
(7)I-不能和_________________________________________________大量共存。
(8)NO-3(H+)不能和_____________________________________________大量共存。
1.下列各组离子在溶液中因发生复分解反应而不能大量共存的是________。
①Na+、H+、CH3COO-、Cl-②Ba2+、Na+、CO2-3、NO-3③Na+、HCO-3、H+、NO-3④Al3+、Fe3+、NO-3、SO2-4⑤K+、Na+、AlO-2、NO-3⑥Na+、H+、Cl-、OH-⑦Cu2+、Fe2+、Cl-、SO2-4⑧K+、Na+、SiO2-3、NO-32.下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是________。
离子共存 离子的检验和推断35张共37页

66、节制使快乐增加并使享受加强。 ——德 谟克利 特 67、今天应做的事没有做,明天再早也 是耽误 了。——裴斯 泰洛齐 68、决定一个人的一生,以及整个命运 的,只 是一瞬 之间。 ——歌 德 69、懒人无法享受休息之乐。——拉布 克 70、浪费时间是一桩大罪过。——卢梭
1、不要轻言放弃,否则对不起自己。
2、要冒一次险!整个生命就是一场冒险。走得最远的人,常是愿意 去做,并愿意去冒险的人。“稳妥”之船,从未能从岸边走远。-戴尔.Байду номын сангаас耐基。
梦 境
3、人生就像一杯没有加糖的咖啡,喝起来是苦涩的,回味起来却有 久久不会退去的余香。
离子共存 离子的检验和推断35张 4、守业的最好办法就是不断的发展。 5、当爱不能完美,我宁愿选择无悔,不管来生多么美丽,我不愿失 去今生对你的记忆,我不求天长地久的美景,我只要生生世世的轮 回里有你。
离子检验和共存

CO32Cl- SO4
2-
NH4+
有刺激性气体生成 红色的石蕊试纸 变蓝
• 例1:为了检验某白色晶体是(NH4)2SO4, 某学生设计了两步: • (1)证明NH4+的存在,必需的操作步骤
加入NaOH溶液,微热,用湿润 是 的红色石蕊试纸放在试管口 ,当观察 到 红色石蕊试纸变蓝 现象时证明有NH4+。
• (2)证明SO42-的存在,该学生设计了两 种方案:①先加BaCl2溶液,再加稀盐酸; ②先加稀盐酸,再加BaCl2溶液。你认为最 合理的方案是 ② ,理由是 方案①无法排除。
Ag+的干扰
• 例2:寒假后,小丽带着快乐的心情返回学 校。当她来到实验室时,意外地发现实验 桌上有瓶敞口放置已久的NaOH溶液。由此 激发了她的探究欲望。
结论
被检物 中有H+ 被检物中 有 OH -
被检物中 有CO32被检物中 有Cl- 被检物中 有SO42被检物中 有NH4+
H+
OH-
紫色石 蕊试液
石蕊试液 酚酞试液 稀盐酸;澄清的 石灰水
AgNO3溶液, 稀HNO3 Ba (NO3 ) 2溶 液;稀HNO3 NaOH溶液; 湿润的红色的 石蕊试纸
• (1) “这瓶NaOH溶液是否变质了呢?” 请大家帮助小丽选择三种不同类别(酸、 碱、盐)的试剂进行实验。 • 实质:检验溶液中是否含Na2CO3。
加入试剂
酸 足量 稀HCl或稀H2SO4 碱 澄清石灰水或Ba(OH)2溶液 盐 BaCl2 溶液或Ba(NO3)2溶液
实验现象
产生气泡 白色沉淀 白色沉淀
• 到两支试管中,并向其中分别滴入无色酚 酞试液作对比实验,结果两试管中溶液均 无色,于是小红认为自己的猜想是正确的 • (2)你认为小红的实验 不能(填“能”或 “不能”)证明她的猜想,理由是 。 • (3)如果要证明你的猜想是正确的,你选 择的试剂是 紫色石蕊试液 或Zn 或碳酸钠 , 实验中可以看到的现象是 。 不能用AgNO3溶液
课件8:离子共存 离子的检验和推断

2.常温下,下列各组离子在指定溶液中一定能大量共存的是( B )
A.某无色溶液中:Al3+、Cu2+、SO24-、Cl- B.由水电离的 c(H+)=1×10-11 mol·L-1 的溶液中:Ba2+、K+、Cl-、NO- 3 C.在 c(OH-)/c(H+)=1010 的溶液中:Na+、Mg2+、NO- 3 、Cl- D.加入足量过氧化钠后的溶液中:Na +、K+、Cl-、I-
4.离子共存判断题中常见的限制条件
限制条件 无色溶液 使甲基橙呈红色 或 pH=1 遇酚酞呈红色 或 pH=13
分析解读 有色离子不能大量共存
溶液显酸性,无大量的 OH-及弱酸的酸根离子
溶液呈碱性,无大量的 H+及弱碱的阳离子、弱酸 的酸式根离子
与 Al 反应放出 H2
由水电离出的 c(H+) =1×10-13 mol·L-1
【解析】能使石蕊试液变红的无色溶液中肯定存在 H+,H+和 CO23-、ClO-、AlO-2 均能 反应,离子不可能大量共存, A 项错误;与金属铝反应放出氢气的溶液,为酸或强碱 溶液,碱溶液中 OH-与 Fe2+、NH+4 反应而不能大量共存,酸溶液中 NO-3 与 Al 发生氧化 还原反应生成 NO,不生成氢气, B 项错误;常温下水电离出的 c(H+)·c(OH-)=10-20 的溶液中水的电离受到抑制,为酸性或碱性溶液,当溶液为酸性时,S2-、SO23-和氢离 子反应生成硫和水不能共存,当溶液为碱性时,溶液中 OH-、Na+、Cl-、S2-、SO23-离 子之间相互不发生任何反应,可大量共存,C 项正确;HCO-3 和 Al3+发生双水解生成气 体和沉淀而不能大量共存, D 项错误。
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( C )
离子共存与离子的分离和检验

离子共存与离子的分离和检验一、离子共存:1.离子共存的定义:离子共存是指在一种溶液中同时存在两种或两种以上的离子。
2.离子共存的条件:溶液中各离子之间不发生化学反应,溶液呈电中性。
3.离子共存的特点:溶液中各离子的浓度保持稳定,不发生明显的沉淀或气体生成。
二、离子的分离:1.离子分离的方法:a.过滤法:利用滤纸或过滤器将固体沉淀与溶液分离。
b.结晶法:通过控制溶液的温度或浓度,使某种离子结晶沉淀,从而实现分离。
c.电解法:利用电解原理,将溶液中的离子通过电流的作用分解成原子或分子。
d.离子交换法:利用离子交换树脂,将溶液中的离子与树脂上的离子进行交换,实现分离。
2.离子分离的选择:a.根据离子的溶解度:选择结晶法或过滤法进行分离。
b.根据离子的电荷:选择离子交换法进行分离。
c.根据离子的亲和力:选择合适的沉淀剂使特定离子沉淀。
三、离子的检验:1.离子检验的方法:a.颜色反应:利用某些离子与特定试剂反应产生的颜色变化来检验。
b.气体生成:利用某些离子与特定试剂反应产生的气体来检验。
c.沉淀形成:利用某些离子与特定试剂反应产生的沉淀来检验。
d.电化学法:利用离子的电化学性质进行检验。
2.离子检验的步骤:a.样品处理:将待检验的溶液进行适当的处理,如稀释、过滤等。
b.选择试剂:根据离子的特性选择合适的试剂。
c.观察现象:观察试剂与离子反应产生的颜色、气体、沉淀等现象。
d.结果分析:根据观察到的现象,判断溶液中是否存在特定离子。
3.常见离子的检验:a.钠离子(Na+):使用硝酸银溶液进行检验,生成白色沉淀。
b.钾离子(K+):使用火焰光度法进行检验,产生特定的光谱。
c.氯离子(Cl-):使用硝酸银溶液进行检验,生成白色沉淀。
d.硫酸根离子(SO42-):使用钡硝酸溶液进行检验,生成白色沉淀。
以上是关于离子共存、离子的分离和检验的知识点介绍。
希望对您的学习有所帮助。
习题及方法:1.习题:在某溶液中,同时存在Na+、K+、Cl-、SO42-四种离子,若要分离出Cl-,最适合的方法是?方法:由于Cl-与Ag+反应生成不溶于水的AgCl沉淀,可以选择使用AgNO3溶液与溶液反应,生成AgCl沉淀,通过过滤法将沉淀与溶液分离,从而分离出Cl-。
离子检验、共存、推断看这里就够了!

离子检验、共存、推断看这里就够了!1.常见离子的检验方法根据离子性质不同而在实验中所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体;③显现特殊颜色。
(小编说:其中氯离子的检验,要先加硝酸,无明显现象,再加硝酸银,出现白色沉淀,说明含有氯离子;铝离子的检验,还要加做加氨水出现白色沉淀,氨水过量沉淀不溶解,则说明含有铝离子;最简便的是加铝试剂检验!)(小编说:其中亚硫酸根离子,有亚硫酸氢根离子干扰;碳酸根离子的检验请参考这篇文章:能用氯化钙鉴别碳酸钠与碳酸氢钠吗?所以理论上,碳酸根离子或亚硫酸根离子的检验是没有意义的!)(小编说:其中亚铁离子的检验,氯水不能加过量,不然将硫氰根离子氧化褪色;在已知是含铁的溶液中,检验亚铁和铁离子的混合液,铁离子同上,亚铁可以直接用酸性高锰酸钾!)常见问题解读1.向某溶液中,加入BaCl2溶液后生成白色沉淀,再加入稀盐酸沉淀不消失,能否判断溶液中存在SO42—?答案:不能,若溶液中存在Ag+,也有相同的现象发生。
2.向某溶液中加入Ca(OH)2溶液,有白色沉淀生成,能否判断溶液中一定存在CO32—?答案:不能,若溶液中存在SO32—、HCO3—,也有相同的现象。
3.向某溶液中滴入稀盐酸,产生能使澄清石灰水变浑浊的气体,能否判断溶液中一定存在CO32—?答案:不能,若溶液中存在HCO3—、SO32—、HSO3—,也有相同的现象。
4.向某溶液中滴入BaCl2溶液,产生白色沉淀,再加入稀HNO3,白色沉淀不溶解,能否确定溶液中一定存在SO42—?答案:不能,若溶液中存在SO32—和Ag+,也有相同现象。
5.向某溶液中加入稀NaOH溶液,把湿润无色酚酞试纸放在试管口,试纸不变红,则溶液中一定不存在NH4+,该判断是否正确?为什么?答案:判断错误,检验NH4+时,应加入浓NaOH溶液,并加热,且用湿润的红色石蕊试纸。
6.向某溶液中滴加氯水,再加入KSCN溶液,溶液变红色,则溶液中一定存在Fe2+,该判断是否正确?为什么?答案:判断错误,检验Fe2+时,应先加KSCN,再加氯水,否则,Fe3+干扰结果的判断。
课件3:离子共存 离子的检验和推断

H+
SiO32-、AlO-2
(2)生成气体及挥发性物质的离子不能大量共存
离子
不能大量共存的离子
H+ S2O23-、CO23-、SO23-、HCO-3 、HSO-3 、S2-、HS-
OH-
NH+4 (浓溶液并加热)
(3)生成难电离物质(水、弱酸、一水合氨等) H+与 CH3COO-、CO32-、S2-、SO23-等生成弱酸不能大 量共存;OH-与 NH+4 (稀溶液)生成弱碱不能大量共存; H+与 OH-生成水不能大量共存。
②H3O+、NO- 3 、Fe2+、Na+ ④H+、S2-、SO23-、SO24- ⑥I-、ClO-、K+、H+ ⑧Fe3+、Ca2+、H+、NO- 3
水解相互促进型
当弱酸的酸根与弱碱的阳离子同时存在于水溶液中时, 弱酸的酸根水解生成的氢氧根离子与弱碱的阳离子水解生成 的氢离子反应生成水,从而使两种离子的水解平衡互相促进 而向水解方向移动,甚至完全反应。常见的因发生相互促进 的水解反应而不能大量共存的离子如下:
A.H+、SO42-、Cl-、OH- C.Na+、OH-、SO24-、H2PO- 4
(B) B.H+、Fe2+、SO24-、NO- 3 D.Ba2+、Na+、S2-、SO42-
1S2-与 SO23-在碱性条件可以共存,但在酸性条件 下则会发生氧化还原反应而不能大量共存。
2NO- 3 在碱性和中性环境中没有氧化性,酸性环境 中具有氧化性。
C.Ag+、K+、NO- 3 、Na+
D.Ba2+、Na+、Cl-、NO- 3
加入金属铝产生 H2 的溶液,可能呈强酸性,也可能 呈强碱性;若溶液呈酸性,则溶液中不能含有 NO- 3 ,否则 与铝反应生成的是 NO 而不是 H2。
