蛋白质印迹分析实验原理和操作步骤
蛋白质印迹分析实验原理和操作步骤
蛋白质印迹分析实验原理和操作步骤蛋白质印迹法又称为免疫印迹法,这是一种可以检测固定在固相载体上蛋白质的免疫化学技术方法。
待测蛋白既可以是粗提物也可以经过一定的分离和纯化,另外这项技术的应用需要利用待测蛋白的单克隆或多克隆抗体进行识别。
关键词:【实验原理】蛋白质印迹法又称为免疫印迹法,这是一种可以检测固定在固相载体上蛋白质的免疫化学技术方法。
待测蛋白既可以是粗提物也可以经过一定的分离和纯化,另外这项技术的应用需要利用待测蛋白的单克隆或多克隆抗体进行识别。
如图所示,可溶性抗原,也就是待测蛋白首先要根据其性质,如分子量,分子大小,电荷以及其等电点等采用不同的电泳方法进行分离;通过电流将凝胶中的蛋白质转移到聚偏二氟乙烯膜上;利用抗体(一抗)与抗原发生特异性结合的原理,以抗体作为探针钓取目的蛋白。
值得注意的是在加入一抗前应首先加入非特异性蛋白,如牛白蛋白对膜进行“封阻”而防止抗体与膜的非特异性结合。
经电泳分离后的蛋白往往需再利用电泳方法将蛋白质转移到固相载体上,我们把这个过程称为电泳印迹。
常用的两种电转移方法分别为:1.半干法: 凝胶和固相载体被夹在用缓冲溶液浸湿的之间,通电时间为10分钟~30分钟。
2.湿法:凝胶和固相载体夹心浸放在转移缓冲溶液中,转移时间可从45分钟延长到过夜进行。
由于湿法的使用弹性更大并且没有明显浪费更多的时间和原料,因此我们在这里只描述湿法的基本操作过程。
对于目的蛋白的识别需要采用能够识别一抗的第二抗体。
该抗体往往是购买的成品,已经被结合或标记了特定的试剂,如辣根过氧化物酶。
这种标记是利用辣根过氧化物酶所催化的一个比色反应,该反应的产物有特定的颜色且固定在固相载体上,容易鉴别。
因此可通过对二抗的识别而识别一抗,进而判断出目标蛋白所在的位置。
其他的识别系统包括碱性系统和1 25I标记系统。
1. 实验器材/PAGE实验相关材料;电转移装置;供电设备;(Millipore Immobion-P #IPVH 000 10);Whatman 3MM 纸;其他工具:镊子、海绵垫、剪子、手套、小塑料或玻璃容器、浅盘。
蛋白质印迹的基本原理

蛋白质印迹的基本原理
蛋白质印迹是一种常用的分子生物学技术,用于检测特定蛋白质在混合样本中的存在和数量。
其基本原理是将混合蛋白质样本进行电泳分离,然后将蛋白质转移到聚丙烯酰胺凝胶膜上,再用特定的抗体与目标蛋白质结合,最后通过化学法将目标蛋白质可视化。
蛋白质印迹的步骤:
1. 样品制备:将待检测的蛋白质混合样本进行电泳分离,通常采用SDS-PAGE电泳技术。
2. 转移:将分离后的蛋白质转移到聚丙烯酰胺凝胶膜上,通常采用半湿式或干式转移法。
3. 阻断:在膜上加入一定浓度的蛋白质,以防止非特异性结合。
4. 探针抗体:将特异性的抗体与目标蛋白质结合,通常采用一一配对的方式进行。
5. 二级抗体:添加二级抗体,这种抗体能够与一级抗体结合,并携带着一定的标记物,用于可视化目标蛋白质。
6. 可视化:在化学反应中,标记物会通过某种方式将目标蛋白质可视化,例如酶联免疫吸附实验(ELISA)中的酶底物反应,或荧光素酶反应等。
蛋白质印迹技术因为其灵敏度高、可重复性好、操作简便等特点,被广泛应用于生物医学、生物学等领域。
同时,随着技术的不断进步,蛋白质印迹技术也在不断改进,例如多通量蛋白质印迹技术,能够同时检测多种蛋白质的存在和变化。
蛋白质免疫印迹实验
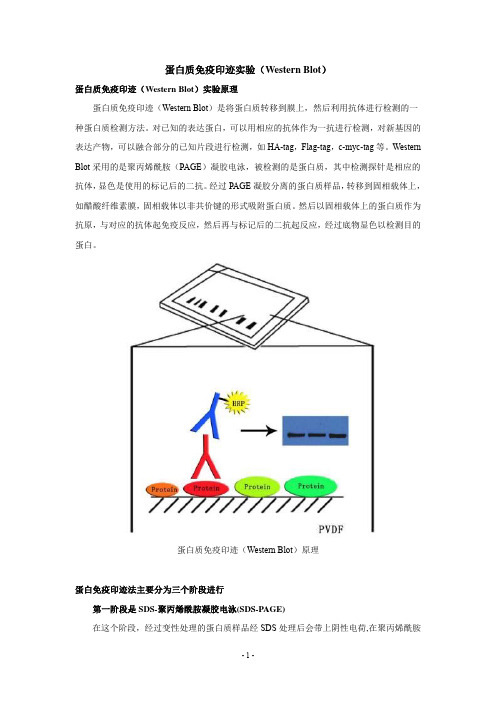
蛋白质免疫印迹实验(Western Blot)蛋白质免疫印迹(Western Blot)实验原理蛋白质免疫印迹(Western Blot)是将蛋白质转移到膜上,然后利用抗体进行检测的一种蛋白质检测方法。
对已知的表达蛋白,可以用相应的抗体作为一抗进行检测,对新基因的表达产物,可以融合部分的已知片段进行检测,如HA-tag,Flag-tag,c-myc-tag等。
Western Blot采用的是聚丙烯酰胺(PAGE)凝胶电泳,被检测的是蛋白质,其中检测探针是相应的抗体,显色是使用的标记后的二抗。
经过PAGE凝胶分离的蛋白质样品,转移到固相载体上,如醋酸纤维素膜,固相载体以非共价键的形式吸附蛋白质。
然后以固相载体上的蛋白质作为抗原,与对应的抗体起免疫反应,然后再与标记后的二抗起反应,经过底物显色以检测目的蛋白。
蛋白质免疫印迹(Western Blot)原理蛋白免疫印迹法主要分为三个阶段进行第一阶段是SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)在这个阶段,经过变性处理的蛋白质样品经SDS处理后会带上阴性电荷,在聚丙烯酰胺凝胶中在电场的作用下从阴极向阳极泳动,且分子量越小,泳动速度就越快。
所以在此阶段,根据蛋白的泳动速度可以将样品中的蛋白质根据其分子量的大小进行分离,此阶段分离效果肉眼不可见。
如果想观察蛋白的电泳情况,可以在电泳完成后进行考马斯亮蓝染色进行观察;第二阶段为电转移,又称为转膜。
即将在凝胶中已经分离的蛋白质条带通过电场的作用转移至硝酸纤维素膜上, 一般选用恒流300 mA,通电90 min即可将凝胶中的蛋白条带转移到醋酸纤维素膜载体上。
转移到载体上的蛋白条带也是肉眼不可见的,如果想观察转移的效果,可以在转移后对载体进行丽春红染液染色。
第三阶段为酶联免疫显色检测将印有蛋白质条带的硝酸纤维素膜(相当于包被了抗原的固相载体)依次与特异性抗体和酶标第二抗体作用后,加入能形成不溶性显色物的酶反应底物,使目的条带蛋白显色。
蛋白印迹实验方法的原理和步骤 -回复

蛋白印迹实验方法的原理和步骤-回复# 蛋白印迹实验方法的原理和步骤引言蛋白印迹技术是一种分子生物学实验方法,旨在研究蛋白质的结构和相互作用。
它通过特定蛋白质与其配体之间的相互作用,为科学家提供了一种探索生物分子间关系的有力工具。
本文将详细介绍蛋白印迹实验的原理和步骤,帮助读者更好地理解和应用这一技术。
一、蛋白印迹实验的原理蛋白印迹实验基于蛋白质的亲和性。
其核心原理是通过在固相载体上固定待检测蛋白,形成“印迹”;然后,通过加入特定配体或标记分子,探测蛋白质的存在和量化信息。
# 1.1 亲和性基础蛋白印迹实验的亲和性基础建立在生物分子相互吸引的原理上。
通过控制条件,使蛋白质与特定的配体结合,从而在实验中可靠地检测目标蛋白质。
# 1.2 固相载体的选择在蛋白印迹实验中,固相载体的选择是至关重要的。
常用的载体包括聚丙烯酰胺凝胶、硝酸纤维素膜等。
载体的选择需根据待检测蛋白的性质和实验目的来确定。
二、蛋白印迹实验的步骤# 2.1 样品准备在进行蛋白印迹实验前,首先需要准备样品。
样品的制备过程包括细胞裂解、蛋白抽提和浓缩等步骤。
确保样品的纯度和完整性对于获得可靠实验结果至关重要。
# 2.2 SDS-PAGE电泳将样品加载到SDS-PAGE凝胶中,通过电泳分离蛋白质。
SDS-PAGE可以根据蛋白质的分子量将其分开,为后续的印迹步骤提供基础。
# 2.3 转膜将SDS-PAGE凝胶上的蛋白质转移到固相载体上,通常使用半湿法或湿法转膜。
这一步骤旨在将蛋白质牢固地固定在载体上,为后续的孔隙印迹创造条件。
# 2.4 孔隙印迹孔隙印迹是蛋白印迹实验的关键步骤,通过将蛋白质印在载体上形成“印迹”。
这一步骤通常涉及用于特定蛋白的抗体或配体,以实现对蛋白质的高度选择性识别。
# 2.5 探测与显色加入特定配体或标记抗体,使其与待检测蛋白结合。
通过适当的显色方法,如酶联免疫吸附实验(ELISA)或化学发光,检测蛋白质的存在并量化其含量。
蛋白质免疫印迹(Western Blot )实验步骤和原理及注意事项

蛋白质免疫印迹(Western Blot )实验步骤和原理及注意事项1.收集蛋白样品(Protein sample preparation)可以使用适当的裂解液。
收集完蛋白样品后,为确保每个蛋白样品的上样量一致,需要测定每个蛋白样品的蛋白浓度。
根据所使用的裂解液的不同,需要采用适当的蛋白浓度测定方法。
因为不同的蛋白浓度测定方法对于一些去垢剂和还原剂等的兼容性差别很大。
BCA法。
2. 电泳(Electrophoresis)(1) SDS-PAGE凝胶配制(2) 样品处理在收集的蛋白样品中加入适量浓缩的SDS-PAGE蛋白上样缓冲液。
例如2X或5X的SDS-PAGE蛋白上样缓冲液。
使用5X的SDS-PAGE蛋白上样缓冲液可以减小上样体积,在相同体积的上样孔内可以上样更多的蛋白样品。
100℃或沸水浴加热3-5分钟,以充分变性蛋白(根据蛋白分子的大小,煮沸时间可适当变化,一般不低于5min。
煮沸只是变性蛋白,而不是分解,一般加了抑制酶不会分解。
煮沸对于SDS-PAGE凝胶电泳是必须的,只有煮沸,才能消除蛋白质的立体二级结构,伸展为一维线性结构,所以一般来讲二聚体都会解体,才能完全按照分子量跑电泳,加的蛋白Marker才有指示分子量的意义。
蛋白样品变性后与SDS充分结合,SDS使每个氨基酸带相同的电荷,使整个蛋白呈线性结构. 抗体因为要是线性表位结合的,100度煮10min 后13000,离心5分钟,取上清电泳,因为沉淀会导致拖尾.也可以取上清到另一管,4度可以放一周备再次电泳)。
(3)电泳i.清洗玻璃板:一只手扣紧玻璃板,另一只手蘸点洗衣粉轻轻擦洗。
两面都擦洗过后用自来水冲,再用蒸馏水冲洗干净后立在筐里晾干。
ii.灌胶与上样(1)玻璃板对齐后放入夹中卡紧。
然后垂直卡在架子上准备灌胶。
(操作时要使两玻璃对齐,以免漏胶。
)(2)配10%分离胶,加入TEMED后立即摇匀即可灌胶。
灌胶时,可用10 ml枪吸取5 ml胶沿玻璃放出,待胶面升到绿带中间线高度时即可。
蛋白质免疫印迹(Western Blot )实验步骤和原理及注意事项

蛋白质免疫印迹(Western Blot )实验步骤和原理及注意事项1.收集蛋白样品(Protein sample preparation)可以使用适当的裂解液。
收集完蛋白样品后,为确保每个蛋白样品的上样量一致,需要测定每个蛋白样品的蛋白浓度。
根据所使用的裂解液的不同,需要采用适当的蛋白浓度测定方法。
因为不同的蛋白浓度测定方法对于一些去垢剂和还原剂等的兼容性差别很大。
BCA法。
2. 电泳(Electrophoresis)(1) SDS-PAGE凝胶配制(2) 样品处理在收集的蛋白样品中加入适量浓缩的SDS-PAGE蛋白上样缓冲液。
例如2X或5X的SDS-PAGE蛋白上样缓冲液。
使用5X的SDS-PAGE蛋白上样缓冲液可以减小上样体积,在相同体积的上样孔内可以上样更多的蛋白样品。
100℃或沸水浴加热3-5分钟,以充分变性蛋白(根据蛋白分子的大小,煮沸时间可适当变化,一般不低于5min。
煮沸只是变性蛋白,而不是分解,一般加了抑制酶不会分解。
煮沸对于SDS-PAGE凝胶电泳是必须的,只有煮沸,才能消除蛋白质的立体二级结构,伸展为一维线性结构,所以一般来讲二聚体都会解体,才能完全按照分子量跑电泳,加的蛋白Marker才有指示分子量的意义。
蛋白样品变性后与SDS充分结合,SDS使每个氨基酸带相同的电荷,使整个蛋白呈线性结构. 抗体因为要是线性表位结合的,100度煮10min 后13000,离心5分钟,取上清电泳,因为沉淀会导致拖尾.也可以取上清到另一管,4度可以放一周备再次电泳)。
(3)电泳i.清洗玻璃板:一只手扣紧玻璃板,另一只手蘸点洗衣粉轻轻擦洗。
两面都擦洗过后用自来水冲,再用蒸馏水冲洗干净后立在筐里晾干。
ii.灌胶与上样(1)玻璃板对齐后放入夹中卡紧。
然后垂直卡在架子上准备灌胶。
(操作时要使两玻璃对齐,以免漏胶。
)(2)配10%分离胶,加入TEMED后立即摇匀即可灌胶。
灌胶时,可用10 ml枪吸取5 ml胶沿玻璃放出,待胶面升到绿带中间线高度时即可。
蛋白质免疫印迹法原理
蛋白质免疫印迹法原理
蛋白质免疫印迹法(Western Blot)是一种常用于检测蛋白质的方法。
其原理基于蛋白质电泳分离和特定抗体与目标蛋白质的特异性结合。
1. 样品制备:首先,待检样品经过蛋白质提取,然后经过电泳分离,通常使用聚丙烯酰胺凝胶电泳(SDS-PAGE)将样品中的蛋白质根据其分子量大小分离。
2. 蛋白转膜:随后,将分离得到的蛋白质通过电泳转印到聚合物(如聚偏氟乙烯)膜上,形成蛋白质膜。
3. 阻断:将膜置于含有蛋白质阻断剂(如牛血清白蛋白)的缓冲液中,阻止非特异性结合。
4. 抗体结合:将膜与特异性抗体一起孵育,抗体与目标蛋白质特异性结合。
这些抗体通常是经过免疫动物制备,针对目标蛋白质的特定抗原位点。
5. 靶蛋白检测:使用荧光标记或酶标记的二抗(即与第一抗体结合的抗体)与第一抗体结合。
这些二抗能够使特定结合的蛋白质与检测标记发生反应。
6. 信号检测:使用荧光标记物或底物,通过荧光检测或发色反应检测结合的蛋白质。
常用方法是使用化学发光底物,比如辣根过氧化物酶和酮硫磺胺基碳酸红等底物。
通过这个原理,蛋白质免疫印迹法可以提供关于特定蛋白质的存在、相对丰度以及蛋白质分子量等信息。
它在分子生物学和生物医学研究中被广泛应用于蛋白质分析和诊断。
蛋白质印迹法实验报告
一、实验目的1. 掌握蛋白质印迹法的基本原理和操作步骤。
2. 学习如何利用蛋白质印迹法检测目标蛋白的表达水平。
3. 掌握蛋白质印迹法的实验操作技巧,为后续相关实验奠定基础。
二、实验原理蛋白质印迹法(Western Blot)是一种常用的蛋白质检测技术,通过特异性抗体与待测蛋白结合,实现对目标蛋白的高灵敏度和高特异性检测。
实验原理如下:1. 蛋白质提取:从组织、细胞或体液中提取总蛋白质,避免蛋白质的降解和失活。
2. 聚丙烯酰胺凝胶电泳(SDS-PAGE):将提取的蛋白质进行SDS-PAGE,根据蛋白质分子量大小进行分离。
3. 蛋白质转移:将分离后的蛋白质从凝胶转移到固相载体(如硝酸纤维素膜或PVDF膜)上。
4. 免疫反应:用特异性抗体与转移至固相载体上的目标蛋白结合,然后与酶或同位素标记的第二抗体发生反应。
5. 显色或放射自显影:通过底物显色或放射自显影等手段,实现对目标蛋白的检测和定量。
三、实验材料1. 细胞株:大鼠原代脊髓星形胶质细胞2. 主要试剂:DMEM/F12培养基、胎牛血清、裂解液、PBS、NaCl、SDS、聚丙烯酰胺凝胶、硝酸纤维素膜、PVDF膜、特异性抗体、酶联第二抗体、底物、显影液等。
3. 仪器:玻璃匀浆器、高速离心机、分光光度仪、-20低温冰箱、垂直板电泳转移装置、恒温水浴摇床、多用脱色摇床等。
四、实验步骤1. 细胞培养:将大鼠原代脊髓星形胶质细胞在DMEM/F12培养基和胎牛血清的条件下培养,直至达到实验所需状态。
2. 蛋白质提取:用裂解液提取细胞总蛋白质,并进行蛋白质浓度测定。
3. SDS-PAGE:将提取的蛋白质进行SDS-PAGE,根据蛋白质分子量大小进行分离。
4. 蛋白质转移:将分离后的蛋白质从凝胶转移到硝酸纤维素膜或PVDF膜上。
5. 免疫反应:将转膜后的膜与特异性抗体进行孵育,然后用酶联第二抗体进行孵育。
6. 显色:加入底物,观察目标蛋白条带的出现,并通过扫描成像系统进行定量分析。
蛋白印迹
蛋白质印迹法一.原理:Western Blot法采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。
经过PAGE(聚丙烯酰胺凝胶电泳)分离的蛋白质样品,转移到固相载体【例如硝酸纤维素薄膜(nc膜)】上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。
以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。
二. 步骤:1.制胶(1)将清洁干净的玻璃板对齐后放入架中卡紧。
然后垂直卡在架子上准备灌胶。
((2)分离胶制法:先将所需量的蒸馏水、30% AcrBis(29:1)、1 MTris,PH8.8、10%SDS、依次加入离心管中,进行摇匀,再将所需量的10%过硫酸铵、TEMED加入,再次进行摇匀(注:要充分摇匀)。
然后用1ml的微量加样器进行灌胶,灌胶时开始可快一些,胶面快到所需高度时要放慢速度,待胶面升到接触绿带高度时即可,然后将板内气泡赶至顶部,再在胶上加一层水进行液封并置于恒温箱内,约20分钟即凝固。
待分离胶凝固后倒去胶上层水并用吸水纸将水吸干再配制浓缩胶。
(注:操作时胶一定要沿玻璃板流下,这样胶中才不会有气泡。
加水液封时要很慢,否则胶会被冲变形。
1.0mm板每板大约需5ml分离胶,1.5mm板每板大约需8ml分离胶)。
(3)浓缩胶制法:先将所需量的蒸馏水、30% AcrBis(29:1)、1 MTris,PH6.8、10%SDS、依次加入离心管中,然后进行摇匀,再将所需量的10%过硫酸铵、TEMED加入,再次进行摇匀。
然后用1ml的微量加样器进行灌胶,待胶面升到玻璃板上端时即可,再将梳子插入浓缩胶中,梳子插入浓缩胶时,应确保没有气泡,待浓缩胶凝固约30分钟中后冷却至室温即可用于电泳。
(1.0mm板每板大约需1.5ml浓缩胶,1.5mm板每板大约需2ml浓缩胶)。
蛋白质印记实验流程
蛋白质印记实验流程
蛋白质印记实验是一种常用的生物化学技术,用于研究蛋白质
的结构、功能和相互作用。
下面将介绍一般的蛋白质印记实验流程。
1. 细胞培养和蛋白质提取。
首先,需要培养所需的细胞系,并收集细胞。
然后,用细胞裂
解液裂解细胞膜,释放蛋白质。
接着,通过超速离心将裂解液离心,以获得上清液中的蛋白质。
2. 免疫沉淀。
将待测蛋白质上清液与特异性抗体结合,形成抗原-抗体复合物。
然后,使用蛋白A/G琼脂糖或其他亲和层析介质进行免疫沉淀,将
抗原-抗体复合物沉淀下来。
3. SDS-PAGE电泳。
将免疫沉淀得到的蛋白质样品进行SDS-PAGE凝胶电泳分离。
SDS-PAGE可以根据蛋白质的大小进行分离,从而得到不同的蛋白质
条带。
4. 免疫印迹分析。
将SDS-PAGE凝胶中的蛋白质迁移到聚丙烯膜或硝酸纤维膜上,形成蛋白质印记。
然后,使用特异性抗体结合目标蛋白质,通过化学发光或染色方法检测蛋白质印记。
5. 数据分析。
最后,根据免疫印迹结果,分析蛋白质的表达水平、分子量和相互作用等信息。
通过比较不同样品的免疫印迹结果,可以得出对蛋白质的定量和定性分析。
总结,蛋白质印记实验流程包括细胞培养和蛋白质提取、免疫沉淀、SDS-PAGE电泳、免疫印迹分析和数据分析等步骤。
这一流程可以帮助研究人员深入了解蛋白质的结构和功能,为生物医学研究提供重要的实验数据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白质印迹分析实验原理和操作步骤
蛋白质印迹法又称为免疫印迹法,这是一种可以检测固定在固相载体上蛋白质的免疫化学技术方法。
待测蛋白既可以是粗提物也可以经过一定的分离和纯化,另外这项技术的应用需要利用待测蛋白的单克隆或多
克隆抗体进行识别。
关键词:印迹蛋白质步骤蛋白质印迹分析蛋白质印迹Westernblottingimmunoblotting免疫印迹法蛋白质印迹
法
【实验原理】
蛋白质印迹法又称为免疫印迹法,这是一种可以检测固定在固相载体上蛋白质的免疫化学技术方法。
待测蛋白既可以是粗提物也可以经过一定的分离和纯化,另外这项技术的应用需要利用待测蛋白的单克隆或多克隆抗体进行识别。
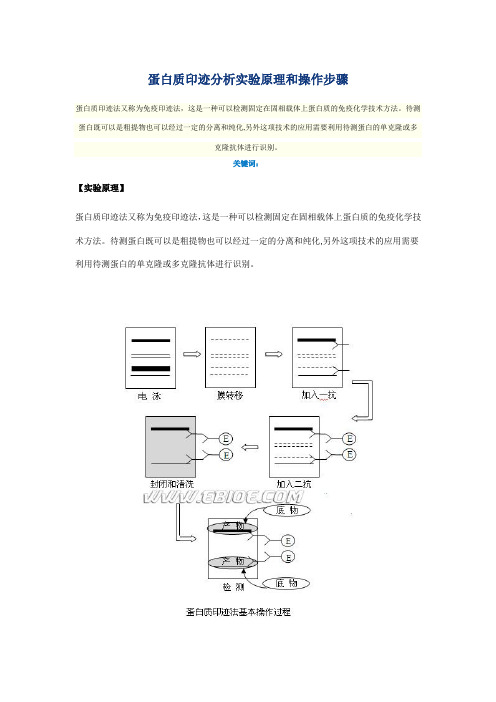
如图所示,可溶性抗原,也就是待测蛋白首先要根据其性质,如分子量,分子大小,电荷以及其等电点等采用不同的电泳方法进行分离;通过电流将凝胶中的蛋白质转移到聚偏二氟乙烯膜上;利用抗体(一抗)与抗原发生特异性结合的原理,以抗体作为探针钓取目的蛋白。
值得注意的是在加入一抗前应首先加入非特异性蛋白,如牛血清白蛋白对膜进行“封阻”而防止抗体与膜的非特异性结合。
经电泳分离后的蛋白往往需再利用电泳方法将蛋白质转移到固相载体上,我们把这个过程称为电泳印迹。
常用的两种电转移方法分别为:
1.半干法: 凝胶和固相载体被夹在用缓冲溶液浸湿的滤纸之间,通电时间为10分钟~30分钟。
2.湿法:凝胶和固相载体夹心浸放在转移缓冲溶液中,转移时间可从45分钟延长到过夜进行。
由于湿法的使用弹性更大并且没有明显浪费更多的时间和原料,因此我们在这里只描述湿法的基本操作过程。
对于目的蛋白的识别需要采用能够识别一抗的第二抗体。
该抗体往往是购买的成品,已经被结合或标记了特定的试剂,如辣根过氧化物酶。
这种标记是利用辣根过氧化物酶所催化的一个比色反应,该反应的产物有特定的颜色且固定在固相载体上,容易鉴别。
因此可通过对二抗的识别而识别一抗,进而判断出目标蛋白所在的位置。
其他的识别系统包括碱性磷酸酶系统和125I标记系统。
1. 实验器材
SDS/PAGE实验相关材料;电转移装置;供电设备;PVDF膜(Millipore Immobion-P #I PVH 000 10);Whatman 3MM 纸;其他工具:镊子、海绵垫、剪子、手套、小塑料或玻璃容器、浅盘。
易生物仪器库:
易生物试剂库:
2. 实验试剂
⑴10x转移缓冲溶液(1L):30.3g Trizma base(0.25M), 144 g甘氨酸(1.92M),加蒸馏水至1L, 此时pH约为8.3,不必调整。
⑵1x转移缓冲溶液(2L):在1.4L蒸馏水中加入400 ml甲醇及200 ml10x 转移缓冲溶液。
⑶TBS 缓冲溶液:将1.22g Tris(10 mM)和8.78g NaCl(150 mM)加入到1L蒸馏水中,用HCl调节pH至7.5。
⑷TTBS buffer:在1L TBS 缓冲溶液中加入0.5ml Tween 20(0.05%)。
⑸一抗:兔抗待测蛋白抗体(多克隆抗体)。
(6) 二抗:辣根过氧化物酶标记羊抗兔。
⑺3% 封阻缓冲溶液(0.5L):牛血清白蛋白15mg加入TBS缓冲溶液并定容至0.5L,过滤,在4°C 保存以防止细菌污染。
⑻0.5%封阻缓冲溶液(0.5L):牛血清白蛋白2.5mg加入TTBS缓冲溶液并定容至0.5L,过滤,在4°C 保存以防止细菌污染。
⑼显影试剂:1ml 氯萘溶液(30mg/ml甲醇配置),加入10 ml甲醇,加入TBS缓冲溶液至50 ml,加入30 ul 30% H2O2。
⑽染色液:1g氨基黑18B (0.1%),250ml异丙醇(25%)及100ml乙酸(10%)用蒸馏水定容至1L。
⑾脱色液:将350ml异丙醇(35%)和20 ml乙酸(2%)用蒸馏水定容至1L。
【实验操作】
⒈.蛋白质的分离
根据目的蛋白的性质,利用电泳方法将其进行分离。
为提高电转移的效率,通常采用SDS/ PAGE技术。
分离实验结束后,首先将样品墙的上边缘用小刀去除,然后在胶板的右上角切一个小口以便定位,小心放入转移缓冲溶液中待用。
⒉.电转移
⑴准备PVDF膜
根据胶的大小剪出一片PVDF膜,膜的大小应略微小于胶的大小。
将膜置于甲醇中浸泡1分钟,再移至转移缓冲溶液中待用。
⑵制作胶膜夹心
在一浅盘中打开转移盒,将一个预先用转移缓冲溶液浸泡过的海绵垫放在转移盒的黑色筛孔板上,在海绵垫的上方放置经转移缓冲溶液浸湿的3MM纸,小心地将胶板放在3MM纸上,并注意排除气泡。
将PVDF膜放在胶的上方同时注意排除气泡,再在膜的上方放上一张同样用转移缓冲溶液浸湿过的3MM纸并赶出气泡,放置另一张浸泡过的海绵垫,关闭转移盒。
将转移盒按照正确的方向放入转移槽中,转移盒的黑色筛孔板贴近转移槽的黑色端,转移盒的白色筛孔板贴近转移槽的白色端,填满转移缓冲溶液同时防止出现气泡。
⑶电转移
连接电源,在4°C条件下维持恒压100v,1小时。
⒊.免疫检测
⑴膜染色
断开电源,将转移盒从转移槽中移出,将转移盒的各个部分分开。
用镊子将PVDF膜小心放入一个干净的容器中,用TBS缓冲溶液进行短暂清洗,从膜上剪下一条宽约5mm的膜放入另一个干净的容器中。
将这条膜在染色液中浸泡1分钟,然后在脱色液中脱色30分钟,确定蛋白质已经转移到PVDF膜上。
⑵膜的封闭和清洗
对于没有进行染色的膜,首先倒出TBS缓冲溶液,加入3%封闭缓冲溶液,轻轻摇动至少1小时。
倒掉3%封闭缓冲溶液,并用TBS缓冲溶液清洗3次, 每次5分钟。
⑶一抗
倒掉TBS缓冲溶液,加入10 ml 0.5%封闭缓冲溶液及适量的一抗,轻轻摇动1小时以上。
从容器中倒出一抗及封闭缓冲溶液,用TTBS缓冲溶液清洗两次,每次10分钟。
⑷二抗
倒出TTBS 缓冲溶液,加入5 ml 0.5%封闭缓冲溶液及适量的二抗。
轻轻摇动30分钟,倒出二抗及封闭缓冲溶液,用TTBS缓冲溶液清洗两次,每次10分钟。
⑸检测
倒掉TTBS 缓冲溶液,并加入显影剂,轻轻摇动PVDF膜,观察显影情况,当能够清晰的看到显色带时,用蒸馏水在30分钟内分三次清洗PVDF膜以终止显色反应的继续进行。
【实验结果】
检查膜上显色结果,蓝紫色带所对应的即是目标蛋白的位置。
