高三化学二轮复习 第1部分 专题2 化学基本理论 突破点9 水溶液中的离子平衡课件
高考化学二轮复习 第一部分 专题篇 二 化学基本理论

考点一
考点 1
考点 2
考点 3 考点 4 限时规范训练
试题
解析
1 精华聚集 A 项,稀释前,两种溶液的导电能力相同,所以溶液中离子浓度 相同,醋酸是弱电解质,所以醋酸的浓度大于盐酸的浓度,错误。
2 题组训练 B 项,导电能力越强,氢离子浓度越大,而溶液的 pH 越小,错误。 C 项,温度不变,水的离子积常数不变,错误。
弱酸、强碱 ―酸――过―量→pH<7
考点一
考点 1
考点 2
考点 3 考点 4 限时规范训练
②已知酸、碱溶液的 pH 之和为 14,若混合后溶液的 pH 为 7,溶 1 精华聚集 液呈中性,则
2 题组训练
强酸、强碱 ―→V 酸∶V 碱=1∶1 强酸、弱碱 ―→V 酸∶V 碱>1∶1
弱酸、强碱 ―→V 酸∶V 碱<1∶1
考点 1
考点 2
考点 3 考点 4 限时规范训练
考点一
试题
3.(1)相同体积、相同浓度的 HCl(a)和 CH3COOH(b),按要求画 出图像。
1 精华聚集 分别与足量的锌粉发生反应:
①产生 H2 的体积 V(H2)随时间(t)的变化图像; 2 题组训练 ②产生 H2 的速率 v(H2)随时间(t)的变化图像;
考点 1
考点 2
考点 3 考点 4 限时规范训练
第9讲 水溶液中的离子平衡
最新考纲
考点 1
考点 2
考点 3 考点 4 限时规范训练
1.了解电解质的概念;了解强电解质和弱电解质的 概念。 2.了解电解质在水溶液中的电离,以及电解质溶液 的导电性。 3.了解弱电解质在水溶液中的电离平衡。 4.了解水的电离,离子积常数。
考点 2Βιβλιοθήκη 考点 3 考点 4 限时规范训练
高考化学大二轮复习专题二化学基本理论9水溶液中的离子平衡课件

下列叙述错误的是( )
关闭
A 项A.,p根H据=1图.2像时,pc(HH=21A.2)=时c(H,HA2A-) 和 HA-物质的量分数相同,则有 c(HB2A.lg)=[Kc(2H(HA2A-),)A]=正-4.确2 ;B 项,根据 pH=4.2 时 时,,CDKH.2.App(HH-的2==A物24)..7=2质时时������(H的���,,���+cc(H)(量(·HH���A���(-分AAA) 2---)数))=>=cc最((HA大2+2A-)),=H=)1=c20Ac(-H(4A.和2+,)2B-)A正2-的确物;C质项的,根量据分图数像相,p同H=,则2.有7
考情分析
-5-
精要排查 真题示例 知能提升 对点演练
(6)任何温度下,根据水溶液中c(H+)和c(OH-)的相对大小可判断溶 液的酸、碱性 ( √ )
(7)完全中和等体积、等pH的盐酸和醋酸消耗的NaOH的量相同 (× )
(8)某溶液的pH=7,该溶液一定为中性溶液 ( × )
考情分析
-6-
精要排查 真题示例 知能提升 对点演练
考情分析
-13-
精要排查 真题示例 知能提升 对点演练
3.图像法理解一强一弱的稀释规律 (1)相同体积、相同浓度的盐酸、醋酸
加水稀释相同的倍数,醋酸的 pH 加水稀释到相同的 pH,盐酸加入
大
的水多
考情分析
-14-
精要排查 真题示例 知能提升 对点演练
(2)相同体积、相同pH的盐酸、醋酸
加水稀释相同的倍数,盐酸的 pH 加水稀释相同的 pH,醋酸加入的
溶液每稀释到体积为原来的10倍,pH增大小于1,说明HX是弱酸,A项错误;
高考化学二轮复习 第1部分 专题突破篇 专题2 化学基本理论 第8讲 水溶液中的离子平衡课件

考
点
点
一
四
考 点 二
第 8 讲 水溶液中的离子平衡
真 题
回
访
考 点 三
体系构建
考纲点击 1.了解电解质在水溶液中的电离,以及电解质溶液的 导电性;了解电解质的概念;了解强弱电解质的概念。 2.了解弱电解质在水溶液中的电离平衡。 3.了解水的电离,水的离子积常数。 4.了解溶液 pH 的定义;了解测定溶液 pH 的方法, 能进行 pH 的简单计算。 5.了解盐类水解的原理、影响盐类水解程度的主要因 素以及盐类水解的应用。 6.了解难溶电解质的沉淀溶解平衡;了解溶度积的含 义及其表达式,能进行相关的计算。
ห้องสมุดไป่ตู้ 2.图像法理解一强一弱的稀释规律 (1)相同体积、相同浓度的盐酸、醋酸
①加水稀释相同的倍数,醋酸的 pH 大。 ②加水稀释到相同的 pH,盐酸加入的水多。
(2)相同体积、相同 pH 值的盐酸、醋酸
①加水稀释相同的倍数,盐酸的 pH 大。 ②加水稀释到相同的 pH,醋酸加入的水多。
题组 1 一强一弱的比较与水的电离判断
a.使电离平衡右移的有___。 b.使 c(H+)增大的有___。 c.能使电离常数变大的有___。 (3)该酸液中水电离出的 c(H+)H2O=________mol/L。
【答案】 1.(1)√ (2)× (3)× (4)× (5)× (6)× 2.(1)c(Ac-()H·cA()H+) 1×10-8 (2)a.①②③ b.①④ c.① (3)1×10
【答案】 C
2.(2015·陕西第一次质检)对室温下 100 mL pH=2 的醋酸和盐酸两种溶液 分别采取下列措施,有关叙述正确的是( )
A.加水稀释至溶液体积为 200 mL,醋酸溶液的 pH 变为 4 B.温度都升高 20 ℃后,两溶液的 pH 不再相等 C.加水稀释至溶液体积为 200 mL 后,两种溶液的 c(OH-)都减小 D.加足量的锌充分反应后,两溶液中产生的氢气体积可用题图表示
高考化学复习考点知识突破解析21: 水溶液中的离子平衡1(解析版)

高考化学复习考点知识突破解析水溶液中的离子平衡1.(2022届·湖南高三月考)Al 3+与F -具有很强的亲和性,当F -的浓度过大时,还会形成AlF 63-。
AlF 3在一定溶剂中也存在分步电离(溶液中存在AlF 3、AlF 2+、AlF 2+、Al 3+等含铝的粒子),常温下,实验测定某浓度的AlF 3中各种含铝的粒子百分含量随p[p= - lg c(F -)]的变化如图所示,下列说法不正确的是( )A .常温下,电离方程式:AlF3 AlF 2++F -的K(AlF 3)的数量级为10-4B .曲线c 表示AlF 2+C .p=6时,溶液中c(AlF 2+)>c(Al 3+)>c(AlF 2+)D .常温下,向AlF 3溶液中加入氟化钠固体,()()22c AlF c AlF ++变小【答案】B【解析】根据图像得到,p[p= - lg c(F -)]越小,则c(F -)越大,从左到右c(F -)越来越大,当c(F -)很小时,浓度最大的是Al 3+,随着c(F -)逐渐增大,Al 3+与一个F -结合得到AlF 2+,然后AlF 2+再与一个F -结合得到AlF 2+,然后AlF 2+再与一个F -结合得到AlF 3,最后AlF 3与三个F -结合得到AlF 63-,因此a 、b 、c 、d 四条曲线分别代表Al 3+、AlF 2+、AlF 2+、AlF 3。
A 项,根据题中信息,p[p= - lg c(F -)]越小,则c(F -)越大,因此p =3.7时AlF 3与AlF 2+浓度相等,因此在常温下,电离方程式:AlF 3AlF 2++F -的2 3.73AlF F F Al ()()==()110()F c c K c c +---⋅=⨯,因此K(AlF 3)的数量级为10-4,故A 正确;B 项,根据前面分析得出曲线c 表示AlF 2+,故B 错误;C 项,根据图中信息,当p=6时,从p=6的点作一条与y 轴相平的平行线,根据a 、b 、c 曲线分别代表Al 3+、AlF 2+、AlF 2+,因此从图中曲线得到溶液中c(AlF 2+)>c Al 3+)>c(AlF 2+),故C 正确;D 项,常温下,向AlF 3溶液中加入氟化钠固体,c(F -)增大,222()()()AlF AlF AlF F ()c K c c +++-=变小,故D 正确。
高考化学二轮复习专题考点剖析—水溶液中的离子平衡

高考化学二轮复习专题考点剖析—水溶液中的离子平衡必备知识解读一、弱电解质的电离(弱电解质:包括弱酸、弱碱、极少数盐(如醋酸铅)、两性氢氧化物、水等。
)1.电离度(1)概念在一定条件下的弱电解质达到电离平衡时,已经电离的电解质分子数占原电解质总分子数的分数。
(2)表示方法α=已电离的弱电解质分子数溶液中原有弱电解质的总分子数×100%也可表示为α=弱电解质的离子浓度弱电解质的浓度×100%(3)影响因素温度的影响升高温度,电离平衡向右移动,电离度增大;降低温度,电离平衡向左移动,电离度减小浓度的影响当弱电解质溶液浓度增大时,电离度减小;当弱电解质溶液浓度减小时,电离度增大2.电离常数(1)概念:电离平衡的常数叫做电离常数。
(2)表达式①对于一元弱酸HA :HAH ++A -,电离常数K a =c(H +)·c (A -)c(HA)。
②对于一元弱碱BOH :BOH B ++OH -,电离常数K b =c(B +)·c(OH -)c(BOH -)。
(3)特点多元弱酸各级电离常数的大小关系是K 1≫K 2≫K 3,故其酸性取决于第一步电离。
(4)影响因素内因:弱电解质本身的性质外因:电离常数只与温度有关,升高温度,K值增大。
(5)意义K越大―→越易电离―→酸碱性越强如相同条件下常见弱酸的酸性强弱:H2C2O4>H2SO3>H3PO4>HF>HCOOH>CH3COOH>H2CO3>H2S>HClO。
3.电离常数的四大应用①判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
②判断盐溶液的酸性(或碱性)强弱,电离常数越大,对应的盐水解程度越小,酸性(或碱性)越弱。
③判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
④计算弱酸、弱碱溶液中的c(H+)、c(OH-)。
有关电离平衡常数的计算(以弱酸HX为例)已知c(HX)和电离平衡常数,求c(H+)。
HX H++X-起始:c(HX)00平衡:c(HX)-c(H+)c(H+)c(X-)则:K=c(H+)·c(X-)c(HX)-c(H+)=c2(H+)c(HX)-c(H+)由于c(H+)的数值很小,可做近似处理:c(HX)-c(H+)≈c(HX),则c(H+)=K·c(HX),代入数值求解即可。
2020-2021备战高考化学压轴题之化水溶液中的离子平衡(备战高考题型整理,突破提升)及详细答案
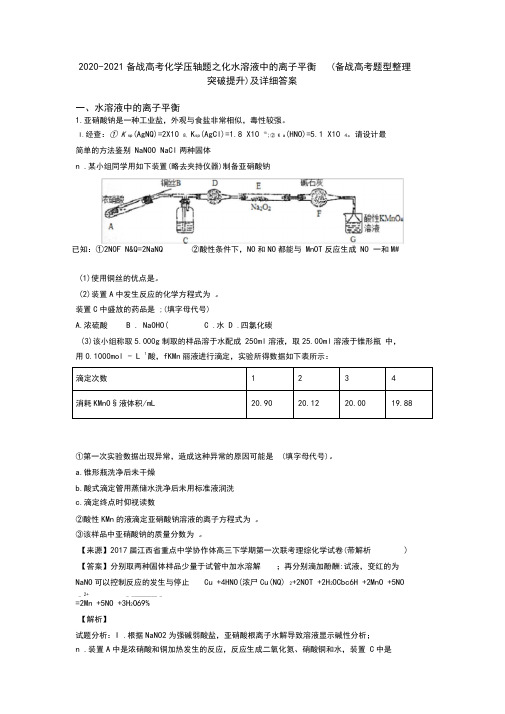
2020-2021备战高考化学压轴题之化水溶液中的离子平衡(备战高考题型整理突破提升)及详细答案一、水溶液中的离子平衡1.亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
I.经查:① K sp(AgNQ)=2X10 8, K sp(AgCl)=1.8 X10 10;② K a(HNO)=5.1 X10 4。
请设计最简单的方法鉴别NaNOO NaCl两种固体n .某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠已知:①2NOF N&Q=2NaNQ ②酸性条件下,NO和NO都能与MnOT反应生成NO 一和M#(1)使用铜丝的优点是。
(2)装置A中发生反应的化学方程式为。
装置C中盛放的药品是 ;(填字母代号)A.浓硫酸 B . NaOHO( C .水D .四氯化碳(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,用0.1000mol - L 1酸,fKMn丽液进行滴定,实验所得数据如下表所示:①第一次实验数据出现异常,造成这种异常的原因可能是 (填字母代号)。
a.锥形瓶洗净后未干燥b.酸式滴定管用蒸储水洗净后未用标准液润洗c.滴定终点时仰视读数②酸性KMn的液滴定亚硝酸钠溶液的离子方程式为。
③该样品中亚硝酸钠的质量分数为。
【来源】2017届江西省重点中学协作体高三下学期第一次联考理综化学试卷(带解析) 【答案】分别取两种固体样品少量于试管中加水溶解;再分别滴加酚酬:试液,变红的为NaNO可以控制反应的发生与停止Cu +4HNO(浓尸Cu(NQ) 2+2NOT +2H2OCbc6H +2MnO +5NO_ 2+ _ __________ _=2Mn +5NO +3H2O69%【解析】试题分析:I .根据NaNO2为强碱弱酸盐,亚硝酸根离子水解导致溶液显示碱性分析;n .装置A中是浓硝酸和铜加热发生的反应,反应生成二氧化氮、硝酸铜和水,装置C中是A 装置生成的二氧化氮和水反应生成硝酸和一氧化氮;通过装置 D 中的干燥剂吸收水蒸气,通过装置 F 中的干燥剂防止水蒸气进入,通过装置 E 中的过氧化钠与一氧化氮反应,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,据此分析解答。
2020-2021高考化学综合题专题复习【化水溶液中的离子平衡】专题解析含详细答案

2020-2021高考化学综合题专题复习【化水溶液中的离子平衡】专题解析含详细答案一、水溶液中的离子平衡1.水合肼(N2H4·H2O)又名水合联氨,无色透明,是具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。
利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
实验1:制备NaClO溶液。
(已知:3NaClO Δ2NaCl+NaClO3)(1)如图装置Ⅰ中烧瓶内发生反应的化学方程式为___________。
(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
a.烧杯b.容量瓶c.玻璃棒d.烧瓶(3)图中装置Ⅱ中用冰水浴控制温度的目的是__________ 。
实验2:制取水合肼。
(4)图中充分反应后,____________(填操作名称)A中溶液即可得到水合肼的粗产品。
若分液漏斗滴液速度过快,部分N2H4·H2O会参与A中反应并产生大量氮气,降低产品产率。
写出该过程反应生成氮气的化学方程式 ________。
实验3:测定馏分中水合肼的含量。
(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250 mL溶液,移出25.00 mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.15 mol·L-1的碘的标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定时,碘的标准溶液盛放在 ________(填“酸式”或“碱式”)滴定管中。
②下列能导致馏分中水合肼的含量测定结果偏高的是 _________(填字母)。
a.锥形瓶清洗干净后未干燥b.滴定前,滴定管内无气泡,滴定后有气泡c.读数时,滴定前平视,滴定后俯视d.盛标准液的滴定管水洗后,直接装标准液③实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为_________。
2023届高三化学高考备考二轮复习专题训练 水溶液中的离子平衡

水溶液中的离子平衡1.数形结合思想应用——分布系数曲线真题研究1.(2017·全国卷Ⅱ,12)常温下,改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=c(X)c(H2A)+c(HA-)+c(A2-)]。
下列叙述错误的是()A.pH=1.2时,c(H2A)=c(HA-)B.lg[K2(H2A)]=-4.2C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)D.pH=4.2时,c(HA-)>c(A2-)>c(H+)2.(2022·辽宁,15)甘氨酸(NH2CH2COOH)是人体必需氨基酸之一。
在25 ℃时,NH+3CH2COOH、NH+3CH2COO-和NH2CH2COO-的分布分数[如δ(A2-)=c(A2-)c(H2A)+c(HA-)+c(A2-)]与溶液pH关系如图。
下列说法错误的是()A.甘氨酸具有两性B.曲线c代表NH2CH2COO-C.NH+3CH2COO-+H2O NH+3CH2COOH+OH-的平衡常数K=10-11.65D.c2(NH+3CH2COO-)<c(NH+3CH2COOH)·c(NH2CH2COO-)3.(2020·全国卷Ⅰ,13)以酚酞为指示剂,用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。
溶液中,pH、分布系数δ随滴加NaOH溶液体积V NaOH的变化关系如下图所示。
[比如A2-的分布系数:δ(A2-)=c(A2-)c(H2A)+c(HA-)+c(A2-)]下列叙述正确的是()A.曲线①代表δ(H2A),曲线②代表δ(HA-)B.H2A溶液的浓度为0.200 0 mol·L-1C.HA-的电离常数K a=1.0×10-2D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)模拟演练1.(2022·福建漳州一模)边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液,水溶液中H2SO3、HSO-3、SO2-3的分布系数δ随pH的变化关系如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
回访1 (2016·全国乙卷)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨 水的电离度为1.32%,下列有关叙述正确的是( )
【导学号:14942040】
A.该滴定过程应该选择酚酞作为指示剂 B.M点对应的盐酸体积为20.0 mL C.M点处的溶液中c(NH+4 )=c(Cl-)=c(H+)=c(OH-) D.N点处的溶液中pH<12
5.溶液的酸碱性判断的最根本的标准是比较溶液中c(H+)和c(OH-)的相对大 小,而pH=7或c(H+)=1×10-7 mol·L-1,仅仅是在室温下的特例,因此在使用pH 判断溶液酸碱性时,要特别注意温度条件。
提炼2 水解平衡及应用 1.水解是微弱的
如浓度为0.1 mol/L、pH=5.5的(NH4)2SO4溶液中,由于c(H+)水=c(OH-)水,而
水电离产生的一部分OH-与很少量的NH
+
4
结合产生NH3·H2O,所以溶液中微粒浓
度关系为c(NH+4 )>c(SO24-)>c(H+)>c(NH3·H2O)>c(OH-)。
2.盐溶液的酸碱性 (1)正盐:谁弱谁水解,谁强显谁性。 强碱弱酸盐(如CH3COONa)―→弱酸根离子水解→结果:c(OH-)>c(H+)。 强酸弱碱盐(如NH4Cl)―→弱碱阳离子水解→结果:c(H+)>c(OH-)。 (2)酸式盐溶液
核 心 知 识 · 聚 焦
突破点9 水溶液中的离子平衡
热 点 题 型 · 探 究
提炼1 电离平衡及应用
1.弱电解质只进行微弱电离,发生电离的弱电解质及产生的离子都是少量
的,同时注意考虑水的电离
如0.1 mol/L的氨水中,由于存在电离平衡:NH3·H2O H2O H++OH-,所以溶液中微粒浓度的关系为
D [A项用0.10 mol·L-1盐酸滴定20.0 mL 0.10 mol·L-1氨水,二者恰好完全反 应时生成强酸弱碱盐NH4Cl,应选用甲基橙作指示剂。B项当V(HCl)=20.0 mL 时,二者恰好完全反应生成NH4Cl,此时溶液呈酸性,而图中M点溶液的pH=7, 故M点对应盐酸的体积小于20.0 mL。C项M点溶液呈中性,则有c(H+)=c(OH-); 据电荷守恒可得c(H+)+c(NH+4 )=c(OH-)+c(Cl-),则有c(NH+4 )=c(Cl-),此时溶 液中离子浓度关系为c(NH+4 )=c(Cl-)>c(H+)=c(OH-)。D项NH3·H2O为弱电解质, 部分发生电离,N点时V(HCl)=0,此时氨水的电离度为1.32%,则有c(OH-)= 0.10 mol·L-1×1.32%=1.32×10-3 mol·L-1,c(H+)=cOKHw -=11..302××1100--143 mol·L- 1≈7.58×10-12 mol·L-1,故N点处的溶液中pH<12。]
3.电离平衡常见影响因素分析 (以CH3COOH CH3COO-+H+为例)
改变条件 平衡移动方向 c(H+) Ka 升高温度 正向移动 增大 增大 加水稀释 正向移动 减小 不变 加冰醋酸 正向移动 增大 不变 加浓盐酸 逆向移动 增大 不变 加入烧碱 正向移动 减小 不变
4.相同pH、相同体积的一元强酸与一元弱酸溶液的比较
如在Na2CO3溶液中存在着Na+、CO
2- 3
ቤተ መጻሕፍቲ ባይዱ
、H+、OH-、HCO
-
3
,它们存在如下关
系:c(Na+)+c(H+)=2c(CO23-)+c(HCO-3 )+c(OH-)。
(2)物料守恒规律
电解质溶液中,由于某些离子能水解或电离,粒子种类增多,但某些关键性
的原子总是守恒的。
c(Na+)=2[c(CO23-)+c(HCO-3 )+c(H2CO3)]
c(NH3·H2O)>c(OH-)>c(NH+4 )>c(H+)。
NH+4 +OH-、
2.多元弱酸的电离分步进行,主要以第一步电离为主 如H2S溶液中,由于存在电离平衡:H2S HS-+H+、HS- S2-+H+、 H2O H++OH-,所以溶液中微粒浓度关系为c(H2S)>c(H+)>c(HS-)>c(S2-)。
3.盐类水解的离子方程式 (1)多元弱酸盐的水解分步进行,以第一步为主,一般只写第一步水解的离子 方程式,如Na2CO3水解的离子方程式:CO23-+H2O HCO-3 +OH-。 (2)多元弱碱阳离子的水解方程式一步写完,如FeCl3水解的离子方程式:Fe3+ +3H2O Fe(OH)3+3H+。 (3)能完全水解的离子组,由于水解程度较大,书写时要用 “===”“↑”“↓”等,如NaHCO3与AlCl3混合溶液反应的离子方程式: Al3++3HCO-3 ===Al(OH)3↓+3CO2↑。
(3)质子守恒规律 电解质溶液中,电离、水解等过程中得到的质子(H+)数等于失去的质子(H+) 数。 如Na2CO3溶液中质子守恒关系可以用图示分析如下:
由得失氢离子守恒可得:c(OH-)=c(H+)+c(HCO-3 )+2c(H2CO3)。
提炼3 沉淀溶解平衡及应用 1.沉淀溶解平衡常数——溶度积 (1)表达式:对于溶解平衡MmAn(s) mMn+(aq)+nAm-(aq) Ksp=[c(Mn+)]m·[c(Am-)]n。 (2)意义:溶度积(Ksp)反映了物质在水中的溶解能力。 (3)影响因素:溶度积常数只与难溶性电解质的性质和温度有关,而与沉淀的 量和溶液中离子的浓度无关。
2.溶度积的应用 通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积(Qc)的相对大 小,判断难溶电解质在给定条件下能否生成或溶解: 当Qc>Ksp时,溶液为过饱和溶液,沉淀析出。 当Qc=Ksp时,溶液为饱和溶液,处于平衡状态。 当Qc<Ksp时,溶液为不饱和溶液,沉淀溶解。
3.Ksp的应用注意事项 (1)用溶度积直接比较难溶电解质的溶解能力时,物质的类型(如AB型、A2B型、 AB2型等)必须相同。 (2)对于同类型物质,Ksp数值越大,难溶电解质在水中的溶解能力越强;当一种 离子和其他几种离子都可能产生沉淀时,Ksp越小,沉淀越容易生成。 (3)对于不同类型的物质,当Ksp相差不大时不能直接作为比较依据,如常温下 Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,不能判断前者溶解度大。 (4)沉淀的转化过程中一般是溶解度大的易转化为溶解度小的,但也可以使溶解 度小的沉淀转化成溶解度大的沉淀,如用饱和Na2CO3溶液浸泡重晶石(BaSO4)可制备 溶于酸的钡盐BaCO3。
