第7章 固体的结构与性质 习题参考答案
第7章 固体的结构与性质 习题参考答案

第7章 固体的结构与性质 习题参考答案1.解:熔点高低、硬度大小的次序为:TiC> ScN> MgO> NaF。
2.解:(1)熔点由低到高的次序:KBr<KCl<NaCl<MgO。
(2)熔点由低到高的次序:N2<NH3<Si。
3.解: 离子 电子分布式 离子电子构型 Fe3+ 1s22s22p63s23p63d59~17Ag+1s22s22p63s23p63d104s24p64d1018Ca2+ 1s22s22p63s23p68Li+ 1s2 2S2−1s22s22p63s23p68Pb2+[Xe]4f145d106s2 18+2Pb4+[Xe]4f145d1018Bi3+[Xe]4f145d106s218+24.解:B为原子晶体,LiCl为离子晶体,BCl3为分子晶体。
5.解:(1)O2、H2S为分子晶体,KCl为离子晶体,Si为原子晶体,Pt为金属晶体。
(2)AlN为共价键,Al为金属键,HF(s)为氢键和分子间力,K2S为离子键。
6.解:物质晶格结点上的粒子晶格结点上离子间的作用力晶体类型预测熔点(高或低)N2N2分子分子间力分子晶体很低SiC Si原子、C原子共价键原子晶体很高Cu Cu原子、离子金属键金属晶体高冰H2O分子氢键、分子间力氢键型分子晶体低BaCl2Ba2+、Cl−离子键离子晶体较高7.解: 3θmf Al(s)+ F (g)AlF (s)H Δ⎯⎯⎯→\D (F -F) −UA 13+3e 3F(g)3F (g)E−−⎯⎯⎯→ +\m sub H ΔAl(g) Al 3+(g)U =+(F -F)+3+ I − \m sub H Δ\D 1AE \m f H Δ= [326.4+32×156.9+3×(−322)+5139.1−(−1510)]kJ · mol −1= 6245 kJ · mol −18.解:f mH ΔK(s) +12I 2(s)KI(s)sub m H Δ(K) sub m H Δ(I 2)12I 2(g) −U12θ(I-I)D I(g) +e − I −(g)+ 1A E −e −K(g) I 1 K +(g)Δ=(K)+ \m f H \m sub H Δ12\m sub H Δ(I 2)+ 12θ(I-I)D ++ I 1A E 1 −U=[90+ 12×62.4+12×152.549+(−295)+418.9−649] kJ · mol −1=−328 kJ · mol −19.解:(1)极化力:Na +,,Al 3+,Si 4+;变形性:Si 4+,Al 3+,Na +。
物质结构和性质知识点归纳习题含答案完美版本

2019年高考第一轮复习《物质结构与性质》一、原子结构1.会画出1到18号的元素的原子结构示意图,注意格式:如Na原子对于钠原子而言,原子序数=核电荷数=质子数=核外电子数=11。
对于钠离子Na+,核外电子数已发生改变,电子数=质子数-所带电荷数=10 ;对O2-,电子数=8+2=10 对于化合物H2O,原子序数总和=核电荷数总和=质子数总和=核外电子数总和=2+8=102.熟记1-36号元素的元素符号、原子序数、在元素周期表的位置、电子排布式、轨道式、所属分区。
注意:(1) 书写原子核外电子排布时,按照能量最低原则排列1s2s2p3s3p4s3d4p5s…,但书写时,相同电子层的要写在一起,即先写3d后写4s,即1s2s2p3s3p3d4s4p5s…此外,还可以把满足稀有气体结构部分写成“原子实”形式:如Zn的电子排布式为1s2 2s2 2p6 3s2 3p6 3d10 4s2 或写成[Ar] 3d10 4s2。
(2)主族元素和0族的外围电子(价电子)为其最外层电子;而过渡元素的外围电子为:简化电子式去掉原子实剩余的部分,如P的外围电子为:3s23p3; Ne的外围电子式为:2s22p6; Zn的外围电子为3d10 4s2(3)注意24Cr 、29Cu这两个原子的电子排布的特殊性(原子无3d4、3d9排布,不稳定):Cr : [Ar]3d5 4s1 ;29Cu :[Ar]3d10 4s1(半满、全满状态能量较低,较稳定)24(4)若形成离子,则考虑先失去最外层电子。
如Cu+的电子排布式为1s22s22p6 3s23p63d10;3.会表示电子的轨道表示式。
方法:先写出电子排布式。
如Na的电子排布式:1s2 2s2 2p6 3s1 ,轨道式:电子排布依据:(1)能量最低原则;(2)“泡利不相容”原则:每个轨道最多只能容纳两个自旋状态不同的电子;(3)洪特规则:电子在相同能量的轨道上排布时,尽可能分占不同的轨道,且自旋状态相同。
王顺荣编高教版社结构化学习题答案第7章
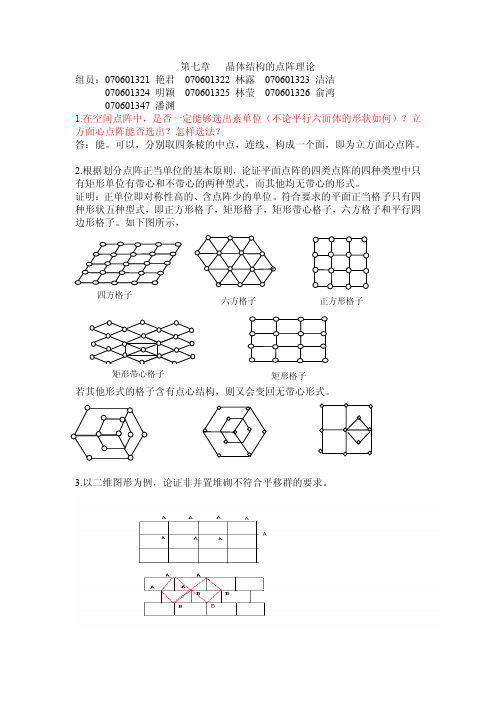
(010)与(210)的夹角为 arc tan1/2 (110)与(210)的夹角为 arc tan1/2-45° 13、利用立方体图形,计算 CH4 正四面体结构 C-H 键的夹角是 109o28' A、B、C、O 为 CH4 中 4 个 H,D 为 CH4 的 C A、O、D 的原子坐标分别为(1,0,1) ,(0,0, 0), (1/2,1/2,1/2) AD=√3/2 , OD=√3/2, AO=√2 ∠AOD 为两个 C-H 键的夹角 Cos∠AOD=(AD2+ OD2- AO2)/2 AD· OD=-1/3 ∠AOD=109o28' 即 CH4 中 C-H 键夹角为 109o28' 14.利用三角函数法,证明由于点阵结构的制约,晶体结构中不存在 5、7 及更高 次轴。
,
解: 设 A 的射散因子为 fa,B 的射散因子为 fb F(hkl)= faei2π(0+0+0) +fbei2π( =fa+ fbeiπ(h+k+l) =fa+ fb[cosπ(h+k+l)+i sin(h+k+l)] 当 fa=fb,即 AB 为相同物质时: 当 h+k+l=奇数时,F(hkl)=0 当 h+k+l=偶数时,F(hkl)=2f 在奇数时不衍射,故为体心点阵(I) 当 fa≠fb,即 AB 为不同物质时: 无消光现象,故为简单点阵(P)
b (s s 0) k
c (s s 0) l
式中 a,b,c 反映了晶胞大小形状和空间取向; s 和 s 0 反映了衍射 X 射线和入射 X 射线的方向;h,k,l 为衍射指标, 为 X 射线波长。 衍射强度 Ihkl 和结构因子 Fhkl 成正比,而结构因子和晶胞中原子种类及其坐标参数 x,y,z 有关:
物质的结构与性质专项训练(讲义及答案)含答案

物质的结构与性质专项训练(讲义及答案)含答案一、物质的结构与性质的综合性考察1.硼(B)、铝及其化合物在化学中有重要的地位。
请回答下列问题:Ⅰ.(1)与B的基态原子电子排布式中成单电子数相同的第二周期元素还有______(填写元素符号)。
Ⅱ.硼酸(H3BO3)是白色片状晶体(层状结构如图1),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。
(2)硼酸分子以范德华力、共价键和氢键形成环状结构,每个含有B原子的环中平均含有B原子的个数为______个。
其中B原子的杂化类型为______。
(3)加热时,硼酸的溶解度增大,主要原因是______。
(4)硼酸是一元弱酸,其分子式亦可写为B(OH)3,在水中电离时,硼酸结合水电离出来OH-的而呈酸性,写出硼酸的电离方程式______。
(5)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子的结构式或结构简式为______(标出配位键)。
Ⅲ.硼氢化钠是一种常用的还原剂。
其晶胞结构如图2所示:(6)该晶体中Na+的配位数为______。
(7)若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到的晶体的化学式为______。
(8)LiAlH4也是一种特殊的还原剂,可将羧酸直接还原成醇:CH3COOH CH3CH2OH,CH3COOH分子中键角2______键角1(填“>”、“<”或“=”)。
Ⅳ.(9)硼化镁晶体在39K时呈超导性。
在硼化镁晶体中,镁原子和硼原子是分层排布的,如图3是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。
则硼化镁的化学式为______。
2.Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。
回答下列问题:(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)A. B.C. D.(2)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___________,中心原子的杂化形式为___________,LiAlH4中存在___________(填标号)A.离子键 B.σ键 C.π键 D.氢键(3)基态K原子中,核外电子占据最高能层的符号是___________,占据该能层电子的电子云轮廓图形状是____________;K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔沸点等都比Cr低,原因是___________(4)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是_____________、_____________(5)气态三氧化硫以单分子形式存在,其分子的立体构型为_________,其中共价键的类型有____3.铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
高中物理(新人教版)选择性必修三课后习题:固体(课后习题)【含答案及解析】

固体课后篇素养形成必备知识基础练1.(多选)下列说法正确的是()A.一块固体,若沿各个方向上的导电性能相同,则该固体为非晶体B.一块固体,若是各个方向导热性能不同,则这个固体一定是单晶体C.一块固体,若有确定的熔点,则该固体必定为晶体D.黄金可以切割加工成各种形状,所以是非晶体,只有单晶体才具有各向异性,B、C正确;多晶体和非晶体都具有各向同性,A错误;黄金是晶体,切割后分子结构不变,仍然是晶体,D错。
2.(多选)(2020陕西西安高二期末)下列物质是晶体还是非晶体的判断不正确的是()A.因为石英是晶体,所以由石英制成的玻璃也是晶体B.食盐熔化过程中,温度保持不变,说明食盐是晶体C.蔗糖受潮后黏在一起,没有确定的几何形状,所以它是非晶体D.用烧热的针尖接触涂有蜂蜡薄层的云母片背面,熔化的蜂蜡呈椭圆形,说明蜂蜡是晶体,且各向异性,是晶体,而玻璃没有确定的熔点,为非晶体,故A错误,符合题意;晶体的特点是在熔化过程中温度保持不变,有固定的熔点,食盐熔化过程中,温度保持不变,说明食盐是晶体,故B正确,不符合题意;蔗糖受潮后黏在一起,没有确定的几何形状,但它是晶体中的多晶体,故C错误,符合题意;烧热的针尖接触涂有蜂蜡薄层的云母片背面,熔化的蜂蜡呈椭圆形,说明云母片是晶体,故D错误,符合题意。
3.如图所示,ACBD是一块厚度均匀的由同一种微粒构成的圆板,AB和CD是互相垂直的两条直径,把圆板从图示位置转90°后电流表示数发生了变化(两种情况下都接触良好),关于圆板,下列说法正确的是()A.圆板是非晶体B.圆板是多晶体C.圆板是单晶体D.不知有无固定熔点,无法判定是晶体还是非晶体,说明圆板沿AB和CD两个方向的导电性能不同,即各向异性,所以圆板是单晶体,故选项A、B、D错误,选项C正确。
4.晶体内部的分子有序排列为如图所示的空间点阵(图中的小黑点表示晶体分子),图中AB、AC、AD 为等长的三条线段。
固体物理参考答案(前七章)

固体物理习题参考答案(部分)第一章 晶体结构1.氯化钠:复式格子,基元为Na +,Cl -金刚石:复式格子,基元为两个不等价的碳原子 氯化钠与金刚石的原胞基矢与晶胞基矢如下:原胞基矢)ˆˆ()ˆˆ()ˆˆ(213212211j i a a i k a a k j a a +=+=+= , 晶胞基矢 ka a j a a ia a ˆˆˆ321===2. 解:31A A O ':h:k;l;m==-11:211:11:111:1:-2:1 所以(1 1 2 1) 同样可得1331B B A A :(1 1 2 0); 5522A B B A :(1 1 0 0);654321A A A A A A :(0 0 0 1)3.简立方: 2r=a ,Z=1,()63434r 2r a r 3333πππ===F体心立方:()πππ833r4r 342a r 3422a 3r 4a r 4a 33333=⨯=⨯=∴===F Z ,,则面心立方:()πππ622r 4r 34434442r 4a r 4a 233ar 33=⨯=⨯=∴===F Z ,,则 六角密集:2r=a, 60sin 2c a V C = a c 362=,πππ622336234260sin 34223232=⨯⨯⨯=⨯=⎪⎭⎫ ⎝⎛a a c a r F a金刚石:()πππ163r 38r 348a r 3488Z r 8a 33333=⨯=⨯===F ,, 4. 解:'28109)31arccos(312323)ˆˆˆ()ˆˆˆ(cos )ˆˆˆ()ˆˆˆ(021*******12211=-=-=++-⋅+-=⋅=++-=+-=θθa a k j i a k j i a a a a a kj i a a kj i a a 5.解:对于(110)面:2a 2a a 2S =⋅=所包含的原子个数为2,所以面密度为22a2a22=对于(111)面:2a 2323a 22a 2S =⨯⨯= 所包含的原子个数为2,所以面密度为223a34a 232=8.证明:ABCD 是六角密堆积结构初基晶胞的菱形底面,AD=AB=a 。
固体物理1-7讲习题参考答案

y
ε xx 代入 0 0
0
ε yy
0
0 Dx 0 ,有 Dy = D ε zz z
绕电场方向为轴转 180 度,电场不变
0 0 Dx′ 3 1 3 1 Dy′ = − 2 Dy + 2 Dz = − 4 ε yy + 4 ε zz E D z′ 1 3 3 3 ε yy + ε zz Dy + Dz 2 4 2 4
证:布里渊区边界垂直且平分倒格矢 K h ,故该边界面上任一矢量满足
(k −
1 Kh ) ⋅ Kh = 0 2 2k ⋅ K h − 1 Kh 2
2
即边界方程为
=0
取 K h 方向最短的倒格矢为 K 0 , K h = nK 0 将面间距公式 d =
2π K0
代入边界方程,有
2⋅
2π
λ
cos ϕ −
可见,体心立方的倒格子是晶格常数为 b =
4π 的面心立方。 a 4π 同理可证,面心立方的倒格子是晶格常数为 的体心立方。 a
3.2.证明:倒格子原胞的体积为(2π)3/ Ω ,其中Ω为正格子原胞的体积 证:正格子原胞体积 Ω = a1 ⋅ (a 2 × a 3 ) 倒格子原胞体积 Ω = b1 ⋅ (b2 × b3 ) = b1 ⋅ [b2 ×
B ' A ' = AB(1 − 2 cos θ ) 1 − 2 cos θ = n cos θ : −1 ∼ +1 n = −1, 0,1, 2,3 θ = 0o , 60o ,90o ,120o ,180o
《固体物理学》房晓勇主编教材-习题参考解答07第七章 能带结构分析

()
()
间的运动轨迹是一条垂直于 B 德平面和等能面所截成的曲线,显然电子从曲线 k1 点运动曲线 k2 点所需 的时间为
J G
t2 − t1 =
∫
t2
dt =
t1
∫
k2
k1
dk dk / dt
其中 dk 是 k 空间曲线的弧元
3
第七章 能带结构分析
G G J G JJ G J G dk 由= = −ev × B = −ev⊥ × B dt JJ G J G v⊥ 为垂直于 B 德速度分量,可得
N = 2×
S2
( 2π )
2
2 × π kF
N ⎞ ⎛ k F = ⎜ 2π 2 ⎟ S ⎠ ⎝
1/ 2
= ( 2nπ )
1/ 2
7.3 试证明,当 n / na = 1.36 时,费米球和面心立方晶格的第一布里渊区相切,其中 na 是原子数密度。 解:参考陈金富 13.6 面心立方晶格原子数密度 nα = 界的最近距离 km = 4
5
第七章 能带结构分析 同理可用 ω =
2π eB =2
dA ( E ) dE
7.7 考虑两个能带
E (k ) = ±
=2k 2Δ + Δ2 ∗ m
式中Δ为一常数。设所有取正号的正能态都是空的,所有取负号的负能态都是填满的。 (1)在 t=0 时刻加上一个电子于正能带上的 ( k0 , 0, 0 ) ,并施加一个电场 E = Ez k ′ ,求 t 时刻的电流 (2)当 t → ∞ 时,上述情况如何? (3)在相同条件下,如果负能带出现一个空穴,求其电流。 解:参考陈金富 13.16 (1)正能带上只有一个电子,它对电流的贡献,根据《固体物理学》式 7-20
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第7章固体的结构与性质习题参考答案
1.解:熔点高低、硬度大小的次序为:TiC> ScN> MgO> NaF。
2.解:(1)熔点由低到高的次序:KBr<KCl<NaCl<MgO。
(2)熔点由低到高的次序:N2<NH3<Si。
3.解:离子电子分布式离子电子构型
Fe3+ 1s22s22p63s23p63d59~17
Ag+1s22s22p63s23p63d104s24p64d1018
Ca2+ 1s22s22p63s23p68
Li+ 1s2 2
S2-1s22s22p63s23p68
Pb2+[Xe]4f145d106s2 18+2
Pb4+[Xe]4f145d1018
Bi3+[Xe]4f145d106s218+2
4.解:B为原子晶体,LiCl为离子晶体,BCl3为分子晶体。
5.解:(1)O2、H2S为分子晶体,KCl为离子晶体,Si为原子晶体,Pt为金属晶体。
(2)AlN为共价键,Al为金属键,HF(s)为氢键和分子间力,K2S为离子键。
6.解:
7.解:
3θm
f Al(s)+ F (g)AlF (s)H ∆−−−
→ D (F -F) -U
A 1
3+3e 3F(g)3F (g)E -
-
−−−→
m sub H ∆ +
Al(g) Al 3+(g)
U =
m sub H ∆+ D (F -F)+31
A E + I - m f H ∆
= [326.4+3
2
×156.9+3×(-322)+5139.1-(-1510)]kJ · mol -1 = 6245 kJ · mol -1
8.解:
K(s)
+
1
2
I 2(s)
KI(s)
sub m H ∆ (K) s u b m
H ∆
(I 2) 12I 2(g) -U 12
θ(I-I)D
I(g) +e - I -(g) 1
A E +
-e -
K(g) I 1 K +(g)
m f H ∆= m sub H ∆(K)+ 12
m sub H ∆(I 2)+ 12
θ(I-I)D +1A E + I 1 -U
=[90+ 12⨯62.4+12
⨯152.549+(-295)+418.9-649] kJ · mol -1
=-328 kJ · mol -1 9.解:(1)极化力:Na +,
,Al 3+,Si 4+;变形性:Si 4+,Al 3+,Na +。
(2)极化力:I -,Sn 2+,Ge 2+;变形性:Ge 2+,Sn 2+,I -。
10.解:极化作用:SiCl 4> AlCl 3> MgCl 2> NaCl 。
f m
H ∆
11.解:(1)阴离子相同。
阳离子均为18电子构型,极化力、变形性均较大,但Zn2+、Cd2+、Hg2+依次半径增大,变形性增大,故ZnS、CdS、HgS依次附加离子极化作用增加,键的共价程度增大,化合物的溶解度减小。
(2)阳离子相同,但F-、Cl-、I-依次半径增大,变形性增大。
故PbF2、PbCl2、PbI2极化作用依次增大,键的共价程度增大,化合物的溶解度减小。
(3)阴离子相同,但Ca2+、Fe2+、Zn2+电子构型分别为8、9~17、18,变形性依次增大,键的共价程度增大,化合物的溶解度减小。
