初三化学溶解度曲线习题含答案
【精品】中考化学复习:专项七 溶解度曲线及溶质质量分数图像习题(含答案)
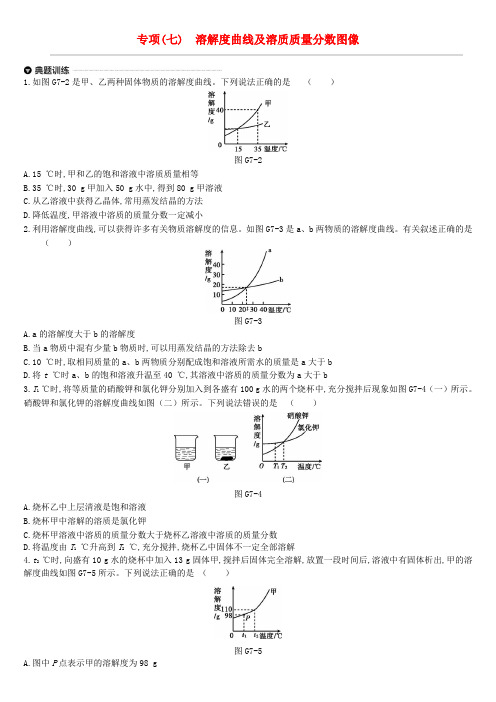
专项(七) 溶解度曲线及溶质质量分数图像1.如图G7-2是甲、乙两种固体物质的溶解度曲线。
下列说法正确的是()图G7-2A.15 ℃时,甲和乙的饱和溶液中溶质质量相等B.35 ℃时,30 g甲加入50 g水中,得到80 g甲溶液C.从乙溶液中获得乙晶体,常用蒸发结晶的方法D.降低温度,甲溶液中溶质的质量分数一定减小2.利用溶解度曲线,可以获得许多有关物质溶解度的信息。
如图G7-3是a、b两物质的溶解度曲线。
有关叙述正确的是()图G7-3A.a的溶解度大于b的溶解度B.当a物质中混有少量b物质时,可以用蒸发结晶的方法除去bC.10 ℃时,取相同质量的a、b两物质分别配成饱和溶液所需水的质量是a大于bD.将t℃时a、b的饱和溶液升温至40 ℃,其溶液中溶质的质量分数为a大于b3.T1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图G7-4(一)所示。
硝酸钾和氯化钾的溶解度曲线如图(二)所示。
下列说法错误的是()图G7-4A.烧杯乙中上层清液是饱和溶液B.烧杯甲中溶解的溶质是氯化钾C.烧杯甲溶液中溶质的质量分数大于烧杯乙溶液中溶质的质量分数D.将温度由T1℃升高到T2℃,充分搅拌,烧杯乙中固体不一定全部溶解4.t2℃时,向盛有10 g水的烧杯中加入13 g固体甲,搅拌后固体完全溶解,放置一段时间后,溶液中有固体析出,甲的溶解度曲线如图G7-5所示。
下列说法正确的是()图G7-5A.图中P点表示甲的溶解度为98 gB.搅拌的目的是增大甲的溶解度C.通过升温可以将甲的不饱和溶液变为饱和溶液D.甲溶于水的过程中一定放出热量5.ZnSO4饱和溶液的溶质质量分数随温度变化的曲线如图G7-6所示。
下列说法正确的是()图G7-6A.N点对应的ZnSO4溶液升温或降温均都可能析出晶体B.M点对应的ZnSO4溶液是不饱和溶液C.ZnSO4饱和溶液的溶质质量分数随温度升高而增大D.40 ℃时,ZnSO4的溶解度为41 g6.已知氯化钾、硝酸钾在不同温度时的溶解度如下表:图G7-7依据上表数据和溶解度曲线判断,下列说法错误的是()A.能表示硝酸钾和氯化钾的溶解度曲线分别是甲和乙B.t1℃时,氯化钾和硝酸钾的溶解度相等,在34.0 g至35.0 g之间C.t2℃时,将接近饱和的丙物质的溶液升高温度,可使其变成饱和溶液D.氯化钾中混有少量的硝酸钾,可采用降温结晶的方法提纯7.一定温度下,向不饱和的氯化铜溶液中逐渐加入足量的下列固体,其对应关系正确的是()图G7-88.硝酸钾和氯化钾的溶解度曲线如图G7-9所示。
初三化学中考专题(5)溶解度曲线练习及答案

初三化学中考专题(5)溶解度曲线练习及答案1.a、b两种物质的溶解度曲线如图所示。
下列说法不正确的是A.将t1℃时b的饱和溶液加水可变为不饱和溶液B.将t2℃时a的饱和溶液降温至t1℃,溶液质量不变C.t2℃时,两种物质的饱和溶液中溶质质量分数a>bD.将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等2.下图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是A.t2℃时,甲、乙两种物质的溶解度相等B.甲的溶解度随温度的升高而增大C.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙D.t1℃时,丙的饱和溶液中溶质的质量分数为40%3.下图是甲、乙、丙三种固体物质的溶解度曲线,将甲、乙、丙三种物质t2℃时的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系正确的是A.甲>乙>丙B.甲=乙=丙C.甲=乙>丙D.丙>甲=乙4.(多选)甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是A.t1℃时,甲物质的溶解度为20gB.t1℃时,30g甲加入到50g水中最多可得70g溶液C.t2℃时,乙物质的饱和溶液升温变成不饱和溶液D.t2℃时,甲乙两物质的饱和溶液分别降温到t1℃时,所得溶液溶质质量分数的大小关系是:甲<乙5.(多选)甲、乙两种固体物质的溶解度曲线如图所示。
20℃时,进行了如下图所示的实验,下列叙述正确的是A.甲的溶解度大于乙的溶解度B.实验过程中,属于不饱和溶液的是A溶液和C溶液C.实验过程中,只有B溶液和D溶液属于饱和溶液D.实验过程中,B溶液与E溶液中溶质的质量分数相同6.(多选)甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是A.t2℃时将50g甲物质放入50g水中,充分搅拌后得到100g甲溶液B.t2℃时配制等质量的三种物质的饱和溶液,甲所需要的水最少C.分别将t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数的大小关系是乙>甲>丙D.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体最多丙溶液中无晶体析出7.甲、乙、丙三种物质的溶解度曲线如下图所示。
溶解度曲线和溶质质量分数计算 含答案完整版

溶解度曲线和溶质质量分数计算1、把少量下列物质分别放到水中,充分搅拌,可以得到溶液是的()A.蔗糖B.面粉C.植物油D.钡餐2、下列物质中,属于溶液的是()A.糖水B.牛奶C.米粥D.豆浆3、根据图4信息判断,下列叙述不正确...的是()A.硝酸钾的溶解度随温度升高而增大B.t1 ℃时,氯化钠和硝酸钾的溶解度相同C.将t2℃时的硝酸钾饱和溶液降温到t1℃,有晶体析出D.t2℃时,80g 硝酸钾溶于100g水中可制得饱和溶液4、A、B、C三种不含结晶水的固体物质的溶解度曲线如图,下列说法中不正确...的是()A.t1℃时,A的饱和溶液65 g中含有溶剂50 gB.将t2℃A、B、C三种物质的饱和溶液降温至t1℃时,溶液中溶质的质量分数保持不变C.在t2℃,A、B两种溶液中溶质的质量分数相同D.要从A溶液中得到A,通常可采用蒸发溶剂使其结晶的方法5、下列有关粗盐提纯的实验操作不正确的是( )6、下图是氢氧化钙的溶解度曲线。
在冬天气温为5℃时配制的氢氧化钙饱和溶液,在夏天气温为38℃时(水的蒸发忽略不计),不可能出现的情况是A.溶液变浑浊B.溶液变为不饱和C.溶液质量变小D.溶质质量分数变小7、(1)汽油与酒精分别加入蒸馏水中,能形成溶液的是▲。
(2)白糖固体放入口中有清凉感觉。
请从溶解现象推测其可能原因是▲。
(3)右图是a、b两种固体物质的溶解度曲线。
①当温度低于20℃时,溶解度:a▲ b(选填“>”“<”或“=”);②t℃时,将a、b两物质的饱和溶液均加热至40℃(a 、b 不分解,水分未蒸发),两种溶液中溶质的质量分数:a ▲b (选填“>”“<”或“=”)。
8、右图是甲、乙两种固体物质的溶解度曲线。
(1)t 2℃时,甲物质的溶解度为 ;(2)从图中你还能获得哪些信息?(任填一条) ;(3)分析t 1℃时,将10g 乙物质放入100g 水中,充分溶解后所得的溶液是 (填“饱和”或“不饱和”)溶液。
初三化学溶解度试题答案及解析

初三化学溶解度试题答案及解析1. A 、B 、C 三种物质的溶解度曲线如图所示.(1)P 点表示t 2℃时完全溶解30gA 物质至少需 g 水.(2)t 2℃时等质量的A 、B 、C 三种饱和溶液中所含溶剂质量最多的是 (序号下同) (3)现有A 、B 、C 三种物质的浓溶液,适用于海水晒盐原理进行结晶的是(4)将t 1℃时A 、B 、C 三种物质的饱和溶液分别升温至t 2℃时,所得溶液的溶质质量分数由大到小的顺序是【答案】(1)100;(2)C ; (3)B;(4) B >C >A【解析】 根据ABC 的溶解度曲线可知,(1)P 点表示t 2℃时完全溶解30gA 物质至少需100g 水;(2)t 2℃时等质量的A 、B 、C 三种饱和溶液中所含溶剂质量最多的是应该为该温度下溶解度最小的物质C ;(3)现有A 、B 、C 三种物质的浓溶液,适用于海水晒盐原理进行结晶的是B ,因为蒸发结晶是溶解度受温度影响不大的物质;(4)将t 1℃时A 、B 、C 三种物质的饱和溶液分别升温至t 2℃时,所得溶液的溶质质量分数由大到小的顺序是B >C >A ,综合起始温度和终了温度的溶解度的数值可知答案。
【考点】溶解度曲线2. a 、b 、c 三种物质的溶解度曲线如下图所示。
取t 2℃的a 、b 、c 三种物质的饱和溶液,分别蒸发等质量的水后恢复至t 2℃,再降温到t 1℃。
下列说法不正确的是A .降温至t 2℃时,三种溶液一定都是饱和溶液B .原饱和溶液中,溶质的质量分数一定是a>b=cC .恢复至t 2℃时,析出溶质的质量一定是a>b=cD .降温至t 1℃, 三种溶液中溶质的质量分数一定a=c>b【答案】D【解析】A .由题意可知,将饱和溶液恒温蒸发水,析出晶体,剩余的溶液仍为饱和溶液.故A 说法正确;B .由a 、b 、c 三种物质的溶解度曲线可知,在t 2℃时的a 、b 、c 三种物质的溶解度的大小是:a >b=c ,由饱和溶液溶质的质量分数为×100%可知,溶质的质量分数是a >b=c ,故B说法正确; C .由于在t 2℃时的a 、b 、c 三种物质的溶解度的大小是:a >b=c .所以,分别蒸发等量水恢复至t 2℃时,析出溶质的质量a >b=c .故C 说法正确; D .由a 、b 、c 三种物质的溶解度曲线可知,a 、b 的溶解度随温度的降低而减小,在降温时析出晶体,得到t 1℃的溶液仍是饱和溶液;由于c 的溶解度随温度的降低而增大,降温时得到的是不饱和溶液,由于t 1℃,a 的溶解度大于b 的溶解度,都大于c 在t 2℃时的溶解度,所以,降温至t 1℃,三种溶液中溶质的质量分数一定a >b >c ,故D 说法不正确.【考点】固体溶解度曲线及其作用;饱和溶液和不饱和溶液;晶体和结晶的概念与现象3. (6分)下表是Ca(OH)2和NaOH 的溶解度数据。
初中化学(新人教版)九年级全一册同步测试:溶解度与溶解度曲线(同步习题)【含答案及解析】

第2课时溶解度与溶解度曲线知能演练提升能力提升1.下列关于溶液的说法中,不正确的是()A.溶液是一种混合物,各部分性质相同B.氢氧化钠溶液能导电,是因为溶液中含有自由移动的离子C.接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态D.20 ℃,氯化钠的溶解度为36 g,则20 ℃时100 g氯化钠饱和溶液中含有氯化钠36 g2.小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见表)。
通过分析她得出以下结论,其中不正确的是()A.温度和溶剂种类对NaOH的溶解度都有影响B.NaOH易溶于水,也易溶于酒精C.40 ℃,40 g NaOH溶解在100 g酒精中达到饱和D.将等质量40 ℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20 ℃,析出的晶体前者比后者多3.甲、乙两种物质的溶解度曲线如右图所示。
下列叙述正确的是()A.依据溶解度曲线可判断,甲的溶解度比乙的大B.将甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量大C.将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法D.t1℃时,甲和乙的饱和溶液各100 g,其溶质的质量一定相等4.在20 ℃时,氯化铵的溶解度为35.5 g,碳酸氢钠的溶解度为9.8 g,现将30 g氯化铵和30 g碳酸氢钠同时加入20 ℃时的100 g水中,充分搅拌,则下列有关说法错误的是()A.在20 ℃时,两种物质相比,碳酸氢钠的溶解能力较小B.未溶解的固体一定是碳酸氢钠C.形成的溶液是20 ℃时氯化铵的饱和溶液D.溶液中的溶质有两种5.右图是KNO3和NH4Cl的溶解度曲线。
下列说法正确的是()A.t1℃时,KNO3的溶解度大于NH4ClB.t2℃时,KNO3和NH4Cl的溶解度相等C.t3℃时,可采用冷却热饱和溶液的方法除去NH4Cl溶液中混有的少量KNO3D.NH4Cl的溶解度受温度的影响大于KNO36.根据下列溶解度表和溶解度曲线图回答问题。
初三化学溶解度曲线习题(含答案)

实用文档一、单选题(本大题共16小题,共32.0分)1.对“10%的食盐溶液”的含义解释错误的是()A. 100g食盐溶液中溶解了10g食盐B. 100g水中溶解了10g食盐C. 将10g氯化钠溶解在90g水中所得的溶液D. 将食盐和水按1:9的质量比配成的溶液2.下列洗涤或去污过程利用乳化原理的是()A. 用洗洁精洗去餐具上的油污B. 用刷子刷去杯子上的油污C. 用酒精除去衣服上的碘D. 用汽油除去衣服上的油污3.下列物质放入水中,能形成溶液的是()A. 面粉B. 冰块C. 花生油D. 蔗糖4.在蒸馏水中加入NaOH颗粒,不断搅拌,用温度传感器记录溶解过程的温度变化如图a、c两点观察到溶液中有固体存在,b点固体完全消失。
下列说法不正确的是()A. NaOH固体溶于水是放热过程B. a、c两点时,NaOH的溶解度相同C. b点时,该溶液一定是不饱和溶液D. c点时的溶剂质量等于a点时的溶剂质量5.如图,在分别盛有100g水的烧杯中放入KNO3充分溶解,则说法正确的是()A. 甲、乙混合后为t1℃的不饱和溶液B. 乙升温至t2℃,溶液质量增加C. 乙、丙溶液中溶质质量相等D. 丙降温至t1℃,有晶体析出6.曼曼用盛有150g水的烧杯进行如图操作,得到相应的溶液①~③。
下列说法正确的是()A. 固体W的溶解度曲线是图乙中的bB. ①~③溶液中,只有②是饱和溶液C. ①~③溶液中,溶质质量分数的大小关系是③>②>①D. 若将②升温至t2℃,固体不能全部溶解7.要将一瓶接近饱和的石灰水变成饱和溶液,小明选择了如下方法。
其中可行的是()①加入CaO ②加入Ca(OH)2 ③升高温度④降低温度。
A. ②③B. ②④C. ①②③D. ①②④8.下列关于硝酸钾的溶解度的说法,正确的是()A. 20℃时,20g硝酸钾溶解在100g水里,所以20℃时硝酸钾的溶解度是20gB. 20℃时,20g硝酸钾溶解在水里制成饱和溶液,所以20℃时硝酸钾的溶解度是20gC. 把31.6g硝酸钾溶解在100g水里,形成饱和溶液,所以20℃时硝酸钾的溶解度是31.6gD. 20℃时,31.6g硝酸钾溶解在100g水里,形成饱和溶液,所以20℃时硝酸钾的溶解度是31.6g9.如图所示,甲、乙试管中分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。
初三化学中考专题溶解度曲线练习及答案

专题五溶解度曲线1.a、b两种物质的溶解度曲线如图所示。
下列说法不正确的是A.将t1℃时b的饱和溶液加水可变为不饱和溶液B.将t2℃时a的饱和溶液降温至t1℃,溶液质量不变C.t2℃时,两种物质的饱和溶液中溶质质量分数a>bD.将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等2.下图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是A.t2℃时,甲、乙两种物质的溶解度相等B.甲的溶解度随温度的升高而增大C.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙D.t1℃时,丙的饱和溶液中溶质的质量分数为40%3.下图是甲、乙、丙三种固体物质的溶解度曲线,将甲、乙、丙三种物质t2℃时的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系正确的是A.甲>乙>丙B.甲=乙=丙C.甲=乙>丙D.丙>甲=乙4.(多选)甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是A.t1℃时,甲物质的溶解度为20gB.t1℃时,30g甲加入到50g水中最多可得70g溶液C.t2℃时,乙物质的饱和溶液升温变成不饱和溶液D.t2℃时,甲乙两物质的饱和溶液分别降温到t1℃时,所得溶液溶质质量分数的大小关系是:甲<乙5.(多选)甲、乙两种固体物质的溶解度曲线如图所示。
20℃时,进行了如下图所示的实验,下列叙述正确的是A.甲的溶解度大于乙的溶解度B.实验过程中,属于不饱和溶液的是A溶液和C溶液C.实验过程中,只有B溶液和D溶液属于饱和溶液D.实验过程中,B溶液与E溶液中溶质的质量分数相同6.(多选)甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是A.t2℃时将50g甲物质放入50g水中,充分搅拌后得到100g甲溶液B.t2℃时配制等质量的三种物质的饱和溶液,甲所需要的水最少C.分别将t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数的大小关系是乙>甲>丙D.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体最多丙溶液中无晶体析出7.甲、乙、丙三种物质的溶解度曲线如下图所示。
初三化学溶解度试题答案及解析

初三化学溶解度试题答案及解析1.下图为硫酸钠和氯化钠的溶解度曲线。
下列说法正确的是A.温度升高,两种物质的溶解度都增大B.50℃的Na2SO4饱和溶液降到40℃时有晶体析出C.40℃时,75g饱和Na2SO4溶液中含25g Na2SO4D.可用降温结晶的方法提纯含少量Na2SO4的NaCl【答案】C【解析】 A选项是错误的叙述,因为氯化钠的溶解度随温度的升高变化不大;B选项是错误的的叙述,在50℃的Na2SO4饱和溶液降到40℃时溶解度的数值增大,没有晶体析出;C选项根据溶解度的数值,可知是正确的叙述;D选项是错误的叙述,因为硫酸钠的溶解度随温度的变化,出现不同的变化趋势,故选C【考点】溶解度曲线2.有关溶液的说法正确的是A.具有均一性、稳定性的液体一定是溶液B.升高温度可将硝酸钾的不饱和溶液变为饱和溶液C.粗盐溶解于水后过滤,滤液中的溶质只有氯化钠D.融雪剂的原理是利用某些物质水溶液的凝固点低于0℃【答案】D【解析】A、具有均一性、稳定性的液体不一定是溶液,还可能是纯净物,如:水、酒精等,错误,B、硝酸钾的溶解度随温度的升高而增大,所以降低温度可将硝酸钾的不饱和溶液变为饱和溶液,错误,C、粗盐溶解于水后过滤,滤液中的溶质除了有氯化钠,还有可溶性的氯化镁、氯化钙,错误,D、融雪剂的原理是利用某些物质水溶液的凝固点低于0℃,正确,故选D【考点】溶液的概念,饱和溶液和不饱和溶液,粗盐的提纯3.下图为甲、乙两种固体物质在水中的溶解度曲线。
下列说法错误的是( )。
A.甲物质的溶解度随温度的升高而增大B.在t1 ℃时,甲、乙两物质的溶解度相等C.在t2 ℃时,N点表示甲物质的不饱和溶液D.在t1℃时,100 g乙物质的饱和溶液中溶质的质量是25 g【答案】D【解析】曲线上面的点表示的含义是有晶体存在的饱和溶液;曲线下面的点表示的是不饱和溶液。
℃时,应该是125 g乙物质的饱和溶液中溶质的质量是25 g。
在t1【考点】溶解度曲线4.下图是某物质的溶解度曲线,60 ℃时,取100 g水配制成该物质的饱和溶液,当温度降低至30 ℃时所得溶液的质量为( )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、单选题(本大题共16小题,共32.0分)1.对“10 %的食盐溶液”的含义解释错误的是()A.100g食盐溶液中溶解了10g食盐B.100g水中溶解了10g食盐C.将10g氯化钠溶解在90g水中所得的溶液D.将食盐和水按1:9的质量比配成的溶液2.下列洗涤或去污过程利用乳化原理的是()A.用洗洁精洗去餐具上的油污B.用刷子刷去杯子上的油污C.用酒精除去衣服上的碘D.用汽油除去衣服上的油污3.下列物质放入水中,能形成溶液的是()A.面粉B.冰块C.花生油D.蔗糖4.在蒸馏水中加入NaOH颗粒,不断搅拌,用温度传感器记录溶解过程的温度变化如图a、c两点观察到溶液中有固体存在,b点固体完全消失。
下列说法不正确的是()A. NaOH固体溶于水是放热过程B.a、c两点时,NaOH的溶解度相同C.b点时,该溶液一定是不饱和溶液D.c点时的溶剂质量等于a点时的溶剂质量5.如图,在分别盛有100g水的烧杯中放入KNO3充分溶解,则说法正确的是()温度cti tzKN@的溶解度Cg/lDOg水)躺90A.甲、乙混合后为t1℃的不饱和溶液B.乙升温至t2℃,溶液质量增加C.乙、丙溶液中溶质质量相等D.丙降温至t1℃,有晶体析出6.曼曼用盛有150g水的烧杯进行如图操作,得到相应的溶液①〜③。
下列说法正确的是()工 片七 £3也加入3()g^ 继续加入升温J J ,卢:\固体$ _______ ^。
吕固体%'^ ___ 并蒸发50 g 本 ------------ - -------------------------------- > —■ ------------------ > 二二二二二 €<«-J 匕三三J150再水 ① ② ③甲f 溶解度/gA.固体W 的溶解度曲线是图乙中的bB.①〜③溶液中,只有②是饱和溶液C.①〜③溶液中,溶质质量分数的大小关系是③,②〉①D.若将②升温至t 2℃,固体不能全部溶解7 .要将一瓶接近饱和的石灰水变成饱和溶液,小明选择了如下方法。
其中可行的是 ()①加入CaO ②加入Ca(OH)2 ③升高温度 ④降低温度。
A ②③ B.②④ C.①②③ D.①②④8 .下列关于硝酸钾的溶解度的说法,正确的是()A. 20℃时,20g 硝酸钾溶解在100g 水里,所以20 ℃时硝酸钾的溶解度是20gB. 20℃时,20g 硝酸钾溶解在水里制成饱和溶液,所以20 ℃时硝酸钾的溶解度是 20gC.把31.6g 硝酸钾溶解在100g 水里,形成饱和溶液,所以20 ℃时硝酸钾的溶解度是31.6gD. 20℃时,31.6g 硝酸钾溶解在100g 水里,形成饱和溶液,所以20℃时硝酸钾的 溶解度是31.6g如图所示,甲、乙试管中分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。
向烧杯中加入一定质量的氢氧化钠固体后,下列分析正确的是()A.甲试管溶液中的溶质质量减少B.甲试管中未溶解的固体质量增加C.乙试管溶液中溶质质量增加D.乙试管中未溶解的固体的质量增加10.氢氧化钙的溶解度随温度升高而减小。
要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤恒温蒸发 水。
其中措施正确的是()A.①②④B.①③④C.①③⑤D.①②⑤H 9.11.如图所示是甲、乙两种固体物质的溶解度曲线。
下列说法正确的是()A.15℃时,甲和乙的饱和溶液中溶质质量相等B.35℃时,30g甲加入50g水中,得到80g甲溶液C.从乙溶液中获得乙晶体,常用蒸发结晶的方法D.降低温度,甲溶液中溶质的质量分数一定减小12.分类思想是化学研究的重要方法,下列分类正确的是()A.常见的非金属单质:金刚石、臭氧和氮气B.常见的黑色固体:CuO、MnO2、Fe2O3C.常见的溶液:生理盐水、稀盐酸、液氧D.常见的有机物:CH4、C2H5OH、CO13.耳℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
则下列说法正确的是()A.烧杯①的溶液一定是不饱和溶液B.烧杯①的溶液是硝酸钾溶液C.烧杯②的溶液升温到t2℃时,烧杯底部还有部分物质不溶解D.若烧杯①和烧杯②的溶液都升温到t2℃时,溶质的质量分数相等14.如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡。
经过一段时间后,下列有关叙述正确的是()A.指针偏左,食盐溶液一定变稀,烧碱潮解B.指针偏右,食盐溶液一定饱和,烧碱潮解C.指针偏左,食盐溶液一定变浓,烧碱潮解D.指针偏右,食盐溶液一定变浓,烧碱潮解15.生活中处处充满化学,下列有关化学知识的应用叙述正确的是()A.温度越高,二氧化碳在水中溶解越多B.厨房煤气泄漏,立即开启排气扇排气C.进入久未开启的菜窖前,先做灯火实验D.洗涤剂常用来洗涤油污,是因为洗涤剂能溶解油污16.夏季暴雨前,常出现“闷热”天气,此时鱼塘中鱼儿往往有“浮头”(浮出水面)现象。
说明气体在水中的溶解度与压强、温度有关。
下列关于气体溶解度的说法正确的是()A.压强增大,气体溶解度不变B.压强减小,气体溶解度增大C.温度降低,气体溶解度减小D.温度升高,气体溶解度减小二、填空题(本大题共1小题,共1.0分)17.甲、乙、丙三种固体物质的溶解度曲线如下图所示。
据图回答问题:(1)80℃时,甲物质的溶解度是_______ 。
(2)欲将tJC甲物质的不饱和溶液变为该温度下的饱和溶液,可采取的方法:( 任填一种)。
(3)t2℃时,把甲、乙、丙三种物质的饱和溶液降温到tJC,溶质质量分数不变的是(4)若要让乙物质从它的饱和溶液中全部结晶析出,应采取的方法是 _______(5)在80℃时,将150克甲物质的饱和溶液稀释成质量分数为20%的溶液需加水—克。
三、简答题(本大题共1小题,共5.0分)18.如图是甲、乙两种固体物质的溶解度曲线.(1)溶解度随温度升高而减小的物质是 ___ .(2)tJC时,甲、乙两种物质的溶解度____ .(3)要使乙的饱和溶液变为不饱和溶液,除加水之外还可采用的方法是 ___ .(4)要从甲、乙的混合物中提纯甲物质,可用 _______________________ 方法.(5)t2℃时,甲的饱和溶液中溶质的质量分数是____ .(6)在t2℃时,用相同质量的甲、乙两种物质的饱和溶液,降温至1℃时,所得溶液的质量甲___ 乙(填“>”、“<”或“=”)。
答案和解析1.【答案】B【解析】【分析】本题难度不大,掌握溶液中溶质的质量分数的概念并能灵活运用即可正确解答本题。
根据溶液中溶质的质量分数=溶质质量X 100%,溶质的质量分数为10%的溶液即溶液中溶液质量溶质和溶液的质量之比为1:10,或溶质和溶剂的质量之比为1:9,或溶剂和溶液的质量之比为9:10。
【解答】溶质的质量分数为10%的溶液即溶液中溶质和溶液的质量之比为1:10,或溶质和溶剂的质量之比为1:9,或溶剂和溶液的质量之比为9:10。
A.10%的食盐溶液即溶液中溶质和溶液的质量之比为1:10,选项中溶质和溶液质量之比10:100 = 1:10,故选项含义正确,不符合题意;B.10%的食盐溶液即溶液中溶质和溶剂的质量之比为1:9,选项中溶质和溶剂质量之比10:100 = 1:10,故选项含义错误,符合题意;C.10%的食盐溶液即溶液中溶质和溶剂的质量之比为1:9,选项中溶质和溶剂质量之比10:90 = 1:9,故选项含义正确,不符合题意;D.10%的食盐溶液即溶液中溶质和溶剂的质量之比为1:9,选项中溶质和溶剂质量之比等于1:9,故选项中含义正确,不符合题意。
故选B。
2.【答案】A【解析】略3.【答案】D【解析】【分析】A.从面粉放到一定量的水中形成的混合物,外界条件不变,分层,形成的是不均一的、不稳定的混合物去分析解答;B.从冰块放入水中,形成的是纯净物;而溶液中混合物去分析解答;C.从花生油不溶于水,放到水中形成的是乳浊液而不是溶液去分析解答;D.从蔗糖易溶于水,放到水中,形成的混合物,外界条件不变,不分层,各部分性质相同形成的是均一的、稳定的混合物是溶液去分析解答;记住溶液的特征:均一、稳定、混合物,三者缺一不可。
【解答】溶液是一种或几种物质分散到另一种物质里,形成的均一的、稳定的混合物;A.面粉放到一定量的水中形成的混合物,外界条件不变,分层,形成的是不均一的、不稳定的混合物,属于悬浊液,故A错误;B.冰块放入水中,冰是由水分子构成的,水是由水分子构成的,同种分子构成的是纯净物,而溶液是混合物,故B错误;C.花生油不溶于水,放到水中形成的是一种以小液滴形式分散在水中形成混合物,静置后可分层,形成的是不均一、不稳定的乳浊液,而不是溶液,故C错误;D.蔗糖易溶于水,放到水中,形成的混合物,外界条件不变,不分层,各部分性质相同,形成的是均一的、稳定的混合物是溶液,故D正确。
故选D。
4.【答案】C【解析】【分析】氢氧化钠溶于水放热,温度相同,溶解度相同饱和溶液是在该温度下不能再溶解某物质的溶液。
解答本题关键是熟悉氢氧化钠溶解的过程。
【解答】A.由图象可知氢氧化钠溶于水放出热量,故A说法正确;B.a、c两点时,温度相同,都有没有溶解的NaOH,所以a、c两点时,NaOH的溶解度相同,故B说法正确;C.b点固体完全消失,可能是饱和溶液,也可能是不饱和溶液,故C说法错误;D.在蒸馏水中加入NaOH颗粒,整个过程溶剂质量没有变化,故D说法正确。
故选C。
5.【答案】C【解析】【分析】根据题意,t1℃硝酸钾的溶解度为60g,t2℃硝酸钾的溶解度为90g,结合溶解度的含义,进行分析判断。
本题难度不大,掌握结晶的原理、溶解度的含义并能灵活运用是正确解答本题的关键。
【解答】A.t1℃硝酸钾的溶解度为60g,盛有100g水的烧杯中最多溶解硝酸钾60g,甲、乙均为饱和溶液,混合后为t1℃的饱和溶液,故选项说法错误。
B.t1℃盛有100g水的烧杯中最多溶解硝酸钾60g,乙为恰好饱和的溶液,乙升温至t2℃,溶液质量不变,故选项说法错误。
C.t1℃硝酸钾的溶解度为60g,t2℃硝酸钾的溶解度为908,加入的硝酸钾均能全部溶解,乙、丙溶液中溶质质量相等,故选项说法正确。
D.t1℃硝酸钾的溶解度为60g,丙降温至t1℃,恰好形成饱和溶液,没有晶体析出,故选项说法错误。
故选C。
6.【答案】D【解析】略7.【答案】C【解析】【分析】根据氢氧化钙的溶解度随温度升高而减小,据此由不饱和溶液与饱和溶液的转化方法进行分析判断即可。
本题难度不大,增加溶质、蒸发溶剂都可以把不饱和溶液变成饱和溶液,但改变温度使不饱和溶液变成饱和溶液时要具体分析溶解度与温度的关系。
