原料药生产记录
药品GMP检查指南原料药(新版)

机构与人员药品GMP认证(原料药)检查评定标准一、药品GMP认证(原料药)检查项目共172项,其中关键项目(条款号前加“*”)47项,一般项目125项。
二、药品GMP认证(原料药)检查时,应根据申请认证的范围确定相应的检查项目,并进行全面检查和评定。
三、检查中发现不符合要求的项目统称为“缺陷项目”。
其中,关键项目不符合要求者称为“严重缺陷”,一般项目不符合要求者称为“一般缺陷”。
四、缺陷项目如果在申请认证的各剂型或产品中均存在,应按剂型或产品分别计算。
五、在检查过程中,企业隐瞒有关情况或提供虚假材料的,按严重缺陷处理。
检查组应调查取证并详细记录。
六、结果评定(一)未发现严重缺陷,且一般缺陷≤20%,能够立即改正的,企业必须立即改正;不能立即改正的,企业必须提供缺陷整改报告及整改计划,方可通过药品GMP认证。
严重缺陷或一般缺陷>20%的,不予通过药品GMP认证。
一、机构与人员*0301 企业应建立药品生产和质量管理机构,明确各级机构和人员的职责。
看企业组织机构图,查生产质量管理组织机构及功能设置(图示),是否涵盖生产、质量、物料仓储、设备、销售及人员管理等内容,并有负责培训的职能部门/人员。
1.有企业的组织机构图。
1.1组织机构图中体现企业各部门的设置、隶属关系及各部门之间的关系,其中生产和质量管理部门分别独立设置。
1.2组织机构图中体现质量管理部门受企业负责人直接领导。
1.3组织机构图中明确各部门名称及部门负责人。
2.岗位职责。
2.1制定了各级领导的岗位职责。
2.2制定了各部门及负责人的职责,特别是质量管理部门有独立的权限,并能对生产等部门执行《药品生产质量管理规范》进行临督和制约。
2.3制定了各岗位的岗位职责。
2.4岗位职责的制定能体现GMP的所有规定,权力、责任明确,且无交叉,无空白。
0302 企业应配备一定数量的与药品生产相适应的具有相应的专业知识、生产经验及工作能力,应能正确履行其职责的管理人员和技术人员。
化药原料药CTD3.2.S【范本模板】

附件2化学仿制原料药CTD格式申报资料撰写要求一、目录3。
2。
S 原料药3。
2。
S.1 基本信息3.2.S.1.1 药品名称3。
2。
S。
1。
2 结构3.2。
S。
1.3 理化性质3.2.S.2 生产信息3.2.S。
2。
1生产商3。
2.S。
2.2生产工艺和过程控制3。
2.S.2.3物料控制3.2。
S。
2.4关键步骤和中间体的控制3。
2.S。
2.5工艺验证和评价3.2。
S.2.6生产工艺的开发3.2.S.3 特性鉴定3。
2.S.3。
1结构和理化性质3.2。
S。
3.2杂质3.2.S。
4 原料药的质量控制3。
2。
S.4.1质量标准3.2。
S.4.2分析方法3.2.S。
4。
3分析方法的验证3。
2。
S。
4.4批检验报告3.2.S.4。
5质量标准制定依据3。
2。
S.5对照品3。
2.S.6包装材料和容器3。
2。
S。
7稳定性3。
2.S。
7.1稳定性总结3.2.S.7。
2上市后稳定性承诺和稳定性方案3.2.S.7.3稳定性数据二、申报资料正文及撰写要求—1 —3.2。
S.1 基本信息3.2.S。
1。
1药品名称提供原料药的中英文通用名、化学名,化学文摘(CAS)号以及其他名称(包括国外药典收载的名称),应与中国药典或上市产品收载一致.3。
2.S。
1.2 结构提供原料药的结构式、分子式、分子量,如有立体结构和多晶型现象应特别说明,应与中国药典或上市产品收载一致。
3。
2。
S。
1.3 理化性质提供文献(一般来源于药典和默克索引等)收载的原料药的物理和化学性质,具体包括如下信息:性状(如外观、颜色、物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),粒度等。
列表提供与已上市产品或药典收载标准进行理化性质比较研究的资料。
3。
2。
S.2 生产信息3.2.S。
2。
1生产商生产商的名称(一定要写全称)、地址、电话、传真以及生产场所的地址、电话、传真等。
3.2。
原料药生产记录范文

原料药生产记录范文日期:XXXX年XX月XX日产品名称:XXXXX原料药批号:XXXXX生产工艺:XXXXX生产工艺流程:1.原料准备:将所需的原料按照配方要求准备齐全。
2.原料称量:使用精密天平将每种原料按照配方比例进行精确称量。
3.原料配料:将已称量好的原料放入设备中,按照设备要求进行搅拌和混合,确保每种原料充分混合均匀。
4.反应:将搅拌好的原料放入反应釜中,按照温度、反应时间等参数进行反应,完成预期的化学变化。
5.中间产物处理:根据工艺要求,对反应后得到的中间产物进行处理,包括过滤、蒸发、结晶等步骤。
6.干燥:将处理后的中间产物放入干燥设备中进行干燥,去除多余水分,保证产品质量。
7.粉碎:对干燥后的产物进行粉碎,得到所需的粒径。
8.包装:将粉碎后的产品按照要求进行包装,包括有无害气氛包装、滚塑包装等。
9.检验:对包装好的产品进行质量检验,检验项目包括外观、溶解度、含量等。
10.包装:合格产品进行包装,标注产品名称、批号、生产日期等,并存放于指定的仓库。
生产过程中的记录:1.原料检验:记录原料的进货日期、产地、供应商信息,对每批原料进行外观、含量、杂质等指标的检验。
2.原料称量记录:记录每种原料的称量重量,并确保每次称量的准确性。
3.设备操作记录:记录设备的运行参数,包括温度、时间、搅拌速度等,以及操作人员的姓名和时间。
4.反应记录:记录反应釜的运行参数,包括温度、压力、pH值等,以及反应情况的观察和记录。
5.中间产物处理记录:记录每次处理的参数和结果,如过滤效果、结晶收率等。
6.干燥记录:记录干燥设备的运行参数,如温度、湿度等,以及干燥时间和效果。
7.粉碎记录:记录粉碎设备的参数和粒径测试结果。
8.包装记录:记录包装设备的运行参数,如速度、温度等,以及包装效果的检查和记录。
9.检验记录:记录对产品进行的各项检验结果,并标明是否合格。
10.包装记录:记录产品包装的日期、数量、批号等信息。
此外,根据GMP规范,还需记录生产设施和设备的清洁和消毒记录,员工的培训和操作规范记录,以及异常情况和相关纠正措施的记录等。
批生产记录模板

批生产记录模板1. 引言本文档为批生产记录模板,用于记录生产过程中的关键信息和操作步骤,以确保生产过程的可追溯性和一致性。
批生产记录是生产过程中的重要记录,对于质量管理和监督具有重要意义。
2. 批生产记录表格模板序号日期产品批号生产线生产工艺操作员审核员1 yyyy-mm-dd 这里填写产品批号这里填写生产线信息这里填写生产工艺信息这里填写操作员姓名这里填写审核员姓名2 yyyy-mm-dd 这里填写产品批号这里填写生产线信息这里填写生产工艺信息这里填写操作员姓名这里填写审核员姓名…………………3. 批生产记录的内容3.1 生产信息记录包括生产日期、产品批号、生产线、生产工艺等关键信息。
3.2 原料使用记录记录使用的原料的名称、批号、用量等信息,确保生产过程中使用正确的原料。
3.3 设备操作记录记录设备的启动、调整和停机过程,包括设备编号、操作员、操作时间等信息。
3.4 生产操作记录记录生产过程中的关键操作步骤,包括操作员、操作时间、操作内容等信息。
例如:•准备生产原料•混合原料•注入容器•运输产品•包装产品3.5 质量控制记录记录生产过程中的质量控制操作和结果,包括原料检验、产品检验等。
确保产品达到质量标准。
3.6 清洁和消毒记录记录清洁和消毒操作,确保生产环境符合卫生要求。
3.7 销售和分发记录记录产品的销售和分发情况,包括销售日期、销售数量、销售对象等信息。
4. 批生产记录的保存和归档完成生产后,批生产记录应按照规定的归档程序进行保存,确保可追溯性和安全性。
5. 批生产记录的审批和验证批生产记录应经过相应部门的审批和验证,确保内容真实可信。
6. 总结批生产记录是生产过程中的重要记录,对于质量管理和监督具有重要意义。
使用本文档的批生产记录模板可以有效地规范和记录生产过程中的关键信息和操作步骤,保证生产的可追溯性和一致性。
在进行生产过程中,请根据实际情况填写各项信息,并按照归档程序进行保存。
【医疗药品管理】原料药批生产记录(带目录)

(医疗药品管理)原料药批生产记录(带目录)目录封面2目录3批生产指令单4开工前现场检查表5XXXXX 岗位生产记录(一)(一)6XXXXX 岗位生产记录(二)7XXXXX 岗位生产记录(三)8一般生产区岗位清场记录9XXXXX 岗位生产记录(一)10XXXXX 岗位生产记录(二)11XXXXXXXX岗位生产记录(三)12XXXXXXXXX岗位生产记录(四)13附录一叠氮化液的配制记录13XXXXXXXXX岗位生产记录(一)15XXXXX双氧化岗位生产记录(二)16XXXXXXXXXX岗位生产记录(三)17XXXXXXXXX岗位生产记录(四)18中间体检验报告单19原料药一般生产区岗位清场记录20XXXXX炔化岗位生产记录(一)21XXXXX炔化岗位生产记录(二)22XXXXX炔化岗位生产记录(三)23XXXXX炔化岗位生产记录(四)24 XXXXX炔化岗位生产记录(五)25 XXXXX炔化岗位生产记录(六)26 XXXXX炔化岗位生产记录(七)27原料药一般生产区岗位清场记录28 XXXXX脱保护基精制岗位生产记录(一)29 XXXXX脱保护基精制岗位生产记录(二)30 XXXXX脱保护基精制岗位生产记录(三)31 XXXXX脱保护基精制岗位生产记录(四)32 XXXXXXXXX护基岗位生产记录(五)33 XXXXX脱保护基精制岗位生产记录(六)34 原料药洁净区岗位清场记录35XXXXX干燥岗位生产记录36原料药洁净区岗位清场记录37批包装指令单38XXXXX粉碎过筛岗位生产记录39原料药洁净区岗位清场记录40XXXXX混合包装岗位生产记录(一)41 XXXXX混合包装岗位生产记录(二)42原料药洁净区岗位清场记录43原料药包装岗位清场记录44XXXXX批生产汇总表45产品生产检验报告单记录表46XXXXX关键岗位工艺查证记录(一)47XXXXX关键岗位工艺查证记录(二)48XXXXX关键岗位工艺查证记录(三)49批生产记录部门审核表50成品检验报告单51成品审核记录52封面XXXXXX有限公司XXXXX批生产记录品名:规格:批号:理论产量:成品数:成品率:生产日期:生产部审阅:质管部审阅:目录序号, 名称, 文件编号, 批生产指令单, RPR023-00, 开工前现场检查表, RPR024-00, XXXXX开环物岗位生产记录, RPR066-00, 一般生产区岗位清场记录, RCL035-00, XXXXX氯甲基化岗位生产记录, RPR067-00, 一般生产区岗位清场记录, RCL035-00, XXXXX叠氮化岗位生产记录, RPR068-00, 一般生产区岗位清场记录, RCL035-00, XXXXX双氧化岗位生产记录, RPR069-00, 中间体检验报告单, RQC009-00, 一般生产区岗位清场记录, RCL035-00, XXXXX炔化岗位生产记录, RPR070-00, 一般生产区岗位清场记录, RCL035-00, XXXXX脱保护基精制岗位生产记录, RPR071-00 , 原料药洁净区岗位清场记录, RCL037-00, XXXXX干燥岗位生产记录, RPR102-00, 原料药洁净区岗位清场记录, RCL037-00, 批包装指令单, RPR032-00, XXXXX粉碎过筛岗位生产记录, RPR103-00, 原料药洁净区岗位清场记录, RCL037-00, XXXXX混合包装岗位生产记录, RPR104-00, 原料药洁净区岗位清场记录, RCL037-00, 原料药包装岗位清场记录, RCL036-00, XXXXX批生产汇总表, RPR106-00, 产品生产检验报告单记录表, RPR037-00, XXXXX关键岗位工艺查证记录, RPR105-00, 批生产记录部门审核表, RPR039-00, 成品检验报告单, RQC012-00, 成品审核记录, RQA026-00, 成品审核放行通知单, RQA027-00批生产指令单填表日期:年月日产品名称, , 规格,批号, , 包装规格,批生产量, , 生产日期, 年月日起草, , 审核, , 批准,原辅料名称, 进厂编号, 检验单号, 生产厂家, 含量, 理论用量, 批准用量, , , , %, kg, kg, , , , %, kg, kg, , , , %, kg, kg, , , , %, kg, kg, , , , %, kg, kg, , , , %, kg, kg, , , , %, kg, kg, , , , %, kg, kg, , , , %, kg, kg, , , , %, kg, kg, , , , %, kg, kg内包装材料名称, 进厂编号, 检验单号, 生产厂家, 理论用量, 批准用量, , , , ,, , , ., ,, , , , ,备注,开工前现场检查表检查日期:年月日原生产产品, , 批号,待生产产品, , 批号,检查项目, 检查情况(打“√), 合格, 不合格门窗清洁、明亮, □, □天花板清洁、无剥落物, □, □墙面清洁、无剥落物, □, □地面清洁、无剥落物, □, □台面清洁, □, □物料外包装清洁, □, □清洁状态标志, □, □清洁场合格证, □, □设备清洁、光亮, □, □操作工人着装符合要求, □, □按净化程序进行净化, □, □无上次生产遗留物, □, □检查结果, 经检查符合生产要求,同意开工。
药品生产企业日常监督检查跟踪检查记录(片剂、原料药、硬胶囊)

3、该公司按所制订的SOP要求,对空调系统、水系统的日常运行进行记录,并按SOP规定维护、保养;
4、该公司已开展产品年度质量回顾工作,对水系统、环境监测、稳定性试验等进行了趋势分析;公司建立了投诉处理及产品召回流程,明确了产品召回或产品撤回的职责和行动方案。
2019年8月23日市局飞行检查和委托检验专项检查中发现的一项缺陷(易制毒试剂存放现场无易制毒试剂清单),已整改完毕。
现场检查时发现严重缺陷0项、主要缺陷0项,发现一般缺陷0项。
检查中发现的缺陷问题
严重缺陷:无
主要缺陷:无
一般缺陷:无
需要说明的问题:
本次检查现场发现的缺陷不代表公司存在的所有问题,公司应举一反三、持续改进、迅速整改。
附件1
药品生产企业现场检查报告
企业名称
******生物制药股份有限公司
检查范围
**胶囊、**霉素片
地 址
法人
企业负责人
检查部门
**区市场监督管理局
检查
类别
√日常监管 √基本药物 □特殊药品 □中药生产 □GMP跟踪检查
□飞行检查 □委托检验 □委托生产 □不良反应 √市局飞行检查复查、三年内新上市品种
5、根据现场检查该公司生产车间、物料仓库的情况,未见有公司自有品种外的物料、标识物,据公司负责人介绍,该公司无受托或委托生产的情况。
6、该公司近2年未发现违法、违规行为。
严重缺陷:未发现。
主要缺陷:未发现。
一般缺陷:
1、***口服固体制剂车间洁净区器具存放间周转桶“已清洁”标识脱落;(第87条)
药品GMP认证(原料药)检查评定标准

机构与人员药品GMP认证(原料药)检查评定标准一、药品GMP认证(原料药)检查项目共172项,其中关键项目(条款号前加“*”)47项,一般项目125项。
二、药品GMP认证(原料药)检查时,应根据申请认证的范围确定相应的检查项目,并进行全面检查和评定。
三、检查中发现不符合要求的项目统称为“缺陷项目”。
其中,关键项目不符合要求者称为“严重缺陷”,一般项目不符合要求者称为“一般缺陷”。
四、缺陷项目如果在申请认证的各剂型或产品中均存在,应按剂型或产品分别计算。
五、在检查过程中,企业隐瞒有关情况或提供虚假材料的,按严重缺陷处理。
检查组应调查取证并详细记录。
六、结果评定(一)未发现严重缺陷,且一般缺陷≤20%,能够立即改正的,企业必须立即改正;不能立即改正的,企业必须提供缺陷整改报告及整改计划,方可通过药品GMP认证。
严重缺陷或一般缺陷>20%的,不予通过药品GMP认证。
- 1 –培训教材一、机构与人员*0301 企业应建立药品生产和质量管理机构,明确各级机构和人员的职责。
看企业组织机构图,查生产质量管理组织机构及功能设置(图示),是否涵盖生产、质量、物料仓储、设备、销售及人员管理等内容,并有负责培训的职能部门/人员。
1.有企业的组织机构图。
1.1组织机构图中体现企业各部门的设置、隶属关系及各部门之间的关系,其中生产和质量管理部门分别独立设置。
1.2组织机构图中体现质量管理部门受企业负责人直接领导。
1.3组织机构图中明确各部门名称及部门负责人。
2.岗位职责。
2.1制定了各级领导的岗位职责。
2.2制定了各部门及负责人的职责,特别是质量管理部门有独立的权限,并能对生产等部门执行《药品生产质量管理规范》进行临督和制约。
2.3制定了各岗位的岗位职责。
2.4岗位职责的制定能体现GMP的所有规定,权力、责任明确,且无交叉,无空白。
0302 企业应配备一定数量的与药品生产相适应的具有相应的专业知识、生产经验及工作能力,应能正确履行其职责的管理人员和技术人员。
原料药生产记录
填写生产中遇到一些生产或设备运转异常情况及处理方法,并要有操作人签字,没有异常就划“/” (有异常写偏差)
清场检查记录 6.特殊问题或异常 事件记录
合成、成品精制记录
生产操作记录
生产操作记录中的内容是根据工艺规程按步骤编定的,操作记录针对操作内容主要从时间、温度、数量、检测结果、收率等方面全面、准确地反映生产情况 。 例如( 1) 投料时:操作记录需填写投料时间、净重; 升温(降温)至保温反应nhr:要填写开始升温(降温)时间,此时的温度;中间保温反应较长的,根据工艺要求每间隔一段时间记录时间、温度;
合成、成品精制记录
2.称量记录 需有原料名称、批号、日期、毛重、余重、净重、操作者、复核者、 QA签字审核,备注,称量时首先检查秤是否调零,按投料的时间先后顺序填写,试剂级(或固体)可以一起称量并记录;液体需每桶称量并记录,以kg为单位保留小数点后一位,以g为单位保留到g,物料均按“先进先出”的顺序使用。记录中填写内容与上项相同时应重复抄写,不得用“…”或“同上”表示;不得留有空格,如无内容填写要用 “/”划掉。
具体如下:
合成、成品精制记录组成
合成、成品精制记录
封面(包含公司名称)
品名:写工艺上统一的名称,不得随意简写,若是成品应按现行标准写全称。
产品批号:原料药的合成和成品批号均由年-月-年流水号6位数组成,合成(中间体)批号中“月”按投料当月月份定,成品批号中“月”按收料当月月份定。成品返工批号在原批号后加2,合成返工批号在原批号后加-1、-02…..
精烘包记录
设备日志(精制釜、微粉机、离心机、烘箱、粉碎机) 每次生产使用上述这些设备时填写,主要操作内容是指XX产品精制或微粉等。
精烘包记录
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
合成、成品精制记录
成品精制记录选择部分生产前清场(合成不需填写):
指当洁净区因间歇式或换产品生产清场时间超过三天有效期,本次成 品精制生产时需对所用设备进行生产前大清场(包括精制釜、离心机、 双锥烘箱等设备用95%乙醇、纯化水冲洗) ,此时需填写此记录, 并写明清场前的产品品名和批号,清洁日期和起止时间、清洁人、并 有QA、车间主任签字。
合成、成品精制记录
一、封面(包含公司名称)
1. 品名:写工艺上统一的名称,不得随意简写,若是成品应按现行标准 写全称。 2. 产品批号:原料药的合成和成品批号均由年-月-年流水号6位数组成, 合成(中间体)批号中“月”按投料当月月份定,成品批号中“月” 按收料当月月份定。成品返工批号在原批号后加2,合成返工批号在 原批号后加-1、-02….. 3. 数量:收料量 4. 生产车间:X车间 5. 生产日期:合成、成品生产日期都是干燥完成日期。
合成、成品精制记录
四、批生产记录(包含6个部分)
1. 生产前清场检查记录 (1) 清场检查前生产品名、批号:是指上批使用了该步产品主要 设备的;若成品精制前面有大清场记录生产品名和批号就用“/”划掉。 (2)常规项目的检查情况。 (3)安全注意事项:记录中要标明该步有哪些有毒有害物料?性质 是什么?如何防备? (4)检查人、复核人、QA签字。
合成、成品精制记录
3.生产操作记录
生产操作记录中的内容是根据工艺规程按步骤编定的,操作记录针 对操作内容主要从时间、温度、数量、检测结果、收率等方面全面、准 确地反映生产情况 。 例如( 1) 投料时:操作记录需填写投料时间、净重; (2)升温(降温)至保温反应nhr:要填写开始升温(降温)时间, 此时的温度;中间保温反应较长的,根据工艺要求每间隔一段时间记录 时间、温度;
合成、成品精制记录
2.称量记录 需有原料名称、批号、日期、毛重、余重、净重、操作者、复核 者、 QA签字审核,备注,称量时首先检查秤是否调零,按投料的时 间先后顺序填写,试剂级(或固体)可以一起称量并记录;液体需每 桶称量并记录,以kg为单位保留小数点后一位,以g为单位保留到g, 物料均按“先进先出”的顺序使用。记录中填写内容与上项相同时应 重复抄写,不得用“…”或“同上”表示;不得留有空格,如无内容 填写要用 “/”划掉。
合成、成品精制记录
4.清场记录 清洁内容和方 法是根据工艺规程 中清洁SOP来编订 的,将生产中所用 到的釜、烘箱、离 心机等设备按同产 品或换产品两种情 况来清洁:并真实 的填写清场的日期、 清场人和清洁起止 时间、清场所使用 的溶剂数量、清场 是否符合要求。并 有QA、车间主任签 字。(换产品清场: 连续生产超过15批 或换产品生产)
合成、成品精制记录
5.清场检查记录 6.特殊问题或异常 事件记录
填写生产中遇到一些生产或 设备运转异常情况及处理方 法,并要有操作人签字,没
有异常就划“/” (有异常写
偏差)
合成区配套记录
合成区根据生产情况配套填写: 1.设备日志:如釜、离心机、 烘箱需填写设备使用日志。 2.称量器具使用前校准记录 (磅秤:1周/次;电子秤:1 天/次)
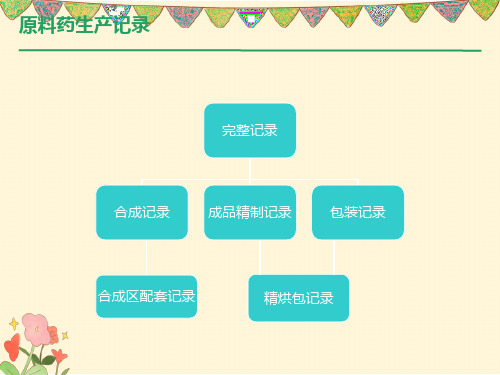
原料药生产记录
完整记录
合成记录
成品精制记录
包装记录
合成区配套记录
精烘包记录
合成、成品精制记录组成
合成记录=批轮次生产指令+批辅料需料单+批生产 记录+装订批封面。 精制记录:相对合成记录少一个批生产指令单, 多 一个超过3天有效期的生产前清场记录。 所有批生产、包装记录页眉要体现记录编号、公司 名称、页码,记录中每个工序必须体现该批产品名 称、产品批号、规格。 具体如下:
包装记录
包装记录=批包装指令单+批包装需料单+批包装记录+成品放行单+ 封面组成
一、封面
要求有公司名称、 批包(或分)装记录, 品名写全称、产品批 号同上精制成品批号, 若总混,总混批号中 的“月”是以总混的 月份定,6位批号后再 加1就成了总混批号), 数量指包装入库数量。 写明生产车间、包装 日期。
包Hale Waihona Puke 记录二、包装指令生产部根据批收料量 下达包装指令(按批下 达),指令中需包含包装 指令单号、指令下达日期、 品名、产品批号、规格、 理论批量、执行日期、生 产日期、有效期至、包装 规格(能体现外包装形式 的:例如:kg/听、kg/ 箱、kg/桶),包材物料 名称、单位、理论用量、 需领用量、备注,指令一 式四份,由车间主任确认、 QA审核签字后,一份给 质管部备案、一份仓库备 料、一份给车间(放每批 包装记录中),一份由生 产部留档。生产指令属公 司受控文件,不得外传或 复印。标签的需领用数都 含了试机用的标签一张。
合成、成品精制记录
二、批生产指令
生产部根据生产计划、 工艺规程中收率和批投料量 下达指令,指令中需包含生 产指令单号(车间代码+生 产代码+产品代码+年+年 流水号)、下达日期、品名、 规格、生产轮次、执行日期 (从执行日期起一个星期执 行都有效)、主原料投料量、 平均收率、产量、主原料名 称和投主原料批量、备注, 指令一式四份,由车间主任 确认、QA审核签字后,一 份给质管部备案、一份给仓 库、一份给车间(放每轮次 记录的第一本中),一份由 生产部留档。生产指令属公 司受控文件,不得外传或复 印。
合成、成品精制记录
三、需料送料单
车间根据生产指令 安排生产,并打印原 辅料需料单(一式三 份):包含内容--,车 间、QA审核签字后, 车间领料人员根据批 需料单,填写领料单 去仓库领料(领料单 需将主原料和辅料分 开开) 。仓管员根据 发货填写批号、检验 单号、实发数量,原 件放记录,两张复印 件一份给仓库,一份 给生产部。
合成、成品精制记录
(3)后处理:要体现开始后处理甩(过)滤时间,进烘箱的时间; (4)干燥:(合成区干燥)需填写时间、温度、每次称量的毛重; (洁 净区双锥精制干燥) 需填写时间、温度、真空度; (5)收料:需填写收料时间、数量、收率计算公式,并填写请验单 (成 品请验单需要在备注中注明生产日期,以便开成品报告,请验单上的数 量包含取样量); (6)入库:收料后包装上贴上标签注明批号和数量 并办理入库,填写入库单。(小批量生产或成品需在记录体现取样量)
