北京化工大学2000考研物理化学试题
北京化工大学考研物化试卷(10年)

0.68 0.65 0.62 0.57 0 .4 8
0.91 0.85 0 .4 8
(1) 根据实验数据绘出该 A. B 二组分系统气一液平衡相菌的示意图,指出气相线和液相线,
并标明各相区的稳定相态和自由度数:
(2) 根据相图分析该二组分系统对拉乌尔定律产生的偏差情况: (3) 温度为严 70.0 'C时.若溶液的总组成为x= 0.85. 总物质量为n= IO mol. 指出平衡时气、液 相的组成,并计算该系统中 n.也}和 na<I):
尔浓度b.lJ.平均活度系数1*:
。)计算在298K时电池反应的标准平衡常数K'. (已知
E~h'Lr = -G.763V I 巧,ρ川" = 0.268叫:
。)已知电池反应的 ll.,H.' =192.973 kJ. mor'. 计算该电池标准电池 电动势的温度系数 (ôE'
5. (15分)
3在气相反应 A → P 的反应机理如下 2
(1) 用 q. , q,、 q.,;表示q. 并写出 q与热力学能耐关系式. (忽略电子运动及核运动}
(2) 利用(1)中的关系式计算1'=298 K时单原子理想气体的热力学能 U.
9. .
第 4 页共 4 页
{但己知 A , 吨 ∞ Eρ)=-39 3.5 W 刷 尸叶飞.6 , 屹'!(仰 zρO. =-28 5.ιB 3kJ .mor 乌 H,!(c 0,.忐 归 严.m 01 乌 H H 叩.1)=忡 衍 盯 九 斗3
A. -53.5 kJ旷咽 r' m。时
B.- 141 2.2 斗 口
kJ .mor'
计算 z
北京化工大学 物理化学试题

A :大水珠变大,小水珠变小 B:大水珠变大,小水珠变大
C:大水珠变小,小水珠变大 D:大水珠、小水珠均变小
19. 溶胶的基本特性之一是 ( )
A: 热力学上和动力学上皆属于稳定体系
B: 热力学上和动力学上皆属于不稳定体系
C: 热力学上不稳定而动力学上属于稳定体系
A: 与体系中A的摩尔分数成比例 B: 等于T温度纯A的蒸汽压
C: 大于T温度下纯A的蒸汽压 D: 等于体系的总压
12. 在一般情况下,电位梯度只影响 ( )
(A) 离子的电迁移率 (B) 离子迁移速率
(C) 电导率 (D) 离子的电流分数
13.基元反应在298K以及的容器中进行,若某时刻反应进度随时间的
变化率为
23ADG+→32dm10.3mols..,则此时G的生成速率(单位3moldms....):( )
A: 0.15 B: 0.9 C: 0.45 D: 0.2
14.已知某复杂反应的反应过程为11kkAB.
..→←..,2kBD+..→,则B的浓度随时间的变化
率[]dBdt.是: ( )
D: 热力学上稳定而动力学上属于不稳定体系
20. Donnan平衡产生的本质原因是: ( )
A: 溶液浓度大,大离子迁移速度慢
B: 小离子浓度大,影响大离子透过半透膜
C: 大离子不能透过半透膜,且因静电作用使小离子在膜两边的浓度不同
D: 大离子浓度大,妨碍小离子通过半透膜
二.填空题(请把正确答案写在答题纸上。共20分)
1.在一封闭的铝锅内装半锅水,放在炉子上加热,以水和蒸汽为体系,则Q 0; W 0;
△U 0; △H 0(请选择<;=;>填写). (4分)
北化2000考研物化试题

北京化工大学2000考研物理化学试题(填空16分,选择题9分,计算5题75分共100分)注意事项:答案写在答题纸上,101.325kPa ≈100kPa=p ,作图用铅笔。
一、填空题(16分)1. 1mol 双原子理想气体由始态370K 、100kPa 分别经(1)等压过程,经(2)等容过程加热到473K ,则(1),(2)两个过程下列物理量的关系是Q 1_____Q 2,W 1_____W 2,△H 1_____△H 2,△S 1_____△S 2。
(填大于、小于或等于)2. 200℃时,Ag 2O 的分解反应为:Ag 2O(s)→2Ag(s)+ 21O 2(g) 己知200℃时固体Ag 2O 的分解压为137.8kPa 。
今让1mol Ag 2O(s)在200℃分解达平衡,则该过程△G=_______,K =_________,反应过程系统与环境交换的功W=______(忽略固体体积,并设气体为理想气体。
3. 根据电池反应设计原电池。
己知电池反应:AgCl(s)+I -(-I a )=AgI(s)+Cl -(-Cl a ) 所设计的原电池为__________________________________________。
4. 有理想气体反应: A(g)+2B(g)→C(g)在等温和总压不变的条件下进行,若原料气中A 与B 的物质的量之比为1:2,达平衡时系统的组分数C=_______,自由度数f=_______。
当温度一定时,增大压力则K _______(填增大、减小或不变),平衡将________移动(填向左、向右或不)。
5. 在一个锥形容器中,放入一滴液体,如下图所示。
试画出接触角θ。
因θ____900 (填大于、小于或等于),则该液体对容器______润湿(填能或不能)。
6. 有(N 、E 、V)确定的理想气体,设分子的运动形式只有三个可及的能级,它们的能量和简并度分别为:k 1ε=0K ,g 1=1k 2ε=100K ,g 1=3k3ε=300K ,g 1=5 (式中k 为玻尔兹曼常数)当温度为200K 时,分子的配分函数值为_______。
北化物理化学题样

-1
5. 在 298K 时已知气相反应 2 A( g ) + B ( g ) ⎯ ⎯→ 2C ( g ) 的 ∆ r Gm 为-514.2kJ·mol ,则 发生 1mol 反应的∆A\: A.∆A\= -514.2 kJ⋅mol C.∆A\> -514.2 kJ⋅mol
-1
B.∆A\= 0 D.∆A\< -514.2 kJ⋅mol
3 -1 3 -1 3 -1 3 -1
29.乙酸乙酯皂化反应的动力学实验中,为了测定不同时间的乙酸乙酯的浓度变化,可采 用物理法, 选用的测量仪器是: A.折光仪 B.电导仪 C.旋光仪 D.酸度计
30.采用静态法测液体的饱和蒸汽压时,实验步骤中要将溶在液体中的空气排出,测定 不同温度下的饱和蒸汽压。若实验中空气没有排净,则实验测得的蒸汽压值比理论 值: A. 偏大 B.偏小 C.不影响 D.没有规律
16.刚性转子的转动量子数为 J 时,其转动能级简并度数为: A.J B .J(J+1) C.2J+1 D.非简并能级 17.在吸附过程中,以下热力学量的变化正确的是: A. ∆G<0, ∆S<0, ∆H<0; B. ∆G>0, ∆S>0, ∆H>0; C. ∆G<0, ∆S>0, ∆H>0; D. ∆G>0, ∆S<0, ∆H<0。 -1 18.浓度为 0.3 mol·kg A2B 电解质溶液的离子强度为 -1 -1 -1 -1 A.0.9mol·kg B.0.3mol·kg C.0.6mol·kg D.1.8mol·kg 19.温度 T 时,浓度均为 0.01 mol·kg 的 NaCl,CaCl2,LaCl3 三种电解质水溶液,离子 平均活度系数最小的是: A. NaCl B. CaCl2 C. LaCl3 D. 都相同 20.下列电极 298K 时其标准电极电势为: 电极 1. Cu++e- = Cu 2. Cu2++ 2e- = Cu 3. Cu2++ e- = Cu+ E\/V 0.522 0.340 0.158
北京化工大学硕士研究生入学考试物理化学样题

≤0
αB
自发 平衡
K
∑ C.
µ
α B
dnαB
≤
0
B
自发 平衡
K
∑ D. µBα dnαB ≥ 0 B
自发 平衡
12.
反应
3 2
H
2
(
g
)
+
1 2
N
2
(
g
)
=
NH 3 (g) ,当
H2 因反应消耗了
0.3mol
时,反应进度
ξ
应为:
A.0.1
B.0.3
C.0.5
D. 0.2
13. 理想气体化学反应平衡时 (∆ν ≠ 0),加入惰性气体,平衡不发生移动的条件是:
5.p\=100kPa≈101.325kPa。
一、选择题(50 分) 1. 1mol 理想气体经恒温膨胀、恒容加热和恒压冷却三步完成一个循环回到始态,此过程
气体吸热 20.0kJ。则该过程的 W :
A.= 20.0kJ ;
B.< 20.0kJ ;
C. >20.0kJ ; D.等于其它值。
2. 若要通过节流膨胀达到制冷的目的,则焦耳—汤姆生系数为:
B.4.883×103kJ·mol-1;
C.0.587×103kJ·mol-1 ;
D.其它值
8. 由 2 mol A 和 2 mol B 形成理想液态混合物,已知某温度下 PA* = 90 kPa, PB* = 30 kPa。
则平衡气相摩尔分数之比 yA:yB 为
A. 3:1
B. 4:1
C. 6:1
已知:E\{Ag2SO4/Ag,SO42-}=0.627V, E\{Ag+/Ag}=0.799V。如上电池的 KSP 为:
北京化工大学860物理化学1999-2016年考研专业课真题试卷

北京化工大学2016年攻读硕士学位研究生入学考试物理化学试题注意事项1.答案必须写在答题纸上,写在试卷上均不给分。
2.答题时可不抄题,但必须写清题号。
3.答题必须用蓝、黑墨水笔或圆珠笔,用红笔或铅笔均不给分。
一、选择及填空题( 30分)1.下列说法不正确的是:( )。
A .临界温度下,临界压力是气体能够液化的最高压力B .不同气体处在相同对应状态时具有相同的压缩因子C .对比参数反映气体所处状态偏离临界点的倍数D .临界温度是气体能够液化的最高温度2. 系统在循环过程中与多个热源接触,吸收(或放出)的热量分别为Q 1、Q 2、… ,下列结论正确的是:( )。
A .0i i i Q T δ⎛⎫ ⎪⎝⎭∑≥B .0i i i Q T δ⎛⎫ ⎪⎝⎭∑≤C .0i i i Q T δ⎛⎫< ⎪⎝⎭∑ D .0i i i Q T δ⎛⎫> ⎪⎝⎭∑ 3. 1mol H 2O(l)在110℃及该温度的饱和蒸气压下,置入一110℃的真空容器中,气化成同温同压的H 2O(g)。
该过程的热力学变化量正确的是:( )。
A .ΔH =0B .ΔU =0C .ΔG =0D .ΔS =04.关于封闭系统的热力学函数,下列说法不正确的是:( )。
A .在等温、等容条件下,系统的亥姆霍兹函数减小值大于对外所做的非体积功B .在等温W ’=0条件下,系统的亥姆霍兹函数变等于对外所做的最大体积功C .在等温、等压、W ’=0条件下,系统吉布斯函数减小的过程能够自发进行D .等温、等压可逆过程,系统的吉布斯函数变等于对外所做的最大功5. 373.15K ,101.325kPa 条件下,H 2O(l)和H 2O(g)的化学势分别为2H O (l)μ和2H O (g)μ,同温下其标准熵分别为2m,H O (l)S 和2m,H O (g)S 。
下列关系正确的是:( )。
A. 2222H O H O m,H O m,H O (l)(g)(g)(l)S S μμ<<,B. 2222H O H O m,H O m,H O (l)(g)(g)(l)S S μμ=>,C. 2222H O H O m,H O m,H O (l)(g)(g)(l)S S μμ<>,D. 2222H O H O m,H O m,H O (l)(g)(g)(l)S S μμ=<,6. 电解质溶液的摩尔电导率与浓度的关系:( )。
北京化工大学 物理化学 2013-2016年硕士研究生考研真题

D.恒熵恒容过程:ΔU≤W'
* 6.A、B 二组分形成理想稀溶液,在温度 T 时达气液平衡。该温度下 p A =50.0 kPa。已知气
相中 A 的组成 yA=0.89, 液相中 B 的组成为 xB=0.15, 则溶质 B 的亨利常数 kx,B=_____。 A.42.5 kPa B.50.0 kPa C.47.8 kPa D.35.0 kPa
北京化工大学 2013 年攻读硕士学位研究生入学考试
物理化学试题
注意事项 1.答案必须写在答题纸上,写在试卷上均不给分。 2.答题时可不抄题,但必须写清题号。 3.答题必须用蓝、黑墨水笔或圆珠笔,用红笔或铅笔均不给分。 4.p=100kPa≈101.325 kPa。
一、选择题(30 分) 1. 下列说法不正确 的是 ... A.临界温度是气体能够液化的最低温度 B.临界温度下,临界压力是气体能够液化的最低压力 C.同种气体在不同温度时的压缩因子可以大于、小于或等于零 D.同温度时不同种类气体的压缩因子可以大于、小于或等于零 2.下列说法正确的是 A.1mol 理想气体从同一始态出发分别经绝热可逆和绝热不可逆过程到相同体积时 W 相等 B.1mol 两气体分别遵循 pVm=C 和 p(Vm–α)=C (α 为常数) ,等温可逆由 V1→V2 时 ΔU 相等 C.某气体分别经节流膨胀和等外压绝热膨胀过程,温度由 T1→T2,系统的 ΔH 相等 D.始终态确定后,某实际气态经历等温过程的 ΔA 和 ΔG 相等
7.对下列化学势表示式或说明不正确 的是 ...
pB A. B =B (pg,T ) RT ln p
B. A = A (l,T ) RT ln aA
pB C. B =B (pg,T ) RT ln p
2000物化答案
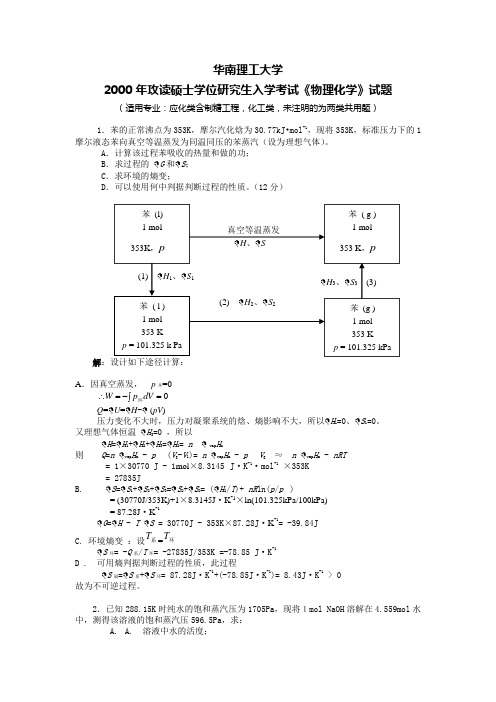
华南理工大学2000年攻读硕士学位研究生入学考试《物理化学》试题(适用专业:应化类含制糖工程,化工类,未注明的为两类共用题)1.苯的正常沸点为353K ,摩尔汽化焓为30.77kJ •mol -1,现将353K ,标准压力下的1摩尔液态苯向真空等温蒸发为同温同压的苯蒸汽(设为理想气体)。
A .计算该过程苯吸收的热量和做的功;B .求过程的 G 和 S ;C .求环境的熵变;D .可以使用何中判据判断过程的性质。
(12分)解A .因真空蒸发, p 环=0⎰=-=∴0dV p W 环 Q = U = H - (pV )压力变化不大时,压力对凝聚系统的焓、熵影响不大,所以 H 1=0、 S 1=0。
又理想气体恒温 H 3=0 ,所以H = H 1+ H 2+ H 3= H 2= n vap H m则 Q =n vap H m - p (V g -V l )= n vap H m - p V g ≈ n vap H m - nRT= 1×30770 J - 1mol ×8.3145 J ·K -1·mol -1×353K = 27835JB. S = S 1+ S 2+ S 3= S 2+ S 2= ( H 2/T )+ nR ln(p /p )= (30770J/353K)+1×8.3145J ·K -1×ln(101.325kPa/100kPa)= 87.28J ·K -1G = H - T S = 30770J - 353K ×87.28J ·K -1= -39.84J C. 环境熵变 :设系T =环TS 环= -Q 系/T 环= -27835J/353K =-78.85 J ·K -1D . 可用熵判据判断过程的性质,此过程S 隔= S 系+ S 环= 87.28J ·K -1+(-78.85J ·K -1)= 8.43J ·K -1> 0 故为不可逆过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京化工大学2000考研物理化学试题(填空16分,选择题9分,计算5题75分共100分) 注意事项:答案写在答题纸上,101.325kPa ≈100kPa=p,作图用铅笔。
一、填空题(16分)1. 1mol 双原子理想气体由始态370K 、100kPa 分别经(1)等压过程,经(2)等容过程加热到473K ,则(1),(2)两个过程下列物理量的关系是Q 1_____Q 2,W 1_____W 2,△H 1_____△H 2,△S 1_____△S 2。
(填大于、小于或等于) 2. 200℃时,Ag 2O 的分解反应为:Ag 2O(s)→2Ag(s)+21O 2(g) 己知200℃时固体Ag 2O 的分解压为137.8kPa 。
今让1mol Ag 2O(s)在200℃分解达平衡,则该过程△G=_______,K =_________,反应过程系统与环境交换的功W=______(忽略固体体积,并设气体为理想气体。
3. 根据电池反应设计原电池。
己知电池反应:AgCl(s)+I -(-I a )=AgI(s)+Cl -(-Cl a )所设计的原电池为__________________________________________。
4. 有理想气体反应: A(g)+2B(g)→C(g)在等温和总压不变的条件下进行,若原料气中A 与B 的物质的量之比为1:2,达平衡时系统的组分数C=_______,自由度数f=_______。
当温度一定时,增大压力则K _______(填增大、减小或不变),平衡将________移动(填向左、向右或不)。
5. 在一个锥形容器中,放入一滴液体,如下图所示。
试画出接触角θ。
因θ____900(填大于、小于或等于),则该液体对容器______润湿(填能或不能)。
6. 有(N 、E 、V)确定的理想气体,设分子的运动形式只有三个可及的能级,它们的能量和简并度分别为:k1ε=0K ,g 1=1k2ε=100K ,g 1=3 k3ε=300K ,g 1=5(式中k 为玻尔兹曼常数)当温度为200K 时,分子的配分函数值为_______。
在某温度下,若kTie ε-→1时,三个能级上最可几分子数之比为_____________。
(注:为i ε) 7. 请设计实验测定反应C 6H 6(l)+215O 2→6CO 2(g)+3H 2O(g) 的摩尔反应焓△r H m 。
实验方法及理论依据是:___________________________________。
(不考虑用光谱或波谱方法,不要求写出实验步骤和实验装置)。
二、选择题(9分)1. 实际气体经节流膨胀过程,正确的结论是: [ ](1) Q<0 ,△H=0 ,△p<0 ; (2) Q=0 ,△H=0 ,△T<0 ; (3) Q=0 ,△H<0 ,△p<0 ;(4) Q=0 ,△H=0 ,△p<0 。
2. 某化学反应在恒容绝热条件下进行,系统的温度由T 1升到T 2,此过程内能的变化是[ ]若此反应在温度T 1下恒温、恒容地进行,其内能的变化是 [ ] (1)△U=0; (2) △U>0; (3) △U<0; (4)不能确定。
3. 对于理想气体化学反应,若△r H m 视为常数,则lnK 与T 的关系中,正确的是 [ ]4. 某二组分凝聚系统相图如下,系统点与相点合一的是 [ ] (1)D 点,C 点 (2) G 点,C 点 (3) E 点,F 点 (4) G 点,F 点5. 等温等压下将一定质量的水,由一个大水球分散为许多小水滴时,以下的物理量中保持不变的有 [ ] (1)表面Gibbs 函数 (2)表面张力 (3) 液面上的附加压力 (4) 饱和蒸气压6. 在一支干净的水平放置的玻璃毛细管中部注入一滴纯水,形成一自由移动的液柱,然后用微量注射管向液柱左侧注入少量KCl 水溶液,设润湿性质不变,则液柱将 [ ] (1)不移动 (2)向右移动 (3) 向左移动 (4) 无法确定 7. 某化学反应的速率方程为:dt dC B =()B A A AC k C k 21221--B C k 2 则该反应的机理为 [ ](1) (2)(3) , (4)8. 反应 CO(g)+2H 2(g)=CH 3OH(g) 在某温度下进行。
当无催化剂存在时,反应的表观活化能为Ea ,标准平衡常数为K ;若加入催化剂后,反应速率加快(表观指前因子不变),此时反应的表观活化能为Ea ‘,标准平衡常数为K ’;则 [ ](1) Ea= Ea ‘,K = K ’ (2) Ea< Ea ‘,K > K ’(3) Ea> Ea ‘,K = K ’ (4) Ea> Ea ‘,K > K ’三、 (15分)1mol 单原子理想气体从300K 、300kPa 的始态,沿TV=常数的途径可逆膨胀到100kPa 的终态,求该过程的W 、Q 、△U 、△H 和△S 。
四、(15)已知CCl 4(l)的蒸气压与温度的关系为lnp/Pa= C KT +-/1.3637,其正常沸点为350K 。
100℃时SnCl 4(l) 的蒸气压p B *=66.66kPa 。
若CCl 4(l)和SnCl 4(l)组成理想液态混合物,在100kPa 压力下,加热该液态混合物至100℃时开始沸腾。
试求:1. 计算CCl 4(l)的摩尔气化热△vap H m *及正常沸点时的摩尔气化熵△vap S m *;2. 绘出此二组分液态混合物在100℃时的蒸气压-组成图(示意图)(绘图时以A 代表CCl 4,以B 代表SnCl 4);3. 计算液态混合物在100kPa 、100℃下的平衡液相组成及沸腾时第一个气泡的组成。
五、(15分)己知电池Pb(s) | PbSO 4(s ) | H 2SO 4(0.01 mol.kg -1) | H 2(g,100kPa) | Pt25℃的电动势为0.1705V 。
有关物质在25℃的标准生成吉布斯函数为:△f G m { H 2SO 4(aq)}=-742.99 kJ.mol -1△f G m { PbSO 4(s)}=-811.24 kJ.mol -1 1. 写出电极反应与电池反应;2. 求25℃时的标准电极电势E {SO 42-| PbSO 4(s) | Pb};3. 求25℃时,H 2SO 4在浓度为0.01 mol.kg -1溶液中的±a 和±γ。
六、(18分)1. 在一恒容反应器中,进行某反应,其机理如下:(1) 实验测得50℃时,产物B 与D 的物质的量浓度之比DBC C =2,且比例不随时间变化。
当反应进行10min 时,A 的转化率为50%,求速率常数k 1和k 2。
(2) 若温度为60℃时,实验测得DBC C 恒为3,试求活化能E a,1与E a,2之差。
2. 某反应A 2+B 2→2AB 己知反应机理如下:(快速平衡)(1) 证明该反应的速率方程式为:dtdC AB=22B A a C C k (2)若A 2及B 2的初始浓度皆为0.01mol.dm -3,且在某反应温度下表观速率常数k a =1.60min -1.mol -1.dm 3,求半衰期。
七、(12分)已知下列两反应:反应1:FeO(s)+CO(g)=Fe(s)+CO 2(g) 反应2:Fe 3O 4(s)+CO(g)=3FeO(s)+CO 2(g)的标准平衡常数分别为K 1、 K 2,它们与温度的关系如下:1 2设两反应的△r C p,m 均为零。
试求:1. 反应1和反应2的标准摩尔反应焓△r H m,1及△r H m,2;2. 在什么温度下,Fe(s)、FeO(s)、Fe 3O 4(s)、CO(g)、CO 2(g)全可共存于平衡系统中;3. 上述两反应达平衡后,若温度再上升时,系统中哪些物质可能消失?北京化工大学2000参考答案一、填空题(16分)1. > < = >。
2. △G=–604J.mol -1, K =1.166, W=-1966J3. Ag| AgI(s)| I -(-I a ) | Cl -(-Cl a ) | AgCl(s)|Ag4. C=1, f=0, (f=C-P=(3-1-1)-1=0); K 不变, 向右。
5. θ<900,能6. 配分函数值为3.936,分子数之比为1:3:5 (q=g 1+g 2kTe2ε-+g 3kTe3ε-=1×kTe0-+3200100-e+5200300-e;kTieε-→1时)7. 用量热法,如燃烧热的测定,原理略。
二、选择题(9分)1. (4)2. (1)(3)3. (1)4. (2)5. (2)6. (3)7. (1)8. (3)三、(15分) 解:TV=T pRT =p T2R=C 222p T =121p T T 2=T 112p p =173.2K△U=nC v,m △T=1×1.5R ×(173.2-300)=-1581 J△H=5/3×△U=-2635 J △S=nC p,m ln12T T +nRln 21p p =1×2.5×8.314ln 3002.173+1×8.314ln 100300=-2.475J.K -1 p=p 1212T TdV=d ⎪⎪⎭⎫ ⎝⎛T V T 11=-211T V T dT w=-⎰pdV =⎰2121TT p 211TV T dT=⎰RdT =R △T=8.314×(173.2-300)=-1054 JQ=△U -W=-527 J四、(15分)1. CCl 4(l)的 △vap H m *=R ×3637.1=30.239 kJ.mol -1△vap S m *(T b )= △vap H m */T b =30239/350=86.4 J.K -1.mol -12. CCl 4(l)的蒸气压:在T 1=350K 时,p 1=101325Pa 代入ln(p/Pa)= C KT +-/1.3637求出C=21.918在T 1=373K 时 p A *=192.348kPa3. 将100℃时的p 、p A *、p B *代入下式: p=p A *x A +p B *(1-x A )得液相组成:x A =0.265 x B =1-x A =0.735气泡的组成:y A =p p A =pxp A A *=100265.035.192⨯=0.510 y B =0.490五、(18分)1. 电极反应:阳极 Pb(s)+ SO 42-→PbSO 4(s ) +2e 阴极 2H ++2e →H 2(g,100kPa)电池反应 Pb(s)+ H 2SO 4(0.01 mol.kg -1)→PbSO 4(s )+ H 2(g,100kPa) 2. △r G m =△f G m { PbSO 4(s)}-△f G m { H 2SO 4(aq)}= -811.24+742.99=-68.25 kJ.mol -1△r G m=-ZFE 电池电动势: E =ZFG m r θ∆-=96485268250⨯=0.3537V因 E = E {H +|H 2}-E {SO 42-| PbSO 4(s) | Pb}E {SO 42-| PbSO 4(s) | Pb}=-E =-0.3537V 3. 能斯特方程:E= E --+a a ZF RT 21ln =E +3ln 2±a F RT ±a ln =()θE E RT F-32=()3537.01705.0298314.83964852-⨯⨯⨯=-4.756 ±a =0.00860±b =()312-+b b =()b 314=()314×0.01=0.01587 mol.kg -1±γ=±±b b a θ=01587.000860.0=0.5419六、(18分) 1. 平行反应(1)50℃(323K)21k k =2 (k 1+k 2)= x t -11ln 1=5.011ln 101-=0.0693由k 1、k 2的比及和可解得:k 1=0.0231 min -1 k 2=0.0462 min -1 (2) 60℃(333K)有:333,2333,1k k =3 ①50℃(323K)有: 323,2323,1k k =2 ②式①÷②得333,2333,1k k 323,1323,2k k =1.5 ③ 两边取对数并引阿仑尼乌斯方程:ln12k k =⎪⎪⎭⎫ ⎝⎛-2111T T R E a ln1.5=ln323,1333,1k k -ln323,2333,2k k =⎪⎪⎭⎫ ⎝⎛-211,11T T R E a -⎪⎪⎭⎫⎝⎛-212,11T T R E a=⎪⎭⎫⎝⎛--333132312,1,R E E a a解得:E a,1-E a,2=36258 J.mol -12. (1)用平衡态法: 21A C k =21A C k - 2A C =11/2-k C k Adt dC AB =222B A C C k =112-k k k 22B A C C =k a 22B A C C k a =112-k k k (2)21t =0,1A a C k =60.101.01⨯=62.5min七、(12分) 同时平衡反应1:FeO(s)+CO(g)=Fe(s)+CO 2(g) 反应2:Fe 3O 4(s)+CO(g)=3FeO(s)+CO 2(g)1. 引范特霍夫方程: ln θθ12K K =⎪⎪⎭⎫⎝⎛-H ∆2111T T R mr θ代入表中数据得:△r H m,1=87319731678.0871.0ln-R =-17694 J.mol -1 同理 △r Hm,2=30460 J.mol -12. 反应1:K 1=COCO p p 2 反应2:K 2=COCO p p 2要5种物质平衡共存,需K1= K2=K T ①对反应1有:ln 871.0θTK =⎪⎪⎭⎫⎝⎛-H ∆T R m r 187311,θ② 对反应2有:ln 15.1θT K =⎪⎪⎭⎫⎝⎛-H ∆T R m r 187312,θ ③ 消去式②、③中的KT ,解得 T=838K3. 在838K 时K1= K2=KT =0.965 再升温,J p > K1反应1向左移,J p < K2反应2向右移。
