第十三章有机合成基础_有机化学及实验
合集下载
有机合成基础知识

有机合成基础知识嘿,朋友们!今天咱来聊聊有机合成基础知识,这可真是个有趣又神奇的领域啊!你想想看,就好像我们是一群神奇的魔法师,能把各种不同的原子和分子组合在一起,创造出全新的化合物。
这多有意思呀!有机合成就像是搭积木,只不过我们用的不是木头积木,而是那些小小的原子。
我们要知道每个原子的脾气和特点,知道它们喜欢和谁在一起,不喜欢和谁在一起。
比如说碳原子,那可是有机世界的大明星,它特别喜欢和其他原子手牵手,组成各种各样的结构。
再说说反应条件吧,这就像是给我们的魔法施加合适的咒语。
温度啦、压力啦、催化剂啦,这些都能决定我们的魔法能不能成功。
有时候就差那么一点点条件不对,整个实验就可能失败。
这是不是跟我们做饭有点像?火候掌握不好,菜的味道就不一样啦。
还有那些反应类型,加成反应、取代反应、消除反应等等,每一种都有它独特的魅力。
加成反应就像是给分子加上一些新的装饰,让它变得更漂亮;取代反应呢,则像是给分子换一身新衣服,让它有了新的模样。
在有机合成的世界里,我们要时刻保持警惕,因为稍有不慎就可能出岔子。
就像走在一条小路上,得小心翼翼地避开那些陷阱和绊脚石。
但别害怕失败呀,失败是成功之母嘛!每次失败都是一次学习的机会,让我们能变得更厉害。
有机合成可不只是在实验室里玩玩哦,它和我们的生活息息相关呢!我们吃的药、用的化妆品、穿的衣服,很多都是通过有机合成得来的。
没有有机合成,我们的生活可就没那么丰富多彩啦!你说,有机合成是不是超级神奇?它就像一个充满奥秘的宝藏,等着我们去探索和发现。
让我们一起在这个神奇的世界里尽情遨游吧,说不定哪天我们也能创造出一个伟大的化合物呢!总之,有机合成基础知识是打开有机世界大门的钥匙,掌握了它,我们就能在有机的海洋里畅游啦!原创不易,请尊重原创,谢谢!。
2020版高三化学大一轮复习__第十三章 有机化学基础_选修_ _课时作业 (2)

解析:有机物的合成,常采用逆推法,要生成 1,2-丙二醇, 则需要通过 1,2-二氯丙烷的水解反应,要生成 1,2-二氯丙烷,则 需要利用丙烯和氯气的加成反应,而丙烯的生成,可利用 2-氯丙 烷的消去反应,所以依次经过的反应类型为消去反应―→加成反 应―→取代反应。
7.(2019·山东滕州一中月考)下列关于甲、乙、丙、丁四种有机
解析:分析 C 与 G 反应产物的结构简式,结合流程可得, D(C2H2)为乙炔,与 Br2 加成生成 E(C2H2Br2),E 的结构简式为
;根据已知②可知,E 与 HCN 发生取代反应生成 F,F
)、
b
的说法正确的是( C )
A.a、b、c 的分子式均为 C8H8
B.a、b、c 均能与溴水发生反应
C.a、b、c 中只有 a 的所有原子会处于同一平面
D.a、b、c 的一氯代物中,b 有 1 种,a为 C8H8,c 的分子式为 C8H10,A 项 错误;a、c 分子中均含有碳碳双键,能与溴水发生加成反应,b 中不含不饱和键,不能与溴水发生反应,B 项错误;b、c 中均含 有饱和碳原子,所有原子不能处于同一平面,C 项正确;c 的一 氯代物有 7 种,D 项错误。
解析:Q 中两个甲基上有 6 个等效氢原子,苯环上有 2 个等 效氢原子,峰面积之比应为 3∶1,A 项错误;Q 中苯环上的卤 素原子无法发生消去反应,P 中与卤素原子相连的碳原子的邻位 碳原子上缺少氢原子,无法发生消去反应,B 项错误;在适当条 件下,卤素原子均可被 OH 取代,C 项正确;Q 中苯环上的氢原 子、甲基上的氢原子均可被氯原子取代,其一氯代物有 2 种,D 项错误。
物说法正确的是( B )
A.四种物质中分别加入氯水,均有红棕色液体生成 B.四种物质中加入 NaOH 溶液共热,然后加入稀硝酸至溶液 呈酸性,再滴入 AgNO3 溶液,均有沉淀生成 C.四种物质中加入 NaOH 的醇溶液共热,然后加入稀硝酸至 溶液呈酸性,再滴入 AgNO3 溶液,均有沉淀生成 D.乙发生消去反应得到两种烯烃
大学有机化学第十三章羧酸

CH3-C CH-COOH CH3
4
3
2
1
3-甲基-2-丁烯酸
取代酸
CH
CHCOOH
3-苯基丙烯酸(肉桂酸) ( -苯基丙烯酸)
◆ 羧酸的物理性质
O R C
=
O
H O
H H H
R C
=
O
H O O
O H
O H
=
C R
羧酸是极性分子,能与水形成氢键,故低级一元酸可 与水互溶,但随M↑,在水中的溶解度↓,从正戊酸开始 在水中的溶解度只有3.7 %,>C10的羧酸不溶于水。
O CH3C OH + NH3
CH3COOH + NH3
O
CH3C O.NH4 200℃CH C NH 3 2
CH3COONH4 Δ CH3CONH2 + H2O
-+
O
二元酸的二铵盐受热则发生分子内脱水兼脱氨,
生成五元或六元环状酰亚胺。
C H2C O O NH 4 C H2C O O NH 4
O
300℃
回流
ClCH2COOH
Cl2 , P
一氯乙酸
Cl2CHCOOH
回流
Cl2 , P Cl3CCOOH
二氯乙酸
回流
三氯乙酸
α-卤代酸是一种重要的取代酸,它可以发生与卤代烃相 似的亲核取代或消去反应,从而转变成其它的取代酸。
如:
CH3COOH Br2 ,P BrCH2COOH NaCN NCCH2COOH α-氰基乙酸
b.p: 羧酸 > M 相同的醇。
IR谱:
OH伸缩振动—
二聚体:2500~3300cm-1(宽而散);
单体: 3550cm-1(气态或非极性溶剂的稀溶液)。 C=O伸缩振动——脂肪族羧酸:1700~1725cm-1 芳香族羧酸:1680~1700cm-1
《有机化学》第13章 杂环化合物和生物碱

4-甲基嘧啶
4-甲基噻唑
⑶ 连有取代基的杂环化合物命名时,也可将杂环作为取代基,以侧链为母体来命名。
4-嘧啶磺酸
β-吲哚乙酸(3-吲哚乙酸)
2-苯并咪唑甲酸乙酯
⑷ 为区别杂环化合物的互变异构体,需标明杂环上与杂原子相连的氢原子所在的位 置,并在名称前面加上标位的阿拉伯数字和大写H的斜体字。
2023/6/13
⑴ 卤代反应
在室温条件下,吡咯、呋喃和噻吩能与氯或溴发生激烈反应,得到多卤代物。将反应 物用溶剂稀释并在低温下进行反应时,可以得到一氯代物或一溴代物。碘化反应需要 在催化剂存在下进行。例如:
2023/6/13
6
(2)硝化反应
在低温条件下,吡咯、呋喃和噻吩能与比较缓和的硝化剂硝酸乙酰酯(CH3COONO2) 发生硝化反应,主要生成α-硝基化合物。例如:
3. 颜色反应
生物碱能与一些试剂发生颜色反应,比如钒酸铵的浓硫酸溶液、浓硝酸、浓硫酸、 甲醛、氨水等,利用此性质可鉴别生物碱。比如莨菪碱遇1%钒酸铵的浓硫酸溶液显 红色,可待因遇甲醛-浓硫酸试剂显紫红色等。
二、重要的生物碱 1. 烟碱 又叫尼古丁,主要以苹果酸盐及柠檬酸盐的形式存在于烟草中。其结构式
2023/6/13
13
血红素是卟啉环与Fe2+形成的配合物;叶绿素是卟啉环与Mg2+形成的配合物,它们的 结构式如下:
血红素在体内与蛋白质结合形成血红蛋白,存在于红细胞中,是人和其他哺乳动物 体内运输氧气的物质。叶绿素是植物进行光合作用不可缺少的物质。
2023/6/13
14
二、呋喃衍生物
呋喃甲醛是最常见的呋喃衍生物,又称为糠醛,它是一种无色液体,沸点为161.7℃, 在空气中易氧化变黑,是一种良好的溶剂。 糠醛是合成药物的重要原料,通过硝化可制得一系列呋喃类抗菌药物,如治疗泌尿 系统感染的药物呋喃坦丁、治疗血吸虫病的药物呋喃丙胺等。
第十三章第四讲 生命中的基础有机化学物质合成有机高分子化合物

考点突破 实验探究 高考演练 课时训练
考点一 糖类
油脂
蛋白质
②蛋白质的性质
水解:在_____________的作用下最终水解生成_________。 两性:蛋白质分子中含有未缩合的—NH2和—COOH,因此具有 两性。 盐析: 向蛋白质溶液中加入某些浓的无机盐(如______________________等)溶
考点突破 实验探究 高考演练 课时训练
考点一 糖类
油脂
蛋白质
②葡萄糖的化学性质:
新制Cu(OH)2 还原性—能发生银镜反应,能与______________ 悬浊液反应
| 加成反应—与H2发生加成反应生成己六醇 | 发酵成醇—C6H12O6(葡萄糖) → 2C2H5OH+2CO2 | 生理氧化—C6H12O6(葡萄糖)+6O2→6CO2+6H2O
第十三章 有机化学基础
第四讲 生命中的基础有机化学物质 合成有机高分子化合物
考点突破 实验探究 高考演练 课时训练
考点一 糖类
油脂
蛋白质
1.油脂 (1)油脂的组成
油脂是油和脂肪的统称,都是高级脂肪酸和甘油形成的酯,属于
C、H、O 三种元素。 酯类化合物,含____________
(2)结构特点 结构通式:
与NaOH溶液反应的化学方程式:
______________________________________________________
考点突破 实验探究 高考演练 课时训练
考点一 糖类
油脂
蛋白质
b.成肽反应
氨基 氨基酸在酸或碱存在的条件下加热,通过一分子的_____ 与另一分子
羧基 间脱去一分子水,缩合形成含肽键的化合物叫做成肽反 的________
有机化学:第十三章羧酸及其衍生物

2. 酸酐的生成
用P2O5作脱水剂制备酸酐
O CH3 C OH O O P2O5 CH3 C O O C CH3
+
HO
C CH3
+
H2O
用低沸点酸酐作脱水剂制备较高沸点的酸酐
O 2 COOH + (CH3CO)2O
(
C
) 2O + 2 CH COOH
3
能形成五元、六元环酸酐的二元羧酸可直接加热制备酸酐
羧酸与PX3 、PCl5(X=Cl、Br)、SOCl2反应
3CH3COOH + PCl3
3 CH3 COCl + H3PO3
COOH+PCl5
(CH3)2CHCH2COOH + SOCl 2
COCl + POCl3+ HCl
(CH3)2CHCH2COCl
+
SO2
+ HCl
注:HX不能与羧酸反应生成酰卤 。 应用:酰卤的反应活性比较高,广泛应于药物合成中 。
( 2)编号:从羧基碳原子开始用阿拉伯数字编号,按所含碳原
子数目称为某酸,取代基名称及位次写在某酸之前。
( 3)简单的酸酸,常用希腊字母表明取代基的位置,从羧基相 邻碳原子开始编号为 ,依次为 、 、 等,将编号写在取代基 名称前面。
CH3CH2CHCH2COOH CH3
-甲基戊酸(3-甲基戊酸)
第十三章
羧酸及其衍生物 主要内容
1、掌握羧酸和取代羧酸的结构、命名和化学性质 2、掌握羧酸衍生物的结构、分类及命名和化学性质
3、熟悉羧酸和取代羧酸的物理性质
4、掌握羟基酸、酮酸的命名及主要化学性质。
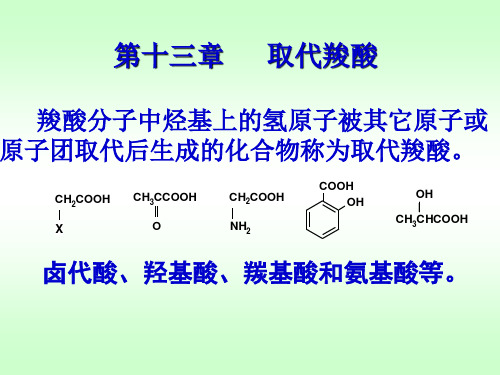
羧酸:
有机化学第十三章 取代羧酸
C HO 浓NaOH CH2OH COOH ’ COOH C anniz z aro 反 应 COOH + COOH
三
丙酮酸: 最简单的α -酮酸
CH3
O C COOH
CH3 CH3
O 浓 H2SO4 CO + CH3 COOH(脱羰) C COOH O 稀 H2SO4 CO + CH CHO (脱羧) 2 3 C COOH
OH O C6H5C=CHCCH 3 90.0%
2 乙酰乙酸乙酯的分解反应 稀OH-
O O CH3C-CH 2-COC 2H5
浓OH-
O CH3CCH3
酮式分解
O CH3C-OH + 其余 酸式分解
3 α-H的活性:被取代
O O CH3C-CH2-COC 2H5
RONa
O Na+ O CH3C-CH--COC 2H5
稀 OH -
CH3COCHC 2H5 CH3
1. 合成甲基酮 经乙酰乙酸乙酯合成:
引入基团
引入基团
CH3 CH3CO CHCH 2CH 3
CH3CO CH 2CH 3
分析:(1) 产物为甲基酮,合成时一定要经过酮式分解。 (2) 将TM的结构与丙酮进行比较,确定引入基团。 (3) 最后确定合成路线。
O C COOH
CO2
RCHO O
CO2
R
C
CH 3
四 醇酸的制备 1 α-羟基酸 羟基腈水解( “醛的化学性质”)
O R-C-R(H) + HCN
2 β-羟基酸(酯)
OH R-C-R(H) CN
H3O
+
OH α R-C-R(H) COOH
有机合成课件

2、逆向合成分析法(逆推法)
目标化合物
中间体
中间体
基础原料
三、有机合成遵循的原则
1)起始原料要廉价、易得、低毒、低污染 2)尽量选择步骤最少的合成路线——保证较高的产率。 3)满足“绿色化学”的要求。 4)操作简单、条件温和、能耗低、易实现 5)尊重客观事实,按一定顺序反应。
原料 顺 中间产物 顺 产品
①卤代烃碱性水解、②烯烃水化、
③醛类加氢(还原)、④酯的水解
加深练习:
只用乙醇一种有机物(无机物可以任选),
合成: COOCH2
COOCH2
请同学们说出其过程
CH3CH2OH
HOOC HOOC
CH2 CH2
O HC HC
O
②
COOCH2 COOCH2
Cl Cl CH2CH2
①
HOCH2 HOCH2
逆
逆
【学以致用——解决问题 二】
O
O
C— OC2H5 C— OC2H5
O
C— OH
4
C— OH
O +CH3CH2OH
CH2
2
CH2
3 1
H2C— OH H2C— OH
H2C— Cl H2C— Cl
产率计算——多步反应一次计算
CH3 H2C= C—COOH
93.0% A 81.7% B
CH3 HSCH2CHCO N
1-丙醇 ①
丙烯 ② A
③
议
甘油 ④ 1,2,3-三氯丙烷
(提示:CH2=CHCH3+Cl2 500℃ CH2=CHCH2Cl+HCl )
请你写出反应①③④各步的化学方程式及反应类型。
展
评
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2)H2SO4
NH2 霍夫曼彻底甲基化 Br2
Br
Br
NMe2 Me2NH -HBr
NMe OH
NMe O 颠茄酮
鲁宾逊的工作(1915年) CH2CHO + CH2CHO NH2CH3 + CH2COOH C O CH2COOH pH = 5
NMe O
1
颠茄酮
13 有机合成基础
魏尔泰思德的工作(1911年) O NMe 假石榴碱 NMe2 1)MeI 2)Ag2O 3) Br2 Br 1)Me2NH 2)MeI 3)Ag2O 4) H2 NMe OH -H2O NMe 1)MeI 2)Ag2O
+
CHCH 2CH2Br CH3
合成:
Br CH3CHCH 3
1) Mg,Et2O 2)
O
CH3
CHCH 2CH2OH CH3 CH3
PBr3
CH3
1) Mg,Et2O 2)CH3CO2Et
CH3
CHCH 2CH2CCH 2CH2CHCH 3 CH3 OH CH3
6
13.1 逆向合成分析
13.1.1切断的选择方法
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
1、考察取代基间的相互关系,寻找能实现正确定位的途径。 例如:
O a b b Br O Cl
O + a
Br
b法切断是错误: 异丙基是邻对位定位基, 乙酰基是间位定位基,异 丙基与乙酰基处于对位。
+ Cl
O
合成
+ Br CH3CHCH 3 AlCl3
H2N OH CO2H O2N OH CO2H OH H2N CO2H O2N O2N H2N OH CO2H OH CO2H OH CO2H
O
1) CH3CCH3 2) H2O
OH CH3CCH2CH2CH2CH3 CH3
一个环和一条链之间的连接处常常是个支化点,通常是切断处。例如:
O O
+
BrMg
O
合成:
CH3CH CH2 1) NBS 2) Mg BrMgCH2CH CH2
O 1) 2) H2O , CuI CH2CH CH2
5
13.1 逆向合成分析
CH(CH 3)2 CH3COCl AlCl3
CH(CH 3)2
COCH3
8
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
2、在定位规则许可下,最先切断最具吸电子性基团(即这个基团最后引入)。
例如:
O2N
NO2 OCH3 OCH3 + OCH3 Cl
合成:
CH3 (CH3)2SO4 OH CH3 (CH3)3CCl OCH3 AlCl3 CH3 HNO3 OCH3 C(CH3)3 O2N CH3 NO2 OCH3 C(CH3)3
13 有机合成基础
有机合成的目的:证明分子结构;为工业提供具有各种性能的分子;为理论工作提 供具有各种特殊性能的分子。
魏尔泰思德的工作(1901年) O 1) 肟 2) 还原 霍夫曼彻底甲基化 Br2 Br Br 喹啉 HBr NMe2 Me2NH 1) H2 2) Br 3) + NMe2 BrBr 1) KOH 2) NMe 1) HBr
CH3
NO2
合成:
CH3 KMnO4,H
CO2H HNO3 H2SO4
CO2H
NO2
10
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
4、许多基团,特别是一般方法难导入的基团(如-CN,-F,-I等)可通过重氮盐导入。
CO2H CN Cl FGI NH2 Cl NH2 NO2
例如:
Cl FGI
13.1.1 切断的选择方法
3、利用目标分子的对称性进行切断,使之切断为简单易得的原料。
对称炔烃:
合成: 对称醇:
OH
Br
HC CH NaNH 2 NaC CNa CH3CH2CH2CH2Br
+ NaC CNa
CH3CH2CH2CH2C CCH 2CH2CH2CH3
CH3CO2Et +
MgBr
O OH MgBr
O CH3CH CH2 H2O CH2 NBS Mg BrCH2CH CH2 BrMgCH2CH CH2 CH2 CHCCH 3 CuI
O CHCH 2CH2CH2C CH3
4
13.1 逆向合成分析
13.1.1 切断的选择方法
2、在支化点处进行切断。
OH O
+
BrMg
合成:
CH3CH2CH2CH2Br Mg CH3CH2CH2CH2MgBr
+NMe 2 OH
Br
瑞普的工作(1948年) Ni(CN) 2 4 HC CH 50℃,15atm
2应;合成设计和策略。
13.1 逆向合成分析 (Retrosynthetic Analysis)
TM 目标分子
特定目标分子(Target Molecule)的合成设计过程: 第一步:对整个分子的结构特征和已知的理化 性质进行收集、考察; 第二步:逆向合成(Retrosynthesis);
合成:
HNO3
NO2
NHCOCH 3
NH2 Cl
1) Fe,HCl 2) (CH3CO)2O
1) Cl2 2)H3O
CN Cl
CO2H Cl
1) NaNO2,HCl 2)KCN,CuCN
H3O
11
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
5、在芳环上引入 -NO2(或-NH2),在定位作用下或占据某一位置后,导入其它基团, 然后通过重氮盐可将-NO2(或-NH2)除去。 例如:
9
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
3、官能团转化可能会改变基团的定位效应。
CO2H CH3 FGI CH3
例如:
合成:
Cl CH3
Cl2 FeCl3
Cl CH3
KMnO4,H
CO2H
Cl
CO2H CO2H
Cl
间硝基苯甲酸中-NO2 与 -CO2H为间位关系,故甲苯先氧化,后硝化。
环状对称醚可切断为对称二醇,对称二醇可切断为对称酯。
例如:
Ph Ph O
Ph Ph
Ph Ph OHHO
Ph Ph
EtO2C
CO2Et + PhMgBr
合成:
Br2 FeBr3
Br
Mg
MgBr
1) EtO2CCH2CH2CO2Et 2) H2O
Ph Ph OHHO
Ph Ph
H
Ph Ph O
Ph Ph
7
D E F G H I J 原料 A B C 合成子
第三步:选择最好的路线进行合成,增加试剂和反 应条件。
3
13.1 逆向合成分析
13.1.1 切断的选择方法
1、 在接近分子的中央处进行切断,使其断裂成合理的两部分 将分子切断成简单易得的原料,可采用下列两种方法:
O O
+
O 试 剂 为 试 剂 为 BrMg
NH2 霍夫曼彻底甲基化 Br2
Br
Br
NMe2 Me2NH -HBr
NMe OH
NMe O 颠茄酮
鲁宾逊的工作(1915年) CH2CHO + CH2CHO NH2CH3 + CH2COOH C O CH2COOH pH = 5
NMe O
1
颠茄酮
13 有机合成基础
魏尔泰思德的工作(1911年) O NMe 假石榴碱 NMe2 1)MeI 2)Ag2O 3) Br2 Br 1)Me2NH 2)MeI 3)Ag2O 4) H2 NMe OH -H2O NMe 1)MeI 2)Ag2O
+
CHCH 2CH2Br CH3
合成:
Br CH3CHCH 3
1) Mg,Et2O 2)
O
CH3
CHCH 2CH2OH CH3 CH3
PBr3
CH3
1) Mg,Et2O 2)CH3CO2Et
CH3
CHCH 2CH2CCH 2CH2CHCH 3 CH3 OH CH3
6
13.1 逆向合成分析
13.1.1切断的选择方法
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
1、考察取代基间的相互关系,寻找能实现正确定位的途径。 例如:
O a b b Br O Cl
O + a
Br
b法切断是错误: 异丙基是邻对位定位基, 乙酰基是间位定位基,异 丙基与乙酰基处于对位。
+ Cl
O
合成
+ Br CH3CHCH 3 AlCl3
H2N OH CO2H O2N OH CO2H OH H2N CO2H O2N O2N H2N OH CO2H OH CO2H OH CO2H
O
1) CH3CCH3 2) H2O
OH CH3CCH2CH2CH2CH3 CH3
一个环和一条链之间的连接处常常是个支化点,通常是切断处。例如:
O O
+
BrMg
O
合成:
CH3CH CH2 1) NBS 2) Mg BrMgCH2CH CH2
O 1) 2) H2O , CuI CH2CH CH2
5
13.1 逆向合成分析
CH(CH 3)2 CH3COCl AlCl3
CH(CH 3)2
COCH3
8
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
2、在定位规则许可下,最先切断最具吸电子性基团(即这个基团最后引入)。
例如:
O2N
NO2 OCH3 OCH3 + OCH3 Cl
合成:
CH3 (CH3)2SO4 OH CH3 (CH3)3CCl OCH3 AlCl3 CH3 HNO3 OCH3 C(CH3)3 O2N CH3 NO2 OCH3 C(CH3)3
13 有机合成基础
有机合成的目的:证明分子结构;为工业提供具有各种性能的分子;为理论工作提 供具有各种特殊性能的分子。
魏尔泰思德的工作(1901年) O 1) 肟 2) 还原 霍夫曼彻底甲基化 Br2 Br Br 喹啉 HBr NMe2 Me2NH 1) H2 2) Br 3) + NMe2 BrBr 1) KOH 2) NMe 1) HBr
CH3
NO2
合成:
CH3 KMnO4,H
CO2H HNO3 H2SO4
CO2H
NO2
10
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
4、许多基团,特别是一般方法难导入的基团(如-CN,-F,-I等)可通过重氮盐导入。
CO2H CN Cl FGI NH2 Cl NH2 NO2
例如:
Cl FGI
13.1.1 切断的选择方法
3、利用目标分子的对称性进行切断,使之切断为简单易得的原料。
对称炔烃:
合成: 对称醇:
OH
Br
HC CH NaNH 2 NaC CNa CH3CH2CH2CH2Br
+ NaC CNa
CH3CH2CH2CH2C CCH 2CH2CH2CH3
CH3CO2Et +
MgBr
O OH MgBr
O CH3CH CH2 H2O CH2 NBS Mg BrCH2CH CH2 BrMgCH2CH CH2 CH2 CHCCH 3 CuI
O CHCH 2CH2CH2C CH3
4
13.1 逆向合成分析
13.1.1 切断的选择方法
2、在支化点处进行切断。
OH O
+
BrMg
合成:
CH3CH2CH2CH2Br Mg CH3CH2CH2CH2MgBr
+NMe 2 OH
Br
瑞普的工作(1948年) Ni(CN) 2 4 HC CH 50℃,15atm
2应;合成设计和策略。
13.1 逆向合成分析 (Retrosynthetic Analysis)
TM 目标分子
特定目标分子(Target Molecule)的合成设计过程: 第一步:对整个分子的结构特征和已知的理化 性质进行收集、考察; 第二步:逆向合成(Retrosynthesis);
合成:
HNO3
NO2
NHCOCH 3
NH2 Cl
1) Fe,HCl 2) (CH3CO)2O
1) Cl2 2)H3O
CN Cl
CO2H Cl
1) NaNO2,HCl 2)KCN,CuCN
H3O
11
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
5、在芳环上引入 -NO2(或-NH2),在定位作用下或占据某一位置后,导入其它基团, 然后通过重氮盐可将-NO2(或-NH2)除去。 例如:
9
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
3、官能团转化可能会改变基团的定位效应。
CO2H CH3 FGI CH3
例如:
合成:
Cl CH3
Cl2 FeCl3
Cl CH3
KMnO4,H
CO2H
Cl
CO2H CO2H
Cl
间硝基苯甲酸中-NO2 与 -CO2H为间位关系,故甲苯先氧化,后硝化。
环状对称醚可切断为对称二醇,对称二醇可切断为对称酯。
例如:
Ph Ph O
Ph Ph
Ph Ph OHHO
Ph Ph
EtO2C
CO2Et + PhMgBr
合成:
Br2 FeBr3
Br
Mg
MgBr
1) EtO2CCH2CH2CO2Et 2) H2O
Ph Ph OHHO
Ph Ph
H
Ph Ph O
Ph Ph
7
D E F G H I J 原料 A B C 合成子
第三步:选择最好的路线进行合成,增加试剂和反 应条件。
3
13.1 逆向合成分析
13.1.1 切断的选择方法
1、 在接近分子的中央处进行切断,使其断裂成合理的两部分 将分子切断成简单易得的原料,可采用下列两种方法:
O O
+
O 试 剂 为 试 剂 为 BrMg
