TAKARA双酶切表
双酶切体系

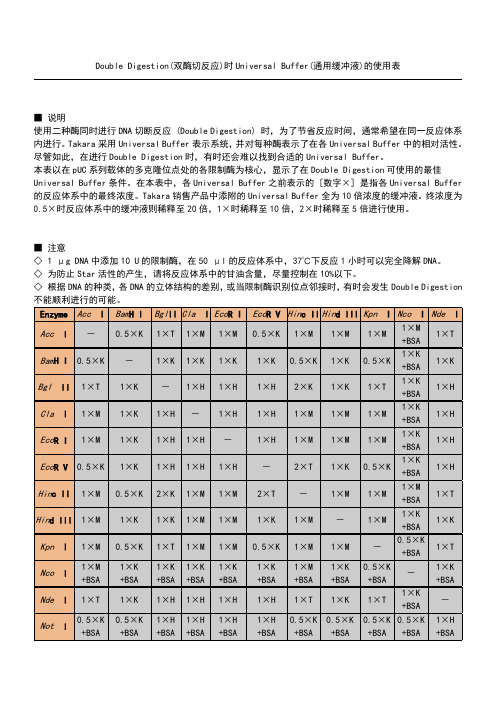
Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表之迟辟智美创作
■说明
使用二种酶同时进行DNA切断反应(Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行.TaKaRa采纳Universal Buffer暗示系统,并对每种酶暗示了在各Universal Buffer中的相对活性.尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer.本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件.在本表中,各Universal Buffer之前暗示的[数字×] 是指各Universal Buffer的反应体系中的最终浓度.TaKaRa销售产物中添附的Universal Buffer全为10倍浓度的缓冲液.终浓度为0.5×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用.
■注意
◇ 1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完全降解DNA.◇为防止Star 活性的发生,请将反应体系中的甘油含量,尽量控制在10%以下.◇根据DNA的种类,各DNA的立体结构的分歧,或当限制酶识别位点邻接时,有时会发生Double Digestion不能顺利进行的可能.。
双酶切体系梳理

Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表■ 说明使用二种酶同时进行DNA切断反应(Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行。
TaKaRa采用Universal Buffer表示系统,并对每种酶表示了在各Universal Buffer中的相对活性。
尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer。
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。
在本表中,各Universal Buffer 之前表示的[数字×] 是指各Universal Buffer的反应体系中的最终浓度。
TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。
终浓度为0.5×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用。
■ 注意◇1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完全降解DNA。
◇为防止Star活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。
◇根据DNA的种类,各DNA的立体结构的差别,或当限制酶识别位点邻接时,有时会发生Double Digestion不能顺利进行的可能。
(精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏)。
DNA限制性内切酶——双酶切反应时通用缓冲液及选用

DNA限制性内切酶——双酶切反应时通用缓冲液的选用
■当酶切位点确定后,最好购买同一家公司生产同一类型的内切酶(若酶切Buffer相同,这样有时候可以省去后期去需找酶切反应通用缓冲液)
■说明
使用两种酶同时进行DNA切断反应(Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行。
TaKaRa采用Universal Buffer表示系统,并对每种酶表示了在各Universal Buffer中的相对活性。
尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer。
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。
在本表中,各Universal Buffer之前表示的[数字×] 是指各Universal Buffer的反应体系中的最终浓度。
TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。
终浓度为0.5×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用。
■注意
◇ 1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完全降解DNA。
◇为防止Star活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。
◇根据DNA的种类,各DNA的立体结构的差别,或当限制酶识别位点邻接时,有时会发生Double Digestion不能顺利进行的可能。
双酶切体系

Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表
■说明
使用二种酶同时进行DNA切断反应(Double Digestion)时,为了节省反应时间,通常希望在同一反应体系内进行。
TaKaRa采用Universal Buffer表示系统, 并对每种酶表示了在各Universal Buffer中的相对活性。
尽管如此,在进行Double Digestion 时,有时还会难以找到合适的Universal Buffer。
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。
在本表中,各Universal Buffer 之前表示的[数字刃是指各Universal Buffer的反应体系中的最终浓度。
TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。
终浓度为0.5 x
时反应体系中的缓冲液则稀释至20倍,1X时稀释至10倍,2X时稀释至5倍进行使用。
■注意
◊1 (i g DNA中添加10 U的限制酶,在50 口的反应体系中,37 C下反应1小时可以完全降解DNA。
◊为防止Star活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。
◊根据DNA的种类,各DNA的立体结构的差别,或当限制酶识别位点邻接时,有时会发生
Double Digestion不能顺利进行的可。
双酶切体系

Double Digestion(双酶切反响)时Universal Buffer(通用缓冲液)的使用表之樊仲川亿创作
时间:二O二一年七月二十九日
■说明
使用二种酶同时进行DNA切断反响(Double Digestion) 时,为了节省反响时间,通常希望在同一反响体系内进
行.TaKaRa采取Universal Buffer暗示系统,并对每种酶暗示了在各Universal Buffer中的相对活性.尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer.本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件.在本表中,各Universal Buffer之前暗示的[数字×] 是指各Universal Buffer的反响体系中的最终浓度.TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液.终浓度为0.5×时反响体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用.
■注意
◇ 1 μg DNA中添加10 U的限制酶,在50 μl的反响体系中,37℃下反响1小时可以完全降解DNA.◇为避免Star活性的产生,请将反响体系中的甘油含量,尽量控制在10%以下.◇按照DNA的种类,各DNA的立体结构的不同,或当限制酶识别位点邻接时,有时会产生Double Digestion不克不及顺利进行的可能.
时间:二O二一年七月二十九日。
双酶切鉴定

四、双酶切鉴定㈠双酶切反应(Double Digests)1、同步双酶切同步双酶切是一种省时省力的常用方法。
选择能让两种酶同时作用的最佳缓冲液是非常重要的一步。
NEB每一种酶都随酶提供相应的最佳NEBuffer,以保证100%的酶活性。
NEBuffer的组成及内切酶在不同缓冲液中的活性见《内切酶在不同缓冲液里的活性表》及每支酶的说明书。
能在最大程度上保证两种酶活性的缓冲液即可用于双酶切。
由于内切酶在非最佳缓冲液条件下的切割速率会减缓,因此使用时可根据每种酶在非最优缓冲液中的具体活性相应调整酶量和反应时间。
2、分步酶切如果找不到一种可以同时适合两种酶的缓冲液,就只能采用分步酶切。
分步酶切应从反应要求盐浓度低的酶开始,酶切完毕后再调整盐浓度直至满足第二种酶的要求,然后加入第二种酶完成双酶切反应。
3、使用配有特殊缓冲液的酶进行双酶切(图)使用配有特殊缓冲液的酶进行双酶切也不复杂。
在大多数情况下,采用标准缓冲液的酶也能在这些特殊缓冲液中进行酶切。
这保证了对缓冲液有特殊要求的酶也能良好工作。
由于内切酶在非最佳缓冲液中进行酶切反应时,反应速度会减缓,因此需要增加酶量或延长反应时间。
通过《内切酶在不同缓冲液里的活性表》可查看第二种酶在特殊缓冲液相应盐浓度下的作用活性。
双酶切建议缓冲液注:只要其中一种酶需要添加BSA,则应在双酶切反应体系中加入BSA。
BSA不会影响任何内切酶的活性。
注意将甘油的终浓度控制在10%以下,以避免出现星号活性,详见《星号活性》。
可通过增加反应体系的总体积的方法实现这一要求。
某些内切酶的组合不能采用同步双酶切法,只能采用分步法进行双酶切。
上表中这些组合以“seq”标注。
㈡连接反应1、回收PCR产物:在进行PCR扩增时候,给引物两端设计好酶切位点,一般说来,限制酶的选择非常重要,尽量选择粘端酶切和那些酶切效率高的限制酶,如BamHI,HindIII,提前看好各公司的双切酶所用公用的BUFFER,以及各酶在公用BUFFER里的效率。
DNA重组常见问题TaKaRa的内切酶和NEB的内切酶哪个更好一些

DNA重组常见问题TaKaRa的内切酶和NEB的内切酶哪个更好一些?参考见解:TaKaRa的内切酶、NEB的内切酶两个公司的酶的品质都非常好。
NEB公司的酶的活性很高,切出两条小带可能是因为出现星活性,可以试试把酶量减半。
NEB的酶很多都是克隆的,所以纯度比较高。
应用磁性微球提取人全血基因组DNA,将提取出的DNA直接用于限制性酶切反应,应用Taq1 酶,但发现酶切后产生的是smier片断,即切碎的状态。
不知原因是什么?在做这类实验时,一般是将PCR产物进行酶切,这与实验结果有联系吗?是不是直接提取出的DNA必须要做PCR扩增,才能应用酶切?参考见解:1.为建立基因组文库时一般才用限制性内切酶酶切人基因组DNA.目的是为获得含有人全部DNA的随机片段的总和.然后再用载体和宿主细胞构建克隆.关于文库建立园内资料很多.lyz7031yz战友感兴趣的话可以自己搜索下.2.电泳图,酶切后是一片弥散的带,是因为基因组中存在大量Taq1酶的酶切位点,由于操作属于随机酶切,所以得到的DNA也是随机的,而不是大量均一的.那么电泳后的出现这样的结果也很容易解释.3. 一般在PCR后采用酶切是由于酶切模板数目巨大且均一,在了解了被切DNA上有关限制性内切酶位点的信息后,我们就可以根据自己的目的来选择合适的内切酶进行酶切.做抑制差减杂交,需要回收细菌基因组酶切(Alu1酶)后的全部片段,要求回收后至少是6微升,浓度要有0.3微克\微升,按照抑制差减杂交说明书,采用酚仿抽提和无水乙醇沉淀法,只要酶切2微克基因组就能满足条件,可已经把酶切量扩大到10多微克了,回收还是达不到浓度(大约只有0.06微克\微升),又不敢切胶回收,怕EB对后续反应造成影响。
请教该怎么办?参考见解:回收酶切产物浓度低的原因可能是:苯酚/氯仿抽提时损失太多。
说明书上说苯酚/氯仿/异戊醇和氯仿各抽提两次,这样经过四次抽提DNA损失得非常多,解决办法是将50?l酶切产物加等体积的灭菌去离子水,然后再抽提,损失会减少很多;另外乙醇沉淀时可以延长,低温沉淀会提高得率;还有用80%乙醇洗涤沉淀弃上清时,要轻轻用移液枪吸出,防止将沉淀随上清倒出。
双酶切Buffer说明
Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表
■ 说明
使用二种酶同时进行DNA切断反应 (Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行。
Takara采用Universal Buffer表示系统,并对每种酶表示了在各Universal Buffer中的相对活性。
尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer。
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。
在本表中,各Universal Buffer之前表示的 [数字×] 是指各Universal Buffer 的反应体系中的最终浓度。
Takara销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。
终浓度为0.5×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用。
■ 注意
◇ 1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完全降解DNA。
◇ 为防止Star活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。
◇ 根据DNA的种类,各DNA的立体结构的差别,或当限制酶识别位点邻接时,有时会发生Double Digestion。
