元素周期律熔沸点比较
高中化学必修2 元素周期表 物质性质规律
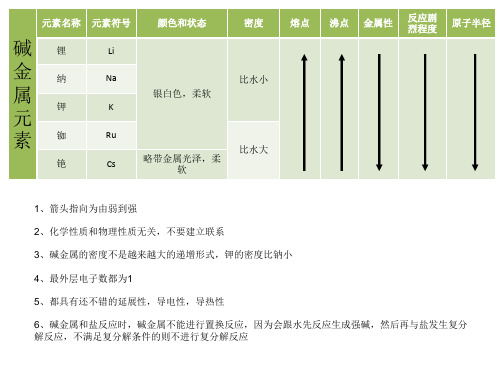
这张元素周期表不是用来查询元素资料的,除非我吃撑了把这个贴在这里。。。它用来研究元素周期律。 元素周期律:箭头指向为金属性(或非金属性)由弱到强的变化。 金属性越强的金属,其对应的碱越强,与水反应得更剧烈,性质更活泼,还原性也越强,其阳离子的 氧化性越弱。 非金属性越强的非金属,其最高价氧化物的水化物的酸性越强,形成的氢卤酸稳定性越强,与氢反应 的更容易,氧化性也越强,其阴离子的还原性越弱。
元素名称元素符号颜色和状态密度熔点沸点金属性反应剧烈程度原子半径li银白色柔软cs略带金属光泽柔1箭头指向为由弱到强2化学性质和物理性质无关不要建立联系3碱金属的密度不是越来越大的递增形式钾的密度比钠小4最外层电子数都为15都具有还不错的延展性导电性导热性6碱金属和盐反应时碱金属不能进行置换反应因为会跟水先反应生成强碱然后再与盐发生复分解反应不满足复分解条件的则不进行复分解反应名称符号单质颜色和状态水溶液颜色四氯化密度熔点沸点溶解度酸性最高价氧化物水化物的酸性化合淡黄绿色气体169cl黄绿色气体浅黄绿3214gl226cbr深红棕色液体黄色或橙色橙红色3119gc紫黑色固体深黄或褐色紫色4930029g箭头指向为由弱到强
226c mᵌ
4.16g
溴
Br
深红棕色, 液体
黄色或 橙色
橙红色
碘
I
紫黑色, 固体
深黄或 弱到强。 1、有机溶剂现在只涉及苯,酒精,四氯化碳。具体需要掌握的区别是,用四氯化碳做萃取剂,分液后水在上 层,四氯化碳在下层,苯则相反,酒精与水互溶不能作为萃取剂。溴在四氯化碳和酒精中颜色都是橙红色, 碘在四氯化碳和酒精中都是紫色。我不写在苯中的颜色啊什么的原因是因为不考,而且我可不敢保证对不对 。。。这句话前半句是个病句童鞋们看出来了没~? 2、形成的氢卤酸为什么氟的最弱呢?这是个问题。。。其实原因很简单,化合物的酸性是依据它在水中氢离 子电解的难易程度,也就是氢离子被电离的多少,碘离子的电子层在这四种元素对应离子里最多,所以碘对 氢离子的吸引力最差,氢离子就爱瞎跑,这一瞎跑,酸性就强了,ok,这个问题我也就解释清楚了。
高中化学物质熔沸点的高低比较

物质熔、沸点高低的规律小结熔点是固体将其物态由固态转变〔熔化〕为液态的温度。
熔点是一种物质的一个物理性质,物质的熔点并不是固定不变的,有两个因素对熔点影响很大,一是压强,平时所说的物质的熔点,通常是指一个大气压时的情况,如果压强变化,熔点也要发生变化;另一个就是物质中的杂质,我们平时所说的物质的熔点,通常是指纯净的物质。
沸点指液体饱和蒸气压与外界压强相同时的温度。
外压力为标准压(1.01×105Pa)时,称正常沸点。
外界压强越低,沸点也越低,因此减压可降低沸点。
沸点时呈气、液平衡状态。
在近年的高考试题及高考模拟题中我们常遇到这样的题目:以下物质按熔沸点由低到高的顺序排列的是,A、二氧化硅,氢氧化钠,萘B、钠、钾、铯C、干冰,氧化镁,磷酸D、C2H6,C(CH3)4,CH3(CH2)3CH3在我们现行的教科书中并没有完整总结物质的熔沸点的文字,在中学阶段的解题过程中,具体比较物质的熔点、沸点的规律主要有如下:1.根据物质在相同条件下的状态不同一般熔、沸点:固>液>气,如:碘单质>汞>CO22. 由周期表看主族单质的熔、沸点同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。
但碳族元素特殊,即C,Si,Ge,Sn越向下,熔点越低,与金属族相似;还有ⅢA族的镓熔点比铟、铊低;ⅣA族的锡熔点比铅低。
3. 同周期中的几个区域的熔点规律①高熔点单质C,Si,B三角形小区域,因其为原子晶体,故熔点高,金刚石和石墨的熔点最高大于3550℃。
金属元素的高熔点区在过渡元素的中部和中下部,其最高熔点为钨〔3410℃〕。
②低熔点单质非金属低熔点单质集中于周期表的右和右上方,另有IA的氢气。
其中稀有气体熔、沸点均为同周期的最低者,如氦的熔点〔-272.2℃,26×105Pa〕、沸点〔268.9℃〕最低。
金属的低熔点区有两处:IA、ⅡB族Zn,Cd,Hg及ⅢA族中Al,Ge,Th;ⅣA族的Sn,Pb;ⅤA族的Sb,Bi,呈三角形分布。
同周期元素单质熔沸点规律的比较

同周期元素单质熔沸点规律的比较在日常工作中,每种元素都有它的固定熔沸点,但有一些元素熔沸点有着一定的规律性,称之为同周期元素单质熔沸点规律。
下面就来讨论一下同周期元素单质熔沸点规律。
首先是同周期一组元素的熔沸点,从原子序数从低到高,并且从第一周期开始分析,可以发现随着原子序数的增加,原子增加一个电子层,它们的熔沸点也会相应的逐渐增大。
这是一种特殊的单质单质元素熔沸点规律。
其次是同周期元素的熔沸温度差异比较。
同组的元素的熔沸温度差异差异较大,比较明显。
比如:碳碳元素的熔沸点是3540K,而氮的是770K,差异差异极大。
最后要讨论的是同周期元素的熔沸点的规律性,一般来说,熔沸点会随原子结构加密程度而增大,但也会随着原子序数的增加而减小。
比如锂单质元素在第一周期,锂原子序数是能量最低的,它的熔沸点是最低的,为1687K,但是当原子序数从第二周期开始时,加餐的电子层会抵消熔沸点的增加,使得熔沸点得以减小。
总而言之,同周期元素单质熔沸点规律可以为我们提供一种简单而又有效的原子结构分析方法,从而更加深入地了解元素科学,为科学研究中各种有关元素的应用提供良好的理论基础。
In daily work, each element has its fixed melting point, but there are some elements, which have certain regularity in their melting point, called the same period element single-substance melting point regularity. Now let's discuss the same period element single-substance melting point regularity.First of all, the melting points of the same period element group, from the atomic number from low to high, and from the first period to analyze, can be found that with the increase of the atomic number, the atom adds one orbital, their melting points will also be gradually increased. This is a special single-substance element melting point regularity.Secondly, the comparison of the melting temperature difference of the same period elements. The melting temperature difference of the same group elements is relatively large and obvious. For example, the melting point of carbon element is 3540K, while that ofnitrogen is 770K, a difference of great difference.Finally, the regularity of the melting point of the same period element is to be discussed. Generally speaking, the melting point will increase with the degree of compression of atomic structure, but also decrease with the increase of atomic number. For example, the lithium element in the first period, the atomic number of lithium is the lowest energy, its melting point is the lowest, 1687K, but when the atomic number begins with the second period, the additional electron layer will offset the increase of melting point, so that the melting point can be reduced.In a word, the same period element single-substance melting point regularity can provide us with a simple and effective atomic structure analysis method, so as to have a deeper understanding of element science, and provide a good theoretical basis for various related elements in scientific research and application.。
元素周期律 熔沸点比较

所以
第一主族的碱金属熔沸点是由金属键键能决定,在所带电荷相同的情况下,原子半径越小,金属键键能越大,所以碱金属的熔沸点递变规律是:从上到下熔沸点依次降低。
第七主族的卤素,其单质是分子晶体,故熔沸点由分子间作用力决定,在分子构成相似的情况下,相对分子质量越大,分子间作用力也越大,所以卤素的熔沸点递变规律是:从上到下熔沸点依次升高。
用这样的方法去判断同主族元素的熔沸点递变规律就行了,因为理解才是最重要的。
同周期的话,不太好说了。
通常会比较同一类型的元素单质熔沸点,比如说比较Na、Mg、Al的熔沸点,则由金属键键能决定,Al所带电荷最多,原子半径最小,所以金属键最强,故熔沸点是:Na<Mg<Al。
非金属元素
一般不会比较它们单质之间的熔沸点,一般比较他们的氢化物的熔沸点。
比较时要注意CH4、NH3、H2O、HF他们的分子间除分子间作用力外,还有氢键,所以同主族氢化物熔沸点他们是最高的,其余的按分子间作用力大小排列。
如氧族元素氢化物的熔沸点是:
H2O>H2Te>H2Se>H2S;卤素:HF>HI>HBr>HCl。
同周期比较的话,是从左至右熔沸点依次升高,因为气态氢化物的热稳定性是这样递变的。
另外有时还要注意物质的类型,比如让你比较金刚石、钙、氯化氢的熔沸点,只要知道金刚石是原子晶体,熔沸点最高,其次是金属钙,最后是分子晶体氯化氢。
还有原子晶体的:比较金刚石、晶体硅、碳化硅的熔沸点,那就要看共价键了,原子半径越小,共价键键能越大,故熔沸点:金刚石>碳化硅>晶体硅。
1/ 1。
高考化学溶沸点比较

主要方法有如下几种(1)由周期表看主族单质的熔、沸点同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。
但碳族元素特殊,即C,Si,Ge,Sn越向下,熔点越低,与金属族相似。
还有ⅢA族的镓熔点比铟、铊低,ⅣA族的锡熔点比铅低。
(2)同周期中的几个区域的熔点规律①高熔点单质 C,Si,B三角形小区域,因其为原子晶体,熔点高。
金刚石和石墨的熔点最高大于3550℃,金属元素的高熔点区在过渡元素的中部和中下部,其最高熔点为钨(3410℃)。
②低熔点单质非金属低熔点单质集中于周期表的右和右上方,另有IA的氢气。
其中稀有气体熔、沸点均为同周期的最低者,而氦是熔点(-272.2℃,26×105Pa)、沸点(268.9℃)最低。
金属的低熔点区有两处:IA、ⅡB族Zn,Cd,Hg及ⅢA族中Al,Ge,Th;ⅣA族的Sn,Pb;ⅤA族的Sb,Bi,呈三角形分布。
最低熔点是Hg(-38.87℃),近常温呈液态的镓(29.78℃)铯(28.4℃),体温即能使其熔化。
(3)从晶体类型看熔、沸点规律原子晶体的熔、沸点高于离子晶体,又高于分子晶体。
金属单质和合金属于金属晶体,其中熔、沸点高的比例数很大(但也有低的)。
在原子晶体中成键元素之间共价键越短的键能越大,则熔点越高。
判断时可由原子半径推导出键长、键能再比较。
如熔点:金刚石>碳化硅>晶体硅分子晶体由分子间作用力而定,其判断思路是:①结构性质相似的物质,相对分子质量大,范德华力(分子间作用力指存在于分子与分子之间或惰性气体原子间的作用力,又称范德华力)大,则熔、沸点也相应高。
如烃的同系物、卤素单质、稀有气体等。
②相对分子质量相同,化学式也相同的物质(同分异构体),一般烃中支链越多,熔沸点越低。
烃的衍生物中醇的沸点高于醚;羧酸沸点高于酯;油脂中不饱和程度越大,则熔点越低。
如:油酸甘油酯常温时为液体,而硬脂酸甘油酯呈固态。
上述情况的特殊性最主要的是相对分子质量小而沸点高的三种气态氢化物:NH3,H2O,HF比同族绝大多数气态氢化物的沸点高得多(主要因为有氢键)。
高一化学熔沸点大小比较规律总结

⼀、从晶体类型看
1)⼀般原⼦晶体,离⼦晶体、⾦属晶体次之,分⼦晶体最⼩。
2)原⼦晶体中:原⼦半径⼩、键短、键能⼤熔沸点⾼,如C-C、C-SI SI-SI
3)离⼦晶体中:原⼦半径⼩、离⼦电荷⾼、键能⼤熔沸点⾼,如NaF>NaCI>NaBr>NaI 如MgCI2>NaCI 如X+CI2=XCI2+Q1
Y+CI2=YCI2+Q2 Q1>Q2键能XCI2>YCI2 4)⾦属晶体中:原⼦半径⼩、⾦属性弱、价电⼦多熔沸点⾼,如锂>钠>钾>铷>铯如铝>镁>钠 5)分⼦晶体中:结构组成相似的,分⼦量⼤熔沸点⾼,如C1-4⽓C5-16液C16以上固如F2
如:烃
6)存在氢键的⼀般熔沸点⾼,如HF>HI>HBr>HCI如H2O>H2Te>H2Se>H2S 注意:分⼦间形成氢键,熔沸点反⽽低。
如邻羟基苯甲酸。
⼆、从状态上看:常温下固态>液态>⽓态如I2 >H2O>HCI
三、从结构上看:直链的、排列紧密的熔沸点⾼,如:正丁烷>异丁烷。
元素周期表沸点变化规律

元素周期表沸点变化规律
在非金属元素中,周期表中的气态元素的沸点随原子序数的增加而逐渐升高,原子序数从1到6的气态元素沸点依次是由低到高的,当原子序数从7开始,沸点开始回落。
直到原子序数为14时,沸点达到最高峰,此后气态元素沸点又开始逐渐降低。
到原子序数为18时,沸点达到最低点,之后依次上升,接着原子序数增大,沸点也随之升高,当原子序数到达30时,沸点达到第二个高峰。
随着原子序数越来越大,沸点也开始逐渐降低。
当原子序数为70时,沸点达到最低点,此后沸点又继续往上增加,当原子序数达到86时,沸点达到第三个高峰,当原子序数为92时,沸点再次降低,而到氢和氦的原子序数为2时就是沸点最低点了。
总的来说,气态元素的沸点比较低,而氢和氦的沸点则最高。
这是气态元素沸点变化规律的总结。
高考化学溶沸点比较

主要方法有如下几种(1)由周期表看主族单质的熔、沸点同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。
但碳族元素特殊,即C,Si,Ge,Sn越向下,熔点越低,与金属族相似。
还有ⅢA族的镓熔点比铟、铊低,ⅣA族的锡熔点比铅低。
(2)同周期中的几个区域的熔点规律①高熔点单质 C,Si,B三角形小区域,因其为原子晶体,熔点高。
金刚石和石墨的熔点最高大于3550℃,金属元素的高熔点区在过渡元素的中部和中下部,其最高熔点为钨(3410℃)。
②低熔点单质非金属低熔点单质集中于周期表的右和右上方,另有IA的氢气。
其中稀有气体熔、沸点均为同周期的最低者,而氦是熔点(-272.2℃,26×105Pa)、沸点(268.9℃)最低。
Bi,呈三角(3熔点:金刚石>①②呈固态。
(4①②③晶体的颗粒很小,肉眼观察不到它的几何形状,但仍是晶体,例如白沙糖,很小很小的颗粒,但它是分子晶体,我们常用的食盐,晶体颗粒很小,但它是离子晶体。
还要指明的是有些物质在常温常压下是气体,一但隆温到它成固体时它是晶体了,例如二氧化碳就是这样,它是分子晶体原子晶体:1.相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体。
2.在原子晶体这类晶体中,晶格上的质点是原子,而原子间是通过共价键结合在一起,这种晶体称为原子晶体。
如金刚石晶体,单质硅,SiO2,碳化硅等均为原子晶体。
3.规律:原子晶体熔沸点的高低与共价键的强弱有关。
一般来说,半径越小形成共价键的键长越短,键能就越大,晶体的熔沸点也就越高。
例如:金刚石(C-C)>二氧化硅(Si-O)>碳化硅(Si-C)晶体硅(Si-Si))金刚石、硅晶体、SiO2、SiC离子晶体:由正、负离子或正、负离子集团按一定比例通过离子键结合形成的晶体称作离子晶体。
离子晶体一般硬而脆,具有较高的熔沸点,熔融或溶解时可以导电。
如强碱(NaOH、KOH、Ba(OH)2)、活泼金属氧化物(Na2O、MgO、Na2O2)、大多数盐类(BeCl₂、Pb(Ac)₂等除外)都是离子晶体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
首先,判断元素单质的熔沸点要先判断其单质的晶体类型,晶体类型不同,决定其熔沸点的
作用也不同。
金属的熔沸点由金属键键能大小决定;分子晶体由分子间作用力的大小决定;离子晶体由离子键键能的大小决定;原子晶体由共价键键能的大小决定。
所以
第一主族的碱金属熔沸点是由金属键键能决定,在所带电荷相同的情况下,原子半径越小,
金属键键能越大,所以碱金属的熔沸点递变规律是:从上到下熔沸点依次降低。
第七主族的卤素,其单质是分子晶体,故熔沸点由分子间作用力决定,在分子构成相似的情况下,相对分子质量越大,分子间作用力也越大,所以卤素的熔沸点递变规律是:从上到下熔沸点依次升高。
用这样的方法去判断同主族元素的熔沸点递变规律就行了,因为理解才是最重要的。
同周期的话,不太好说了。
通常会比较同一类型的元素单质熔沸点,比如说比较Na、Mg Al的熔沸点,则由金属键键
能决定,Al所带电荷最多,原子半径最小,所以金属键最强,故熔沸点是:Na<Mg<Alo
非金属元素
一般不会比较它们单质之间的熔沸点,一般比较他们的氢化物的熔沸点。
比较时要注意CH4 NH3 H2O HF他们的分子间除分子间作用力外,还有氢键,所以同主族氢化物熔沸点他们是最高的,其余的按分子间作用力大小排列。
如氧族元素氢化物的熔沸点是:
H2O>H2Te>H2Se>H2S 卤素:HF>HI>HBr>HCI。
同周期比较的话,是从左至右熔沸点依次升高,因为气态氢化物的热稳定性是这样递变的。
另外有时还要注意物质的类型,比如让你比较金刚石、钙、氯化氢的熔沸点,只要知道金刚
石是原子晶体,熔沸点最高,其次是金属钙,最后是分子晶体氯化氢。
还有原子晶体的:比较金刚石、晶体硅、碳化硅的熔沸点,那就要看共价键了,原子半径越小,共价键键能越大,故熔沸点:金刚石>碳化硅>晶体硅。
