有机化学第三章烯烃分析
合集下载
第三章 烯烃
2-甲基-1-丁烯
CH2 CHC CH3 CH3
CH2
CH3CH
CH2
C CH3 CH3 2-甲基-2-丁烯
CH3CH2CH
CHCH3
3-甲基-1-丁烯
2. 顺反异构:由于双键旋转受阻,构造相同的分子中的 原子在空间排列方式的不同所造成的异构现象。
CH3 C H C CH3 H
顺-2-丁烯,bp:3.5℃,mp: -139.3℃,r:0.6213
(2).顺反异构体的命名 对于取代基不同的烯烃,很难用顺或反来表示,则 用Z,E表示。
a C b (Z) C d b (E) c a C C c c>d d a>b
优先基团选择规律 a. 原子量大的原子优先 Br>Cl>S>P>Si>F>O>N>C>B>Li>H b. 若取代基游离价所在的原子的原子序数和原子量相同而 无法决定其次序时,应用外推法即顺次比较第一个、第二 个…… (CH3)3C->(CH3)2CH->CH3CH2->CH3c. 确定不饱和基团的次序时,应把不饱和键的成键原子看 做是以单键分别和相同的原子相接。 例如: C O C 当作 C C C O 当作
CH3 C H C CH3 H
CH3 H
C C
H CH3
(Z)-2-丁烯
(E)-2-丁烯
较优先基团在双键同侧的构型为Z,在异侧的构型为E。 例如:
CH3 C C CH3CH2 CH(CH3)2 CH2CH2CH3
CH3 C C CH3CH2
CH(CH3)2 >
CH(CH3)2 CH2CH2CH3
CH2CH2CH3
在酸催化剂存在时,烯烃可与羧酸、醇加成生成羧酸酯和醚:
CH2 CHC CH3 CH3
CH2
CH3CH
CH2
C CH3 CH3 2-甲基-2-丁烯
CH3CH2CH
CHCH3
3-甲基-1-丁烯
2. 顺反异构:由于双键旋转受阻,构造相同的分子中的 原子在空间排列方式的不同所造成的异构现象。
CH3 C H C CH3 H
顺-2-丁烯,bp:3.5℃,mp: -139.3℃,r:0.6213
(2).顺反异构体的命名 对于取代基不同的烯烃,很难用顺或反来表示,则 用Z,E表示。
a C b (Z) C d b (E) c a C C c c>d d a>b
优先基团选择规律 a. 原子量大的原子优先 Br>Cl>S>P>Si>F>O>N>C>B>Li>H b. 若取代基游离价所在的原子的原子序数和原子量相同而 无法决定其次序时,应用外推法即顺次比较第一个、第二 个…… (CH3)3C->(CH3)2CH->CH3CH2->CH3c. 确定不饱和基团的次序时,应把不饱和键的成键原子看 做是以单键分别和相同的原子相接。 例如: C O C 当作 C C C O 当作
CH3 C H C CH3 H
CH3 H
C C
H CH3
(Z)-2-丁烯
(E)-2-丁烯
较优先基团在双键同侧的构型为Z,在异侧的构型为E。 例如:
CH3 C C CH3CH2 CH(CH3)2 CH2CH2CH3
CH3 C C CH3CH2
CH(CH3)2 >
CH(CH3)2 CH2CH2CH3
CH2CH2CH3
在酸催化剂存在时,烯烃可与羧酸、醇加成生成羧酸酯和醚:
有机化学--第三章 不饱和烃:烯烃和炔烃

碳架异构 官能团位次异构 构造异构 官能团异构 互变异构
碳碳双键不能绕键轴自由旋转。因此,当两个双键碳 原子各连有两个不同的原子或基团时,可能产生两种不同 的空间排列方式。
一些烯烃的物理性质
构型:(I)和(Ⅱ)的分子式相同,构造亦相同,但分子中的原子在空间 排列不同。分子中原子在空间的排列形式称为构型。 构型异构体:(I)和(Ⅱ)是由于构型不同而产生的异构体,称为构型异 构体(configurational isomers)。构型异构体具有不同的物理性质。
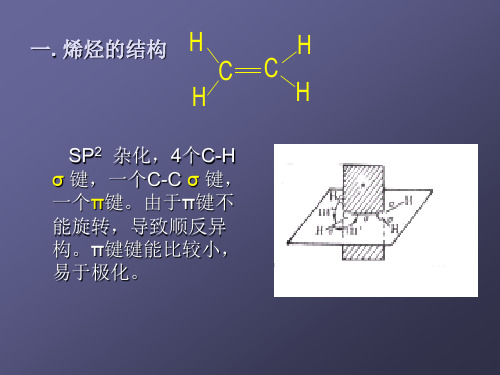
3.1.1 碳原子轨道的sp2杂化
H
H
CC
H
Hale Waihona Puke H1/3s +2/3p
3.1.2 碳碳双键的组成
在乙烯中,成键的两碳原子各以一个sp2杂化轨道彼 此交盖形成一个C—C σ键,并各以两个sp2杂化轨道分 别与两个氢原子的1s轨道形成两个C—H σ键,这样形成 的五个σ键其对称轴都在同一平面内。
由于每个碳原子上余下的p轨道的对称轴垂直于同一 平面,且彼此平行,这样两个p轨道就从侧面相互平行交 盖成键,组成新的轨道,称为π轨道。处于π轨道的电子称 为π电子,这样构成的共价键称为π键。
含一个碳碳三键者称为炔烃(alkynes),通式为CnH2n-2, 碳碳三键(一C≡C一)是炔烃的官能团。分子中既含有碳碳 双键,又含有碳碳三键者称为烯炔。
3.1 烯烃和炔烃的结构
碳碳双键是由两对共用电子构成,通常用两条短线表 示:C=C。碳碳三键由三对共用电子构成,通常用三条 短线表示:C≡C。但实验事实表明,它们都不是由两个 或三个σ键加合而成:
与烷基相似,一个不饱和烃从形式上去掉两个氢原 子也构成亚基。最常见的不饱和亚基有—CH=CH—, 称为1,2-亚乙烯基。
碳碳双键不能绕键轴自由旋转。因此,当两个双键碳 原子各连有两个不同的原子或基团时,可能产生两种不同 的空间排列方式。
一些烯烃的物理性质
构型:(I)和(Ⅱ)的分子式相同,构造亦相同,但分子中的原子在空间 排列不同。分子中原子在空间的排列形式称为构型。 构型异构体:(I)和(Ⅱ)是由于构型不同而产生的异构体,称为构型异 构体(configurational isomers)。构型异构体具有不同的物理性质。
3.1.1 碳原子轨道的sp2杂化
H
H
CC
H
Hale Waihona Puke H1/3s +2/3p
3.1.2 碳碳双键的组成
在乙烯中,成键的两碳原子各以一个sp2杂化轨道彼 此交盖形成一个C—C σ键,并各以两个sp2杂化轨道分 别与两个氢原子的1s轨道形成两个C—H σ键,这样形成 的五个σ键其对称轴都在同一平面内。
由于每个碳原子上余下的p轨道的对称轴垂直于同一 平面,且彼此平行,这样两个p轨道就从侧面相互平行交 盖成键,组成新的轨道,称为π轨道。处于π轨道的电子称 为π电子,这样构成的共价键称为π键。
含一个碳碳三键者称为炔烃(alkynes),通式为CnH2n-2, 碳碳三键(一C≡C一)是炔烃的官能团。分子中既含有碳碳 双键,又含有碳碳三键者称为烯炔。
3.1 烯烃和炔烃的结构
碳碳双键是由两对共用电子构成,通常用两条短线表 示:C=C。碳碳三键由三对共用电子构成,通常用三条 短线表示:C≡C。但实验事实表明,它们都不是由两个 或三个σ键加合而成:
与烷基相似,一个不饱和烃从形式上去掉两个氢原 子也构成亚基。最常见的不饱和亚基有—CH=CH—, 称为1,2-亚乙烯基。
有机化学 key note ch03 第三章 烯烃

(2) H2C C(Cl)CH3
H3CH2C
H H (3) H3C C C CH2I
解:(1)、(2)无顺反异构,(3)有顺反异构,其表示方法和命名如下: H3C H H3C CH2I
H
H
H
CH2I
Z-1-碘-2-丁烯
E-1-碘-2-丁烯
提示:顺反异构是构型不同的异构体,其构造是相同的。烯烃顺反异构的形成除了双键 不能自由旋转外,还必须是双键所连的两个取代基是不同的,否则不会产生顺反异构。例 1 中的(1)(2)两题都是双键连有两个相同的取代基,因而无顺反异构。 [例题 2] 解释下列排序
H3C 3 (+ I) δ+ δHC CH2 1 2 + HX H H3C C CH3 X
由于供电子基的存在,是电子云向 1 号碳上偏移,使得 1 号碳上的电子云密度大些,H+ 就易于与 1 号碳结合。而对下例反应来说情况正好相反:
F3C 3 (- I) δ+ δHC CH2 1 2 + HX H2 F3C C CH2 X
b
X-
a 反应过程生成仲 C+正离子,b 反应过程生成伯 C+正离子。中间体的稳定性决定了反 应的主要取向。由于仲 C+的稳定性大于伯 C+,因而反应以 a 路线为主要。
3.3 例题分析
[例题 1] 下列烯烃中哪个有顺反异构?写出其顺反异构体,并以 Z、E 标记法命名。
H3C
(1)
C2H5 C2H5
R
H2SO4
R
HBr 过氧化物
R
马尔考夫尼考夫(V. V. Markovnikov)规则(简称马氏规则) :当不对称烯烃和亲电试剂 加成时,不对称试剂中负电荷一端总是和含氢较少的双键碳相连,正电荷一端(一般是 H+) 主要和含氢较多的双键碳相连。 (2) 氧化反应 R H KMnO4 C C R 冷,稀,中性 ROHOH
H3CH2C
H H (3) H3C C C CH2I
解:(1)、(2)无顺反异构,(3)有顺反异构,其表示方法和命名如下: H3C H H3C CH2I
H
H
H
CH2I
Z-1-碘-2-丁烯
E-1-碘-2-丁烯
提示:顺反异构是构型不同的异构体,其构造是相同的。烯烃顺反异构的形成除了双键 不能自由旋转外,还必须是双键所连的两个取代基是不同的,否则不会产生顺反异构。例 1 中的(1)(2)两题都是双键连有两个相同的取代基,因而无顺反异构。 [例题 2] 解释下列排序
H3C 3 (+ I) δ+ δHC CH2 1 2 + HX H H3C C CH3 X
由于供电子基的存在,是电子云向 1 号碳上偏移,使得 1 号碳上的电子云密度大些,H+ 就易于与 1 号碳结合。而对下例反应来说情况正好相反:
F3C 3 (- I) δ+ δHC CH2 1 2 + HX H2 F3C C CH2 X
b
X-
a 反应过程生成仲 C+正离子,b 反应过程生成伯 C+正离子。中间体的稳定性决定了反 应的主要取向。由于仲 C+的稳定性大于伯 C+,因而反应以 a 路线为主要。
3.3 例题分析
[例题 1] 下列烯烃中哪个有顺反异构?写出其顺反异构体,并以 Z、E 标记法命名。
H3C
(1)
C2H5 C2H5
R
H2SO4
R
HBr 过氧化物
R
马尔考夫尼考夫(V. V. Markovnikov)规则(简称马氏规则) :当不对称烯烃和亲电试剂 加成时,不对称试剂中负电荷一端总是和含氢较少的双键碳相连,正电荷一端(一般是 H+) 主要和含氢较多的双键碳相连。 (2) 氧化反应 R H KMnO4 C C R 冷,稀,中性 ROHOH
有机化学 第三章 烯烃全

KOH
Br
C2H5OH
+ HBr
17
3-4 烯烃的物理性质
物质状态 C2~C4 气体,C5~C18液体 ,C19~固体
沸点、熔点和相对密度 均随相对分子量的增加而上升;直链烯烃的沸 点略高于支链烯烃;末端烯烃(α-烯烃)的沸点 略低于双键位于碳链中间的异构体。
溶解性 不溶于水,易溶于有机溶剂。
HCl CF3CH2CH2 Cl
Cl
CF3CH2CH2
(主)
HCl CF3CHCH3
Cl
Cl
CF3CHCH3
35
烯烃的亲电加成反应
HX反应活性 HI > HBr > HCl > HF
H2C CH2
HBr HAc
CH2 Br
CH2 H
HCl H2C CH2 AlCl3
H2C CH3 Cl
36
与硫酸的加成 ——间接水合
H3C C
H
CH3 C
H
H C
H3C
CH3 C
H
顺式
反式
7
3-2 烯烃的异构和命名
系统命名法
选主链:选择含双键的最长碳链作主链, 称 “某烯”, 若碳原子数大于10, 则称为“某碳 烯”;
编号:从靠近双键的一端开始编号,确定双键 (两双键碳原子中编号小的数字)及其它取代 基的位次;
其它同烷烃的命名。
18
顺 反 异 构 体 的 差 异
极性较大, b.p. 较高 极性较小, b.p. 较低
对称性较差,m.p. 较低
对称性较好,m.p. 较高19
3-5 烯烃的化学性质(重点)
• 反应:加成、氧化、卤代
α HCCC
课件有机化学第3章 烯烃

第三章烯烃Alkenes12烯烃的结构烯烃的顺反异构烯烃的命名烯烃的物理性质CONTENT1234烯烃的化学性质烯烃的制备56SP杂化轨道C C C C7乙烯键长和键角乙烷键长和键角134 pm 烯烃的键长和键角烯烃的结构特征•sp2杂化•π-键•C=C键长比C-C短•π键电子云流动性较大•存在顺反异构——相同基团在双键同侧为顺式,不同侧为反式83.3 烯烃的命名•主链应含双键称“某碳烯”•C10•主官能团的位号尽可能小•如烯烃存在位置异构,母体名称前要加官能团位号•取代基的位置、数目、名称按“次序规则”顺序写在母体前面•Z或E加圆括号,写在化合物名称最前面123.5 烯烃的化学性质1. 烯烃的亲电加成2. 烯烃的自由基加成3. 硼氢化反应4. 催化氢化5. 烯烃的氧化6. 烯烃的α−卤化7. 聚合反应21烯烃亲电加成的原则当不对称烯烃与极性试剂加成时:试剂中的正离子(或带有部分正电荷的部分)加到带有部分负电荷的双键碳原子上试剂中的负离子(或带有部分负电荷的部分)加到带有部分正电荷的双键碳原子上24可能发生重排反应重排反应( rearrangement)——在化学键的断裂和形成过程中,组成分子的原子配置方式发生了改变,从而形成组成相同,结构不同的新分子。
31结论•反应是亲电加成反应•反应是分步进行的•立体化学上表现为反式加成38反应特点•Br2, Cl2对烯烃的加成主要为环正离子过渡态的反式加成•碘加成一般不发生,但ICl, IBr可与烯键发生定量加成反应,用来监测油脂中双键的含量40。
有机化学之烯烃详解

诱导效应对酸性的影响
Ka: 羧酸在水溶液中解离平衡常数,较大的Ka
值(或较少的pKa值)代表较强的酸
归纳酸性变化的规律
•酸中的氢被卤原子取代,酸性增强;被烷基取代,酸性变弱。 •在烃基的同一位置引入的卤原子数多,酸性增加的多;引入烷基 多,酸性变弱的多。 •引进的卤原子离羧基近,酸性大。 •引进卤原子形成的碳卤键极性大,酸性增加。
(3)诱导效应强弱变化规律:
A.同一族的元素随着原子层的增加而吸电子诱导效应降低。 如: —F > —Cl > —Br > —I —OR > —SR —NR2 > —PR2 B.同一周期的元素从左到右吸电子诱导效应增加。如: —F > —OR > —NR2 > —CR3
C.不同杂化状态的碳原子以s轨道成分多者吸电子 能力强。(sp>sp2>sp3)
H3C CH2 CH 2 C H C
Cl Br
H3C H
C
C
CH2 CH2 CH3 CH3
(E)-1-氯-1-溴-1-戊烯
(Z)-3-甲基-2-己烯
H3C
C C
CH2CH3 CH CH3 CH3
H3C
CH3CH2
C C
CH3 Cl
CH3CH2
(Z)-3-甲基-2-氯-2-戊烯 (Z)-2,4-二甲基-3-乙基-3-己烯
若双键两碳原子所连接 CH3 的四个原子不相同时,就 H 无法用顺反来命名
顺、反异构命名——Z、E命名法:
1.依次对双键碳原子上所连接基团排序。 2.序数大的基团在同侧为Z, 在不同侧为E 。
a C b C b (Z)-构型 c a d C b (E)-构型 C c
有机化学 第三章 烯烃
在次卤酸中,氧原子的电负性(3.5) 较氯原子(3.0)和溴 原子(2.8)强,使分子极化成HO X。加成仍符合马氏规律。 在实际生产过程中,通常用氯和水代替次卤酸,结果生成 氯乙醇和,1,2-二氯乙烷。
CH2=CH2
Cl2/H2O
δ- δ+
CH2CH2 + CH 2CH2 Cl OH Cl Cl
– 反应机理
– 顺反异构体的命名
• 顺/反标记法 相同基团在双键同侧为“顺(cis)” ,反之,为“反(trans)”。 • Z/E标记法 依照“次序规则”,比较双键碳上连接的两个基团, 较优基团在双键同侧为“Z” ,反之,为“E”。
CH3 H C C CH3 CH3 H
H
C
C
CH3 CH2CH3
CH3CH2 H
有 机 化 学 ORGANIC CHEMISTRY
第三章 烯烃
CHAPTER 3 ALKENES
第三章 烯 烃 3 ALKENES
分类
开链烯烃 如:(CH3)2C=CH2
按碳的连 接方式分
环烯烃
如:
单烯烃 按双键 数目分 多烯烃
如:H2C=CH2
如:
第一节 烯烃的结构、异构和命名 3.1 Structure,Isomerism and nomenclature
• 加卤化氢 如:
一卤代烷
AlCl3 130~ 250℃
CH2=CH2 + HCl
CH3CH2Cl
分子不对称的烯烃加HX时,可得两种加成产物:
CH3CH=CH2 + HX CH 3CH2CH2X + CH 3CHCH3 X
马氏(Markovnikov)规律:不对称烯烃发生亲电加成时, 酸中带正电荷的质子H+总是加到含氢较多的双键碳原子 上,而负性基团加到含氢较少的双键碳原子上。如:
有机化学 理论篇 第五版 第3章 烯烃
H
H
CH3 H
C=C
H CH3
(I) 顺-2-丁烯
(II) 反-2-丁烯
(沸点3.7 ℃)
(沸点0.9 ℃)
两个相同基团(如I 和 II中的两个甲基或两个氢原子)在双键 同一侧的称为顺式,在异侧的称为反式。这种由于分子中的原子 或基团在空间排布方式不同而产生的同分异构现象,称为顺反异 构,也称几何异构。分子中原子或基团在空间的排布方式称为构 型。因此顺反异构也是构型异构,它是立体异构中的一种。
9
第3章 烯烃
有机化学(理论篇)
需要指出的是,顺反异构现象普遍存在于烯烃、环烃等有 机化合物分子中,但并不是所有的烯烃、环烃都有顺反异构 现象。产生顺反异构的条件是除了σ键的旋转受阻(如π键、 碳环等)外,还要求两个双键碳原子上分别连接有不同的原子 或基团。也就是说,当双键的任何一个碳原子上连接的两个 原子或基团相同时,就不存在顺反异构现象了。例如,下列 化合物就没有顺反异构体。
有机化学(理论篇)
第3章 烯烃
第3章 烯烃
有机化学(理论篇)
【课程思政】 绿色生态与可持续发展—烯烃的聚合反应
烯烃类化合物由于其容易获得且价格便宜,并能进行各种 转化,不断被应用到工业生产中,为一些功能材料、农药、化 妆品和药物等提供关键合成中间体。
烯烃聚合反应与人类生活息息相关,高分子材料聚乙烯、 聚丙烯、聚苯乙烯、聚氯乙烯、聚四氟乙烯等被广泛用于日常 生活用品、建筑材料、有机光电材料、人造器官等实用性物质 中。由美国杜邦公司研制的聚四氟乙烯具有耐高温、耐腐蚀、 质地致密光滑的特异性能,被誉为“塑料王”。2008 年北京 奥运会标志性建筑物之一“水立方”是世界上最大的膜结构工 程,采用最先进的新型环保节能膜材料乙烯-聚四氟乙烯共聚 物(ETFE),该材料耐腐蚀性、保温性极强,抗压性好,自清洁 能力强。
有机化学第五版 第三章 烯烃
2* 烷基硼的氧化反应:烷 基硼在碱性条件下与过氧 化氢作用,生成醇的反应。
硼氢化反应的机理
B2H6 CH3CH=CH2 + H-BH2
亲电加成
+ CH3CH—CH2 …
硼接近空阻小、p电荷密度 高的双键碳,并接纳p电子。 CH3CH—CH2 …
H…BH2
四中心过渡态
H—BH2 - + 负氢与正 碳互相吸 引。 CH3CH2CH2—BH2 缺电子的硼是亲核试剂
H Br Br
CH3 Br H CH3 Br
CH3 H Br CH3 CH3
b
b
H H Br CH3 CH3
H Br
Br H CH3
注意立体表达式 之间的转换
3、
烯烃的硼氢化反应
(1) 甲硼烷、乙硼烷的介绍 BH3
H H B H
H
H3B THF
H3B OR2
B2H6
H H
B
H
B
H H
能自燃,无色 有毒,保存在 醚溶液中。
碳正离子中间体
C
C
-
-X C C C C X
慢
H X
H X
快
H
H有亲电性
反应进程分析
C
C
C
-
C H
-
C
C H
H
X
X
过渡态 I
X
中间体
C H
C X
-
势 能
C
X H
C
C H C X
-
过渡态 II
C + H X C
C H
C
C H
C X
+ X C H C X
有机化学第三章 烯烃
(Ⅰ) Ⅰ 。 2 正离 子
容易生成的碳正离子也一定是稳定的碳正离子。 容易生成的碳正离子也一定是稳定的碳正离子。一 般烷基碳正离子的稳定性次序为: 般烷基碳正离子的稳定性次序为:
(CH3)3C 。 3 C+
+
+
+
+
(CH3)2CH 。+ 2C
CH3CH2 。+ 1C
CH3
碳正离子这样的稳定性次序是分子内原子间相互影 响的结果。 响的结果。
C-C 键能/kJmol-1 键长/nm 346 0.154 C=C 610 0.134
碳原子的SP 二、 碳原子的 2杂化
2P1
sp2杂化态
118° 118°
乙烯分子的σ 乙烯分子的σ键
121° 121°
乙烯分子的π 乙烯分子的π键
H H
.......
C C
H H
.......
杂化轨道中, 的 (1)根据碳原子的杂化理论, 在 SPn杂化轨道中 , n的 ) 根据碳原子的杂化理论, 数值越小, 的性质越强 由于s电子靠近原子核 它比p 的性质越强。 电子靠近原子核, 数值越小 , s的性质越强 。 由于 电子靠近原子核 , 它比 电子与原子核结合的更紧, 越小 轨道电负性越大, 越小, 电子与原子核结合的更紧, n越小, 轨道电负性越大, 电 负性大小次序是: 负性大小次序是:
第三章 烯 烃
【本章重点】 本章重点】 亲电加成反应历程 【必须掌握的内容】 必须掌握的内容】 1.烯烃的结构。 2.烯烃的化学性质。 3.亲电加成反应机理。 4.自由基加成机理
烯烃概念 分子中含有碳碳双键的烃 单烯烃的通式 CnH2n
第一节 烯烃的结构 以 CH2=CH2 为例,从实验事实出发, 乙烯中碳原子的键角是120度,平面结构
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CC
δ+ δ–
-X—
X—
H
碳正离子
X CC
H
25
Markovnikov 规则
1
1
+ H Br 2 2
Br
Br
第三章 烯烃 (Alkene)
一、烯烃的结构 二、烯烃的同分异构和命名 三、烯烃的来源和制备 四、烯烃的物理性质 五、烯烃的化学性质
烯烃概述
烯 烃:分子中含有碳碳双键的不饱和烃 官能团:碳碳双键 通式:CnH2n ,有一个不饱和度。
2
乙烯
乙烯与生长素、赤霉素一 样,是植物的内源激素, 不少植物器官中都含有少 量乙烯,尤其是在成熟的 果实中,有较多的乙烯, 利用人工方法,提高未成 熟青果中的乙烯含量,可 促使果实成熟,是水果的 催熟剂。
OC
CO
CO
-I > -Br > -Cl > -SO3H > -F > -OCOR > -OR >-OH >… … >-CR3 > -C6H5 > - CHR2 > -CH2R > - CH3 > -H
15
顺式不一定是Z构型,反式也不一定是E构型
H3C C
CH3CH2
CH3 C
Cl
(Z)-3-甲基-2-氯-2-戊烯 顺-3-甲基-2-氯-2-戊烯
H3C C
H
CH3 C
H
H C
H3C
CH3 C
H
顺式
反式
7
3-2 烯烃的异构和命名
系统命名法
选主链:选择含双键的最长碳链作主链, 称 “某烯”, 若碳原子数大于10, 则称为“某碳 烯”;
编号:从靠近双键的一端开始编号,确定双键 (两双键碳原子中编号小的数字)及其它取代 基的位次;
其它同烷烃的命名。
基” 。
CH2 CH
乙烯基
CH3CH CH 丙烯基 (1-丙烯基)
CH2 CHCH2 CH3
CH2 C
烯丙基 (2-丙烯基)
异丙烯基 (1-甲基乙烯基)
10
3-2 烯烃的命名 顺反异构体的命名
顺(反)-系统命名名称
H3C
CH3
CC
H
H
顺- 2-丁烯
H C
H3C
CH3 C
H
反-2-丁烯
H3C C
CH3CH2
H2C CH2 < H2C CHR < RHC CHR < R2C CHR < R2C CR2
23
3-5 烯烃的化学性质 *亲电加成反应
亲电 试剂
由亲电试剂E+ 的进攻而引起
的加成反应。
24
与HX的加成
C C + H:X
(HX=HCl, HBr, HI)
机理
CC XH
卤代烷
δ+ δ– 慢
+
快
C C + H—X
将双键碳原子所连接的原子或基团按其原子 序数的大小排列,把原子序数大的排在前面, 小的排在后面,同位素则按原子量大小次序 排列,如
I,Cl, S, O, N, C, D, H -I >-Cl >-SH >-OH >-NH2 >-CH3 >-H
13
3-2 烯烃的命名
次序规则
(Sequence rule)
如果与双键碳原子上连接的基团第一个原子
相同,则应看基团的第二个原子的原子序数,
依次类推,如
CH3CH2
< CH3CH
CH3
把不饱和键看作成键原子以单键与多个原子
相连。
CC
CH2 CH
CH2 CH
14
3-2 烯烃的命名
CC
CH C
CH C CC
常见基团排列次序
次序规则
(Sequence rule)
CH3 C
H
顺- 3-甲基-2-戊烯
Cl
CH3
CC
CH3CH2
H
11
3-2 烯烃的命名
E-Z标记法
(Z)或(E)-系统命名名称
Z型:将同一双键碳上的两个基团按次序规则比 较出先后次序,若两双键碳上的较优基团 在双键同侧的为Z型。
E型:两个碳上的较优基团在双键异侧。
12
3-2 烯烃的命名
次序规则
(Sequence rule)
18
顺 反 异 构 体 的 差 异
极性较大, b.p. 较高 极性较小, b.p. 较低
对称性较差,m.p. 较低
对称性较好,m.p. 较高19
3-5 烯烃的化学性质(重点)
• 反应:加成、氧化、卤代
α HCCC
Cl or Br
加成、氧化
20
3-5 烯烃的化学性质 催化加氢
CC
常用催化剂: Pt Pd Ni Raney Ni
Br
Cl
CC
Cl
H
(Z)-1,2-二氯(-1-)溴乙烯 反- 1,2-二氯溴乙烯
16
3-3 烯烃的制备
烯烃的实验室制法
✓醇脱水
CH3CH2OH
浓H2 SO 4
170 ℃
+ CH2 CH2 H2O
CH3 CH2 OH
Al2 O3
350~360℃
CH2
CH2 + H2O
✓卤(代)烷脱卤化氢(反应需强碱性条件)
3
3-1 烯烃的结构
H 121.7°
C
C
H
116.6° 乙 烯
H
1.076 Å
H
1.330 Å
C的sp2杂化
平面分子
2p 2s
2p
激发
杂化
2s
p
sp2
4
3-1 烯烃的结构
118°
H H
C
C
H H
1 双键碳是sp2杂化。
2 键是由p轨道侧面重叠形成。
3 由于室温下双键不能自由 旋转, 所以有Z-, E-异构体。
KOH
Br
C2H5OH
+ HBr
17
3-4 烯烃的物理性质
物质状态 C2~C4 气体,C5~C18液体 ,C19~固体
沸点、熔点和相对密度 均随相对分子量的增加而上升;直链烯烃的沸 点略高于支链烯烃;末端烯烃(α-烯烃)的沸点 略低于双键位于碳链中间的异构体。
溶解性 不溶于水,易溶于有机溶剂。
8
1 2 345 6
CH3C CHCHCH2CH3 CH3 CH3
2,4-二甲基-2-己烯
CH2CH3
4 321
CH3CHC CH2
CH3
CH3
CH3C CHCH2CCH3
CH3
CH3
3-甲基-2-乙基(-1-)丁烯 2,5,5-三甲基-2-己烯
9
3-2 烯烃的异构和命名 烯 基 的 命 名
烯烃失去一个氢原子形成的基团, 称“某烯
H2 / catalyst
CC HH
立体化学: 顺式加成
反应机理
H2
催化剂
H
H
CC
CC
H
H
21
烯烃的催化加氢
氢化热
每摩尔烯烃催化加氢放出的能量氢烯 化烃 热结 也构 Nhomakorabea不 同同
氢化热越小,分子越稳定 22
烯烃的催化加氢
氢化热
烯烃的相对稳定性 ✓ 反式异构体较同碳数顺式异构体稳定; ✓ 双键碳原子上取代基多的烯烃较稳定。
双键比单键更活泼 5
3-2 烯烃的异构和命名
CH3 CH2 CH 1-丁烯
CH3 CH CH 2-丁烯
CH2 CH3
CH3 CH3 C CH2
异丁烯
异构
碳链异构 位置异构
构造异构
顺反异构
6
3-2 烯烃的异构和命名
顺反异构
顺反异构:两个双键碳原子上各连两个不 同基团而形成的异构,属立体异构。
CH3CH CHCH3
