强酸弱酸的稀释.
pH的计算 高二化学(人教版2019选择性必修1)

离子浓度最接近于
()
A、10 8
10 10
2
mol·L-1
B、10 6
10 4 2
mol·L-1
D
C、(10-8+10-10)mol·L-1
D、2×10-10 mol·L-1
pH=-lgKW/[OH—] =-lg(10-14/ 5×10-5 ) =-lg(2×10-10 )
=10 - lg2 = 9.7
溶液(V)的变化关系如下图所示,下例说法错误的是
A. pH=2时,A、B、C都是弱酸
pH
()
A
B . 稀释前的浓度大小为 c(C)>c(B)>c(A) C. 稀释后,A溶液中c(H+)最小
5 4
A
3
B
2
1
C
D. A是强酸,B和C是弱酸
0
1 000 mL V
4.已知水的电离平衡曲线如图所示,试回答下列问题:
pH 单一溶液 的 计 算 混合溶液
强酸与强碱 弱酸与弱碱
强酸或强碱混合 强酸与强碱混合
稀释后c(OH-) =
c(H+)=
Kw c(OH-)
10-3mol/L 1+99
=10-5 mol/L
=1×10-9 mol/L
氢氧根离子 进行计算!
稀释后溶液的pH = 9
若将上述溶液加水稀释到原体积的1000倍,则pH=__8_
若稀释到原体积的105倍,则溶液的pH_约___为__7
强碱的稀释
练
两溶液等体积混合(25 ℃)
稀释后所得
习
甲溶液
乙溶液
溶液的pH
pH=3的HCl
pH=5的HCl
3.3
水的电离和溶液的酸碱性

水的电离和溶液的酸碱性◎重难点1.pH的计算2.酸碱稀释的pH的计算3.酸碱混合的pH计算4.酸碱中和滴定实验◎本节知识网络知识点1水的电离平衡水是一种极弱的电解质,它能微弱地电离,生成H3O+和OH-:H2O+H23O++OH-通常简写为:H2++OH-,水总是电离出等量的H+和OH-,从实验可知,在25℃时,1 L 纯水中只有1×10-7 mol H2O电离,即纯水中 [H+ ]=[OH-]=1×10-7mol. L-1在酸碱溶液中,+-知识点2水的电离平衡影响因素1、温度对水电离的影响水的电离是个吸热过程,故温度升高,水的离子积增大。
25℃时,K W= 1×10-14 ;100℃时,K W= 1×10-12。
(水的离子积只随温度的改变而改变)2、外加试剂对水电离的影响水的离子积是水电离平衡时的性质,它不仅适用于纯水,也适用于任何酸、碱、盐稀溶液。
即任何物质的水溶液中,25℃时,K W= c(H+)·c(OH-) =1×10-143、直接增大[H+]在H2 O ++OH-平衡中,加入(酸或强酸的酸式盐或中强酸的酸式盐),增大[H+],则平衡向左移动,α水减小,水的电离被抑制,由于水的电离平衡仍然存在,K w不变,则[OH-]必然会减小。
4、直接增大[OH-]在H2 O H+ +OH-平衡中,加入碱,增大[OH-] ,则平衡向左移动,α水减小,水的电离被抑制,由于水的电离平衡仍然存在,K w1×10-14,则[H+]必然会减小。
总结:(1)在纯水中分别加入等量的H+和OH-时,能同等程度地抑制水的电离,并使水电离出的[H+ ]和[OH-]均小于10-7mol .L-1。
(2)如果一个溶液中水的电离度小于纯水,即水的电离被抑制,表明既可以是加入酸或某些酸式盐,也可以是加入碱,则该溶液既可以显酸性也可以显碱性。
〖例1〗常温的某无色溶液中,由水的电离产生的C(H+)=1×10-12mol/l,则下列各组离子肯定能共存的是()A、Cu2+NO3-SO42-Fe3+B、Cl- S2- Na+K+C、SO32-NH4+ K+ Mg2+D、Cl- Na+ NO3- SO42-〖变式训练1〗下列说法正确的是( )A 酸溶于水后能促进水的电离,碱溶于水后能抑制水的电离。
难点突破4-1强酸(碱)与弱酸(碱)的比较

难点突破4-1 强酸(碱)与弱酸(碱)的比较1.一元强酸(HCl)与一元弱酸(CH3COOH)的比较1)相同物质的量浓度、相同体积的盐酸与醋酸溶液的比较2.一元强酸(HCl)与一元弱酸(CH3COOH)稀释图像比较(1)相同体积、相同浓度的盐酸、醋酸典例1】【强酸、弱酸比较】在一定温度下,有 A .盐酸B.硫酸C.醋酸三种酸:1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是___ (用字母表示,下同)。
2)同体积、同物质的量浓度的三种酸,中和NaOH 的能力由大到小的顺序是_________ 。
3)若三者c(H +)相同时,物质的量浓度由大到小的顺序是______________ 。
4)当三者c(H +)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序5)当三者c(H +)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为_____________________________ ,反应所需时间的长短关系是。
6)将c(H+)相同的三种酸均加水稀释至原来的____________________________________ 100 倍后,c(H +)由大到小的顺序是。
7)将c(H+)相同且体积也相同的三种酸,分别与等浓度的NaOH 稀溶液反应至pH =7,则消耗NaOH 溶液的体积大小关系为_________ 。
典例2】【强酸弱酸,强碱弱碱比较】25 ℃时,有下列四种溶液:列说法中正确的是()A .①稀释到原来的100 倍后,pH 与②相同B.①③等体积混合、②④等体积混合所得的溶液都呈酸性C.①②中分别加入少量CH3COONa 固体,c(NH 3·+H2O)的值都变小c(NH 4 )D.③④稀释到原来的100倍后,稀释后④溶液中的pH 大典例3】【等浓度强碱弱碱稀释图像】两种一元碱MOH 和ROH 的溶液分别加水稀释,溶液图所示,下列叙述不正确的是( )A .MOH 是一种弱酸++B.在x 点, c (M +)=c(R+)C.稀释前,c(ROH) =10c(MOH)D.稀释前MOH 溶液和ROH 溶液中由水电离出的c(OH -)前者是后者的10 倍典例4】【等pH算稀释图像】已知常温时HClO 的K a=3.0 × 1-08,HF 的K a=3.5 × 1-04,现将pH 的变化如pH 和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,()pH 随溶液体积的变化如图所示,下列叙述正确的是A .曲线Ⅰ为次氯酸稀释时 pH 变化曲线B .取 a 点的两种酸溶液,中和相同体积、相同浓度的 NaOH 溶液,消耗氢氟酸的体积较小C .b 点溶液中水的电离程度比 c 点溶液中水的电离程度小D .从 b 点到 d 点,溶液中 c(R ) - 保持不变 (HR 代表 HClO 或 HF)c(HR) ·c(OH )典例 5】【等 pH 弱酸稀释, lg V V -pH 图像】 常温下, pH 均为 2、体积均为 V 0的 HA 、HB 、HC 溶液,分 别加水稀释至体积为 V ,溶液 pH 随 lg V 的变化关系如图所示,下列叙述错误的是( )A .常温下: K a (HB) > K a (HC)B .HC 的电离度: a 点<b 点C .当 lgV=4 时,三种溶液同时升高温度, c(A -)减小 V 0 c(C )D .当 lg V V =5时, HA 溶液的 pH 为 7正确的是2.某温度下,相同 pH 随溶液体积变化的曲线如图所示。
混合液的pH值计算方法公式

混合液的pH 值计算方法公式值计算方法公式1、强酸与强酸的混合:(先求[H +]混:将两种酸中的H +离子数相加除以总体积,再求其它)[H +]混 =([H +]1V 1+[H +]2V 2)/(V 1+V 2)2、强碱与强碱的混合:、强碱与强碱的混合:(先求(先求[OH -]混:将两种酸中的OH -离子数相加除以总体积,再求其它)[OH -]混=([OH -]1V 1+[OH -]2V 2)/(V 1+V 2)(注意:不能直接计算[H +]混) 3、强酸与强碱的混合:(先据H ++OH - ==H 2O 计算余下的H +或OH -,H +有余,则用余下的H +数除以溶液总体积求[H +]混;OH -有余,则用余下的OH -数除以溶液总体积求[OH -]混,再求其它),再求其它)说明:1、在加法运算中,相差100倍以上(含100倍)的,小的可以忽略不计!倍)的,小的可以忽略不计!2、混合液的pH 值是通过计算混合液的[H +]混或[OH -]混求解的,因此,计算时一定要遵循“酸按酸”“碱按碱”的原则进行。
“酸按酸”“碱按碱”的原则进行。
3、不同体积的溶液相互混合时,混合后溶液的体积都会发生改变,但在不考虑溶液体积的变化时,我们可近似认为体积具有加和性,我们可近似认为体积具有加和性,即混合后体积等于原体积的和,即混合后体积等于原体积的和,即混合后体积等于原体积的和,当题目给出混当题目给出混合后溶液的密度时,则不能运用体积的加和性来计算溶液的体积,而应该用质量与密度的关系求算溶液的体积。
系求算溶液的体积。
(四)稀释过程溶液pH 值的变化规律:值的变化规律:1、强酸溶液:稀释10n 倍时,pH 稀=pH 原+n (但始终不能大于或等于7)2、弱酸溶液:稀释10n 倍时,pH 稀<pH 原+n (但始终不能大于或等于7)3、强碱溶液:稀释10n 倍时,pH 稀=pH 原-n (但始终不能小于或等于7)4、弱碱溶液:稀释10n 倍时,pH 稀>pH 原-n (但始终不能小于或等于7)说明:1、常温下不论任何溶液,稀释时pH 均是向7靠近(即向中性靠近);任何溶液无限稀释后pH 均为7。
化学课件(通用版)专题20强酸(碱)与弱酸(碱)的比较

同倍数前后的pH变化
HA为弱酸
(5)测等体积、等pH的HA溶液与盐酸
分别与足量Zn反应产生H2的快慢及H2 的量
若HA溶液与Zn反应过程中产生H2较快 且最终生成H2的量较多,则HA为弱酸
(6)测等体积、等pH的HA溶液和盐酸 溶液中和等浓度NaOH溶液所消耗的 NaOH溶液的体积
若HA溶液消耗NaOH溶液体积较大, 则HA为弱酸
(7)测升高温度后HA溶液pH的变化 若溶液的pH明显减小,则HA为弱酸
【专题精练】 1.下列事实中不能证明CH3COOH是弱电解质的是( ) A.常温下某CH3COONa溶液的pH=8 B.常温下0.1 mol·L-1CH3COOH溶液的pH= C.向CH3COOH溶液中加入少量CH3COONa固体,溶解后溶液的pH 变大 D.0.1 mol·L-1的乙酸溶液与同体积0.1 mol·L-1的氢氧化钠溶液恰 好反应
3.相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液② 分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示 意图正确的是( )
答案:C
4.常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积 的n倍,稀释过程中,两溶液pH的变化如图所示。下列叙述正确的是 ()
答案:B
答案:D
A.HA是强酸 B.a~b段,HA电离放热,使溶液温度升高 C.c~d段,c(H+)增大,HA电离程度增大 D.c点时,加入等体积、等浓度的NaOH溶液,则c(Na+)=c(A-)+ c(HA)
B.用一定浓度的NaOH溶液分别滴定等体积、等pH的盐酸和次磷酸 溶液,比较消耗碱液的体积
C.加热滴有酚酞试液的NaH2PO2溶液,溶液颜色变深 D.常温下,稀释0.1 mol·L-1次磷酸溶液至原溶液体积的100倍,测 得pH在4~5之间
溶液PH值的计算总结

溶液pH值的计算与规律的探讨溶液pH值问题涉及面广,与生活实际关系密切,内容多而繁杂,是高中阶段学习的重点和难点,尤其是pH值计算更是考试的热点。
因此,探讨pH值的计算方法和技巧,寻找解决问题的关键与规律,对于解决溶液pH问题具有重要意义。
一、单一溶液的pH的计算若是酸性溶液,应先确定c(H+),再进行pH的计算。
若是碱性溶液,应先确定c(OH-),再根据c(H+)·c(OH-)=Kw换算成c(H+), 求pH二、溶液稀释后的pH的计算1、强酸或强碱的稀释在稀释强酸或强碱时,当浓度大于10-5mol/L时,不考虑水的电离如pH=6的盐酸,稀释100倍后,p H≈7(不能大于7);pH=8的NaOH溶液,稀释100倍后,p H≈7(不能小于7);pH=3的盐酸,稀释100倍后,pH=5;pH=10的NaOH溶液,稀释100后,pH=82、弱酸或弱碱的稀释(1) 强酸或强碱的稀释在稀释强酸或强碱时,当它们的浓度大于10-5mol/L时,不考虑水的电离;当它们的浓度小于10-5mol/L时,应考虑水的电离。
如pH=6的盐酸,稀释100倍,稀释后pH≈7(不能大于7);pH=8的氢氧化钠溶液,稀释100倍,稀释后pH≈7(不能小于7);pH=3的盐酸,稀释100倍,稀释后pH=5;pH=10的氢氧化钠溶液,稀释100倍,稀释后pH=8。
(2) 弱酸或弱碱的稀释在稀释弱酸或弱碱过程中既有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其PH范围。
如pH=3的醋酸溶液,稀释100倍,稀释后3<pH<5;pH=10的氨水,稀释100倍,稀释后8<pH<10;pH=3的酸溶液,稀释100倍,稀释后3<pH≤5;pH=10的碱溶液,稀释100倍,稀释后8≤pH<10。
(3) 总结pH=a的强酸与弱酸和pH=b的强碱与弱碱溶液,稀释10-n倍(相同倍数),溶液的PH及其变化情况如何如下表物质pH 稀释后溶液的pH强酸 a pH=a+n弱酸 a a<pH<a+n强碱 b pH=b-n弱碱 b b-n<pH<b如:PH=3的醋酸溶液,稀释100倍,稀释后3<pH<5;PH=10的氨水,稀释100倍,稀释后8<pH<10;(4)溶液稀释后pH变化曲线pH分别相同的强酸与弱酸或强碱与弱碱溶液稀释相同的倍数(10n),对应溶液pH变化曲线如下图所示。
强酸、弱酸常见的七种判断方法
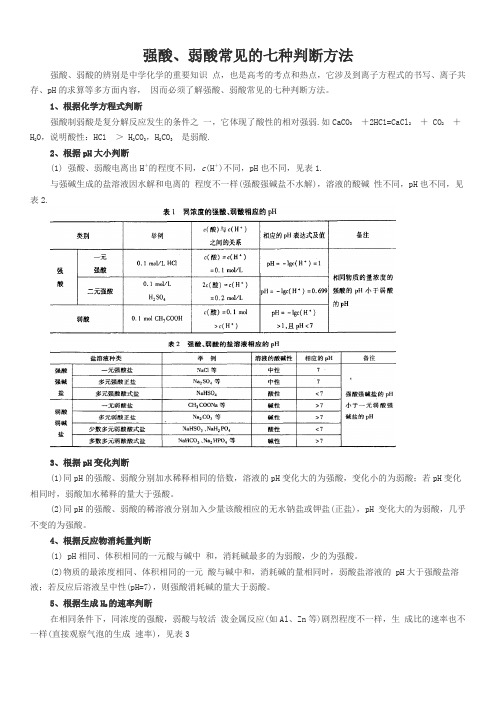
强酸、弱酸常见的七种判断方法强酸、弱酸的辨别是中学化学的重要知识点,也是高考的考点和热点,它涉及到离子方程式的书写、离子共存、pH的求算等多方面内容,因而必须了解强酸、弱酸常见的七种判断方法。
1、根据化学方程式判断强酸制弱酸是复分解反应发生的条件之一,它体现了酸性的相对强弱.如CaCO3+2HC l=CaCl2+ CO2+H2O,说明酸性:HC l> H2CO3,H2CO3是弱酸.2、根据pH大小判断(1) 强酸、弱酸电离出H+的程度不同,c(H+)不同,pH也不同,见表1.与强碱生成的盐溶液因水解和电离的程度不一样(强酸强碱盐不水解),溶液的酸碱性不同,pH也不同,见表2.3、根据pH变化判断(1)同pH的强酸、弱酸分别加水稀释相同的倍数,溶液的pH变化大的为强酸,变化小的为弱酸;若pH变化相同时,弱酸加水稀释的量大于强酸。
(2)同pH的强酸、弱酸的稀溶液分别加入少量该酸相应的无水钠盐或钾盐(正盐),pH 变化大的为弱酸,几乎不变的为强酸。
4、根据反应物消耗量判断(1) pH相同、体积相同的一元酸与碱中和,消耗碱最多的为弱酸,少的为强酸。
(2)物质的最浓度相同、体积相同的一元酸与碱中和,消耗碱的量相同时,弱酸盐溶液的 pH大于强酸盐溶液;若反应后溶液呈中性(pH=7),则强酸消耗碱的量大于弱酸。
5、根据生成H2的速率判断在相同条件下,同浓度的强酸,弱酸与较活泼金属反应(如Al、Zn等)剧烈程度不一样,生成比的速率也不一样(直接观察气泡的生成速率),见表36、根据导电性强弱判断同温度、同物质的量浓度强酸、弱酸溶液,电离出自由移动离子浓度不同(强酸是完全电离,弱酸是部分电离),溶液的导电性也不同,强酸溶液的导电性强于弱酸溶液(可以用电流计测出)。
7、根据中和热大小判断相同条件下,绝大多数弱酸电离时需要吸收大量的热量,因此与强碱中和释放出的热量 (又称中和热)小于强酸(可以用量热计测出)_ 如1 L0. 1 mol/L HC l与CH3COOH稀溶液与同浓度的NaOH溶液中和,测得HC l的中和热所放出的热量为57. 3 KJ/mol,CH3COOH的中和热所放出的热量为56.0 KJ/mol。
证明弱酸的十种方法

证明弱酸的十种方法嘿,朋友们!今天咱们就像福尔摩斯探案一样,来探索证明弱酸的十种超有趣方法。
方法一:pH值不完全“叛逆”。
就像一个有点小脾气但又不敢太放肆的孩子。
如果一种酸,在相同浓度下,它的pH值比强酸要高那么一点点,那它很可能就是弱酸啦。
强酸就像一个火爆脾气的大汉,一下子把氢离子都释放出来,pH值降得很低。
而弱酸呢,扭扭捏捏,氢离子只出来一部分,就像小气鬼只拿出一点糖果,所以pH值没有那么低。
方法二:中和反应“耐力赛”。
想象中和反应是一场长跑比赛。
强酸就像短跑健将,和碱反应那叫一个快,“嗖”的一下就结束了。
而弱酸呢,就像个慢悠悠的小老头,和碱反应的时候,总是不紧不慢的。
因为弱酸不能一次性把氢离子都提供出来,就像小老头不能一下子拿出所有的积蓄,得一点一点来。
方法三:盐溶液的“小脾气”。
弱酸形成的盐溶液可有趣了。
这就好比一个被妈妈管着的孩子,一旦妈妈不在(酸根离子水解的时候),就开始“调皮”了。
弱酸根离子会结合水中的氢离子,让溶液显示碱性,就像孩子偷偷做自己想做的事。
而强酸形成的盐就比较“老实”,溶液基本呈中性。
方法四:稀释的“假把式”。
强酸稀释的时候,pH值那是规规矩矩按照公式来,直线下降。
弱酸可就不一样了,它就像一个爱耍小聪明的魔术师。
稀释的时候,pH值开始上升得很慢,就像魔术师故意放慢动作,因为它还在不断地电离出氢离子,想保持自己的“酸性尊严”。
方法五:导电性的“小秘密”。
如果把溶液的导电性看成是一群小电灯泡亮起来的程度。
强酸溶液就像连接了大电源,灯泡亮得很耀眼,因为它有大量的离子。
弱酸溶液呢,就像连接了一个小电池,灯泡有点昏暗,因为它电离出的离子比较少,就像小电池电量不足一样。
方法六:与金属反应的“小磨蹭”。
强酸和金属反应那是“干柴烈火”,反应速度超快。
弱酸和金属反应就像两个陌生人慢慢熟悉的过程,速度比较慢。
就像一个慢性子的人去交朋友,总是不慌不忙的,因为弱酸电离出氢离子的速度慢,所以和金属的反应也就慢腾腾的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
⑷向同体积同物质的量浓度的两溶液加同浓度的
加水量 NaOH溶液中和至pH=7,消耗NaOH溶液体积多
的是弱_____酸
等物质的量浓度是指溶质的物质的浓度相等,
应与离子物质的量浓度相等区别开
pH
7 d ·
·e
A B
加水量
结论1:同物质的量浓度的强酸弱酸溶液 加水稀释时,pH大是__强___酸
结论2:同体积同物质的量浓度的强酸弱 酸溶液含溶质量相等,完全中和时耗碱 量相等。中和至pH=7时,弱酸耗碱量少。
pH
7 d ·
·e
左图表示的是同体积等物质的量浓度的强酸弱酸
溶液加水稀释时,溶液pH的变化曲线。试回答下
A
列问题: ⑴图中代表强酸稀释的曲线是__B______
B ⑵将两溶液稀释至相同倍数时,pH大的是_弱____酸
⑶向同体积同物质的量浓度的两溶液加同浓度的
NaOH溶液完全中和,消耗NaOH溶液体积_相__同__。
pH
7a · ·b ·c
A B
结论1:同pH的强酸弱酸溶液加水稀释时, 强酸的pH变化大,弱酸的pH变化小
结论2:同pH的强酸弱酸溶液加水稀释至 相同倍数时,弱酸的pH大;将两溶液稀释 至相同pH时,弱酸的稀释倍数大
加水量
结论3:同pH的强酸弱酸溶液,弱酸的物 质的量远大于强酸物质的量,完全中和时 消耗碱多
结论3:同pH的强酸弱酸溶液,弱酸的 物质的量远大于强酸物质的量,完全中 和时消耗碱多
pH
7a · ·b ·c
A B
加水量
左图表示的是同体积同__浓__度__的强酸弱酸溶液加 水稀释时,溶液pH的变化曲线。试回答下列问题: ⑴图中代表强酸稀释的曲线是__A______(填“A” 或“B”) ⑵将两溶液稀释至相同倍数时,pH大的是_强_____ 酸
⑶将两溶液稀释至相同pH时,稀释倍数大的是 _弱_____酸 ⑷向同体积同pH的两溶液加同浓度的NaOH溶液 完全中和,消耗NaOH溶液体积多的是_弱____酸 ⑸向同体积同pH的两溶液加同浓度的NaOH溶液 中和至pH=7,消耗NaOH溶液体积多的是_弱____ 酸
