交流电桥法测电解质溶液的电导
溶液电导的测定及其应用(1)

溶液电导的测定及其应用一、实验目的1.了解溶液电导的基本概念。
2.学会电导率仪的使用方法。
3.掌握溶液电导的测定及应用。
二、预习要求掌握溶液电导测定中各量之间的关系,学习电导率仪、恒温槽的使用方法。
三、实验原理1.弱电解质电离常数的测定AB型弱电解质在溶液中电离达到平衡时,电离平衡常数K C与原始浓度C 和电离度α有以下关系:(1)在一定温度下K C是常数,因此可以通过测定AB型弱电解质在不同浓度时的α代入(1)式求出K C。
醋酸溶液的电离度可用电导法来测定,图1是用来测定溶液电导的电导池。
图1 电导池将电解质溶液放入电导池内,溶液电导(G)的大小与两电极之间的距离(l)成反比,与电极的面积(A)成正比:(2)式中,为电导池常数,以K cell表示;κ为电导率。
其物理意义:在两平行而相距1m,面积均为1m2的两电极间,电解质溶液的电导称为该溶液的电导率,其单位以SI制表示为S·m-1(c·g·s制表示为S·cm-1)。
由于电极的l和A不易精确测量,因此在实验中是用一种已知电导率值的溶液先求出电导池常数K cell,然后把欲测溶液放入该电导池测出其电导值,再根据(2)式求出其电导率。
但是电解质溶液电导率不仅与溶液性质有关,还与其浓度有关,它不能确切的反映溶液的导电性,所以为确切的反映溶液的导电能力,又引入了摩尔电导率。
溶液的摩尔电导率是指把含有1mol电解质的溶液置于相距为1m的两平行板电极之间的电导。
以Λm表示,其单位以SI单位制表示为S·m2·mol-1(以c·g·s 单位制表示为S·cm2·mol-1)。
摩尔电导率与电导率的关系:(3)式中,C为该溶液的浓度,其单位以SI单位制表示为mol·m-3,Λm单位为S · m2·mol-1。
对于弱电解质溶液来说,可以认为:(4)是溶液在无限稀释时的摩尔电导率。
电解质溶液的电导率测定方法

电解质溶液的电导率测定方法
引言
电解质溶液的电导率测定是一个重要的实验方法,用于评估电解质的导电性能。
本文将介绍一种常见的电导率测定方法,供参考之用。
实验原理
电解质溶液的电导率是指单位体积内的电导率值,用于衡量电流通过电解质溶液时的导电能力。
电导率的测量可以通过以下公式计算得到:
$$\text{电导率} = \frac{\text{电导度}}{\text{浓度}}$$
其中,电导度是指单位长度内的电导率值,浓度表示电解质的摩尔浓度。
实验步骤
1. 准备电导仪和电解质溶液。
2. 将电解质溶液注入电导仪中,保持溶液温度恒定。
3. 将电导仪的电极插入溶液中,并确保两电极不相互接触。
4. 打开电导仪并进行校准,使仪器读数归零。
5. 测量电导仪的读数,记录下电导度值。
6. 根据溶液的浓度,计算出电解质溶液的电导率值。
注意事项
1. 在进行实验前,要确保电导仪的电极清洁,并校准仪器准确读数。
2. 实验时应保持电解质溶液的温度稳定,避免温度变化对测量结果造成影响。
3. 在进行实验时要注意避免电极之间相互接触,以避免影响测量结果的准确性。
结论
电解质溶液的电导率测定方法是一种简单有效的方法,可用于评估电解质的导电性能。
通过测量电导度值,并计算出电解质溶液的电导率,可以得到电解质溶液的导电能力的定量指标。
该方法可以广泛应用于电解质溶液的研究和实验中。
参考文献
[1] 张三, 李四. 电解质溶液的电导率测定方法研究. 化学实验, 20XX, 10(2): 100-110.。
交流电桥法测定电解质溶液的电导
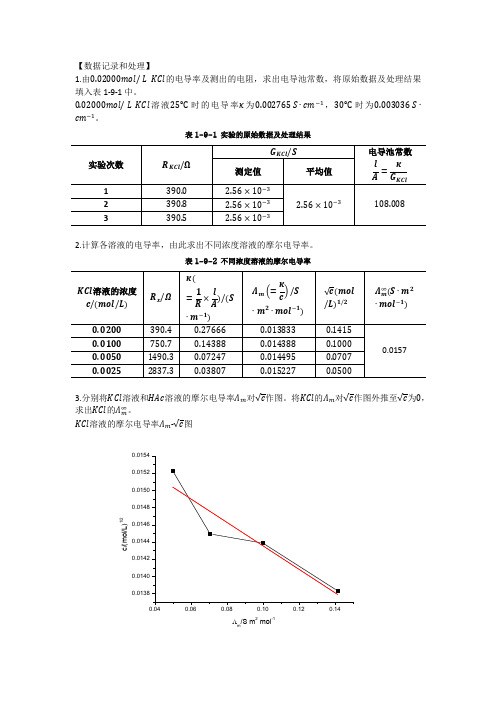
【数据记录和处理】1.由0.02000mol/ L KCl 的电导率及测出的电阻,求出电导池常数,将原始数据及处理结果填入表1-9-1中。
0.02000mol/ L KCl 溶液25℃ 时的电导率κ为0.002765 S ∙cm −1,30℃ 时为0.003036 S ∙cm −1。
表1-9-1 实验的原始数据及处理结果2.计算各溶液的电导率,由此求出不同浓度溶液的摩尔电导率。
表1-9-2 不同浓度溶液的摩尔电导率3.分别将KCl 溶液和HAc 溶液的摩尔电导率Λm 对√c 作图。
将KCl 的Λm 对√c 作图外推至√c 为0,求出KCl 的Λm ∞。
KCl 溶液的摩尔电导率Λm -√c 图c /(m o l /L )1/2m /S m 2mol-1HAc 溶液的摩尔电导率Λm -√c 图c /(m o l /L )1/2m /S m 2mol-14.求出KCl 溶液的摩尔电导率与浓度的关系式Λm =Λm ∞−β√c 由图得,Λm ∞=0.01439 β=0.01295故得出摩尔电导率与浓度的关系式为Λm =0.01439−0.01295√c5.根据所测数据计算HAc 溶液在所测浓度下的电离度和电离常数,并求电离常数的平均值。
表1-9-3 HAc 溶液在所测浓度下的电离度、电离常数以及电离常数的平均值已知:λm ∞(H +)=[349.82+0.0139(t −25)]×10−4S ∙m 2∙mol −1λm ∞(Ac +)=[40.9+0.02(t −25)]×10−4S ∙m 2∙mol −1算出λm ∞(HAc )=(349.82+40.9)×10−4−0.0147=0.024372 S ∙m 2∙mol −1。
电解质溶液的电导率与电流强度的关系

电导率是衡量电解 质溶液导电能力的 物理量
欧姆定律适用于电 解质溶液的导电过 程
公 式 : I = K * S *A 意义:电流强度I与电导率K、截面积A成正比,与距离S成反比 影响因素:电解质溶液的种类、浓度、温度等 应用:用于测量电解质溶液的电导率,研究其物理化学性质
浓度越高,电导率越大,电流 强度也越大
核能发电:在核能发电中,电导率与电流 强度的关系可用于控制反应堆的核反应, 确保核能的安全和稳定利用。
电导率与电流强 度关系可用于监 测水体污染情况, 评估水质。
通过电导率与电 流强度的变化, 可实时监测工业 废水处理效果, 优化处理工艺。
在土壤污染治理 中,电导率与电 流强度的关系可 用于指导土壤电 解修复技术,提 高修复效率。
生物医学领域:通过研究生物体内电 解质溶液的电导率与电流强度的关系, 深入了解生物电现象,为生物医学研 究提供新的思路和方法。
汇报人:XX
交流电桥法:利用交流电桥测量电解质溶液的阻抗,通过计算得到电导率
恒流电源法:通过恒流电源向电解质溶液施加恒定电流,测量相应的电压降,计算得到 电导率
电导率仪直接测量法:利用专用的电导率仪直接测量电解质溶液的电导率,操作简便, 精度高
PART THREE
电流强度与电导率 成正比
电压一定时,电导 率越大,电流强度 越大
随着浓度的降低,电导率减小, 电流强度也减小
当浓度达到一定值时,电导率 与电流强度呈线性关系
不同电解质溶液的电导率和电 流强度关系存在差异
PART FOUR
电解质种类:不 同电解质具有不 同的电导率,对 电流强度的影响 也不同
电解质浓度:浓 度越高,电导率 越大,电流强度 也越大
应用场景:在电 解、电镀、电导 率传感器等领域 具有重要应用
交流电桥法测定电解质溶液的电导

弱电解质的电离度与摩尔电导的关系为:
Λm α= ∞ Λm
电离平衡常数与摩尔电导的关系随电解质类型不 同而异,对1-1型电解质如HAc的电离平衡为: HAc= H++ Ac– 电离平衡常数为:
AC k c = 1 − a = Am ( A − Am ) ∞
α c
2
2 m ∞ m
• 四臂交流电桥线路原 理如图1,交流电桥 的测量原理与直流电 桥相仿,当电桥平衡 时各臂的阻抗之间有 一定的关系:
实验步骤
1 水浴恒温25oC(为什么?), 按照图2连接线路,将R1和R2
调节为等值,调节音频信号发生器的输出为1000赫。 2 将 0.1000mol/L HAc 溶 液 分 别 稀 释 为 0.0500mol/L 、 0.0250mol/L、0.0125mol/L和0.00625mol/L. 3. 将电导池中盛的液体倒出,用0.1000mol/L 的 KCl溶液洗 涤三次,然后盛入该溶液并使液面略高出电极,将电导 池浸入恒温槽中,并使电导池液面在恒温水下,恒温10~ 15 min,将电导池的引线接入电桥。
2.结合本实验结果,分析当HAc浓度变稀时,Rx 、к、∧m、α、Kc等怎样随浓度变化?你的实 验结果与理论是否相符合?为什么?
三次测量结果的相对标准偏差S=0.52%
注意事项
为了得到精确的结果,必须用电导水;测定前,必须将 电导电极及电导池洗涤干净,以免影响测定结果。 实验中温度要恒定,测量必须在同一温度下进行,恒温槽 的温度要控制在25.0 ℃±0.1 ℃。
思考题
1.测定溶液的电导为什么要用交流电桥?能否用 直流电桥?
1 A = k G = k L K Cell
摩尔电导的定义:在相距1m的两平行电极间,放入1 mol 的电解质溶液所呈现的电导,称为摩尔电导Λm。摩 尔电导Λm与电导率k的关系为:
交流电桥法测溶液电导率

用交流电桥法测定测Nacl溶液电导率[实验目的]测不同浓度下的Nacl溶液电导率[实验原理]电解质溶液正像金属导体一样遵循欧姆定律。
因此,通过给定的溶液本体的电流i与电位差E成正比,E/i=R,式中R是溶液本体的电阻。
电导L被定义为电阻的倒数。
L=1/R (1)其单位为oh m/s。
横截面积均匀物体的电导与截面积A成正比,与长度L成反比。
L=(χA)/l或χ=1/R l/A=k/R (2)式中χ是电导率,单位为oh/m/cm。
电导率是电阻率的倒数。
在任意形状和大小的电导池中要测定溶液的电导率,首先要用该电导池测量一已知电导率溶液的电阻确定其电导池常数k(l/A的“有效”值)。
0.02000N KCl可用来作这种校准的标准液,它在25℃下的χ等于0.002768oh/m/cm 。
一旦求出了电导池常数,即可用式χ=k/R从实验测出的电阻计算电阻率。
[实验仪器及仪器介绍]UJ31型电位差计(1台)信号发生器(1台,供给高频交流电)精密插塞式电阻箱或十进电阻箱(1个)十进微调电容器(1个)25℃恒温槽(1套)示波器(一台,检流)恒温槽中安装电导池的支架导线,100mL容量瓶,25mL移液管100ml或250ml烧瓶2个,125ml锥形瓶2个,储存电导水的500ml玻璃塞烧瓶。
电导水,0.02000mol·dm-3标准KCl溶液(若没有则自己配制,具体看实验步骤)充以电导水并盖上清洁的橡皮淀帚的电导池[实验线路]装满离子溶液的电导池电阻,可用高频交流的惠斯通电桥加以精确测量,这种方法的电源用信号发生器,而检测器用示波器。
(后附交流惠斯通电桥示意图和平衡条件的讨论)。
为了清晰的观测到明确的平衡点,需要θ1=θ2和θ3=θ4(θi是在第i臂电桥的相漂移)。
桥臂R3和R4是学生型电位差计滑线电阻的两部分,接到该滑线电阻有两套引线—L和H或L'和H'—他们给出的R3/R4分别等于A/(1000-A)或(4500+A)/(5500-A)。
电桥法测定弱电解质的电离常数

实验目的
1.掌握电桥法测量电导的原理,初步掌握数 字电桥的使用方法。
2.测定电解质溶液的电导并计算弱电解质的 电 离常数。
实验重点
通过用交流电桥测定氯化钾和醋酸溶液的 电导,使学生掌握测量电导的原理和方法。
实验原理
醋酸在溶液中电离达到平衡时,其电离平衡常 数Kc与浓度c和电离度a有以下关系
2.关于电导电极的选择问题:一般当交流电 的频率为1000~4000Hz时,溶液电阻的范围 应在100Ω~5×105Ω之间。为此应正确选用 不同数量级的电导池以满足测量要求。
课后作业】
1. 电导池常数(l/A)是否可用卡尺来测量? 若实际过程中电导池常数发生改变,它对平 衡常数有何影响?
2. 测定溶液电导,一般不用直流电,而用交 流电,为什么?
3. 为了防止电极极化,交流电源频率常选在 1000Hz左右,为什么频率不选择更高一些?
Kc
c c0
a2
1 a
a m
m
Kc m m)
它们之间关系:
Gk A l
k Am c kA l GKcelG l
实验原理:
交流电桥法测量原理图
实验注意问题
1.使用一定频率的交流电源的有关问题:使用 交流电源,电源的电压一般不超过10V,频 率一般为1000~4000Hz 。
物理化学复习

• 3.研究电解质溶液离子平均活度系数的意 研究电解质溶液离子平均活度系数的意 义和重要性何在? 义和重要性何在 非电解质溶液的活度系 数能用该公式计算吗? 数能用该公式计算吗? • 答:因在溶液中阴、阳离子是相伴存在, 因在溶液中阴、阳离子是相伴存在, 不能单独测出单种离子的化学势、 不能单独测出单种离子的化学势、活度 和活度系数,有了平均活度系数的概念, 和活度系数,有了平均活度系数的概念, 便可计算整个强电解质的化学势与活度。 便可计算整个强电解质的化学势与活度。 若将γ 用于非电解质, 若将 ±ν=γ+ν++γ-ν- 用于非电解质,则ν+, ν- 均为零,则γ±=1。故非电解质活度系 均为零, 。 数不能用该式求出, 数不能用该式求出,但可用依数性方法 算出。 算出。
• 4.恒温下,电解质溶液的浓度增大 4.恒温下 恒温下, 其电导率增大, 时,其电导率增大,摩尔电导率减 小。( × ) 5.某电解质处于离子强度相同的不同 5.某电解质处于离子强度相同的不同 溶液中, 溶液中,该电解质在各溶液中的浓 度不一样, 度不一样,但是离子的平均活度系 数相同。( 数相同。( √ )
问答题
• 2.为什么用交流电桥测定溶液的电导? 2.为什么用交流电桥测定溶液的电导 为什么用交流电桥测定溶液的电导? 为什么用1000Hz( c/s,周每秒) 1000Hz(即 为什么用1000Hz(即c/s,周每秒)频率测 定溶液的电导? 定溶液的电导? 为什么在未知电阻的线 路上并联一电容? 路上并联一电容? 测准溶液电导的关键 是什么? 是什么? • 答:用交流电流测溶液的电导,可以避免 用交流电流测溶液的电导, 电解作用而改变电极本性, 电解作用而改变电极本性,并且可以消除 电极的极化作用。 电极的极化作用。 • 1000Hz的交流频率可防止电极上的 用1000Hz的交流频率可防止电极上的 极化作用,并可用耳机检零。 极化作用,并可用耳机检零。并联电容是 为了消除电导池的电容的影响。 为了消除电导池的电容的影响。测准电导 的关键是在各接触点均接触的条件下, 的关键是在各接触点均接触的条件下,电 桥平衡,正确检零。 桥平衡,正确检零。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
数据处理:
C HAc =0.1221mol*L -1 K cell =κKCl /G KCl =103.3039m -1 α=Λm /Λm ∞ Λm ∞(HAc ,25℃)=390.71E-4 S*m 2*mol -1
Kc=α2c/(1-α)=Λm 2C/(Λm ∞(Λm ∞-Λm ))
Kc=1.8061E-05 理论Kc=1.75E-5 相对误差Er=3.21%
思考题:
1. 为什么要测定电导常数?
如果电导池二极间的距离刚好为1cm3,则不必测电导池常数,但这样的电导池制作是十分困难的。
测这类仪器常数,是实验通常用来从已知量测未知量的有效手段。
电导常数不能通过其定义L/A 计算(精度太低),要用已知浓度和电导率的KCl 溶液,通过实验求算。
2. 弱电解质的无限稀摩尔电导率如何求得?
弱电解质溶液稀释至0.005mol*dm -3时,摩尔电导率Λm 与
C 1/2仍然不成直线关系。
并且极稀得溶液中,浓度稍微改变一点,Λm 的值可能变动很大,即实验上的少许误差对外推求得Λm
∞的值影响很大。
用实验所得数据Λm 与C 1/2关系的图,是一条曲线,Λm 与
C 1/2没有直线关系,不能用外推法求Λm ∞。
弱电解质的无限稀摩
尔电导率可以用Kohlrausch 的离子独立移动定律通过强电解质
的Λm ∞求得。
实验讨论:
1. 电导受温度影响较大,温度偏高时其摩尔电导偏高,温度每
升高1度,电导平均增加1.92%,即G t =G 298K [1+0.013(t-25)]。
实验中,更换溶液后电导池中的电介质变了,相应的电容也会有所变化;在每次测定时,都需要重新调节平衡。
2. 电导池常数(K cell )未测准,则导致被测物的电导率(κ)偏离文献值。
溶液电导一经测定,则κ正比于K cell 。
即电导池常数测值偏大,则算得的溶液的电离度、电离常数都偏大。
电导水电导大,测量时相对误差也就越大。
示波器对于电阻较大(如电导水)的溶液,受干扰波的影响较大,影响测定。
3. 如果电桥的电路对地没有漏电,电桥各部分之间也不漏电,并且电桥各支线间没有互感,则平衡时,对臂电抗(阻抗、容抗、感抗)复数乘积相等,由于交流电阻采用双线并绕的无感电阻箱,所以平衡条件就成为:1/(1/R 3+j ωC 3)*R2=1/(1/R x +j ωC x )*R 1 当二电阻箱电阻R 1=R 2时误差最小,可以解得Rx=R 3,Cx=C ,也就是说,精确测量时应在与电容相邻的R3上并联一个与最导池的电容相等的电容C ,达成邻臂电抗的相位角相等。
4. 测电导就是测量电阻的倒数,在测量电解质溶液的电阻时必须用一定频率的交流电,是为了使溶液不至于(趋直流)电解、极化,高频交流电则趋于短路,所用电极也必须是隋性的(光铂电极、铂黑电极),不与溶液发生化学反应。
5. 对于电阻大的溶液,宜用面积大、距离近的电导电极,即电导池常数小的,因为电阻大的溶液电导测值G 小,而G=κ/K cell ,选择K cell 小的,测读的G 值相对大,误差自然减小。
镀铂黑使电极比表面积大,易吸附稀溶液电解质离子,导致溶液浓度改变大,引起测量误差增大,此时宁可用K cell 值虽比铂黑电极大但吸附较少的光铂电极。
所以,铂黑电极还是在测量中等电导的溶液时使用。
KCl 溶液电阻相对而言大,可用K cell 大的电极。
6. 利用阴极发射X 射线的示波管,当纵偏(Y 方向)板加可变电压u y ,横偏板加锯齿波(正比于时间)电压时,得到正弦波,只有当被观察波频率等于锯齿波频率整数倍的时候,扫描的波形才会稳定。
换言之,当周期Tx=2Ty(或fy=2fx)时,得2个正弦波。
7. Kc=1.8061E-05 理论Kc=1.75E-5,实验值偏高的原因可能是通电时间较长,溶液的温度有所上升,溶液电导变大,由Kc=Λm 2C/(Λm ∞(Λm ∞-Λm ))求出的电离平衡常数偏大;或计算式中的HAc 浓度应该用活度,用浓度代替活度计算导致结果偏大等。
8. 纯水的电导率:即使在纯水中也存在着H +和OH -两种离子,水仍是一种很弱的电解质,它存在如下的电离平衡: H 2O←→H ++OH 或2H 2O←→H 3+O+OH - ,其平衡常数:K W =[H +]*[OH -]=10-14,式中K W 称为水的离子积[H +]2=[OH -]2=10-14
[H +]=[OH -]=10-7
Λm ∞(H2O)= Λm ∞(H +)+Λm ∞(OH -)=349.82+198.0=5.4782E4 S*m 2*mol -1
已知水的密度d(25℃,H 2O)=0.9970781g*cm -3 故原有假设为1的水离子浓度只能达到0.99707。
实际上是仅0.99707份额的水离解成0.99707E-7的[H +]和[OH -],那么离解后的[H +]和[OH -]电导率的总和κH2O 用下式求出: κH2O =(C M /1000)* Λm ∞(H2O)=(0.99707E-7/1000)*5.4782E4=5.4622E-6 S*m -1
ρH2O =1/κH2O =0.183M Ω*m
普通蒸馏水的电导率是1.0E-3S*m -1,重蒸馏水(蒸馏水经用KMnO4和KOH 溶液处理以除去CO2及有机杂质,然后在石
Λm C 1/2。
