药物溶液的形成理论
药剂学学习指导与习题集-03药物溶解及溶出与释放

4、研磨法(机械分散法)
将药物与较大比例的载体材料混合后,强力持久 地研磨一定时间,借助机械力降低药物的粒度, 形成固体分散体。
常用的载体材料有微晶纤维素、乳糖、PVP等。
(四)固体分散体的物相鉴定
1.溶解度及溶出速率 2.热分析法 3.X射线衍射法 4.红外光谱法 5.拉曼光谱 6.核磁共振谱法
( pHm)
6.48
lg
4.0102 3.07 104 3.07 104
8.59
计算结果表明,输液的PH值不得低于8.59, 若低于此PH值则磺胺嘧啶将从输液中析出。
例:普鲁卡因在25℃ pKa=9.0,S0=0.5g/100ml, 配制20mg/ml的盐酸普鲁卡因注射液,其PH不应高 于多少?
(三)固体分散体的制备
1、熔融法 2、溶剂法 3、溶剂-熔融法 4、机械分散法
1、熔融法
药物 载体材料
加热 熔融
剧烈搅拌 迅速冷却
骤冷成固体
本法简便、经济,适用于对热稳定的药物,多用于 熔点低、不溶于有机溶剂的载体材料。
也可将熔融物滴入冷凝液中制成滴丸。
2、溶剂法(共沉淀法)
药物 载体材料
4、溶剂化物
药物在结晶过程中,因溶剂分子加入而使结晶 的结构发生改变,得到的结晶称为溶剂化物。 如溶剂是水,则称为水合物。
多数情况下,在水中的溶解度和溶解速度: 水合物 < 无水物 < 有机化物
5.粒子大小的影响
Ostwald-Freundlich方程
药物微粒半径
药物的溶解度
药物的固有常数
计算表明注射液PH值不应高于8.52,同时要考虑 药物的稳定性,因此盐酸普鲁卡因注射液PH应为4.5。
药剂学第二章预习

3.恒温搅拌并考虑药物达到溶解平衡的时间
4.温度:测定取样时要保持温度和测试温度一致并滤除未溶的药物
数份不同程度过饱和溶液
横坐标:药物质量-溶剂体积的比率
纵坐标:测得药物溶液浓度
正偏差:表明在该溶液中药物发生解离,或者杂质成分或溶剂对药物有复合及增溶作用等。
增加溶出速度的方法
固体的粒径和表面积
微粉化增加溶出速度
温度
温度升高,药物的溶解度增大、有利于扩散、粘度降低,从而加快药物的溶出速度
溶出介质的性质
溶出介质的体积
扩散系数
药物在边界层的扩散系数越大,溶出速度越快。
扩散层的厚度
扩散层的厚度与搅拌程度有关,搅拌速度快,扩散层薄,溶出速度快。
第二章药物溶液的形成理论
1.药物的特性溶解度与平衡溶解度的异同。
药物溶解度:一定温度(人体:37℃;存放4-5℃)下药物溶解在一定溶剂中达饱和时溶解的最大药量。表示:100ml溶剂中溶解溶质的最大克数,或mol/L
溶解度
相同点
不同点
溶液测定曲线Fra bibliotek测定曲线的含义
特性溶解度
1.测定条件:一般需要在低温(4-5℃)和体温(37℃)两种条件下进行
1、有机弱酸弱碱药物可制成可溶性盐增加其溶解度。
2、难溶性药物分子中引入亲水基团可增加其在水中的溶解度。
溶剂化作用与水合作用
晶型
将药物制成无定型,即无结晶结构的药物
溶剂化物
粒子大小
对于难溶性药物,在药物微粒小于100nm时,其溶解度与微粒的大小有关,溶解度随微粒径减小而增加。
温度
吸热时,溶解度随温度的升高而升高;放热时,溶解度随温度的升高而下降。
药剂学——液体制剂
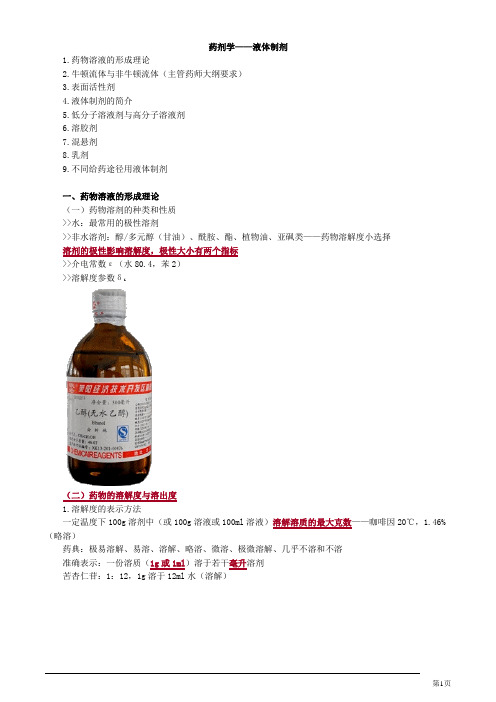
药剂学——液体制剂1.药物溶液的形成理论2.牛顿流体与非牛顿流体(主管药师大纲要求)3.表面活性剂4.液体制剂的简介5.低分子溶液剂与高分子溶液剂6.溶胶剂7.混悬剂8.乳剂9.不同给药途径用液体制剂一、药物溶液的形成理论(一)药物溶剂的种类和性质>>水:最常用的极性溶剂>>非水溶剂:醇/多元醇(甘油)、酰胺、酯、植物油、亚砜类——药物溶解度小选择溶剂的极性影响溶解度,极性大小有两个指标>>介电常数ε(水80.4,苯2)>>溶解度参数δi(二)药物的溶解度与溶出度1.溶解度的表示方法一定温度下100g溶剂中(或100g溶液或100ml溶液)溶解溶质的最大克数——咖啡因20℃,1.46%(略溶)药典:极易溶解、易溶、溶解、略溶、微溶、极微溶解、几乎不溶和不溶准确表示:一份溶质(1g或1ml)溶于若干毫升溶剂苦杏仁苷:1:12,1g溶于12ml水(溶解)溶解度是反映药物溶解性的重要指标前方高能预警!2.溶解度的测定方法(1)新药的特性溶解度药物不含任何杂质,在溶剂中不发生解离或缔合,也不发生相互作用时所形成的饱和溶液的浓度。
假设某药物在0.1mol/ml的NaOH溶解度约为1mg/ml。
实测时配制四种浓度的溶液,即分别将3、6、12、24mg药物溶于3ml溶剂中,装入容器,计算药物质量(mg)与溶剂用量(ml)之比,即药物质量-溶剂体积的比率分别为1、2、4、8。
将配制好的溶液恒温持续振荡达到溶解平衡,测定药物在饱和溶液中的浓度。
以测得药物溶液浓度为纵坐标,药物质量-溶剂体积的比率为横坐标作图,直线外推到比率为零处S0即得药物的特性溶解度。
(2)药物的平衡溶解度取数份药物,配制从不饱和溶液到饱和溶液的系列溶液,置恒温条件下振荡至平衡,经滤膜过滤,取滤液分析。
测定药物在溶液中的实际浓度S,并对配制溶液浓度C作图,曲线的转折点A即为该药物的平衡溶解度。
3.影响药物溶解度的因素药物,溶剂,温度,pH,同离子效应,助溶剂,增溶剂①药物a.极性大小:对溶解度影响很大,相似相溶b.药物晶格:排列紧密,引力大,溶解度小c.药物晶型:无定形>亚稳定型>稳定型d.粒子大小:难溶(0.1-100nm)粒径减小增溶②溶剂:降低药物分子或离子间引力使之溶剂化而溶解;水合作用,潜溶③温度:溶解过程吸热,T↑溶解度↑,反之下降④pH:有机弱酸、弱碱及其盐类⑤第三种物质同离子效应:NaCl可致盐酸小檗碱溶液析出结晶助溶剂:I2+KI——1:2950→1:20增溶剂:表面活性剂4.增加药物溶解度的方法(注意实例)①加入增溶剂:表面活性剂②使用助溶剂:I2+KI、咖啡因+苯甲酸钠,茶碱+乙二胺③应用混合溶剂(潜溶剂):洋地黄毒苷-水+乙醇苯巴比妥-90%乙醇④改变部分化学结构√制成盐类:弱酸、弱碱,如乙酰水杨酸-钙盐√引进与溶剂有较强亲和力的基团:维生素K3-亚硫酸氢钠增溶剂——表面活性剂(请注意,我很重要!)增溶原因:表面活性剂在水中形成“胶束”影响增溶的因素①增溶剂的种类②增溶剂的用量③药物的性质④加入顺序(药物和增溶剂混合后,再加水稀释)5.药物溶出速度的表示方法①单位时间:药物溶解进入溶液主体的量②两个阶段:表面溶解、扩散对流③固体药物:溶出受扩散控制Noyes-Whitney方程dC/dt:溶出速度C:t时间溶液中溶质的浓度K:溶出速度常数 S:固体的表面积C S:溶质在溶出介质中的溶解度6.影响药物溶出速度的因素(增加溶出速度的方法)①固体的表面积:粒径小,孔隙率高,表面积大;加润湿剂——增加溶出界面②温度(T)③溶出介质的体积(V)④扩散系数(D)⑤扩散层的厚度(h):加强搅拌QIAN溶出速度影响因素蔗糖粉细孔又多温度升高多加水考虑系数勤搅拌溶出速度能加快随堂练习A1型题:苯巴比妥在90%的乙醇溶液中溶解度最大,则90%的乙醇溶液是A.非极性溶剂B.潜溶剂C.助溶剂D.消毒剂E.增溶剂『正确答案』B『答案解析』90%的乙醇溶液为混合溶剂做潜溶剂。
最新药剂学-第二章药物溶液形成理论资料

第二章药物溶液形成理论习题部分一、概念与名词解释1.介电常数:2.助溶剂:3.增溶剂:二、判断题(正确的填A,错误的填B)1.药物的介电常数和溶剂的介电常数越接近,药物在该溶剂中溶解性越好。
( ) 2.正辛醇的溶解度参数与生物膜脂质接近,因此常用作模拟生物膜测定分配系数。
( )3.通常所测定的溶解度是药物的特性溶解度。
( )6.将维生素K3制备成维生素K3,亚硫酸氢钠的目的是改变维生素K3的药理作用。
( ) 7.在多数情况下,药物的溶解度和溶解速度的顺序为无水物<水合物<有机化物。
( ) 8.粒子大小对药物溶解度的影响的规律是:药物粒子越小,药物的溶解度越大。
( ) 9.温度升高,药物的溶解度增大。
( )10.许多盐酸盐类药物在生理盐水中溶解度减小的原因是由于同离子效应。
( )11.苯巴比妥在20%乙醇中的溶解度为0.22g/100ml,在40%乙醇中的溶解度为0.88g/100ml,在90%乙醇中溶解度达最大值,这种现象称为潜溶。
( )12.碘溶解时加入碘化钾的目的是增溶。
( )13.灰黄霉素溶解时加人胆酸钠的目的是增溶。
( )14.药物溶液的pH值的调节主要考虑机体的耐受性、药物的稳定性及药物的溶解度。
( )15.药物的pK a越大,碱性越强。
( )16.同一药物的多晶型中,亚稳定型比稳定型的溶出速率与溶解度均大。
( )17.药物溶解度参数与生物膜的溶解度参数越接近,越易吸收,吸收也越快。
( ) 18.药物分子间的作用力大于药物分子与溶剂分子间的作用力则药物溶解度小。
( ) 19.介电常数大的药物其极性小,介电常数小的药物极性大。
( )20.对于可溶性药物,粒子大小对溶解度影响不大。
( )三、填空题1.药物分子间的作用力大于药物分子与溶剂分子间作用力时药物在该溶剂中的溶解度,反之,则。
2.药物分子形成分子内氢键,则在极性溶剂中的溶解度;而在非极性溶剂中的溶解度。
3.当药物的△H S>0,溶解度随温度升高而,当药物的△H S<0,溶解度随温度升高而。
药剂2 22章

药剂2 22章药剂2-22章------第二章药物溶液的形成理论――1,水:最常用极性溶剂化学性质平衡存有较好的生理相容性稀释慢。
――2,非水溶剂:药物在水中容易水溶性或不平衡时用。
――3,常用的非水溶剂主要有:1醇与多元醇类―能与水混溶2醚类―能与乙醇、丙二醇和甘油混溶3酰胺类―能与水和乙醇混溶4酯类5植物油类6烃类7亚砜类―能与水和乙醇混溶。
――4,药用溶剂的性质:溶剂的极性大小常以介电常数和溶解度参数的大小来衡量――5,介电常数:指将恰好相反电荷在溶液中分离的能力,充分反映溶剂分子的极性大小。
介电常数小溶剂极性小。
――6,物质的溶解性与溶剂介电常数:水80―无机盐有机盐、二醇类50―糖鞣质、甲醇乙醇―蓖麻油蜡、醇酮氧化物高级醇20―树脂挥发油弱电解质、乙烷苯四氯化碳乙醚5―脂肪石蜡烃类汽油、矿物油植物油0(极性递减)(水溶性递减)。
――7,溶解度参数:系指同种分子间的内聚力,也就是则表示分子极性大小的一种量度。
溶解度参数越大,极性越大。
――8,正辛醇模拟生物膜相测定分配系数的溶剂:药物在体内转运过程中,药物分子能溶于生物膜极为重要,但生物膜不是简单的溶剂。
因此,简单的溶液理论并不适用于体内。
生物膜脂层的溶解度参数的平均值为17.80+-2.11与正丁烷的和环己烷的溶解度参数接近。
整个膜的平均值为21.07+-0.82,很接近正辛醇的因此正辛醇常作为模拟生物膜相测定分配系数的溶剂――9,溶解度;系指在一定温度(气体在一定压力)下,在一定量溶剂中超过饱和状态时熔化的最小药量,就是充分反映药物溶解性的关键指标。
常用一定温度之下100g溶剂中或100ml溶液中熔化溶质的最小克数去则表示。
――10,药物的特性溶解度;药物不含任何杂质,在溶剂中不发生解离和缔合,也不发生相互作用时所形成的饱和溶液的浓度。
(在测定数份不同程度过饱和溶液,测定药物在饱和溶液中的浓度)------11,药物的均衡溶解度(又称表观溶解度)测药物实际浓度s,对溶液浓度c作图,图中曲线转折点a,即为为均衡溶解度)――12,影响药物溶解度的因素:1.药物的分子结构:相似相溶、药物分子与溶剂分子间氢键―极性溶剂中的溶解度增大;药物分子形成分子内氢键―极性溶剂中溶解度减小,非极性溶剂中溶解度增大;有机弱酸弱碱药物制成可溶性盐,难溶性药物分子中引入亲水集团溶解度增加2,溶剂化作用与水合作用;药物离子的水合作用与药物离子性质有关,阳离子和水之间的作用力强以至于阳离子周围保持有一层水。
1.药物溶液的形成理论介绍

一、药用溶剂的种类
非水溶剂: 醇与多元醇:乙醇、丙二醇、甘油、PEG-200 PEG400、PEG600、丁醇、苯丙醇等,能与水 混溶。 醚类:四氢糠醛聚乙二醇醚、二乙二醇二甲基 醚等,能与乙醇、丙二醇和甘油混溶。 酰胺类:二甲基甲酰胺(DMF)、二甲基乙酰 胺等(DMAC),能与水和乙醇混溶。 (第二类溶剂)
第二篇 药物制剂的基本理论 (物理药剂学)
药物溶液的形成理论 表面活性剂 微粒分散体系 药物制剂的稳定性 粉体学基础 流变学基础 药物制剂的设计
第二章 药物溶液的形成理论
2
药物溶液
溶剂:种类、性质 溶质(药物):溶解度、影响溶解度因素、增 加溶解度方法、溶出度 溶液:渗透压、pH值、解离常数、表面张力、 粘度等
3
应用
1.液体制剂:注射剂 外用:洗剂、搽剂、滴耳剂等 内服:合剂、芳香水剂等 冻干粉针复溶 2.半固体制剂:基质配制 3.固体制剂:溶液配制 溶出
4
第一节 药用溶剂的种类和性质
一、药用溶剂的种类
二、药用溶剂的性质
5
一、药用溶剂的种类
水: 理化性质稳定,生理相容性好 制药用水: 纯化水 注射用水 无菌注射用水
34
3、溶剂化物
药物在结晶过程中,溶剂分子进入晶格使晶型 发生改变,形成溶剂化物(solvate). 如溶剂为水,即为水合物。
药物的溶解度和溶出速率以有机溶剂化物 最高、无水物次之,而水合物最低。
有机化物>无水物>水合物
35
36
4、晶型的影响
37
药剂学重点总结
第一章绪论1. 药剂学的概念: 是将原料药制备成用于治疗,诊断,预防疾病所需的制剂的一门学科2.药物剂型(Dosage form)(简称“剂型” )适合于疾病的诊断、治疗或预防的需要而制备的不同给药形式。
第二章药物溶液的形成理论1. 影响药物溶解度的因素药物极性溶剂:药物分子的溶剂化作用与水合作用,有机溶剂化物>无水物>水合物药物的多晶型:无定型>亚稳型>稳定型,温度,pH,同离子效应粒子大小(公式:因此我们减小粒径来增大难容性药物溶解度,如微粉化),混合溶剂a 助溶剂hydrotropy :难溶性药物与加入的第三种物质在溶剂中形成可溶性分子间的络合物、复盐或缔合物等,以增加药物在溶剂中的溶解度。
这第三种物质称为助溶剂。
①有机酸及其钠盐:苯甲酸钠、水杨酸钠等②酰胺类化合物:乌拉坦、尿素、乙酰胺等。
b 增溶剂solubilization: 难溶性药物在表面活性剂的作用下,在溶剂中溶解度增大并形成澄清溶液的过程。
具有增溶能力的表面活性剂称增溶剂, 被增溶的物质称为增溶质。
c 潜溶剂cosolvent: 在混合溶剂中各溶剂在某一比例时,药物的溶解度比在各单纯溶剂中的溶解度大,而且出现极大值,这种现象称为潜溶,这种溶剂称为潜溶剂。
如乙醇、丙二醇。
3. 等张溶液istonic solution :是指溶液的张力与红细胞的张力相等,也就是药物溶液与细胞接触时使细胞功能和结构保持正常,红细胞在该溶液中不发生溶血。
4. 等渗溶液:系指渗透压与血浆渗透压相等的溶液。
5. 增加难溶性药物溶解度的方法:制成可溶性盐、引入亲水基团、加入潜溶剂、加入助溶剂、加入增溶剂6 药物溶出速度方程Noyes-Wh 方程:dC/dt= KS(CS-C)=DS/Vh(CS-C)dC/dt ——溶出速度;K ——溶出速度常数; S ——固体的表面积;Cs——溶质在溶出介质中的溶解度;C——t 时间溶液中溶质的浓度。
D——溶质在溶出介质中扩散系数;V——溶出介质体积;h——扩散层的厚度。
药物溶液的形成理论
2020/11/18
药物溶液的形成理论
Contents
•1 •药用溶剂的性质 •2 •药物的溶解度
•目录 •3 •药物的溶出速度 •4 •药物溶液的pH与pKa值测
•5 •药物定溶液的表面张力
药物溶液的形成理论
药用溶剂的性质
l 药用溶剂与药物的性质均影响到药物在溶剂中的溶解 性能,溶剂的极性直接影响药物的溶解度。溶剂极性 的大小常用介电常数和溶解度参数来表示.
•式中,Ksp——盐的溶度积。
药物溶液的形成理论
• 如果与解离型浓度相比,非解离型的浓度小到 可以忽略不计,则该药物的溶解度St随着[Cl-]的增 加而减少,此时表观溶度积为:
• 除以上因素外,尚与离子强度、温度及水性介质 的组成有关。 • 一般向难溶性盐类饱和溶液中,加入含有相同离 子化合物时,其溶解度降低,这是由于同离子效应的影 响。如许多盐酸盐类药物在0.9%氯化钠溶液中的溶解度 比在水中低。
药物溶液的形成理论
l 特性溶解度的测定是根据相溶原理图来确定的.在 测定数份不同程度过饱和溶液的情况下,将配制好 的溶液恒温持续振荡达到溶解平衡,离心或过滤后, 取上清夜并做适当稀释,测定药物在饱和溶液中的 浓度.
l 以测得药物溶液浓度为纵坐标,药物质量-容积体积 比率为横坐标作图,直线外推到比率为零处即得药 物的特性溶解度,
•
• 计算结果表明,输液的pH值不得低于8.59,若低 于此pH值则磺胺嘧啶将从输液中析出。
药物溶液的形成理论
• 对于弱碱性药物,若已知pKa和S0,由下式即可计 算弱碱在任何pH值的溶解度。此时也表明溶液的pH值高 于计算值时弱碱即游离析出,即为弱碱溶解时的最高pH 值。
•或
药物溶液的形成理论
药剂学6版
注射用水
无菌注射用水
●性质稳定 ●生理相容性 ●使用安全 ●成本低
水能溶解大多数无机盐类和极性大的有机药物及药材中
的有效成分;有些药物水中不稳定,降解、霉变等。
▢氨基酸口服液
▢氨基酸注射液
★利巴韦林口服溶液
★利巴韦林滴眼液
★ 利巴韦林滴鼻液
复方氨基酸注射液
羟喜树碱注射液
非水溶剂
▤ 醇及多元醇类
内就地查封、扣押。
▤广东省药检所反复检验和验证 ●齐二药生产的亮菌甲素注射液含有了该药中不应该含
有的二甘醇
▤含有“二甘醇”的亮菌甲素注射液--直接导致病人肾功
能急性衰竭
●二甘醇在体内氧化成草酸而引起肾脏损害
▢江苏省泰兴市不法商人王桂平以中国地质矿业总公司泰兴化工总厂的名义, 伪造药品生产许可证等证件,于2005年10月将工业原料二甘醇假冒药用辅 料丙二醇,出售给齐二药。 ▢齐二药采购员钮忠仁违规购入假冒丙二醇 ▢化验室主任陈桂芬等人严重违反操作规程,未将检测图谱与“药用标准丙二 醇图谱”进行对比鉴别,并在发现检验样品“相对密度值”与标准严重不符 的情况下,将其改为正常值,签发合格证。 ▢假药用辅料投入生产,制造出假药“亮菌甲素注射液”并投放市场。 ▢广州中山三院和广东龙川县中医院使用此假药后,11名患者出现急性肾功能 衰竭并死亡。
处货值金额5倍罚款1682万元,罚没款合计1920万元; 吊销其《药品生产许可证》,撤销其129个药品批准文
号。收回GMP认证证书。
▤齐二药原总经理等10人被公安机关立案侦查
一批药品监管及工商行政管理部门负责人受到行政处分
二.药用溶剂的性质 溶剂的极性直接影响药物的溶解度。 溶剂极性的大小以介电常数和溶解度参数衡量。 (一)介电常数 溶剂介电常数表示将相反电荷在溶液中分开的能力
药剂学-第三章-药物溶解与溶出及释放
一些溶剂的介电常数(20℃)
溶剂 H2SO4 HCONH2 H2 O HCOOH H2NNH2 HCON(CH3)
2 CH3 OH
介电常数 110 109 80.4 57.9 53.0 37.6 33.6
溶剂 C4H9OH C 5 H5 N ClCH2CH2Cl CH3COOH C6H5Cl CHCl3 C 6 H6
3.多晶型的影响
• 晶型不同,导致晶格能不同,药物的熔点、溶解速度、 溶解度等也不同。 • 无定型的溶解度和溶解速度比结晶型的大。
4.溶剂化物
• 在多数情况下,溶解度和溶解速度按水合物<无水物< 有机化物的顺序排列。
药物溶剂化对药物熔点和溶解度的影响
药物
氨苄青霉素
溶剂
(无水物)
熔点/℃
200 203 68 83 188
物溶液的性质必须满足药用部位的要求,渗透
压、pH、pKa、表面张力、粘度等是液体制剂的 重要质量指标。
第一节 药用溶剂的种类和性质
药物溶液的形成是制备液体制剂的基础,以溶液
状态使用的制剂有:
• 1.注射剂; • 2.内服的有:合剂、芳香水剂、糖浆剂、溶液剂和酊剂等; • 3.外用的有:洗剂、搽剂、灌肠剂、含漱剂、滴耳剂、滴 鼻剂等;
溶剂中各溶剂的比例有关。 • 药物在混合溶剂中的溶解度通常是各单一溶剂溶解度的 相加平均值,但也高于相加平均值。
8.混合溶剂的影响
• 在混合溶剂中各溶剂在某一比例时,药物的溶解度比在 各单纯溶剂中溶解度出现极大值,这种现象称为潜溶 (cosolvency)。 • 潜溶剂提高药物溶解度的原因: (1)两溶剂之间发生氢键缔合,改变混合溶剂极性,有利 于药物溶解。 (2)潜溶剂改变了原来溶剂的介电常数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(二)溶解度的测定方法
分类:特性溶解度和平衡溶解度。
1.药物的特性溶解度s0(intrinsic solubility) 指药物不含任何杂质,在溶剂中不发生解
离或缔合,也不发生相互作用时所形成饱和 溶液的浓度,是药物的重要物理参数之一。
在一些情况下,如果口服药物的特性溶解 度小于1mg/mL,就可能出现吸收问题。
12
例如 求25℃时水的溶解度参数δ。
已知 H2O气化热 ΔHv=43932J/mol, VH2O =18.01cm3 则 :
H 2O
(43932
8.314 18.01
298.15 )1 2
4 7 .9 7 ( J
/ cm 3 )1 2
一些溶剂的摩尔体积与溶解度参数
液体 正己烷
乙醚 环己烷 乙酸乙酯 正辛醇 二甲基亚砜
20
测定举例:假设某药物在0.1mol/L NaOH水溶 液中的溶解度约为1mg/ml。实测时配制四种浓 度的溶液,即分别将3、6、12、24mg药物溶 于3ml溶剂中,装入安瓿,计算药物质量(mg) 与溶剂用量(ml)之比,即药物质量-溶剂体积 的比率分别为1、2、4、8,溶液量不能少于 3ml,保证能够供测试用。将配制好的溶液恒温 持续振荡达到溶解平衡,离心或过滤后,取出上
甘油 水
V(cm3/mol) 131.6 104.8 108.7 98.5 157.7 71.3
73.3 18.0
δ(J1/2/cm3/2) 14.93 15.75 16.77 18.20 21.07
26.59 36.20 47.86
14
生物膜
15
两组分的δ值越接近,越易互溶。 整个生物脂膜的溶解度参数δ平均值为
式中,C0——在电容器中以空气为介质时的电 容值,通常测得空气的介电常数接近于1。 规律:溶剂的介电常数越大,其极性越大。
9
物质的溶解性与溶剂介电常数
溶剂
溶剂的近似介电常数
适宜的溶质
水
溶
剂
二醇类
的
极
甲醇、乙醇
性
递
醛,酮,氧化物
减
己烷,苯,乙醚,石油醚
矿物油、植物油
80
溶 无机盐,有机盐
质
50
的
糖,鞣质
第一篇 药物制剂的基础理论 第二章 药物溶液的形成理论
1
本章基本内容
第一节 药用溶剂的种类及性质 第二节 药物的溶解度与溶出速度 第三节 药物溶液的性质与测定方法
2
第一节 药用溶剂的种类及性质
一 药用溶剂的种类
(一)水 水不具有任何药理与毒理作用,其理化性质稳定,且 廉价易得,是最常用和最为人体所耐受的极性溶剂。 水溶性药物多制备成水溶液。
(二)非水溶剂 药物在水中难溶,选择适量的非水溶剂或使用混合 溶剂,可以增大药物的溶解度,制备成溶液。如醇 类、植物油类、亚砜类、酯类等。
3
一 药用溶剂的种类
(一)水溶剂 饮用水:天然水经净化处理得到的水。 纯化水:饮用水经蒸馏法、离子交换等法除去大部
分阴、阳离子,不含任何附加剂。(普通制剂) 注射用水:纯化水经蒸馏所得的水。(注射剂) 灭菌注射用水:注射用水经灭菌所得。 (灭菌粉
Vi
液式态中时,的Δ摩Ei—尔—体分积子。间在的一内定聚温能度;下V,i—分—子物间质内在聚
能可从物质的摩尔气化热求得。
Ei H v RT
11
在一定温度下,分子间内聚能可从物质的摩尔气化 热求得,即, 因此,
i
(H v Vi
RT
)1 2
(2-3)
式中,Vi——物质在液态时T温度下的摩尔体积; ΔHv——摩尔气化热;R——摩尔气体常数;T—— 热力学温度。
21.07±0.82,很接近正辛醇的δ=21.07, 因此正辛醇常作为模拟生物膜相溶剂来测 算分配系数。
16
第二节 药物溶解度
一、药物的溶解度(solubility) 定义:在一定温度(气体在一定的压力)
下,在一定溶剂中达到饱和时溶解的最 大药量,是反映药物溶解性的重要指标。 表示方法:溶解度常用一定温度下100g 溶剂中(或100g溶液,或100ml溶液)溶解 溶质的最大克数来表示。亦可用质量摩 尔浓度mol/kg或物质的量浓度mol/L来表 示。
水
30
溶 蓖麻油,蜡
性
20
递 树脂,挥发油
5
减 脂肪,石蜡,烃类,汽 油
0
10
(二)溶解度参数(solubility parameter)
定义:表示同种分子间的内聚能,也是表示分子 极性大小的一种量度。
溶解度参数越大,极性越大。 溶解度参数δi可用式(2-2)表示。
i
( Ei
1
)2
6
一 药用溶剂的种类
(二)非水溶剂 3.酰胺类 如二甲基甲酰胺、二甲基乙酰胺、
正-(羟乙基)乳酰胺、N,N-二乙基乳酰胺、 N,N-二乙基吡啶酰胺等,能与水混合,易溶 于乙醇中。 4.酯类 如三醋酸甘油酯、乳酸乙酯、油酸 乙酯、乙酰丙酸丁酯、苯甲酸苄酯、肉豆蔻 酸异丙酯等。
7
二、药用溶剂的性质(极性)
末的溶媒) 以上统称制药用水
4
一 药用溶剂的种类
(二)非水溶剂 1.醇类 如乙醇、丙二醇、甘油、1,3-丁
二醇、异丙醇、聚乙二醇-200、-300、-400、 -600、苯甲醇等。这类溶剂多数能与水混合。 2.醚类 如四氢糠醛聚乙二醇醚、二乙二醇 二甲基醚,能与水混合,并溶于乙醇、甘油。
17
第二节 药物溶解度与溶出速度
一、药物的溶解度 (一)药物溶解度的表示方法
药典: 在一定温度(气体在一定的压力)下
溶解1g(或1mL)药物所需的最小溶剂体积 (单位ml)用1:n来表示。
18
各国药典中常以近似溶解度的术语表示:
药物的溶解度数据可查阅各国药典、默克索引(The Merk Index)、专门性的溶解度手册等。
清液并作适当稀释,测定药物在饱和溶液中的浓 度。以测得药物溶液浓度为纵坐标,药物质量-溶 剂体积的比率为横坐标作图,直线外推到比率为 零处即得药物的特性溶解度。
溶剂与药物的性质直接影响药物的溶解性。溶剂 的极性大小常以介电常数和溶解度参数两个参数 的大小来衡量。
(一)介电常数(dielectric constant) 溶剂的介电常数表示将相反电荷在溶液中分开的 能力,它可以反映溶剂分子的极性大小。
一般用ε来表示。
8
ε的测定与ห้องสมุดไป่ตู้算方法:
通 过 测 定 溶 剂 的 电 容 值 C 求 得 , ε =c/c0 (2-1)
