热力学第一定律
热力学第一定律简述

热力学第一定律简述《热力学第一定律》是物理学中非常重要的一条定律,被称为“热力学三大定律”之一。
这一定律由德国物理学家弗里德里希蝴蝶(Friedrich Hermann von Helmholtz)提出,它宣称,任何动力学变化的改变都伴随着势能的变化,即动能的变化可以转换为热能。
由于势能变化和热能变化的相互关系,热力学得以成立。
热力学第一定律,也称为Helmholtz定律,其简单来说是:“在完全可定义的力学过程中,可以计算出全部热力学计算量,而这些热力学计算量完全相等。
”换句话说,在完全可定义的力学过程中,可以计算出所有变化的总能量。
这一定律表明,总能量在这一过程中是守恒的,它是描述热力学过程的基础。
热力学第一定律的由来也可以追溯到17世纪,时至今日它仍是物理学中最基础的原理之一。
英国物理学家叔本华(Isaac Newton)曾指出,他试图将物理学和化学联系起来,从而发展出动力学和热力学,他说:“能量是守恒的,但不是保持不变的”。
他的观点表明,能量守恒的概念形成了热力学的基础。
热力学第一定律的另一种表述是这样的:“在物理可定义的过程中,总能量不会减少或增加,因为能量是守恒的。
”这个定律有几个重要的含义:它意味着能量在物理过程中可以在形式上转换,但总量是不变的;它也意味着,在热力学过程中,能量在过程中只能转换,不能新增或减少。
热力学第一定律有其他重要的推论,例如热力学第二定律,它表明,生物体在维持热力平衡时,存在着温度差和能量流动,因此温度和熵也是能量守恒的载体。
它表明,动物体能量的改变本质上是由温度差引起的,这也是动物体维持生命的重要原理。
热力学第一定律的意义重大,它得到了广泛的应用,它对所有自然现象的解释都有着重要的作用。
它使热力学成为真正可用的工具,使得可以准确地预测物理系统的热力行为,从而为诸如热物理学、动力学等研究领域带来了重要的贡献。
热力学第一定律的发现使物理学的发展变得更加完整,为人类文明的发展做出了重要的贡献。
热力学第一定律
21
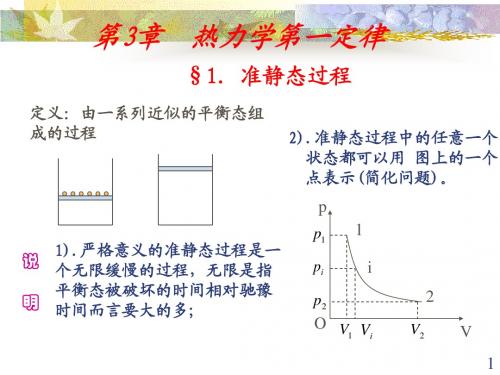
例1: 一定量的理想气体从体积V1 膨胀到体积V2 ,经历 以下几个过程: AB等压过程; AC等温过程; AD绝热 过程。问:从P-V图上,(1) 哪一个过程做功较多?哪 一个过程做功较少?(2) 经历哪一个过程内能增加?经 历哪一个过程内能减少?(3) 经历哪一个过程吸热最多? P 解: (1) 等压过程做功最多 A A A P A B p T Q 绝热过程做功最少 P C
例2:图示两卡诺循环,S1 = S2 P (1) 吸热和放热差值是否相同? (2) 对外所做净功是否相同? (3) 效率是否相同? 答案:(1)相同;(2)相同;(3)不相同
讨论
T2 1 )卡诺热机效率C 1 T1
只与T1和T2有关
与物质种类、膨胀的体积无关
2 ) 理论指导作用
T1 提高 c T2
提高高温热源的温度现实些
31
3)理论说明低温热源温度T2 0
说明热机效率 且只能 进一步说明 •热机循环不向低温热源放热是不可能的
T
(2) 等压膨胀:系统吸热 O V1 V2 V 系统内能增加,且对外做功; 等温膨胀:系统吸热,全部用来对外做功,内能不变; 绝热膨胀:系统不吸收热量,靠减少系统的内能对外做功
PQ
D
等压:内能增加;等温:内能不变;绝热:内能减少。
(3) 等压膨胀过程吸热最多。(4)绝热线比等温线陡 22
例2: 一mol单原子理想气体在汽缸中,设汽缸与活塞无 摩擦,开始时,P1=1.013*105Pa, V1=1.0*10 –2m3 ,将 此气体在等压下加热,使其体积增大一倍,然后在等体 下加热至压强增大一倍,最后绝热 膨胀为起始温度。 (1)画P-V图(2)求内能的增量(3)过程中的功 解: (1)图示 (2)0 (3) P2
热力学第一定律

假定控制容积形状、大小、空间位置均不随时间改变。
——因而统计系统的总能时,不考虑系统整体的外观能量,但要计及 流体的流动动能,重力位能以及热力学能。
假定系统除与外界有物质流交换,在没有质量流穿越的边界
上还可以有传热和作功的相互作用。
假定进、出口截面上存在局部平衡。 假定流动为一元流动
——仅在沿流动的方向上才有参数的变化。
热能工程教研室
§2-2 热力学能和总能
一、热力学能
物质内部拥有的能量称为热力学能,其组成是: 内动能(分子平移,旋转,振动)
内位能(分子间作用力)
化学能(维持一定的分子结构) 原子能(原子核内部)
如果无化学反应,无核反应, 热力学能 U = 内动能 + 内位能 1kg物质的热力学能称比热力学能 u,单位是J / kg 。 热力学能是热力状态的单值函数,它与路径无关,是状态参数。 u = f(T,v); u = f(T,p); u = f(p,v) (2 - 1)
进入系统的能量 - 离开系统的能量 =系统中贮存能量的增加 它适用于任何过程和任何工质的热力系统。 闭口系的能量方程 Q - W = U = U2 – U1 Q = U + W ( 输入) (贮增)(输出) 对于一个微元过程,第一定律的解析式的微分形式: Q = dU + W 对于1kg工质,有 q = u + w q = du + w (2-9)
– p1 u
)
(2-19)
由式(2-18)并考虑q -△u = w,则
wt = w -△(p u)= w -(p2 u
热能工程教研室
2
1
(2-20)
技术功在示功图上的表示
对可逆过程:wt =
热力学第一定律

23
本章学习要求
• 掌握能量、热力系统储存能、热力学能、热量和功量 的概念,理解热量和功量是过程量而非状态参数。 • 理解热力学第一定律的实质能量守恒定律。 • 掌握稳定流动能量方程,能熟练运用稳定流动能量方 程对简单的工程问题进行能量交换的分析和计算。 • 掌握膨胀功、轴功、流动功和技术功的概念、计算及 它们之间的关系。 • 理解焓的定义式及其物理意义。 • 了解常用热工设备主要交换的能量及稳定流动能量方 程的简化形式。
2. 宏观位能: Ep ,单位为 J 或 kJ
Ep mgz
5
热力系总储存能:E ,单位为 J 或 kJ
E U Ek Ep
比储存能:e ,单位为 J/kg 或 kJ /kg
1 2 e u ek ep u cf gz 2
6
内动能-温度 热力学能 (内能U、u) 外储存能 内位能-比体积
∴流动功是一种特殊的功,其数值取决于
控制体进、出口界面上工质的热力状态。
14
根据热力学第一定律, 有 :
1 2 1 2 u1 cf 1 gz1 p1v1 q u2 cf 2 gz2 p2v2 ws 0 2 2
令 upv h,由于u、p、v都是状态参数,所以h也是 状态参数,称为比焓。
对一切热力系统和热力过程,有:
进入系统的能量-离开系统的能量 = 系统储存能量的变化
8
二、闭口热力系的能量方程
如图: Q=△U+W 对微元过程: Q QdUW 或 qduw 即: 热力系获得热量= 增加的热力学能+膨胀做功 对于可逆过程 : qdupdv 或
ΔU
W
qu pdv
热力学第一定律的理解

热力学第一定律的理解
热力学第一定律被视为热力学最基本的定律,也被称为能量守恒定律。
其核心思想是能量不会消失,只会从一种形式转化为另一种形式。
即在任意过程中,系统与外界交换的总能量不变,也就是系统内部能量改变的量等于输入输出能量的代数和。
热力学第一定律的原理是:系统的内能变化等于从外界获得的能量减去对外做的功,内能变化公式可以表示为∆U = Q - W。
其中,∆U表示热力学系统内能的改变;Q表示由外界传递给系统的热量;W 则是由系统对外做的有效功。
例如,当两个物体之间存在温差时,热能将从高温物体向低温物体传递,直到两个物体达到热平衡态。
根据热力学第一定律,此过程中,系统内部的总能量不会减少也不会增加,而只会发生能量形式的转化。
从实际应用角度看,热力学第一定律的应用非常广泛,例如在工程领域中常常可以用于计算发生热量变化的化学反应的反应热;在制冷技术中,也可以用于计算制冷量;在生物学中,可以用于研究生物体内能量的转化等等。
总之,热力学第一定律是一个基本而重要的物理学定律,关系到能源的利用和转换,也对可持续的社会发展和能源的长期稳定有着重要的影响。
热力学第一定律

= PdV
A=
∫
V2
V1
pdV
7
A =
∫ dA = ∫
V2
V1
pdV
dV > 0, dA > 0, 系统对外作正功;
dV < 0,dA < 0, 系统对外作负功;
dV = 0,dA = 0, 系统不作功。
A = ∫ pdV
V1
V2
由积分意义可知,功的大小等于p—V 图上过程 曲线p(V)下的面积。功的数值不仅与初态和末 态有关,而且还依赖于所经历的中间状态,功 8 与过程的路径有关.
QT 热源 Q V
等容过程
热源 QP
等压过程
T 恒温大 V
6
三、功 热量 内能 dx 1功 如图示的热力学系统: P S 若过程为无摩擦的准静 态过程 活塞迎着气体一侧的面积为S气体膨胀推动活塞对 外作功:
dA =
当系统体积从 V1→ V2,系统对外界作功:
F Fdx = S Sdx
在等温过程中,理想气体吸热全部用于对外作 功,或外界对气体作功全转换为气体放出的热。 22
四、绝热过程
系统在状态变化过程中始终与外界没有热交换。
绝热膨胀过程中,系统对外作的功,是靠内能减少实 现的,故温度降低;绝热压缩过程中,外界对气体作 功全部用于增加气体内能,故温度上升。 绝热过程方程: 气体绝热自由膨胀 Q=0, A=0,△E=0
14
Q=∫
V2
V1
i pdV + νR(T2 − T1 ) 2
Q = ( E 2 − E 1) + A = ∆ E + A
热力学第一定律,是包含热量在内的能量守恒定律。
Q>0 Q<0
热力学第一定律

3. 摩尔恒压热容与摩尔恒容热容的关系
C p,m CV ,m
H m T
p
U m T
V
(Um pVm ) T
p
U m T
V
Um Um p Vm
T p T V
C p,m Cv,m
Um Vm
p
T
Vm T
p
2.4.8
C p,m
CV ,m
Um V
T
p
Vm T
p
对理想气体
(0
p)
(R / p)T T
p
R
C p,m CV ,m R
状态函数法举例
§2.2 热力学第一定律
热力学第一定律的本质是能量守恒原理,即隔离系统 无论经历何种变化,其能量守恒。
热Q
U U2 U1 Q W dU U2 U1 Q W 途径函数
(2.2.1a) (2.2.1b)
符号规定: 若系统从环境吸热+,若系统向环境放热-
第二章 热力学第一定律
热力学是自然科学中建立最早的学科之一 1. 第一定律:能量守恒,解决过程的能量衡算问题 (功、热、热力学能等) 2. 第二定律:过程进行的方向判据 3. 第三定律:解决物质熵的计算
经典热力学 1 . 研究含有大量质点的宏观系统 2. 只考虑平衡问题
§2.1 基本概念和术语
1. 系统与环境 系统:作为研究对象的那部分物质 环境:系统以外与之相联系的那部分物质(与系统密切 相关、有相互作用或影响所能及的部分)
热力学第一定律

热力学第一定律科技名词定义中文名称:热力学第一定律英文名称:first law of thermodynamics其他名称:能量守恒和转换定律定义:热力系内物质的能量可以传递,其形式可以转换,在转换和传递过程中各种形式能源的总量保持不变。
概述热力学第一定律热力学第一定律:△U=Q+W。
系统在过程中能量的变化关系英文翻译:the first law of thermodynamics简单解释在热力学中,系统发生变化时,设与环境之间交换的热为Q(吸热为正,放热为负),与环境交换的功为W(对外做功为负,外界对物体做功为正),可得热力学能(亦称内能)的变化为ΔU = Q+ W或ΔU=Q-W物理中普遍使用第一种,而化学中通常是说系统对外做功,故会用后一种。
定义自然界一切物体都具有能量,能量有各种不同形式,它能从一种形式转化为另一种形式,从一个物体传递给另一个物体,在转化和传递过程中能量的总和不变。
英文翻译:The first explicit statement of the first law of thermodynamics, byRudolf Clausiusin 1850, referred to cyclic thermodynamic processes "In all cases in which work is produced by the agency of heat, a quantity of heat is consumed which is proportional to the work done; and conversely, by the expenditure of an equal quantity of work an equal quantity of heat is produced."基本内容能量是永恒的,不会被制造出来,也不会被消灭。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
热力学第一定律【学习目标】1.知道物体的内能是物体内所有分子的动能和势能的总和.2.知道物体内能的变化量可以由做功的数值来量度.3.通过焦耳的实验的观察,分析和思考,培养学生实事求是,严谨的科学态度和想象能力.4.能区别功和内能.做功与内能变化的关系.5.知道热传递及热传递的三种方式以及热传递的实质.6.知道热传递与内能变化的关系,理解热功当量。
7.知道做功和热传递对改变物体内能的等效结果.8.明确温度、热量、功和内能四个物理量的区别和联系.9.掌握热力学第一定律及其表达式,能够从能量转化的观点理解定律;10.会用表达式ΔU=W+Q 对问题进行分析和计算;11.掌握能量守恒定律,理解定律的重要意义,会用能量转化和守恒的观点分析物理现象;12.能综合运用学过的知识,用能量守恒定律对有关问题进行计算、分析;13.了解第一类永动机不可能制成的原因.【要点梳理】要点一、功和内能1.热功当量实验——焦耳实验(1)方法:在水中放置叶片,叶片上缠绕两根绳子,每根绳子各跨过一滑轮,且分别悬挂一个重物,盛水的容器用绝热性能良好的材料包好.如图所示,当重物下落时便带动叶片转动,容器中的水受叶片的搅动,水由于摩擦而温度上升.(2)结论:只要重力所做的功相同,容器内水温上升的数值就相同,即系统的状态变化相同.2.利用电流的热效应给水加热的实验(1)方法:如图所示,利用降落的重物使发电机发电.电流通过浸在液体的电阻丝.引起液体温度上升.(2)结论:对同一个系统,在绝热过程中,只要所做的电功相等,系统温度上升的数值就相同,即系统的状态变化相同.3.内能(1)内能是物体内部所有分子做热运动的动能和分子势能的总和.内能类比于重力做功与路径无关,仅由物体初、末位置决定.而热力学系统的绝热过程中,外界对系统所做的功也仅由初、末状态决定,与具体做功的过程和方法无关,我们认识到。
任何一个热力学系统必定存在一个只依赖于系统自身状态的物理量,这个物理量是系统的一种能量,叫内能.(2)内能变化和做功的关系系统由状态1在绝热过程中达到状态2时,内能的增加量21U U U ∆=-,U W ∆=。
绝热过程中:内能的增加量等于外界对系统所做的功.当外力做正功时,系统内能增加,外力做负功时,系统内能减少,且内能变化量等于外力所做的功.(3)功和内能的区别功是能量转化的量度,与内能变化相联系,是过程量,而内能是状态量,只有在内能变化过程中才有功.物体内能大,并不意味着做功多,只有内能变化大,才意味着做功多.(4)热传递和内能的改变热传递有传导、对流和辐射三种形式.热传递和做功对改变系统的内能来说是等效的.系统在不对外做功,外界也不对系统做功时,系统吸收的热量为Q 时则内能增加量为Q .系统对外界放出的热量为Q 时,则内能减少Q ,即U Q ∆=.4.物体的内能及内能的变化物体的内能是指物体内所有分子的平均动能和势能之和,在微观上由分子数和分子热运动剧烈程度和相互作用力决定,宏观上体现为物体的温度和体积,因此物体的内能是一个状态量.当物体温度变化时,分子热运动剧烈程度发生改变,分子平均动能变化.物体体积变化时,分子间距变化,分子势能发生变化.因此物体内能的变化只由初、末状态决定,与中间过程及方式无关.5.做功与内能的变化做功改变物体内能的过程是将其他形式的能(如机械能)与内能相互转化的过程,做功使物体内能发生变化时,内能改变了多少可用做功的数值来度量.外界对物体做多少功,物体的内能就增加多少;物体对外界做多少功,物体的内能就减少多少.压缩气体,外界对气体做了功,气体的内能增加,气体内能的增加量等于外界对气体做的功;气体膨胀,是气体对外界做功,气体内能减小,气体内能的减少量等于气体膨胀对外做的功.实质上,对气体我们还能从另一个方面来判断,那就是看气体的体积,被研究的气体体积增大就一定对外做功;气体的体积减小,外界就一定对气体做功.在绝热过程中,末态内能大于初态内能时,U ∆为正,形为正。
外界对系统做功.末态内能小于初态内能时.U ∆为负,形为负,系统对外界做功.内能和其他形式的能一样,是状态量,物体的状态一定时,它的内能也一定.和讨论重力势能一样,我们能确定的只是内能的变化,因为任何状态下的内能,只有在标准参考态的值确定后,才可能得出相应的确定值,由此可知,要测得物体某一状态内能的绝对值,是不可能的.6.内能与机械能物体的内能与机械能是两个不同的物理概念.内能是由大量分子热运动和分子间的相对位置所决定的能.机械能是物体做机械运动和物体形变所决定的能.物体具有内能的同时可具有机械能.物体的机械能在一定条件下可等于零,但物体的内能不可能等于零,因为分子永不停息地做无规则运动,它们之间有相互作用.内能和机械能在一定条件下可以相互转化,且总量保持不变.7.具体现象的分析如图所示,大口玻璃瓶内有一些水,水的上方有水蒸气,向瓶内打气,当瓶塞跳出时,观察瓶内的变化。
解析:当瓶塞跳出时,我们会发现瓶内的瓶口处有“白雾”产生.我们所选的研究对象是瓶内水面上方的水蒸气,在瓶塞跳出的过程中,是系统膨胀对外界做功,在这个过程中系统的内能减少.瓶内的瓶口处的“白雾”实际上是瓶内的水蒸气液化形成的无数小液滴,水蒸气液化过程中内能减少. 要点二、热和内能1.热传递(1)热传递①热传递的定义高温物体总是自发地把它的内能传递给低温物体,这种没有做功而使物体内能改变的现象称为热传递.热量从物体的一部分传递到另一部分,或从一物体传递到另一个物体的物理过程.②热传递的方式热传导、热对流、热辐射.③热传递的条件是存在温度差,最终结果是使物体的温度一样.④热传递的规律是热量从高温物体传向低温物体.(2)热传递和内能变化的关系系统在单纯的传热过程中,内能的增量U ∆等于外界向系统传递的热量Q ,即U Q ∆=.2.做功和热传递在改变物体内能上的关系(1)两种方式的区别做功:其他形式的能和内能之间的转化.当机械能转化为内能时,必须通过物体的宏观运动才能实现.热传递:物体间内能的转移,即内能从物体的一部分传到另一部分,或从一个物体传递到另一个物体.它是在分子相互作用下,通过分子的微观运动来达到内能的改变的.物体间发生热传递的必要条件是存在温度差.在热传递过程中,内能从高温物体传递到低温物体,使高温物体内能减少,低温物体内能增加,最后达到温度相等.(2)两种方式的联系做功和热传递都可以改变物体的内能,从它们改变内能的最终结果看,两者是等效的.3.“温度”“热量”“功”“内能”四个量的区别与联系(1)内能是由系统的状态决定的,状态确定,系统的内能也随之确定,要使系统的内能发生变化,可以通过热传递或做功两种过程来完成.而热量是热传递过程中的特征物理量,和功一样,热量只是反映物体在状态变化过程中所迁移的能量,是用来衡量物体内能变化的,有过程,才有变化,离开过程,就毫无意义.就某一状态而言,只有“内能”,根本不存在什么“热量”和“功”,因此,不能说一个系统中含有“多少热量”或“多少功”.(2)热量和温度热量是系统的内能变化的量度,而温度是系统内部大量分子做无规则运动的激烈程度的标志.虽然热传递的前提是两个系统之间要有温度差,但是传递的是能量,不是温度。
(3)热量和功热量和功都是系统内能变化的量度,都是过程量,一定量的热量还与一定量的功相当,热量可以通过系统转化为功.功也可以通过系统转化为热量,但它们之间有着本质的区别.用做功来改变系统的内能,是系统内分子随整体的有序运动转化为另一系统的分子的无规则运动的过程,是机械能或其他形式的能和内能之间的转化过程.用热传递来改变系统的内能,是通过传导、对流和辐射来完成的,它将分子的无规则运动,从一个系统转移到另一个系统,这种转移就是系统间内能转换的过程.4.关于热传递和物体内能改变的关系的定量计算和定性分析热传递也可以改变物体的内能.物体吸收了热量,分子热运动变得剧烈,分子平均动能就增加,物体的内能就增大,反之物体的内能就减少.在只有热传递的情况下,系统由状态1到达状态2,内能增量为21U U U ∆=-,吸收的热量即U Q ∆=,也就是说:物体吸收热量,内能增加,物体放出热量,内能减少,并且内能的变化量等于物体吸收或放出的热量.对于Q cm t =∆应明确其中各量的意义.5.功、热量、内能、温度四个概念易混淆的问题关于功、热量、内能、温度四个物理量的概念易混淆的问题,我们区别四者的根据是功、热量是能量转化转移的量度,是与内能的变化相联系的,是过程量;内能是状态量.物体的内能大,并不意味着物体一定会对外做功或向外传递热量,或者做的功多,传递的热量多.只有物体内能的变化大时,过程中做的功或传递的热量才会多.温度只是分子平均动能的标志,物体的内能除与温度有关外,还与物体的质量、体积、物态等因素有关,结合这些方面的联系与区别进行判断才不易出错.6.热传递的实质用热传递来改变系统的内能,是通过传导、对流、辐射来完成的,它将分子的无规则运动从一个系统转移到另一个系统,这种转移也就是系统间的内能转换的过程.功是在没有热传递的过程中,系统能量变化的量度;热量是在没有做功的过程中,系统能量变化的量度.7.对“热功当量”的理解J=,不能理解为“1 cal热量可以做功4.2 J”或“1 cal热量等于对于热功当量的大小 4.2 J/cal4.2 J的功”.J=应理解为“传热功当量的前提是做功和热传递在改变内能上的等效性,因此,对于 4.2 J/cal递给物体1 cal的热量使物体内能的增加,与对物体做功4.2 J使物体内能的增加在效果上是相当的”.也就是说,使物体内能发生变化,1 cal热量相当于(等效于)4.2 J功.要点三、热力学第一定律能量守恒定律1.热力学第一定律(1)热力学第一定律的研究对象研究功、热量跟内能的变化之间的定量关系.(2)热力学第一定律的表达式我们知道,做功和热传递都可以改变物体的内能.在一般情况下,如果物体跟外界同时发生做功和热传递的过程,那么外界对物体所做的功彬加上物体从外界吸收的热量Q等于物体内能的增加∆=+。
∆,即U Q WU上式所表示的功、热量跟内能改变之间的关系,叫做热力学第一定律.一个热力学系统的内能增量等于外界向它传递的热量与外界对它所做的功的和,这个关系叫做热力学第一定律.一般情况下,如果外界对一个物体做功W,同时给物体传递热量Q,则该物体内能的增加应为两者之和,这就是热力学第一定律.2.能量转化和守恒定律(1)不同形式的能量之间可以相互转化①自然界中能量的存在形式:物体运动具有机械能、分子运动具有内能、电荷具有电能、原子核内部的运动具有原子能等,可见,在自然界中不同的能量形式与不同的运动形式相对应.②不同形式能量之间的转化:“摩擦生热”是通过克服摩擦做功将机械能转化为内能;水壶中的水沸腾时水蒸气对壶盖做功将壶盖顶起,表明内能转化为机械能;电流通过电热丝做功可将电能转化为内能等,这些实例说明了不同形式的能量之间可以相互转化,且这一转化过程是通过做功来完成的.(2)能的转化和守恒定律①人类通过对大量的实践经验进行总结得知,要获得一种能量,一定需要利用另一种能量通过做功的方式进行转化,能量不能凭空产生,即不可能设计、创造出一种不消耗任何能量而能源源不断地对外做功的永动机.②能的转化和守恒定律:能量既不能凭空产生,也不能凭空消失,它只能从一种形式转化为另一种形式,或者从一个物体转移到另一个物体,这就是能的转化和守恒定律.(3)能量守恒定律的重要意义能的转化和守恒是分析解决问题的一个极为重要的方法.它比机械能守恒定律更普遍.例如物体在空中下落受到阻力时,物体的机械能不守恒,但包括内能在内的总能量总是守恒的.3.永动机不可能制成如图是历史上有名的一种永动机的设计.从图上看,设计者为什么认为这个机器会永远运动下去?不用能量的概念,你能不能说明它不会永远运动下去?[解析]这种永动机是在一个轮子的边缘等距地安装12根活动短杆,杆的自由端分别套上一个重球.无论轮子转到什么位置,右边的各个重球总比左边的各个重球离轴心更远一些.设想,右边甩过去的重球作用在离轴较远的位置,就会迫使轮子按照箭头所示的方向永不停息地旋转下去,至少转到轮轴磨坏时为止.但是,实际上轮子转动一两圈后就停了下来,在这种永动机的设计中,我们总可以找到一个平衡位置,在这个位置上,各个力恰好相互抵消.不再有任何推动力使它运动.永动机必然会在这个平衡位置上静止下来,变成不动机.(1)第一类永动机概念:不消耗能量的机器.结果:无一例外地归于失败.原因:违背能量守恒定律.(2)永动机给我们的启示人类利用和改造自然时,必须遵循自然规律.要点诠释:能量守恒定律的发现,使人们进一步认识到。
