炔 炔烃
炔烃
HC
CCH2CH=CH2
4-甲基-2-己炔 4-2-
1-戊烯-4-炔
炔烃分子中同时含有双键和叁键时的命名规则 命名规则: 命名规则 选择含C=C和C≡C的最长碳链为主链,母体称”某烯炔” = 编号:谁近谁优先,相同烯在先
炔
烃
课堂练习
写出下列化合物的结构式或命名 (1) (CH3)3CC CCH2C(CH3)3 (2) C4H9 C C CH3 2,2,6,6-四甲基-3-庚炔 2-庚炔
CH3
CHBr2
Br Br HBr CH C CH2 3 C CH3 Br
炔
4、加水 、
烃
为什么呢? 为什么呢
条件: 条件:5%硫酸汞水溶液和10%硫酸溶液 所生成的烯醇式(CH2=CH–OH)不稳定,将发生分子内重排反应
CH CH + HOH
乙炔
HgSO4 H2SO4
CH2 CH OH
分子重排
CH3 C H O
炔烃是否有顺反异构? 炔烃是否有顺反异构?
杂化的碳上只连接一个基团。 无!因为炔烃的sp杂化的碳上只连接一个基团。
炔 烃烃 炔
二、炔烃的异构现象和命名
炔烃的同分异构现象与烯烃相似 碳链异构 位置异构(无顺反异构) 无顺反异构) 官能团异构 【例如】 1-丁炔 2-丁炔 HC≡C-CH2CH3 CH3-C≡C-CH3
氯化亚铜氨溶液
CH3 C
CCu + NH3 + NH4Cl
此反应可鉴别乙炔和推测端基炔结构
炔
烃
炔烃与卤代烷作用可在炔烃分子中引入烷基: 炔烃与卤代烷作用可在法
炔
烃
课堂练习
写出下列反应的产物: 写出下列反应的产物: (1) CH3CH2CH2C CH + HBr(过量)
有机化学 第四章 炔烃
R-C
C-Na + NH3↑
R-C≡C-Na + R/X R/X/
6、聚合反应
Cu2Cl2 2 CH CH NH Cl H2O CH2 CH 4
CH CH CH2 CH Cu2Cl2 NH 4Cl H 2O
C CH
C
C CH CH2
增碳
例: 以乙炔为原料合成下列化合物: (1)Z-3-己烯; (3)醋酸乙烯脂; (2)E-3-己烯;
2) 和卤化氢加成
RC
注:
CH
HX
HgCl2
R
C X
CH2 HX
HgCl2
R
X C X
CH3
① 反应可以停留在卤代烯烃阶段; ② 在催化剂汞盐或铜盐存在时,叁键与HX反应 活性比双键大; ③ 不对称炔烃与HX加成符合马氏规则,对于HBr 有过氧化物效应。
3) 和水加成
RC CH + H2O
HgSO4 H 2SO4 ) (稀
5 4 3 2 1
CH3-CH = CH-C
CH
3-戊烯-1-炔
(不叫 2-戊烯-4-炔)
如对称,优先考虑双键。
HC CCHCH=CH 2 CH 3
6 5 4 3 2 1
3-甲基-1-戊烯-4-炔
HC C-CH2-CH2-CH=CH2
1-己烯-5-炔
§4.3 物理性质(自学) §4.4 化学性质 1、氢化反应 1)催化氢化
RC CR' + H2
催化加氢反应活性:炔烃>烯烃
Ni(Pt , Pd)
RCH
CHR'
Ni(Pt, Pd)
H2
RCH2CH2R'
RC
炔烃

(S)-7-甲基环辛烯-3-炔 (S)-7-methylcycloocten-3-yne
4,8-壬二烯-1-炔
4,8-nonadien-1-yne
6.2
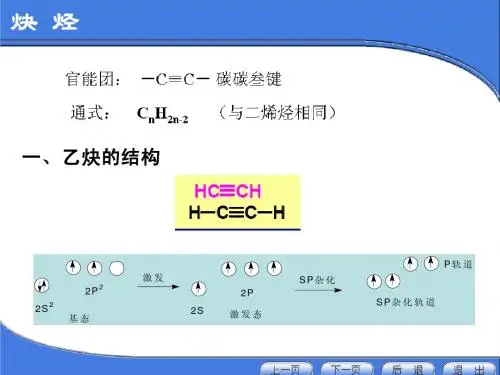
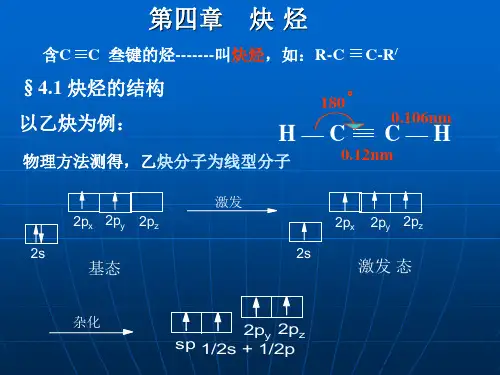
炔烃的结构
炔烃的结构特征是分子中含有“ C≡C ”,它与 “ C=C ”一样是由键和键构成,下面以乙炔为 例说明叁键的形成及结构,乙炔为一直线型分子, 全部四个原子在同一直线上,在乙炔分子中 0.1061nm
R
X2
R
C
CH
Cl2
X2
R
CHCl2
C X
CH X CHCl2
HC
CH
黑暗
CHCl
CHCl
黑暗
这一反应如在光照的情况下,反应剧烈并爆炸。 所以盛乙炔气、氯气的钢瓶要分开存放,以确保 安全。炔烃和溴也可以发生类似反应,反应现象 为Br2的红棕色褪去,故可用于炔烃的鉴别。
炔烃 26
有机化学
加 X2
HC
C2H5NH2
蓝色溶液
*2 反应体系不能有水,因为钠与水会发生反应。
*3 与制NaNH2的区别 Na + NH3 (液)
Fe3+
NaNH2
炔烃的加氢和还原
H2/Ni, or Pd, or Pt H2/ Pd-CaCO3 or Pd-BaSO4 orNiB
RCH2CH2R’
R H R H
C C
C C
R' (>90%) H R' H
R-CC-R’
硼氢化
RCOOH ~0oC
R H R H
C C
H R' H R'
(90%)
Na, NH3
(82%)
炔烃燃烧公式

炔烃燃烧公式
炔烃是一种含有碳-碳三重键的有机化合物,通式为CnH2n-2。
它们燃烧时会产生剧烈的火焰,释放大量的能量。
炔烃燃烧的化学方程式可表示为:
CnH2n-2 + (3n/2 + 1)O2 → nCO2 + (n-1)H2O
其中,n表示炔烃分子中碳原子的数目,O2表示氧气,CO2表示二氧化碳,H2O表示水。
方程式中的系数是为了使反应的摩尔比例满足化学平衡而进行的调整。
例如,乙炔(C2H2)的燃烧方程式为:
2C2H2 + 5O2 → 4CO2 + 2H2O
这意味着每个乙炔分子需要5分子氧气才能完全燃烧成4分子二氧化碳和2分子水。
炔烃的燃烧反应是一种放热反应,释放的能量可以用来进行工业生产、汽车驱动等许多应用。
然而,由于燃烧会产生有害气体和污染物,我们也需要寻求更环保的能源替代品。
- 1 -。
第4章 炔烃

O
HC
CH + CH3C
OH
Zn(OAc)2/活性炭 170~230 °C
O H2C CH O CCH3
乙酸乙烯酯
二、聚合反应 乙炔也能聚合。在不同条件下乙炔可生成链状的二聚
物或三聚物,也可生成环状的三聚物或四聚物。
乙炔的二聚物与氯化氢加成,得到2-氯-1,3-丁二烯 。是合成氯丁橡胶的单体。
三、氧化反应 与C=C双键相似,C≡C三键也被高锰酸钾烟花。
最终的产物是二氧化碳(C≡C三键断裂),高锰酸钾被 乙炔还原生成棕色的二氧化锰沉淀。
如果是非末端炔烃,氧化的最终产物是羧酸(C≡C三键 断裂)。如:
“十二五”职业教育国家规划教材修订版
有机化学
(第六版)
高职高专化学教材编写组 编
Organic Chemistry
第四章 炔 烃
“十二五”职业教育国家规划教材修订版
主要内容
炔烃的通式、同分异构和命名; 炔烃的结构; 炔烃的物理性质; 炔烃的化学性质; 炔烃的制法。
学习目标
了解炔烃的制备方法及炔烃的物理性质; 了解不同杂化状态碳原子电负性的比较; 理解碳原子sp杂化及直线形的空间构型; 理解炔烃的结构; 掌握炔烃的同分异构现象; 掌握炔烃的命名、烯炔的命名; 掌握炔烃的化学性质及其应用。
CH3-CH=CH-C CH
3-戊烯-1-炔 (不叫2-戊烯-4-炔)
第二节 炔烃的结构
一、乙炔的结构 乙炔(CH≡CH)分子是一个直线形结构,四个原子
都排布在同一直线上。X-光衍射和电子衍射等物理方法 测定,分子中各键的键长与键角如下式所示:
炔烃的课件
HgSO4 CH (CH ) C CH CH3(CH2)5C CH + HOH 3 2 5 3 H2SO4 O
加水反应方程式的意义: 加水反应方程式的意义:
①烯醇式结构是不稳定结构,不能稳定存在; 烯醇式结构是不稳定结构,不能稳定存在; ②有机化学反应中存在分子结构的重排现象; 有机化学反应中存在分子结构的重排现象; ③炔烃加水产物的写法---乙炔加水生成乙醛。 炔烃加水产物的写法---乙炔加水生成乙醛。 ---乙炔加水生成乙醛
CH3(CH2)3C 过氧化物 Br CH3(CH2)3CH CH2 CHBr HBr HBr 过氧化物 CH3(CH2)3CBr2CH3 CH3(CH2)3CH2CHBr2
CH3(CH2)3C
CH
ቤተ መጻሕፍቲ ባይዱ
HBr
炔烃与HX作用,在一定的条件下可以停留在一分子加成阶段。 乙炔与一分子氯化氢作用生成氯乙烯,这是工业上生产氯乙烯的方法之一。
方程式的书写注意根据条件确定产物。
Ni,C2H5OH CH3CH2CH2CH3 CH 3C CCH 3 + 2H 2 25 C,5MPa
5 % Pd-BaSO4 R CH2 C C CH2 R 25℃,喹啉, 0。MPa CH2 C C CH2 R R HH
CH3 Pd-CaCO3 HC C C CHCH2CH2OH + H2
CH + NaNH 2 CH + NaNH 2
HC R C
液氨 液氨
HC R
CNa + NH3 C CNa + NH3
(2)炔氢的微弱酸性使它能被某些金属离子所取代生成金 )
属炔化物。反应非常灵敏,可被用来鉴别乙炔和端炔。 属炔化物。反应非常灵敏,可被用来鉴别乙炔和端炔。用 此法可鉴定炔烃中是否含有炔氢。 此法可鉴定炔烃中是否含有炔氢。 CH CH + 2Ag(NH3)2NO3 AgC CAg + 2NH4NO3 + 2NH3 乙炔银(白色)
4第四章 炔烃 二烯烃
RCCR` KMnO4 RCOOH + R`COOH
H2O
(2) 缓慢氧化——二酮
OO
CH3(CH2)7CC(CH2)7COOH
KMnO4 H2O
CH3(CH2)7-C-C-(CH2)7COOH
pH=7.5
92%~96%
•利用炔烃的氧化反应,检验叁键的存在及位置
•这些反应产率较低,不宜制备羧酸或二酮.
有机化学 Organic Chemistry 第四章 炔烃 二烯烃
第四章 炔烃 二烯烃
(一) 炔烃
定义:分子中含有碳碳叁键的烃叫做炔烃,它的通式:
CnH2n-2 官能团为: -CC-
4.1 炔烃的异构和命名**
(1)异构体——从丁炔开始有异构体.
•同烯烃一样,由于碳链不同和叁键位置不同所引起的.由 于在碳链分支的地方不可能有叁键的存在,所以炔烃的 异构体比同碳原子数的烯烃要少. •由于叁键碳上只可能连有一个取代基,因此炔烃不存在 顺反异构现象.
炔烃和烯烃一样,也能和卤化氢、卤素等起亲电加成反
应,但炔的加成速度比烯慢
(A) 和卤素的加成
Br2
RC CR
Br
+
RC CR
Br-
反式加成
Br
R
CC
R
Br
卤素的活性F2>Cl2>Br2>I2
Br Br Br2 R C C R
这一反应可用于炔烃的鉴别。
Br Br
控制条件也可停止在一分子加成产物上.
❖加氯必须用FeCl3作催化剂。
•含有双键的炔烃在命名时,一般 先命名烯再命名炔 .
碳链编号以表示双键与叁键位置的两个数字之和最小
为原则。在同等的情况下,要使双键的位次最小。
有机化学-炔烃
b.London 5/22/1912 d.IN,US 12/20/2004
“For their development of use of boron and phosphorus-containing compounds,respectively, into important reagents in organic synthesis"
1500oC HC CH + 3H2
3) CH4 + O2 1500oC HC CH + CO + H2O
2. 由烯烃制备:
CH3CH2 HC
Br2 CH2
CCl4
CH3CH2 HC CH2 Br Br
NaNH2
Mineral Oil 110-160oC
NH4Cl CH3CH2 C CH
R Cl + Mg ether
R Mg Cl
R C CH + CH3CH2MgBr
R C CMgBr
炔格氏试剂
R C CMgBr + R' Cl
R C C R'
炔烃制备
四、炔烃的制备
1. 乙炔的制备:
1) CaO + C
CaC2 + CO
CaC2 + H2O
HC CH + Ca(OH)2
2) 2CH4
“For their development and use of molecules with structure-specific interactions of high selectivity"
3) 控制加氢------反式加氢
炔烃的性质
1.物态
通常情况下,炔烃是无色的,低级炔烃(C2~C4)是气体, C5~C17的炔烃是液体,高级炔烃(C18以上)是固体。
2.熔、沸点
炔烃溶点、沸点都随碳原子数目增加而升高。
3.相对密度
炔烃的相对密度都小于1,比水轻。相同碳原子数的烃的相对密 度:炔烃>烯烃>烷烃。
4.溶解性
炔烃分子的极性略比烯烃强,难溶于水,易溶于乙醚、氯仿、 四氯化碳、丙酮和苯等有机熔剂。
CH2 CH OCH3 甲基乙烯基醚
CH3COOH
CH2 CH O C CH3 乙酸乙烯酯 O
聚合
二聚 H2C CH C CH 乙烯基乙炔
多聚
CH CH n
聚乙炔
炔化钠性质活泼,在有机合成上用来与伯卤代烃作用,生成高
级炔烃。此反应是增长碳链的方法之一。
液氨
R C CH NaNH2
RC
CNa R' X
R C C R'
2.与硝酸银或氯化A亚g(N铜H3的)2N氨O3 溶Ag液C 反CA应g
含有炔氢原子的炔烃与硝酸银或乙氯炔银化亚铜的氨溶液作 用或,棕炔 红氢色C原的H子炔C可化H被亚铜Ag。+C或例u(NC如Hu3:+)2C取l 代C,乙uC生炔亚成C铜C灰u白色的炔化银
(1)加HCN
HC
CH + HCN
Cu2Cl2 NH4Cl 80~90℃
H2C
CH CN
丙烯腈
(2)加醇
CH CH + CH3 OH
(3)加乙酸
20%NaOH 160~165℃, 2~2.2MPa
CH2
CH
OCH3
甲基乙烯基醚
CH CH + H O C CH3 乙酸锌-活性炭 CH2 CH O C CH3
03-第三章:炔烃
三、氧化反应
• 炔烃和氧化剂反应,往往使碳碳叁键断裂,最后得到完全
氧化的产物——羧酸或二氧化碳。
CH CH R C C R'
KMnO4 H2O
KMnO4 100oC
CO2 + H2O
O
O
R C OH + R' C OH
• 在缓和的氧化条件下,二取代炔烃的氧化可停止在
二酮的阶段。
CH3(CH2)7 C
C-H
0.120
0.106
0.133
0.108
0.154
0.110
1)s轨道的电子较p电子接近原子核,故杂化轨道的s成分越多,则在杂化 轨道上的电子越接近原子核。乙炔分子中的Csp- Hs 键,因sp杂化轨道的 s成分大(50%),其电子云更靠近原子核。
2)乙炔分子中有两个形成键,且sp杂化轨道参与了碳碳键的组成。
和叁键时,首先在双键上发生卤素的加成。
Br
低温
Br
+ Br2
• 炔烃的亲电加成不如烯烃活泼,是由于第一步得到的烯基
碳正离子不如烷基碳正离子稳定。从电离势能来看,从乙炔 分子中移去一个电子所需要的能量比乙烯更大。
(B)与氢卤酸的加成
• 炔烃可和氢卤酸HX(X = Cl、Br、I)加成,但不如烯烃易
进行,不对称炔烃的加成按马尔可夫尼克夫规律进行。
(2)液氨还原
H3C
H
CH3C≡CCH3
Na,NH3(l)
或Li,HNHEt
H
CH3
反应机理:
.R
Na
RC≡CR’
H-N··H2 R
H
·R
Na
·· H
R
R
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
| C H 3 炔 炔烃夏津一中 李泽会课标解读知识再现知识点1:乙炔的组成和结构分子式: 最简式: 结构简式 结构式:结构特点:乙炔分子是直线型分子,分子中有 键,相邻两个键的夹角为知识点2:乙炔的性质物理性质:纯净的乙炔是 、 ,密度比空气 。
由电石生成的乙炔混有 、 等杂质而有特殊臭味。
2、化学性质(1)加成反应:分别写出乙炔与溴水、氯化氢,氢气反应的化学方程式: ①____________②____________③______________ (2)氧化反应①燃烧: 现象②被酸性高锰酸钾溶液氧化: (3)聚合反应:____________nCH CH ≡−−−→引发剂知识点3:实验室制法(了解)2222()H O CaC CH CH Ca OH +→≡↑+知识点4:炔烃(1)炔烃的官能团 通式: 炔烃的化学性质与乙炔类似,炔烃燃烧的化学方程式通式:(2)命名:32CH CH C CH ≡ 33CH CH C C CH -≡-典题解悟:例1 (MCR1996,16)描述33CH CH CH C C CF -=-≡-分子结构的下列叙述中,正确的是( )A 、6个碳原子有可能都在一条直线上B 、6个碳原子不可能都在一条直线上C 、6个碳原子有可能都在同一平面上D 、6个碳原子不可能都在同一平面上 [分析与解答]认真审题,抓住要回答问题的实质:该分子里6个碳原子是否在同一条直线上,是否在同一平面上,然后进行联想、知识的迁移、归纳综合,解答问题。
根据平时已掌握的知识,应联想到下列知识点: (1)CH 4是正四面体结构,CHF 3是四面体结构; (2)CH 3—CH=CH —CH 3的结构为:它的4个碳原子一定不在同一条直线上,而4个碳原子在同一平面上; (3)CHCH 是直线型结构,2个碳原子与2个氢原子都在同一条直线上;(4)CH 3—CH 2—CH 2—CH 3虽然它是不带支链的链烃,但它的碳链不是直线型的,而是锯齿形的,即4个碳原子不可能在同一条直线上。
全面、综合分析上述知识点,深入思考,抓住 C H 3—C H =C H —CC —C F 3分子的结构特点是上述几种烃的结构物点的综合,进而推出该有机物分子里6个碳原子不可能在同一条直线上,但有可能在同一平面上。
正确答案国B 、C 。
变形题:在 分子中,处于同一平面上的原子,最多可能是( )A 、12个B 、14个C 、18个D 、20个例2 1mol 某烃最多能与2mol 氯化氢发生加成的应,生成氯代烃。
1mol 该氯代烃能和6mol 氯气发生取代反应,生成只含碳元素和氯元素的氯代烃。
求该烃的分子式及可能的结构简式。
解析:1mol 此烃能和2mol 氯化氢加成,可知此烃分子结构中含一个—C C—或两个 ,1mol 氯代烃和6mol 氯气发生取代反应后,分子中不含氢原子,说明这种氯代烃分子中含6个氢原子,推知原来的烃分子中含4个氢原子,即该烃为C 3H 4。
答:该烃的分子式为C 3H 4,结构简式为:CH 3—CCH 。
CCC H 3╱C H 3 ╲ ╲HHCCC H 3╱C H 3╲ ╲HH C H 3——C H =C H —C C —C H 3C C╱╲╲夯实双基一、选择题1、1mol气态烃A最多和2molHCl加成,生成氯代烷B,1mol与4molCl2发生取代反应,生成只含碳氯两种元素的C。
则A的分子式为()A、C2H2B、C2H4C、C3H4D、C4H62、具有相同碳原子数的炔烃和二烯烃()A、一定为同分异构体B、一定为同系物C、化学性质完全相同D、是足量H2加成的产物一定是同种物质3、某炔烃与H2反应的最终产物是2—甲基戊烷,这种炔可能是()A、2—甲基—2—戊炔B、2—甲基—1—戊炔C、4—甲基—2—戊炔D、4—甲基—1—戊炔4、下列各组物质完全反应时,能得到纯净物的是()A、1m o l乙炔和4g H2B、1m o l C H4与1m o l C l2C、等物质的量乙烯与C l2D、等物质的量的1,3—丁二烯与B r25、科学家于1995年合成了一种分子式为C200H200含多个碳碳叁键(—C C—)的链状烃,其分子中含碳碳叁键最多是()A、49个B、50个C、51个D、无法确定6、通式为C n H2n-2的某烃,在密闭容器内与O2恰好完全燃烧,温度为150℃,若反应前后压强和温度均不改变,此烃分子式中n值为()A、2B、3C、4D、57、有a L乙炔和乙烯的混合气体,在催化剂作用下跟足量的H2发生加成反应,消耗H21.25a L,则乙烯与乙炔的体积比为()A、1:1B、2:1C、3:1D、4:18、P m o l C2H4在密闭容器中加强热分解,达到平衡时生成m m o l C2H2和n m o l H2。
将平衡混合气体完全燃烧生成水和二氧化碳,要消耗氧气()A、(3m/2+n/2+2P)m o lB、(3P-3m/2-n/2)m o lC、3P m o lD、(3m/2+n/2)m o l9、下列各种物质相互反应时,只产生一种气体的是()A、电石投入到食盐水中B、镁粉投入到溴水中C、镁粉投和到饱和N H4C l溶液中D、炭块投入到热的浓硝酸中10、常温常压下,50m L三种气态烃的混合物与足量的氧气混合后点燃爆炸,恢复到原来状况时,体积共缩小100m L,则三种烃可能是()A、C H4、C2H2、C3H4B、C2H6、C3H6、C4H6C、C H4、C2H6、C3H8D、C2H4、C2H6、C2H211、C a C2和Z n C2、A l4C3、M g2C3、L i2C2等都同属于离子型碳化物。
请通过C a C2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是()A、Z n C2水解生成乙烷(C2H6)B、A l4C3水解生成丙炔(C3H4)C、M a2C3水解生成丙炔(C3H4)D、L i2C2生解生成乙烯(C2H4)12、150℃时,1L混合烃与9L氧气混合,在密闭容器内充分燃烧,当恢复到150℃时,容器内压强增大8%,则该混合烃的组成是()A、甲烷:乙烷=1:1B、丙炔:乙炔=1:4C、乙烯:丁烷=1:4D、乙烯:丁烯=1:4二、填空题13、写出下列各有机物的结构简式:(1)当0.2mol烃A在氧气中完全燃烧时生成CO2和H2O各1.2mol,催化加氢后生成2,2—二甲基丁烷,则A的结构简式为。
(2)某炔烃和H2充分加成生成2,5—二甲基己烷,该炔烃的结构简式为。
(3)某气态烃100mL(标况)与含1.43g溴的溴水恰好完全加成,生成物经测定每个碳原子上都有一个溴原子,该烃的结构简式为。
(4)某烃1mol与2molHCl完全加成,生成的氯代烷烃最多还可以与4mol氯气反应,则该烃的结构简式为。
(5)若0.5mol的有机物恰好与1mol氢气加成生成3—甲基—2—丁醇,则该有机物的结构简式为。
(6)有三种学过的有机物完全燃烧后,生成的CO2和H2O(气)体积比为2:1,试写出它们的结构简式。
(7)有三种学过的有机物完全燃烧后,生成CO2和H2O(气)体积比为1:2,试写出它们的结构简式。
三、计算题14、常温下,一种烷烃A和一种单烯烃B组成混和气体,A或B分子最多只含有4个碳原子,且B分子的碳原子数比A分子的多。
(1)将1升该混合气体充分燃烧,在同温同压下得到2.5升CO2气体。
试推断原混和气体中A和B所有可能的组合及其体积比,并将结果填入下表:(2)120℃时取1升该混合气体与9升氧气混和,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大6.25%,试通过计算确定A和B的分子式。
15、将某有机物进行热分解时得链烃A,经分析该烃的组成为:含C的质量分数为88.24%,含H的质量分数为11.76%,分子量为68。
烃A在室温下易和溴发生反应,1molA与2molBr2反应生成B,B的分子结构中主链上每一个碳原子都连有一个溴原子。
试回答:(1)A的分子式;(2)B的分子式;(3)由A生成B的反应属于反应;(4)推断A的结构简式是,原有机物的结构简式是,名称是。
高考聚焦1、(05,上海)某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如右图。
加热聚丙烯废塑料得到的产物如下表:产物氢气甲烷乙烯丙烯苯甲苯碳质量分数(%)12 24 12 16 20 10 6(1)试管A中残余物有多种用途,如下列转化就可可制取高聚物聚乙炔。
A中残留物(1)电石(2)乙炔(3)聚乙炔写出反应②-③的化学方程式(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有种。
(3)锥形瓶C中观察到的现象。
经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为。
(4)写出C中逸出的气体在工业上的两种用途、。
2、(05,全国理综Ⅱ)下图中的实验装置可用于制取乙炔。
请填空:(1)图中,A管的作用是。
制取乙炔的化学方程式是。
(2)乙炔通入K M n O4酸性溶液中观察到的现象是,乙炔发生了反应。
(3)乙炔通入溴的C C l4溶液中观察到的现象是,乙炔发生了反应。
(4)为了安全,点燃乙炔前应,乙炔燃烧时的实验现象是。
3、(05,全国Ⅲ)右图中每一方框的字母代表一种反应物或生成物:已知气态烃D(其密度在同温同压下是氢气密度的13倍)跟物质F 反应时产生明亮而带浓烈黑烟的火焰。
请写出下列字母代表的物质的化学式(分子式):A、B、E、。
4、(2001·理综)具有单双键交替长链(如:…—C H=C H—C H=C H —C H=C H—…)的高分子有可能成为导电塑料。
2000年诺贝尔化学奖即授予开辟此领域的3位科学家。
下列高分子中可能成为导电塑料的是()A、聚乙烯B、聚丁二烯C、聚苯乙烯D、聚乙炔5、(2002·上海)为了探究乙炔与溴水的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明忆炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去杂质,再与溴水反应,请你回答下列问题:(1)写出甲同学实验中两个主要的化学方程式:、。
(2)甲同学设计的实验(填“能”或“不能”)验证乙炔与溴水发生加成反应,其理由是。
a、使溴水褪色的反应,未必是加成反应b、使溴水褪色的反应,就是加成反应c、使溴水褪色的物质,未必是乙炔d、使溴水褪色的物质,就是乙炔(3)乙同学推测此乙炔中必定含有的一种杂质气体是,它与溴水反应的化学方程式是;在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来验证乙同学的实验方案,将它们的编号装入方框,并写出装置内所放的化学药品。
