超共轭效应
学习参考:有机化学中的电子效应

有机化学中的电子效应电子效应是影响有机化合物反应活性和反应规律的重要因素之一,深入理解有机化学中的电子效应,可以对有机化学的认识由感性向理性方向发展。
电子效应包括诱导效应、共轭效应和超共轭效应;有时三种效应同时存在,表现共同作用的综合结果。
一、诱导效应(Inductive effect )诱导效应是电子效应的一种,是由路易斯(Lewis )首先提出。
路易斯认为,对于有机化合物,诱导效应是由一个电负性较强的原子X 取代了碳原子上的氢原子后,在C -X 键上产生一个极性分布,这个极性分布通过电性诱导作用,在分子中其它键上引起一系列的极性变化,结果在整个分子中产生一个向着X 原子方向的较大范围的电子运动,这种电子运动称为诱导效应:CCδ-电负性比碳弱的元素原子也可以在分子中引起一系列的极性变化,只是所产生的诱导效应的方向刚好相反。
诱导效应是指在有机化合物分子中引入一个基团或原子后,由于原子的电负性差异,导致σ键电子的移动,使分子中的电子云密度分布发生变化,而这种变化不但发生在直接相连的部分,也可以影响到不直接相连的部分。
这种因某一原子或基团的极性而引起电子沿碳链向某一方向移动的效应,称为诱导效应。
如氯丙烷分子中,取代在碳上的氯原子的电负性较强, C -Cl 键产生偶极,使与氯原子连接的第一个碳原子(α-碳原子)产生部分正电荷(δ+),也使第二个碳原子带有部分正电荷,第三个碳原子带有更少的正电荷,依次影响下去。
这种影响的特征是沿着碳链传递,并随着碳链的增长而迅速减弱或消失,一般传递到第三个碳原子就可忽略不计。
诱导效应是一种静电作用,共用电子并不能完全转移到另一原子,只是电子云密度分布发生变化,亦即键的极性发生变化。
δ+ δ+ δ+ δ- CH 3—CH 2—CH 2→Cl1.静态诱导效应(I s )诱导效应分为静态诱导效应和动态诱导效应。
静态诱导效应是由分子本身结构决定的,是分子本身所固有的极化效应,与由极性溶剂或反应试剂等产生的外电场无关。
共轭效应与超共轭效应的定义及特点

1. 共轭效应与超共轭效应的定义及特点共轭效应不饱和的化合物中,有三个或三个以上互相平行的p轨道形成大n键,这种体系称为共轭体系•共轭体系中,n电子云扩展到整个体系的现象称为电子离域或离域键共轭效应:电子离域,能量降低,分子趋于稳定,键长平均化等现象称为共轭效应,也叫做C效应共轭效应的结构特点:共轭体系的特征是各6键在同一平面内,参加共轭的P轨道轴互相平行,且垂直于(T键在的平面,相邻P轨道间从侧面重叠发生键离域•共轭效应与诱导效应相比还有一个特点是沿共轭体系传递不受距离的限制•超共轭效应烷基上C原子与极小的氢原子结合,由于电子云的屏蔽效力很小,所以这些电子比较容易与邻近的n电子(或p电子)发生电子的离域作用,这种涉及到6轨道的离域作用的效应叫超共轭效应•超共轭体系,比共轭体系作用弱,稳定性差,共轭能小•2. 共轭效应共轭的类型2.1.1 n-n共轭通过形成n键的p轨道间相互重叠而导致n电子离域作用称为n-n共轭.参加共轭的原子数目等于离域的电子总数,又称为等电子共轭•我们可以简单地概括为双键,单键相间的共轭就是n-n共轭.例如:共轭体系的分子骨架称做共轭链2.1.2 p- n共轭体系通过未成键的p轨道(包括全满,半满及全空轨道)与形成n键的p轨道的重叠而导致的电子离域作用,称为p- n共轭.包括富电子,足电子,缺电子三种p- n共轭类型.我们也可以简单地理解为:双键相连的原子上的p轨道与n键的p轨道形成的共轭即为p- n共轭.例如:共轭方向及强弱判断共轭效应的方向及强弱直接影响物质的性质和稳定性,因此共轭方向及强弱的判断也就有着非常重要的作用.能够给出电子的称给电子共轭,用符号+C表示.相反,能接受电子的称吸电子共轭,用符号-C表示.卤素,羟基,氨基,碳负离子等与双键直接相连时,X. O. N .C等原子的孤对电子对与n键共轭.由于是由一个原子向共轭体系提供两个电子,相当于使n电子密度增大,所以有给出电子的能力,称为+C效应.一般富电子p- n共轭都属于给电子共轭.例如:中的都是+C效应.当参与共轭的O. N只提供一个电子,而本身电负性大于C原子,所以有使共轭体系电子向O. N转移的能力,因此有-C效应.电负性大于C的原子参与的等电子共轭是吸电子共轭.例如:都是-C效应.大多数共轭效应是由碳的2p轨道与其他原子的p轨道重叠所产生的,当某原子参与共轭的p轨道的形状大小,能量与碳的2p轨道越接近时,轨道重叠越,离域越易,共轭作用越强•即共轭效应的强弱与参与共轭的原子轨道的主量子数有关.n=2时有强的共轭,n>2有弱的共轭,n越大共轭越弱.另外,元素的电负性越小,越容易给出电子,有较强的+C效应.相反,元素的电负性越大,越容易吸引电子,有较强的-C效应.因此共轭效应也有周期性变化.同一类元素随n值增大,共轭减弱;同一周期n值相同,随原子序数增大,电负性增大,给电子共轭效应减弱吸电子共轭主要有电负性决定,电负性越大,吸电子共轭越强.3. 超共轭效应超共轭效应视其电子电子转移作用分为o- n . -p . (- a几种,以o- n最为常见.c- n超共轭丙烯分子中的甲基可绕C—C o键旋转,旋转到某一角度时,甲基中的C-Hc键与C=C的n键在同一平面内C-H -键轴与n键p轨道近似平行,形成l n共轭体系,称为o- n超共轭体系.在研究有机反应时有着重要的应用,在学习不对称烯烃的HX加成反应时,我们以C正离子形成的稳定性来解释马尔科夫尼科夫规则,若应用bn超共轭效应,则不仅说明甲基是推电子的,同时加深了对这一经验规则的深入理解.再如,不饱和烯烃的a-H的特殊活泼性也可以用& n超共轭效应来理解.丙烯的甲基比丙烷的甲H易被取代,丙烷中甲基的H不易被取代.基活泼的多,在液氨中丙烯中甲基的o-p超共轭当烷基与正离子或游离基相连时,C-H上电子云可以离域到空的p空轨道或有单个电子的p轨道上,使正电荷和单电子得到分散,从而体系趋于稳定,称做o-p超共轭体系.简单的说就是C-H的(键轨道与p轨道形成的共轭体系称做^p超共轭体系.如乙基碳正离子即为o-p超共轭体系.参加o-p超共轭的C-H数目越多,正电荷越容易分散,C正离子就越稳定.应用超共轭效应的应用也很广泛,可以应用于对碳正离子稳定性的解释,碳游离基稳定性的解释,甲苯是邻对位定位基的解释,羰基活性的解释等。
σπ超共轭 -回复

σπ超共轭-回复什么是σπ超共轭?σπ超共轭(Sigma-Pi(σπ)conjugation)是一个化学术语,用于描述分子中由σ键与π键之间的共轭作用。
在有机化学中,分子中存在π电子的共轭结构可以影响分子的稳定性、电子分布和反应性质。
σπ超共轭可通过共轭结构中单键上的σ电子对π键上的电子进行共轭,从而调整电子的位置和能量。
共轭结构可以通过将多个共轭的单键轨道进行堆积形成。
通常,这些结构比其他化合物更加稳定,因为其能量低于非共轭结构。
在共轭体系中,σ电子通过交叠与相邻的π轨道发生共振,形成链式的共轭结构。
这种共振现象可以有效地调整π电子的能量和分布,使分子表现出特殊的性质,如色彩、导电性以及化学反应中的特殊选择性。
通常情况下,σ键由两个原子之间的轨道电子形成,而π键则主要由相邻两个原子之间的p轨道电子形成。
分子中,由于原子之间的化学键的形成,会出现σ与π间的相互作用。
具体而言,σ电子对π电子起到了类似共振的作用,通过共振的方式调整π电子的位置与能量。
σπ超共轭对于化学反应的速率和选择性有重要影响。
共振效应可以调整π键的位置和能量,有助于使π键变得更加稳定。
此外,σπ超共轭还可以调整分子的电子分布,从而改变分子的化学反应性质。
例如,共轭体系可以改变分子中化学基团的电子密度,并通过共振向相邻的有机基团传递电荷,从而使分子发生亲电或亲核反应。
此外,共轭结构对分子的光学性质也有重要影响。
共轭体系中的π电子可以吸收特定波长的光,从而使分子显示出颜色。
例如,共轭体系通常呈现出较长的共轭结构,可以吸收可见光区域的光子。
这也解释了为什么很多天然色素、染料和有机化合物呈现出丰富的颜色。
在总体上,σπ超共轭是一种广泛存在于有机化学和分子领域的现象。
共振作用通过调整分子的电子位置和能量,影响着分子的稳定性、反应性质以及光学性质。
进一步理解和研究σπ超共轭的机制,有助于我们更深入地理解化学反应和分子行为,也为设计和开发具有特殊性质的化合物提供了理论依据。
有机化学课后习题答案第二章

有机化学课后习题答案第⼆章2章思考题2.1 分析共轭效应和超共轭效应的异同点,重点阐述σ-π和p-π共轭。
2.2 请举例说明同分异构体中各种异构体的定义及其异同点。
2.3解释甲烷氯化反应中观察到的现象:(1)(1)甲烷和氯⽓的混合物于室温下在⿊暗中可以长期保存⽽不起反应。
(2)(2)将氯⽓先⽤光照射,然后迅速在⿊暗中与甲烷混合,可以得到氯化产物。
(3)(3)将氯⽓⽤光照射后在⿊暗中放⼀段时期,再与甲烷混合,不发⽣氯化反应。
(4)(4)将甲烷先⽤光照射后,在⿊暗中与氯⽓混合,不发⽣氯化反应。
(5)(5)甲烷和氯⽓在光照下起反应时,每吸收⼀个光⼦产⽣许多氯化甲烷分⼦。
2.4 3-氯-1,2-⼆溴丙烷是⼀种杀根瘤线⾍的农药,试问⽤什么原料,怎样合成?2.5 写出烯烃C5H10的所有同分异构体,命名之,并指出哪些有顺反异构体。
2.6 找出下列化合物的对称中⼼.(1)⼄烷的交叉式构象(2)丁烷的反交叉式构象(3)反-1,4-⼆甲基环已烷(椅式构象)(4)写出1,2,3,4,5,6-六氯环已烷有对称中⼼的异构体的构象式(椅式)。
2.7 ⼀个化合物的氯仿溶液的旋光度为+10o, 如果把溶液稀释⼀倍, 其旋光度是多少? 如化合物的旋光度为-350o, 溶液稀释⼀倍后旋光度是多少?2.8 ⼄烯、丙烯、异丁烯在酸催化下与⽔加成,⽣成的活性中间体分别为、、,其稳定性>>, 所以反应速度是>>。
解答2.1 答:在离域体系中,键长趋于平均化,体系能量降低⽽使分⼦稳定性增加。
共轭体所表现出来的这种效应叫共轭效应。
共轭体系分为π-π共轭体系和p-π共轭体系。
超共轭效应是当C—H键与相邻的π键处于能重叠位置时,C—H键的轨道与π轨道也有⼀定程度的重叠,发⽣电⼦的离域现象,此时,键向π键提供电⼦,使体系稳定性提⾼。
它分为-p 和-π超共轭。
超共轭效应⽐共轭效应⼩。
异构现象异同点举例构造异构分了中原互相联结的⽅式和次序不同1. 碳链异构碳链不同2. 位置异构取代基在碳链或环上的位置不同3.官能团异构官能团不同⽴体异构分⼦中原⼦在空间2.3 答:(1)⽆引发剂⾃由基产⽣(2)光照射,产⽣Cl·,氯⾃由基⾮常活泼与甲烷⽴即反应。
3-2 卤代反应选择性——共轭效应和超共轭效应
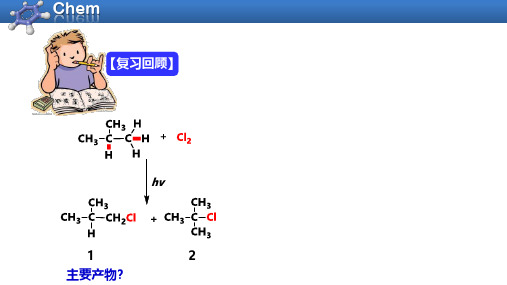
【复习回顾】12主要产物?内容:学习目标:区域选择性和化学选择性学会用超共轭效应和共轭效应来判断自由基稳定性反应活性-选择性原理烷基自由基的稳定性3区域选择性(regioselectivity )和化学选择性(chemoselectivity )1)区域选择性——优先对同一化合物中某个位置的相同化学键发生化学反应1期望值90%10%实验值64%36%期望值75%25%实验值43% 57%2)化学选择性——在一定反应条件下,优先对底物分子中某一化学键起化学反应烯丙基氢苄基基氢N-溴代琥珀酰亚胺(NBS)(1 -溴代四氢吡咯2,5-二酮)(1-bromopyrrolidine-2 ,5-dione)NBS自由基溴代反应机理1. 链引发2. 链增长3)氢原子的相对反应活性设伯氢的反应活性为1,仲氢的反应活性为X,叔氢的反应活性为Y,烯丙基氢(苄基氢)Z:57﹕2X=43﹕6X=436﹕Y=64﹕9Y=5.0680﹕2Z=20﹕3Z=6相对反应活性1o H﹕2o H﹕3o H﹕烯丙基氢(苄基)=1﹕4﹕5.06﹕6烷烃卤代反应中各种氢原子的反应活性顺序为:烯丙基氢(包括苄基氢)>3o H>2o H>1o H>CH47不同碳氢键的键能反应活性中间体的稳定性为什么烷烃卤代反应的氢原子反应活性是烯丙基氢(包括苄基氢)>3o H>2o H>1o H>CH 4?2烷基自由基的稳定性烯丙基氢CH 2=CHCH 2—H 苄基氢PhCH 2—H 1o H CH 3CH 2CH 2—H 2o H (CH 3)2CH —H 3o H (CH 3)3C —H BDE=423 kJ/mol BDE=413 kJ/mol BDE=404 kJ/mol 1)不同C-H 的解离能BDE=376 kJ/mol CH 3—H BDE=439.5 KJ/mol烯丙基自由基苄基自由基BDE=372 kJ/mol2)超共轭效应(hyperconjugation)定义:C -H 键的σ电子的离域效应Robert S. Mulliken (1896-1986)美国化学家1966年获奖Further Reading :Mulliken, R. S. J. Chem. Phys. 1939, 7, 339.大学化学. 2017, 32 (1), 84.σ-π超共轭特点:a)只存在C-H σ键♦强度:直接连接的C-H 键越多,超共轭效应越大 表示:Further Reading :钟成. 化学教育,2018, 39(12): 19.b) 给电子效应无键共振3)共轭效应(conjugation)——C效应定义:在共轭体系内由于原子的相互影响使体系内的π电子或p 轨道电子发生分布发生变化的一种电子效应π-π共轭丙烯醛C=C双键C=O双键3)共轭效应(conjugation)——C效应定义:在共轭体系内由于原子的相互影响使体系内的π电子或p轨道电子发生分布发生变化的一种电子效应π-π共轭p-π共轭乙烯基甲醚3)共轭效应(conjugation)——C效应定义:在共轭体系内由于原子的相互影响使体系内的π电子或p轨道电子发生分布发生变化的一种电子效应烯丙基自由基烯丙基碳正离子p-π共轭p-π共轭特点:a)通过π电子或p轨道孤对电子传递b)长程的c)贯穿整个共轭体系 表示:用弯箭头表示电子的离域价键理论共轭(conjugation)共振(resonance)电子离域电子离域π-π共轭和p-π共轭π-π共轭和p-π共轭都可写出共振式应用范围有局限应用范围比共轭广共轭效应分类甲氧基给电子共轭效应羰基吸电子共轭效应a)吸电子的共轭效应为-C. 如:-N O 2,-C N, -C OOH, -C HO,-C OR, -C O O R ,-C O N HR ,b) 给电子的共轭效应为+C.如:-N H 2(R),-N HCOR,-O H,-O R, -O COR. X 2(卤素)共轭效应强度a) 同周期原子(-C )-=O > -=N R > -=C H 2b )同主族原子(+C )-F> -Cl > -Br > -I(+C )-N R 2>-O R>-Fc)相同原子带更多电正性有更强的-C ,带更多电负性有更强的+C-C=N R>-C=N R+(-C )--O >-O R>-O R+(+C )-O R>-S R诱导效应vs 共轭效应和超共轭效应电子效应种类诱导效应共轭效应超共轭效应产生原因电负性离域效应离域效应适应范围所有分子共轭体系C-H键和共轭键相邻体系电子传递σ键π键σ键传递程度三键内长程短程电子效应给电子和吸电子给电子和吸电子给电子相对强弱弱强中等共轭效应和超共轭效应的相对强弱π-π共轭p-π共轭σ-π超共轭σ-p超共轭4)烷基自由基的稳定性sp3杂化sp2杂化o1o碳自由基甲基自由基更稳定诱导效应碳自由基sp 2杂化sp 3杂化超共轭效应σ-p 超共轭σ-p超共轭5)烯丙基和苄基自由基的稳定性共振式烯丙基自由基苄基自由基26p-π共轭···σ-p 超共轭共轭效应乙烯基自由基3反应活性-选择性原理(The reactivity-Selectivity Principle)溴代反应的选择性为什么比氯代反应高?卤素反应活性:F 2>Cl 2>Br 2>I 21)反应活性-选择性原理: 进攻试剂越活泼,反应的选择性越差Mayr H. , Ofial A. R. Angew. Chem. Int. Ed. 2006, 45, 1844•X + CH 3-H •CH 3+ H-XF Cl Br I568.2431.8366.1298.3-128.9+7.5+73.2+141H (kJ/mol)Ea (kJ/mol)+4.2+16.7+75.3> +141439.3439.3439.3439.3反应过程能量甲烷自由基卤代反应能量变化中间体能量增加能量减少过渡态反应过程能量甲烷自由基卤代反应能量变化中间体过渡态♦活化能E a :发生化学反应所需最低能量(反应物能量与过渡态能量之差))中间体:发生化学反应的中间产物,一般为碳正离子、碳负离子、自由基等2)如何看能量线图 过渡态:发生化学反应经过的能量最高中间状态,过渡态旧键未完全断裂,新键未完全形成反应过程能量甲烷自由基卤代反应能量变化中间体过渡态E a 1=16.7 KJ/molE a 2=8.3KJ/mol反应物阻力大阻力小反应过程甲烷自由基卤代反应能量变化中间体过渡态反应物E a 1=16.7 KJ/molE a 2=8.3KJ/mol能量♦活化能E a :发生化学反应所需最低能量(反应物能量与过渡态能量之差)) 中间体:发生化学反应的中间产物,一般为碳正离子、碳负离子、自由基等2)如何看能量线图❶过渡态:发生化学反应经过的能量最高中间状态,过渡态旧键未完全断裂,新键未完全形成❹反应热∆H :化学反应中吸收或放出的热量(反应物与产物能量之差)反应过程甲烷自由基卤代反应能量变化中间体过渡态反应物E a 1=16.7 KJ/molE a 2=8.3KJ/mol△H=-110kJ/mol△H=-101kJ/mol产物能量能量接近的有关物种结构也相似,过渡态的结构与相隔最近的稳定物种结构类似。
超共轭效应名词解释

超共轭效应名词解释
嘿,你知道超共轭效应吗?这玩意儿可神奇啦!就好像一群小伙伴
手拉手一起发挥作用一样。
比如说,在有机化学里呀,超共轭效应就像是一场无声的协作。
拿
烯烃来说吧,那碳氢键和碳碳双键之间,就存在着这种奇妙的超共轭
效应呢!你想想看,这不就像是一群小伙伴相互配合,让整个体系变
得更加稳定嘛!
再比如烷烃里,碳氢键和碳碳单键之间也有这种效应在起作用。
它
可不是那种轰轰烈烈的大变化,而是悄然地在背后助力,让整个分子
的性质都有所不同哦!
“哎呀,这超共轭效应到底是怎么一回事呀?”你可能会这么问。
嘿嘿,简单来说,它就是电子的一种微妙转移和共享。
就好比大家一起
做一件事,每个人都出一点力,最后事情就变得更容易完成啦!
在化学反应中,超共轭效应的影响可不小呢!它能改变反应的速率、选择性等等。
就好像是给化学反应这辆车加了一把力,让它跑得更快
或者跑得更稳。
想象一下,如果没有超共轭效应,那有机化学的世界会变得多么不
一样呀!很多反应可能就不会那么顺利地进行,很多化合物的性质也
会大相径庭。
所以呀,超共轭效应真的是超级重要的呢!它就像一个隐藏在化学世界里的小魔法,默默地发挥着它的作用。
你现在是不是对超共轭效应有了更清楚的认识啦?反正我是觉得它超级有趣又超级重要的!。
超共轭效应,场效应and空间效应

[例1]邻氯苯基丙炔酸的酸性比氯在间位或对位小。
C C COOH C C COOH
场效应
诱导效应
Cl
+ Cl δδ -
[例2] 顺、反丁烯二酸第一酸式电离常数和第二酸式 电离常数的明显差异。
H C HOOC C COOH H C H H C
HOOC
COOH
H C C
COO
-
H C C
COO-
COOH
• 例3.
N + BMe3 N
+
BMe3
3. I-张力 (internal strain,内张力) • 某些环状化合物中,由于键的扭曲所产生的分子内部 固有张力叫做I—张力(Internal Strain,内张力), 主要表现为角张力(Angle Strain)。
• 例1. 环丙烷衍生物1-甲基-1-氯环丙烷离解为碳正 离子比相应的开链化合物叔丁基氯要 慢 。
(一) 空间效应与原子(或基团)的大小和形状有关
例1
OH H3C CH3 H3C NO2
OH
CH3 NO2
(Ⅰ) pKa=7.16
(Ⅱ) pKa=8.24
图1-3. 对硝基苯酚的p轨道离域
• [例2]联苯的邻位有较大的取代基时,常常因空间 效应的干扰而使σ键的自由旋转受阻,呈现了对 映异构现象。
COOH
H C C
COO
-
H C C
COO-
COOH
H
H
COOH
pKa1 3.03
1.92
pKa2 4.34
6.59
原因二: 顺式丁烯二酸第一个氢电离后与另一 个羧基形成氢键,体系能量降低,促进一 级电离,抑制二级电离。
超共轭效应场效应空间效应

场效应和诱导效应
它们通常难以区分,往往同时存在而且作用方向 一致,实际上场效应是诱导效应的一种表现形式, 所以也把场效应和诱导效应总称为极性效应。但在 某些场合场效应与诱导效应的方向相反,从而显示 出场效应的明显作用。
例如:邻氯苯基丙炔酸的酸性比氯在间位或对位的小。
C C COOH Cl
C C COOH
(Isopropyl)
(CH3)3C-
(t-Butyl)
1.0
SN2 反应
0.28
0.03
乙氧基从背后进攻
4.2× 10-5
R越大,位阻越大
13
卤代烷在乙醇解的SN2反应中,随着R体积的大小不同, 对乙氧基从背面进攻的难易,由于空间阻碍不同而反应 速度各异。
[例2] SN1反应 P51表2-15
R
RC X R 109° 28'
sp3-四面体
R
120°
C +X RR
sp2-平面三角型
SN1反应 形成正碳离子的 一步 键角的变化
缓解了基团的 拥挤程度
来自于离去基团背后的张力-B-张力 (back strain)
14
张力对反应活性的影响
当胺同质子酸作用时,其碱性强度顺序为:
R3N > R2NH > RNH2 > NH3
看出。
叔丁苯 异丙苯 乙苯 甲苯
μ(D) 0.70
0.65
0.58
0.38
1
进行苯环上的硝化反应和卤代反应时,得到的结果却 恰恰相反。
溴化 硝化
CH3 CH3CH2 340 290 14.8 14.3
(CH3)2CH180 12.9
(CH3)3C110 10.8
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(hypercongugative effect)
超共轭效应的提出 超共轭体系 静态和动态超共轭效应 超共轭效应与反应方向 关于超共轭效应的讨论
超共轭效应的提出
R CH2 Br C5H5N R CH2 NC5H5 Br
R=硝基(亲电基) R=烷基(供电基)
反应速度降低 反应速度增加
R
超共轭效应表示:
•由于电子的离域,上式中C-C单键之间的电子云密 度增加,所以丙烯的C-C单键的键长(0.150nm)缩短.(一 般烷烃的 C-C 单键键长为0.154nm)
H H
H H H C H C O
H
C
H H H C N
O
H
O
H H
C
HC CH2
超共轭效应(,P共轭效应) A正离子 •带正电的碳原子具有三个sp2杂化轨道,还有一个空 p 轨 道. •碳氢键和空p轨道有一定 程度的交盖, 使电子离域 并扩展到空p轨道上. 使正 电荷有所分散,增加碳正离 子的稳定性.
•和游离基碳原子相连的 碳氢键越多,也就是能起 超共轭效应的碳氢键越多,越有利于使电子与单 电子配对,就可使游离基的能量更低,更趋于稳定.
超共轭效应(, 共轭效应)
C-H键通过单键与饱和碳原子相连,如果这个 碳原子在反应中趋于不饱和,那么在反应中能 表现出下面的共轭关系
H
H C C
C
C
H
X
X
慢
C
C
+
X
ClHg
ClHg
CH2
CH
CH2
CH
OH
Cl
, 共轭效应在静态分子中不明显只有在试剂的 进攻下,才会表现出这种效应的存在
C
CH2
+
CH3 CH3 CH3 C
+ +
CH2
由实验事实可知烷基超共轭效应强弱 ,由烷基中与不饱和键处于共轭状态 的C-H键数目而定. C-H键越多,超共 轭效应越强
超共轭体系
1σ-π超共轭 2σ-p超共轭 3σ-σ超共轭
超共轭效应(,共轭效应) — 轨道和碳氢轨 道的交盖,使原来基本上定域于两个原子周围的电子 云和电子云发生离域而扩展到更多原子的周围,因而 降低了分子的能量,增加了分子的稳定性.这种离域效 应叫为例,碳原子的sp3杂化轨道与氢原子的1s轨 道重叠为C-H键,由于H原子很小,它好比嵌在 碳的原子轨道中,而电子云密度相对地向碳集中 在它和π键相邻时,就发生电子的离域现象,即σ 键与π键之间的电子偏移,使体系变得较稳定。
H CH2=CH-C-H H
H H CH3
H CH3 CH3
C
+ CH2
CH2
Br C5H5N
R
CH2
NC5H5 Br
CH3C
3
> CH3CH 2
> CH3CH2 > CH3
根据实验数据,不同烷基对反应加速程度影响如下
CH3 > CH3CH2 > CH3CH > CH3C 2 3
此结果与烷基诱导效应相反
烷基离反应中心较远,立体障碍可忽略. 根据此种情况故贝克和雷赛提出:C- H键和不饱和基团相连接时,它通过单 键和不饱和体系发生一定程度的共轭
•和碳正原子相连的碳氢键越多,也就是能起超共轭效应 的碳氢键越多,越有利于碳正原子上正电荷的分散,就可 使碳正离子的能量更低,更趋于稳定.
超共轭效应(,P共轭效应)
B游离基 • 带单电子的碳原子具有三个sp2杂化轨道,还有一个有 单电子 p 轨道. • 碳氢键和单电子 p轨道有一定 程度的交盖, 使电子离域 并扩展到单电子p轨道上. 使电子可能 与 单电子配对,增加游离基的稳定性. 超共轭
