基础化学复习题库
基础化学复习题

一、选择题1.下列关于电子云的说法不正确的是( )A. 电子云是描述核外某空间电子出现的几率密度的概念;B. 电子云是│ψ│2的数学图形;C. 电子云有多种图形,黑点图只是其中一种;D. 电子就象云雾一样在原子核周围运动,故称为电子云.2.下列说法不正确的是( )A. 氢原子中,电子的能量只取决于主量子数n;B. 多电子原子中,电子的能量不仅与n有关,还与l有关;C. 波函数由四个量子数确定;D. m s=±½表示电子的自旋有两种方式.3.n=4时m的最大取值为( )A. 4B. ±4C. 3D. 04.2p轨道的磁量子数可能有( )A. 1.2B. 0.1.2C. 1.2.3D. 0.+1.-15.原子中电子的描述不可能的量子数组合是( )A. 1.0.0.+½B. 3.1.1.-½C. 2.2.0.-½D. 4.3.-3.-½6.下列电负性大小顺序错误的是( )A. H>LiB. P<NC. Si>CD. Cl>Br7.下列说法错误的是( )A、电子的钻穿效应越强,电子能量越低;B、电子所受屏蔽效应越强,电子能量越低;C、n值相同,l越小,则钻穿效应越强;D、屏蔽效应和钻穿效应的结果引起能级交错.8.关于影响屏蔽常数σ大小的因素,正确的说法是( )A. 被屏蔽电子的l值越小,σ值越大;B. 屏蔽电子的n值越小,σ值越大;C. 被屏蔽电子离核越远,σ值越大;D. 屏蔽电子的数目越少,σ值越大;9.基态原子的核外电子在原子轨道上的能量大小关系不正确的是()A. 3s>2sB. 3p>3sC. 4s>3dD. 3d>3s10.下列关于原子半径的周期性变化描述不严谨的是()A.元素的原子半径随元素原子序数的递增呈周期性变化B.同周期元素随着原子序数的递增,元素的原子半径自左到右逐渐减小C.同主族元素随着原子序数的递增,元素的原子半径自上而下逐渐增大D.电子层数相同时,有效核电荷数越大,对外层电子的吸引作用越强11.下列各离子的电子排列式错误的是()A. Na+1s22s22p6B. F¯1s22s22p6C N3+ 1s22s22p6 D. O2¯1s22s22p612.下列有关认识正确的是()A.各电子亚层的原子轨道数量按s、p、d、f的顺序分别为1、3、5、7 B.各电子层的电子亚层能级都是从s能级开始至f能级结束C.各电子层含有的电子亚层数为n-1D.各电子层含有的电子数量为2n213.Ca原子的电子排布式写成1s22s22p63s23p63d2,其违背了()A.能量最低原理B.能量守恒原理C.泡利不相容原理D.洪特规则14.共价键最可能存在于()。
化学基础复习题(附答案)

化学基础复习题(附答案)一、单选题(共100题,每题1分,共100分)1、下列化合物中,不能发生酯化反应的是A、HCOOHB、CH3COOHC、CH3CH2OHD、CH3CHO正确答案:D2、能与浓溴水反应生成白色沉淀的是()A、乙烯B、苯酚C、乙醇D、苯正确答案:B3、乙醇沸点(78.3℃)与分子量相等的甲醚沸点(-23.4℃)相比高得多是由于 ( )A、乙醇能形成分子间氢键,甲醚不能B、甲醚能与水形成氢键C、甲醚能形成分子间氢键,乙醇不能D、乙醇能与水形成氢键,甲醚不能正确答案:A4、分子中含有碳碳双键的是( )A、苯B、丙烯C、乙炔D、聚乙烯正确答案:B5、下列使蛋白质变性的物理方法是( )A、紫外线照射B、加重金属盐C、加酸D、加有机溶剂正确答案:A6、一定温度下,加水稀释弱酸,数值将减小的是( )B、αC、pHD、[H+]正确答案:D7、与溶液渗透压大小有关的因素是A、溶质颗粒的大小B、溶质的颗粒总数C、溶质的性质D、溶剂的性质正确答案:B8、欲配制PH=4.50的缓冲溶液,若用HAc及NaAc配制,则c(HAc)及c(NaAc)的浓度之比为(HAc的pKa=4.76)( )A、4.76/1B、1/4.76C、1.78/1D、1/1.78正确答案:C9、下列哪项不属于羧酸衍生物()A、乳酸B、甲酸乙酯C、乙酰胺D、乙酸酐正确答案:A10、苯酚俗称()A、石炭酸B、溴苯C、苄醇D、甘油正确答案:A11、在常温下,pH=6的溶液与pOH=6的溶液相比,其氢离子浓度A、高10倍B、高2倍C、高100倍正确答案:C12、单糖与浓酸和α-萘酚反应能显紫色,这一鉴定糖的反应叫( )A、糖脎反应B、Seliwanoff反应C、成苷反应D、Molish反应正确答案:D13、下列不能做为配位体的物质是( )A、C6H5NH2B、CH3NH2C、NH4+D、NH3正确答案:C14、为了保证某工作液的PH值为4--5,应选用( )缓冲对配制缓冲溶液。
基础化学复习题
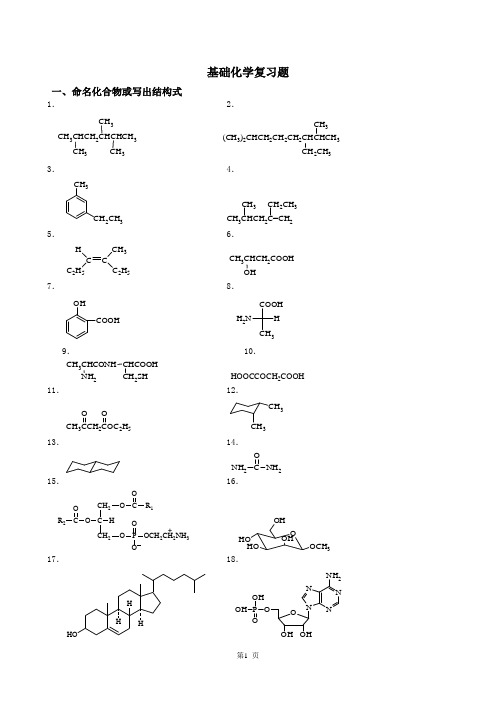
基础化学复习题一、命名化合物或写出结构式1. 2.CH 3CHCH 2CHCHCH 3CH 3CH 3CH 3(CH 3)2CHCH 2CH 2CH 2CHCHCH 3CH 2CH 3CH 33. 4.CH 3CH 2CH 3 CH 3CHCH 2C=CH 2CH 3CH 2CH 35. 6.C C H C 2H 53C 2H 5CH 3CHCH 2COOHOH7. 8.OHCOOHCOOHH 2NH CH 39. 10.CH 3CHCONH NH 2CHCOOHCH 2SH HOOCCOCH 2COOH11. 12.CH 3CCH 2COC 2H 5O OCH 3CH 313. 14. C NH 2NH 2O15. 16.CH 2C CH 2O O COR 1HO C P OCH 2CH 2NH 3O OO R 2+O HOHOOHOCH 3OH17. 18.HHH HONNNN NH 2OOHOH OOP OH OH19.苯酚 20.顺-2-丁烯 21.丙酮 22.乙酰苯胺 23.柠檬酸24.乙酸乙酯 25.阿司匹林 26.油酸 27.卵磷脂 28.葡萄糖29.半胱氨酸 30.赖氨酸二、是非题(正确的打✓,错误的打×)1.烷烃分子都是非极性分子。
()2.环己烷有两种构象,一种是椅式构象,一种是船式构象。
()3.在过氧化物存在下,烯烃与氯化氢的加成遵循马氏规则。
()4.凡是双键碳原子都是sp2杂化。
()5.乙烷有两种构象,一种是重叠式构象,一种是交叉式构象。
()6.碳原子的类型分为伯、仲、叔、季碳,氢原子的类型也分为伯、仲、叔、季氢。
()7.具有旋光性的物质一定存在对映异构现象。
()8.一对对映体的混合物能用蒸馏的办法分开。
()9.左旋2-丁醇和右旋2-丁醇的混合液可用蒸馏方法分开。
()10.只有一个手性碳原子的分子一定具有旋光性。
()11.一个分子结构中含有3个手性碳原子,则这个分子一定是手性分子。
基础化学题库

第二章原子结构一、选择题1、在多电子原子中,决定电子能量的量子数为()A、nB、n、l、mC、n、l、m、mD、n、ls2、在多电子原子中,决定电子原子轨道的量子数为()A、nB、n、l、mC、n、l、m、mD、n、ls3、在多电子原子中,决定电子运动状态的量子数为()D、n、lA、nB、n、l、mC、n、l、m、ms4、下列多电子原子能级能量最高的是()A、n=1,l=0B、n=2,l=0C、n=4,l=0D、n=3,l=25、下列各元素的基态原子的电子排布式违背了能量最低原理的是()A、C 1s22s32p1B、Li 1s22p1C、N 1s22s22px22py1D、O 1s22s22p46、2Px代表的意义是()A、Px轨道上有2个电子B、2个Px轨道C、Px轨道可以有两种伸展方向D、第二电子层上沿X轴方向伸展的P轨道7、在下列各电子亚层中,能容纳电子数最多的是()A、3dB、4pC、6sD、4f8、描述3S电子运动状态的量子数正确的一套是()A、(3,2,0,+1/2)B、(3,0,0,-1/2)C、(3,1,0,+1/2)D、(3,1,1,-1/2)9、下列各元素的基态原子的电子排布式违背了鲍利不相容原理的是()A、C 1s22s32p1B、Li 1s22p1C、N 1s22s22px22py1D、O 1s22s22p410列各元素的基态原子的电子排布式违背了洪特规则的是()A、C 1s22s32p1B、Li 1s22p1C、N 1s22s22px22py1D、O 1s22s22p411、描述2p运动状态的量子数正确的一套是()A、(2,1,0,1/2)B、(2,1,2,1/2)C、(2,0,1,1/2)D、(2,2,1,1/2)12、指出4d能级有几个轨道()A、1B、2C、4D、513、指出4f能级有几个轨道()A、2B、3C、7D、914、某基态原子的某电子量子数组合是(2,0,0,+1/2),它的轨道符号是()A、2sB、2PxC、2PyD、2Pz15、在多电子原子中,决定电子层的量子数为()D、n、lA、nB、n、l、mC、n、l、m、ms16、某一电子有下列成套量子数(n,l,m,m),其中不可能存在的是()sA、(3,2,2,1/2)B、(3,1,-1,1/2)C、(1,0,0,1/2)D、(2,-1,0,1/2)17、基态26Fe原子的最后填充的电子的四个量子数分别为()A、3,0,0,+1/2B、3,1,1,+1/2C、.3,2,0,+1/2D、4,0,0,+1/218、某一电子有下列成套量子数(n,l,m,ms),其中不可能存在的是()A、(3,3,2,1/2)B、(3,1,-1,1/2)C、(1,0,0,1/2)D、(2, 1,0,1/2)19、某一电子有下列成套量子数(n,l,m,ms),其中不可能存在的是()A、(3,2,2,1/2)B、(3,1,-1,1/2)C、(1,0,1,1/2)D、(2, 1,0,1/2)20、表示原子轨道角度分布的函数是()A、R(r)B、Y(Θ,r)C、. R(r) 2D、Y(Θ,r)221、同一原子中,可能存在下列量子数的两个电子()A、(1,1,0,+2/1 )和(1,0,0,-2/1 )B、(2,0,1,+2/1 )和(2,0,0,-2/1 )C、(3,2,0,-2/1 )和(3,2,1,-2/1 )D、(1,0,0,-2/1 )和(1,0,0,-2/1 )22、下列状态中不是基态的是()A、通常条件的气体H。
基础化学试题库(附参考答案)

基础化学试题库(附参考答案)一、判断题(共100题,每题1分,共100分)1.在实验室里,倾注和使用易燃、易爆物时,附近不得有明火。
A、正确B、错误正确答案:A2.缓冲溶液的缓冲能力是无限的。
A、正确B、错误正确答案:B3.当某弱酸稀释时,其解离度增大,溶液的酸度也增大。
A、正确B、错误正确答案:B4.用Na2C2O4标定KMnO4,需加热到70~80℃,在HCl介质中进行。
A、正确B、错误正确答案:B5.将0.1mol/LHAc稀释为0.05mol/L时,H+浓度也减小为原来的一半。
A、正确B、错误正确答案:B6.对于同类型的难容电解质,在一定的温度下,Ksp越小。
其溶解能力越小。
A、正确B、错误7.某物质如果含有6.02×1023个粒子,它的物质的量就是1mol。
A、正确B、错误正确答案:A8.由于溶液的体积随温度变化而变化,所以物质的量浓度也随温度的变化而改变。
A、正确B、错误正确答案:A9.标准物质在分析中主要用于分析仪器的校准和分析方法的评价。
A、正确B、错误正确答案:A10.质量百分比浓度是溶液的质量与溶质的质量的百分比。
A、正确B、错误正确答案:B11.在滴定分析中一般利用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定,这一点称为化学计量点。
A、正确B、错误正确答案:B12.将醋酸溶液加水稀释一倍,则溶液中的氢离子浓度就减少到原来的二分之一。
A、正确B、错误13.溶液的体积随温度变化而变化,但物质的量浓度不受温度变化的影响。
A、正确B、错误正确答案:B14.实验中,应根据分析任务、分析方法对分析结果准确度的要求等选用不同等级的试剂。
A、正确B、错误正确答案:A15.定量分析中产生的系统误差是可以校正的误差。
A、正确B、错误正确答案:A16.EDTA滴定某金属离子有一允许的最高酸度(PH值),溶液的PH 再增大就不能准确滴定该金属离子了。
A、正确B、错误正确答案:B17.在溶解过程中,溶质和溶剂的体积之和一定就是溶液的体积。
基础化学复习题

基础化学复习题work Information Technology Company.2020YEAR基础化学复习题单项选择题1. 理想气体绝热自由膨胀时,则 BA . 0U ∆>,0S ∆=B .0U ∆=,0S ∆>C . 0U ∆>,0S ∆>D .0U ∆=,0S ∆= 2.下面关于标准摩尔生成焓的描述中,不正确的是 CA.生成反应中的单质必须是稳定的相态单质B.稳态单质的标准摩尔生成焓被定为零C.生成反应的温度必须是298.15KD.生成反应中各物质所达到的压力必须是100KPa3. 理想气体在可逆的绝热膨胀过程中是 BA . 内能增加B . 熵不变C . 熵增大D . 温度不变 4. 封闭系统中吉布斯函数G 与热力学U 的关系是 DA. G > UB. G < UC. G = UD. 无固定关系A. 零级反应 B . 一级反应 C . 二级反应 D . 三级反应5.工作在100℃和25℃的两个大热源间的卡诺机其效率是 AA . 20%B . 25%C . 75%D . 100%6.若将人作为一个体系,则该体系是 CA .孤立体系 B.封闭体系 C.敞开体系 D.半封闭系统7.在100℃,101.325 kPa 下,1 mol 水全部向真空气化为100℃,101.325 kPa 的水蒸气,则该过程为 BA . ΔG < 0,不可逆B . ΔG = 0,不可逆C . ΔG > 0,不可逆D . ΔG < 0,可逆 8. 液态水在100℃及101.325 kPa 下汽化,则该过程的 DA . ΔH = 0B . ΔS = 0C . ΔA = 0D . ΔG = 09.对于封闭体系的热力学 , 下列各组状态函数之间的关系正确的是 B A . A > U B . A < U C . G < U D . H< A10. 下列各式表示偏摩尔量的是 AA . )(..(B A n P T B A n U≠⎪⎭⎫ ⎝⎛∂∂ B . )(..S (B A n P B A n H ≠⎪⎭⎫ ⎝⎛∂∂ C . )(..(B A n V T B A n A≠⎪⎭⎫ ⎝⎛∂∂ D . )(..B (B A n P T B A n ≠⎪⎭⎫ ⎝⎛∂∂μ 11.刚性绝热箱内发生一化学反应,则反应体系是 AA.孤立体系B.敞开体系C.封闭体系D.绝热体系 12. 已知反应C (s )+O 2(g) →CO 2 (g)的ΔH ,下列说法中不正确的是 C A . ΔH 为CO 2(g)的生成热 B . ΔH 为C (S )的燃烧热 C . ΔH 与反应的ΔU 数值不等 D . ΔH 与反应的ΔU 数值相等13.封闭系统中吉布斯函数A 与热力学U 的关系为 BA . A > UB . A < UC . A = UD . 无固定关系14. 热力学第三定律可以表示是 BA . 在0K 时,任何晶体的熵等于零B . 在0K 时,纯物质完美晶体的熵等于零C. 在0℃时,任何晶体的熵等于零 D . 在0℃时,完美晶体的熵等于零 15. 一级反应完成99.9%所需时间是完成50%所需时间是 C A . 2倍 B . 5倍 C . 10倍 D . 20倍 16. 选出下列性质参数中属于容量性质的量是 CA . 温度TB . 浓度cC . 体积VD . 压力p17. 在恒温,恒压下,已知反应A →2B 和2A →C 的反应热分别为ΔH 1和ΔH 2,则反应C →4B 的反应热ΔH 3是 DA .2ΔH 1+ΔH 2B . ΔH 2-2ΔH 1C . ΔH 1+ΔH 2D . 2ΔH 1-ΔH 2 18. 不挥发的溶质溶于溶剂中形成溶液之后将会引起C A . 熔点升高 B . 沸点降低C . 蒸汽压降低D . 总是放出热量19.下列是化学势的是 C A . )(..(B A n P T B A n U≠⎪⎭⎫ ⎝⎛∂∂ B . )(..(B A n P T B A n H ≠⎪⎭⎫ ⎝⎛∂∂ C . )(..(B A n V T B A n A≠⎪⎭⎫ ⎝⎛∂∂ D . )(..(B A n V T B A n G ≠⎪⎭⎫ ⎝⎛∂∂ 20. 在 - 10 °C, 101.325kPa 下,水的化学式势μ(水)与冰的化学势μ(冰)的大小关系应为 CA . μ(水)=μ(冰)B . μ(水) >μ(冰)C . μ(水) <μ(冰)D . 无法确定21. 理想气体从状态p 1V 1T 自由膨胀至p 2V 2T 。
化学基础习题库及答案

化学基础习题库及答案一、单选题(共100题,每题1分,共100分)1、下列化合物能与托伦试剂反应生成银镜的是()A、丙酸B、丙酮C、甲醇D、甲酸正确答案:D2、下列化合物中酸性最强的是()A、α-羟基丙酸B、β-羟基丙酸C、丙酸D、α,β-二羟基丙酸正确答案:D3、在氨溶液中加入少量盐酸,使:( )。
A、溶液OH-浓度变小B、NH3的Kb变大C、NH3的α增大D、pH值保持不变正确答案:C4、下列说法正确的是:()A、增大反应物的浓度,平衡向生成物浓度增大的方向移动。
B、有气体存在的可逆反应,该变压强,都会使化学平衡移动。
C、加热能使吸热反应速率加快,放热反应速率减慢,平衡向吸热反应方向移动。
D、凡能影响反应速率的因素,都能使化学平衡移动正确答案:A5、下列可用来区分葡萄糖和果糖的是( )A、斐林试剂B、苯肼C、托伦试剂D、赛利凡诺夫试剂正确答案:D6、 CH3CH2CH2CH3与CH3CH(CH3)2是什么异构体?( )A、碳架异构B、位置异构C、官能团异构D、互变异构正确答案:A7、既能发生水解反应,又能发生银镜反应的物质是()A、麦芽糖B、蔗糖C、丙酸甲酯D、葡萄糖甲苷正确答案:A8、欲使蛋白质沉淀而不变性,应选用( )A、浓硫酸B、重金属盐C、甲醛D、硫酸铵正确答案:B9、人体血浆中最重要的缓冲对是A、H2PO4 — HPO42-B、HCO3 — CO32-C、H2CO3 — HCO3-D、HPO42 — PO43-正确答案:C10、下列试剂中,常用于糖尿病患者尿液中葡萄糖含量检查的是( )A、FeCl3B、溴水C、班氏试剂D、茚三酮溶液正确答案:C11、医用生理盐水的质量浓度是多少?A、8g/LB、10g/LC、9g/LD、7g/L正确答案:C12、有关简单的饱和链烃的叙述:①都是易燃物;②特征反应都是取代反应;③相邻两个烷烃在分子上组成相差一个甲基。
正确的是( )A、②和③B、①和②C、①D、①和③正确答案:B13、可以用来判断油脂不饱和程度的是( )A、酸值B、皂化值C、碘值D、密度正确答案:C14、某缓冲溶液的共轭碱的Kb=1.0×10-6,从理论上推算该缓冲溶液的缓冲范围是( )A、5~7B、6~8C、7~9D、5~6正确答案:C15、 HPO42-的共轭酸是( )A、H2PO4-B、OH-C、H3PO4D、PO43-正确答案:A16、下列哪种物质具有致癌性( )A、蒽B、菲C、萘D、苯并芘正确答案:D17、下列有机物分子中不含有羧基的是()A、苯甲酸B、过氧乙酸C、乳酸D、苯酚正确答案:D18、人的肠胃不能消化的多糖是. ( )A、纤维素B、糖原C、右旋糖酐D、淀粉正确答案:A19、将淀粉碘化钾混合溶液装在半透膜中,浸泡在盛有蒸馏水的烧杯中,过一段时间后取出杯中液体进行试验,不能证明半透膜有破损的是:( )A、加入碘水变蓝B、加入碘化钠不变蓝C、加入FeCl3 溶液变蓝D、加入溴水变蓝正确答案:B20、下列化合物中无顺反异构现象的是()A、2-氯-2-丁烯B、2-甲基-2-丁烯C、3-甲基-2-戊烯D、2-丁烯正确答案:B21、下列不属于有机物的是 ( )A、HCOOHB、C2H4C、CH3OHD、HCN正确答案:D22、不能配制 pH = 7 左右的缓冲溶液的共轭酸碱混合物是( ) (已知HClO :K = 3.4 × 10-8 H2CO3 :K1 = 4.2 × 10-7 ,K2 = 5.6 × 10-11 H3PO4 :K1 = 7.6 × 10-3 ,K2 = 6.3 × 10-8 ,K3 = 4.4 × 10-13)A、NaHCO3-Na2CO3B、NaH2PO4-Na2HPO4C、HClO-NaClOD、H2CO3-NaHCO3正确答案:A23、构成蛋白质的基本单位是( )A、多肽B、β-氨基酸C、α-氨基酸D、肽链正确答案:C24、β-醇酸加热脱水生成( )。
大一基础化学复习题

基础化学复习题第一章溶液和胶体一、选择题1、将98%的市售浓硫酸500ml缓慢加入200g水中,所得到的硫酸溶液的质量百分浓度为(C)A 49%B 24.5%C 80.5%D 70%2、糖水的凝固点为(C)A 0℃B 高于0℃C 低于0℃D 难以判断3、下列0.1mol/L溶液的凝固点最高的是( B)A KClB CH3COOHC HClD K2SO44、在温度为375K时,沸水的压力应为(C )A 1000KPaB 10KPaC 高于100KPaD 低于100KPa5、在200g水中含有9g某非电解质溶液,其凝固点为-0.465℃,则溶液的摩尔质量为(D )A 135B 172.4C 90D 1806、某温度时,具有相同体积相同渗透压的甲醛和葡萄糖溶液中,甲醛和葡萄糖的质量比为(B )A 6:1B 1:6C 1:3D 3:17、胶体溶液中决定溶胶电性的物质时(B )A胶团B电位离子C反离子D胶粒8现有蔗糖,氯化钠,氯化钙三种溶液,它们的浓度均为0.1mol/L,则渗透压由高到低的顺序是(B )A CaCl2 < NaCl<C12H22O11B C12H22O11< NaCl < CaCl2C NaCl< C12H22O11<CaCl2D C12H22O11<CaCl2< NaCl9质量分数为5.8%NaCl溶液产生的渗透压接近:( C )(M(葡萄糖)=180g/mol,M(蔗糖)=342g/mol,M(NaCl)=58.5g/mol)A 5.8% 蔗糖溶液B 5.8% 葡萄糖C 2.0mol/L蔗糖溶液D 1.0mol/L葡萄糖溶液10在下列溶液组成标度的表示方法中,与温度有关的是( A )A 物质的量浓度B 质量分数C 物质的量分数D 质量摩尔浓度11非电解质稀溶液的蒸汽压下降,沸点升高和凝固点下降的数值取决于(B )A溶质的本性 B 溶液的质量摩尔浓度 C 溶液的体积 D 溶液的温度12 在等量的水中,分别加入质量相同的葡萄糖(M=180),蔗糖(M=342),KCl(M=74.5),CaCl2(M=111),其蒸汽压下降最少的是(A )A蔗糖溶液 B KCl溶液 C CaCl2 溶液D葡萄糖溶液13.某温度下,1mol/L糖水的饱和蒸汽压为P1,1mol/L的盐水的饱和蒸汽压为P2,则( B)A P2>P1B P2<P1C P2=P1D 无法判断二判断题1.由于溶液中溶质和溶剂的量是一定的,所以温度变化不影响溶液的浓度(×)2.难挥发非电解质稀溶液的依数性,不仅与溶液的浓度成正比,而且与溶质的种类有关(×)3.难挥发非电解质稀溶液在凝固时实际上是溶剂分子凝固(√)4.植物在较高温度下耐干旱是因为细胞液的蒸汽压下降所致(√)5. 渗透压力比较高的溶液,其渗透浓度也一定比较大(√)三填空题1 溶液的沸点升高是由于其蒸汽压 降低 的结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4:在集气瓶里,将H2S和SO2两种气体充分混合后,可观察到得现象是()
A.有黄色粉末产生B.有棕色烟生成
C. 有红色沉淀生成 D. 有黑色固体生成
5.下列各组物质在一定条件下反应,其中生成+3价铁盐的是( )
A.铁和稀硫酸B.铁和氯化铜溶液C.铁和氯气D.铁和氧气
6:氨能用来表演喷泉实验,这是因为它( )
A.比空气轻B.是弱碱C.极易溶于水D.在空气中不燃烧
7:能溶解单质硅的是()
A.氢氧化钠溶液B.盐酸C.硫酸D.氨水
8:下列元素的原子中,电负性最大的是()
A. FB. OC. ND. C
9:下列物质中,不能用作漂白剂的是()
A. Na2O2B. H2O2C.HClOD. H2S
7. HNO3中溶解过量的NO2,可得到红棕色的发烟硝酸。( )
8. Al2S、Al2(CO)3这样的弱酸铝盐不能用湿法制取。( )
9.碱金属是活泼金属,是强还原剂;在同一族中,金属的活泼性自上而下逐渐减弱。( )
10. P有多种同素异形体,常见的有白磷和红磷。( )
1:臭氧层是一个保护层,但近来发现大气层上空臭氧逐渐减少,甚至出现了空洞。( )
11:氧的同素异形体是和,其中比氧化能力更强。
二、选择题
1:下列物质中酸性最强的是()
A.HClO4B. HClO3C. KClO3D. HClO
2:0.5mol Na2SO4中所含的Na+离子数为()
A.3.01×1023B.0.5C.6.02×1023D.1
3:用10g NaOH固体配制成0.5mol/L NaOH,所得溶液的体积是()
12:无水硫酸铜具有强吸水性,可以用来做剂。
1:碱金属位于元素周期表第族,最外层有个电子,包括、、、、、六种元素。
2:卤族元素中是周期表中电负性最强的元素。
3:臭氧的化学式是,具有,可用来作为消毒剂,净化剂,漂白剂。
4:在500ml NaOH溶液中含有2g NaOH,该溶液的物质的量浓度是。
5:S的两种氧化物是和,其中常温下是固体。
A.强氧化性B.不挥发性C.吸水性D.酸性
2:氨能用来表演喷泉实验,这是因为它()
A.比空气轻B.是弱碱C.极易溶于水D.在空气中不燃烧
3:盐酸的性质是( )
A.有酸性、无氧化性、无还原性
B.有酸性、有氧化性、有还原性
C.有酸性、无氧化性、有还原性
D.有酸性、有氧化性、无还原性
4:浓硫酸具有很多重要的性质,在与含有水分的蔗糖作用时不能显示的性质是()。
10:下列关于将金属钠放入CuSO4溶液中的说法中,不正确的是()
A.金属钠浮在溶液的上面B.金属钠在液面不停地游动并发出声音
C.有红色物质生成D.有蓝色沉淀生成
1:近年来,加“碘”食盐较少使用碘化钾,因其口感苦涩且在储藏和运输中易变化,目前代之加入的是()。
A. I2B. KIO C. NaIO D. KIO3
6:SiO2是晶体,Si-O键的键能很高,因此石英的硬度大,熔点高。
7:过氧化钠的化学式是,能够和CO2和H2O反应放出,因此可用作防毒面具,潜艇中的供氧剂。
8:Al位于周期表中第周期,第族。
9:F,Cl,Br,I对应的氢化物的化学式分别是、、、,其中
Cl的氢化物对应的水溶液称为。
10:N的主要氧化物有和。
2.为什么硫化氢水溶液在空气中放置时易变浑浊?
3.卤族元素处于周期表中什么位置?写出所有的卤族元素的元素符号。
1.卤族元素处于周期表中什么位置?写出所有的卤族元素的元素符号?
2.为什么向含有Fe2+的溶液中加入NaOH溶液后,有灰绿色沉淀生成,然后沉淀逐渐变成红褐色?
3.为什么不能用玻璃器皿储存氢氟酸?
C.有红色物质生成D.有蓝色沉淀生成
三、判断题
1. NaOH的摩尔质量是40g/mol。( )
2.高氯酸是酸性最强的无机含氧酸。( )
3.硫的化学性质比较活泼,既有氧化性又有还原性。( )
4.冷的浓硝酸能使Fe、Al发生钝化。( )
5.单位物质的量的气体所占的体积叫做气体摩尔体积,符号Vm( )
6.重铬酸钾在酸性溶液中是强氧化剂。( )
6:氨是一种具有气味的色气体。
7:和以体积比1:3的比例配制的混合液称为王水。
8:浓硫酸有性,可用来干燥Cl2、H2、CO2等气体。蔗糖放入浓硫酸中,发生“炭化”现象,这是由于浓硫酸有性。
9:氮的主要氧化物有和。
10:碱金属与氧能形成三种类型的重要氧化物,即氧化物、氧化物和
氧化物。
11:铜、银、金都有特征颜色,铜是色金属,银是色金属,金是色金属。
7:金属越活泼,硝酸的浓度越低,HNO3被还原后氮的氧化值越低。( )
8:单质硫俗称硫磺。( )
9:Fe是地壳中含量最多的元素。( )
10:K2Cr2O7,KMnO4是强氧化剂。( )
1:臭氧层能吸收太阳光的紫外辐射,是保护地球上生命免受太阳辐射的天然屏障。(系统瘫痪。()
2013-2014第一学期基础化学期末考试复习提纲
一、填空题
1:卤素在元素周期表的第族,最外层有个电子。包括、、、、五种元素。
2:在500ml NaOH溶液中含有2g NaOH,该溶液的物质的量浓度是。
3:氧的同素异形体是和,其中比氧化能力更强。
4:漂白粉的有效成分是。
5:过氧化氢是一种不造成二次污染的氧化剂,所以常用来做剂、剂。
五、计算题
欲配制0.1mol/L0.2mol/L0.4mol/L硫酸500mL,需要质量分数为98%的浓硫酸(密度为1.84g/cm3)多少毫升?
六、推断题:共10分
某几种物质有以下转化关系:
X粉末,加热
1 H2SO4
澄清石灰水
②
(1)A是,B是,C是,X粉末是。
(2)写出反应①的化学方程式。
(3)写出反应②的离子方程式。
2:氨能用来表演喷泉实验,这是因为它()
A.比空气轻B.是弱碱C.极易溶于水D.在空气中不燃烧
3:下列物质中,不能用作漂白剂的是()
A. Na2O2B. H2O2C.HClOD. H2S
4:下列气体中,既有氧化性又有还原性的是()。
A. H2S B. SO2C. SO3D. CO2
5:0.5mol Na2SO4中所含的Na+离子数为()
A.3.01×1023B.0.5C.6.02×1023D. 1
6:在实验室制备氯化氢时,经常采用向食盐里加入浓硫酸的方法,使用浓硫酸的理由是( )
A.浓硫酸具有脱水作用B.浓硫酸具有吸水作用
C.浓硫酸具有氧化作用D.浓硫酸是难挥发的酸
7:下列物质中属于不挥发性酸的是()。
A.H2S B. H3PO4C.HNO3D. HCl
3:碱金属比碱土金属活泼。( )
4:浓硫酸具有吸水性和强氧化性。( )
5:CO气体有毒。( )
6:白磷化学性质很活泼,在空气中可自燃。( )
7:石墨是原子晶体、金属晶体和分子晶体之间的一种过渡型的晶体。( )
8:Al是典型的两性元素,主要体现在它的单质、氧化物、氢氧化物都能和酸、碱作用。
( )
9:刚玉的主要成分是SiO2。( )
8:下列元素的原子中,电负性最大的是()
A.F B. OC. ND. C
9:能溶解单质硅的是()
A.氢氧化钠溶液B.盐酸C.硫酸D.氨水
10:用10g NaOH固体配制成0.5mol/L NaOH,所得溶液的体积是()
A0.5ml B. 5ml C. 50ml D. 500ml
1:工业上常用稀硫酸清洗铁表面的锈层,这是利用稀硫酸的()。
10:N2是两个N原子共用三对电子结合而成,其性质很稳定,常温下不易参加化学反应。
( )
四、简答题
1.为什么不能用玻璃器皿储存氢氟酸?
2.为什么硫化氢水溶液在空气中放置时易变浑浊?
3.碱金属位于周期表中什么位置?写出所有碱金属元素的元素符号。
1.为什么向含有Fe2+的溶液中加入NaOH溶液后,有灰绿色沉淀生成,然后沉淀逐渐变成红褐色?
A.酸性B.吸水性C.强氧化性D.脱水性
5:下列物质中酸性最强的是()
B.HClO4B. HClO3C. KClO3D. HClO
6:用10g NaOH固体配制成0.5mol/LNaOH,所得溶液的体积是()
B.0.5ml B. 5ml C. 50ml D. 500ml
7:在集气瓶里,将H2S和SO2两种气体充分混合后,可观察到得现象是()
11:是酸性最强的无机含氧酸。
1:C是周期表中第族元素,最外层有个电子。其最常见的氧化物是
和。试举出C的两种单质,。
2:硝酸最典型的性质是它的,能氧化C,S,Cu等多种非金属和金属。
3:氮族元素在元素周期表的第族,最外层都有个电子。包括、
等元素。
4:氢氧化钠的化学式是,NaHCO3俗称。
5:常温下,氯气是一种______色,有______气味的气体;溶于水所得溶液称______;氯水能使有色布条褪色,其中起主要作用的是______;氯水跟硝酸银溶液的反应中起主要作用的是______。
2:H2S是无色有臭鸡蛋气味的气体,有毒,是大气污染物之一。( )
3:HF能和SiO2作用,生成SiF4和H2O,其他氢卤酸则不能。( )
4:SCN-能和Fe3+形成红色配合物,化学检验中常用此反应鉴定Fe3+。( )
5:冷浓硫酸可以使Fe,Al钝化。( )
6:Al(OH)3属于两性物质,其碱性略强于酸性,属于弱碱。( )
A.有黄色粉末产生B.有棕色烟生成
C.有红色沉淀生成D.有黑色固体生成
8:能溶解单质硅的是()
