强碱滴定二元弱酸曲线-2019高考复习专题——酸碱中和滴定曲线大全
酸碱中和滴定及曲线PPT课件

2.仪器
2 酸式滴定管
.
酸碱 中
碱式滴定管
和 滴
锥形瓶
定 铁架台 所 需 滴定管夹 的 仪 容量瓶 器
20
21
滴定管的构造
上
①上端标有: 温度 、容积 、0刻度 ;端
25℃
25mL 50mL
下端。盛满溶液时,
体积 大于 所标容积。
②碱式滴定管:橡胶管+玻璃珠,盛 碱性 溶液; 酸式滴定管:玻璃活塞,盛酸性 和强氧化性 ,溶液。
38
39
40
注意:左手、右手、眼睛 41
关键: 紧扣公式,分析V(标)的变化
3、结果计算: 用上述标准液体积的平均值进行计算
已知
↑
c(待) ↓ 计算来自c( 标 ) .V( 标 ) V↓(待)
→滴定测得
预先量取
42
P H
中和滴定曲线
12
10
8
突 变
6
反应终点
范
围
4
2
10
20
30
40 加入NaOH(ml)
• 3.装液,排气泡,调液面:
• 先装入液体至“0”刻度以上2-3厘
米处, 排净气泡后调整液面到“0”
或“0”以下,记下刻度,注意平视,不
能仰视或俯视
28
⑶滴定管的“0”刻度线—上—方—— —,但并未最在上—方————,滴定管 上的刻度由上到下,读由数小—到——大— ———,最大刻度线在滴定下管方—— —想—。一想:量筒的构造与滴定管 有何不同?
NaOH(m 0.00 18.00 19.68 19.98 20.00 20.02 20.20 22.00 23.00 l)
溶液PH值
强碱滴定二元弱酸曲线-2019高考复习专题——酸碱中和滴定曲线大全.docx

强碱滴定二元弱酸曲线-2019 高考复习专题——酸碱中和滴定曲线大全- 1- 1(其1.常温下,向 20 mL 0.2 mol L · H 2A 溶液中滴加0.2 mol L· NaOH 溶液。
有关微粒物质的量变化如下图中Ⅰ代表H 2A ,Ⅱ代表 HA -,Ⅲ代表 A 2- ) 。
根据图示判断,下列说法正确的是()A. H 2A 在水中的电离方程式是:H2A===H ++ HA -、HA -H ++ A 2-B.等体积等浓度的 NaOH 溶液与 H 2A 溶液混合后溶液显碱性C. 当 V(NaOH) = 20 mL 时,溶液中存在以下关系:+2--c(H )+ c(H 2A) = c(A)+ c(OH )D. 当 V(NaOH) =30mL 时,溶液中各粒子浓度的大小顺序为:c(Na +)>c(HA -)>c(A 2- )>c(H+ )>c(OH - )【答案】 C2.已知: pK a= -lgK a,25℃时, H 2SO3的 pK a1=1.85,pK a2=7.19。
常温下,用0.1mol/LNaOH 溶液滴定 20mL 0. 1mol/L H SO溶液的滴定曲线如图所示。
下列说法不正确的是A. A 点所得溶液中:V o等于 lOmLB. B 点所得溶液中:C. C 点所得溶液中:D. D 点所得溶液中水解平衡常数【答案】 A【解析】分析: A .A 点溶液中 pH=1.85 ,则溶液中 c( H+)=10 -1.85mol/L ,结合亚硫酸的电离平衡常数分析;B . B 点加入 NaOH 溶液的体积为 20mL,此时反应恰好产生 NaHSO3,根据溶液中电荷守恒分析;C.根据亚硫酸的电离平衡常数结合电荷守恒分析;D . D 点为加入NaOH 溶液 40mL ,此时溶液中恰好生成亚硫酸钠,根据水解常数与电离常数的关系计算。
详解: A . A点溶液中 pH=1.85 ,则溶液中 c ( H+) =10-1.85mol/L , H 2SO3的一级电离平衡常数为K a1=c(H + )c(HSO 3- )/c(H 2SO3)=10 -1.85 mol/L ,所以 c( H +)=K a1,表明溶液中 c( NaHSO 3)=c( H2 SO3),若恰好是 10mLNaOH ,由于此时溶液显酸性,则所得溶液中c(H 2SO3)< c(NaHSO 3),因此所加 NaOH 体积需< 10mL,才能使溶液中c(NaHSO 3)=c ( H2SO3),即 V 0< 10mL , A 错误;B . B 点加入 NaOH 溶液的体积为20mL ,此时反应恰好产生NaHSO 3,为第一个滴定终点,溶液中存在电荷守恒, c( Na+)+c ( H+) =c(HSO 3-)+2c( SO32-)+c( OH -), B 正确;C.H2SO3的二级电离平衡常数为K a2=c(H + )c( SO32-)/c(HSO 3- )=10 -7.19mol/L , C 点溶液的 pH=7.19 ,即溶液中 c( H +)=10-7.19 mol/L ,则 c(H +)=K a2,表明溶液中 c( SO32-)=c(HSO 3- ),溶液中存在电荷守恒, c( Na+)+c( H +) =c(HSO 3- )+2c( SO32-) +c( OH -),溶液显碱性,则溶液中c(Na+)> 3c(HSO 3- ), C 正确;D . D 点为加入 NaOH 溶液 40mL ,此时溶液中恰好生成亚硫酸钠,为第二个滴定终点,此时亚硫酸钠水解使溶液显碱性,则 K h1= K w /K a2= 10- 14- 7.19= 10-6.81, D 正确。
酸碱滴定图像的演变

氢氧化钠滴定等浓度等体积的盐酸、醋 盐酸滴定等浓度等体积的氢氧化钠、
酸的滴定曲线
氨水的滴定曲线
曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、 弱碱的曲线,强碱起点高
突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围 大于强碱与弱酸反应(强酸与弱碱反应)
解题方法导引
高考热点训练
酸碱中和滴定图象的 演变
核心知识梳理
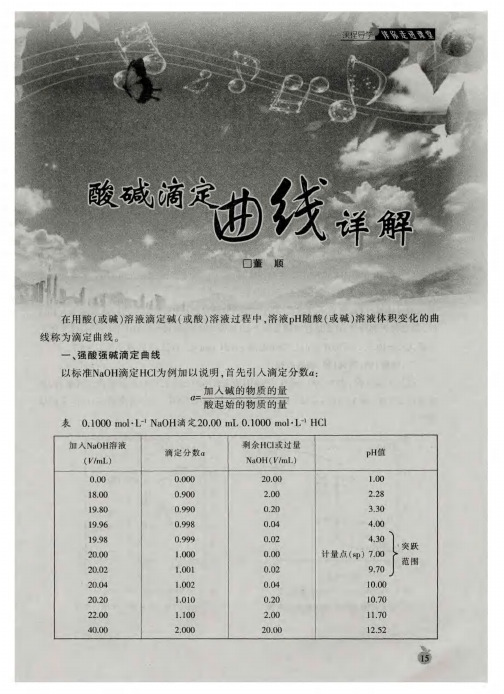
• 1.图示强酸与强碱滴定过程中pH曲线 • (以0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1盐
酸为例)
特别提醒 恰好中和=酸碱恰好完全反应≠滴定终点≠溶液呈中性。
2.强酸(碱)滴定弱碱(酸)pH曲线比较
误的是 D
• A.pH=1.2时,
• B.
• C.pH=2.7时,
• D.pH=4.2时,
例题精讲
• 5.常温下将NaOH溶液添加到己二酸(H2X)溶液中,混 合溶液的pH与离子浓度变化的关系如图所示。下列叙述错
误的是 D
• A.Ka2(H2X)的数量级为10-6
• B.曲线N表示pH与
的变化关系
略溶液体积变化)。下列说法不正确的是( B)
• A.A点溶液的pH等于1
• B.由图中数据可知,H2A为弱酸 • C.B点水电离出的H+浓度为1.0×10-6 mol·L-1
• D.C点溶液中[NH4+]>[A2-]>[OH-]>[H+]
例题精讲
• 8.25℃时,将浓度均为0.1 mol·L-1、体积分别为Va和Vb的 HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示。下列说法正确
酸碱滴定曲线详解
c . c 点: c ( C l 一 ) = c ( N H : )
D. d 点后 , 温度略 下降 的主 要 原 因是N H3 ・ n 2 0电 离吸 热
试 题说 明 : 本 试题 “ p H变 化 曲 线 ” 实为 强酸 滴 定弱碱 的滴 定 曲线 。
解析 由电荷守恒知 : C ( N H : ) + c ( H ) = c ( C 1 一 ) + c ( O H 一 ) , 在c 点p H = 7 , 溶液呈中性,
分 数口 与p H之 间的关 系 绘制 成 曲线 ( 如图1 ) 。 通 过计 算 , 可 以得 到不 同浓 度 N a O H与 H C 1 的滴 定 曲线 ( 如 图2 ) 。当酸碱 浓度 增 大 l 0 倍
时, 滴 定突 跃 部分 的p H变 化 范 围增 加 两个 p H单位 。用 1 m o l ・ N a O H滴定 1 m 0 卜 H C l , 突 跃 为3 . 3 - 1 0 . 7 , 若 用0 . 0 1 m o l ・ L N a O H滴定 0 . 0 1 mo l ・ L。 。 HC 1 , 突跃 减 小为5 . 3 ~ 8 . 7 。
如 图4
滴定分数 n 图3 0 . 1 0 0 0 mo l ・ I 2 N a 0 H滴 定 0 . 1 0 0 0 m o l - I 『 H A c的 滴 定 曲线
滴定分数 。 图4 0 . 1 0 0 0 m o l ・ L H C 1 滴 定
0 . 1 0 0 0 mo l ・ L - l N i l - 的 滴 定 曲线
度 随 加入 盐酸 体积 变化 曲 线如 下 图所 示 。 下列 有 关说 法正 确 的是 (
) 。
A . a 点 由 水 电 离 出的 c ( H ) = l x l 0 m o l ・ L 一
专题10 酸滴定碱的曲线-2019高考复习专题——酸碱中和滴定曲线大全(原卷版)

1.常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数δ(X)随-1g(OH-)变化的关系如图所示。
下列叙述错误的是A. 反应N2H62++N2H4=2N2H5+的pK=90(已知pK=lgK)B. N2H5Cl溶液中存在:c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+)C. N2H5Cl溶液中c(H+)>c(OH-)D. K b1(N2H4)=10-62.某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。
向10mL稀B(OH)2溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液POH[POH=-lgc(OH)-]变化的关系如图,以下说法正确的是A. 交点a处对应加入的盐酸溶液的体积为5mLB. 当加入的盐酸溶液的体积为10mL时存在c(Cl-)>c(B(OH)+)>c(H+)>c(OH-)>c(B2+)C. 交点b处c(OH)=6.4×10-5D. 当加入的盐酸溶液的体积为15mL时存在:c(Cl-)+c(OH-)= c(B2+)+c(B(OH)+)+ c(H+),3.已知常温下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.01mol/L的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示。
下列说法错误的是A. n=7B. 水的电离程度先增大再减小C. 常温下,0.01mol/L的氨水溶液中NH3·H2O的电离度为3.98%D. Y点溶液中c(NH3·H2O)+(OH-)=c(CH3COO-)+c(H+)4.常温下用0. 1000 mol/L的盐酸分别逐滴加入到20.00 mL 0.1000 mol/L的三种一元碱XOH、MOH、YOH 溶液中,溶液的pH随加入盐酸体积的变化如图所示。
专题09 强碱滴定三元酸曲线-2019高考复习专题——酸碱中和滴定曲线大全(原卷版)

1.砷(As)是一些工厂和矿山废水中的污染元素。
常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:p K a=-lg K a),下列说法错误的是A. Na2HAsO4溶液显碱性B. H3AsO4溶液p K a2为2.2C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)2.25℃时,向10mL0.1mol·L-1H3AsO4水溶液滴加0.1 mol·L-1NaOH溶液,含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下图,下列说法错误的是A. H3AsO4H2AsO4-+H+的电离常数为10-2.2B. b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-)C. 水的电离程度:a>b>cD. HAsO4-的水解程度大于电离程度3.亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。
向1L0.1mol·L-1 H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各种微粒物质的量分数与溶液的pH 关系如下图所示。
下列说法正确的是( )A. H3AsO3的电离常数K a1的数量级为10-9B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2OC. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33- )+c(H3AsO3)= 0.1mol·L-1D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)4.常温下,某酸H3A水溶液中含A的各种粒子的分布分数(平衡时某种粒子的浓度占各粒子浓度之和的分数)与pH关系图如下所示,下列说法正确的是A. NaH2A水溶液呈碱性B. H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+c(HA2-)+c(A3-)C. 向H3A溶液中加入一定量的NaOH溶液至pH=5时,D. 向H3A溶液中加入氨水使PH从5→9发生的主要离子反应是:H2A-+OH-=HA2-+H2O5.亚砷酸(H3AsO3)可以用于治疗白血病,在溶液中存在多种微粒形态。
专题06 对数曲线-2019高考复习专题——酸碱中和滴定曲线大全(原卷版)

1.若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HAˉ)、pC(A2-)随着溶液pH的变化曲线如图所示。
下列说法一定正确的是A. pH=4时,c(HAˉ)<c(A2-)B. c(H2A)+c(HAˉ)+c(A2-)是定值C. 该酸的电离常数K a1=10-1.3D. 常温下,NaHA的水溶液呈碱性2.已知:pOH=-lgc(OH-)。
常温下,某弱酸的钠盐(Na2XO3)溶液中微粒浓度的变化关系如下图所示。
下列说法正确的是A. 溶液加水稀释,先增大后不变B. 在NaHXO3溶液中:>1C. 向Na2XO3溶液中滴加稀盐酸至溶液显中性时:c(Na+)+2c(H+)=c(HXO3-)+2c(XO32-)+2c(OH-)D. 实线M表示pOH 与的变化关系3.常温下,二元弱酸H2Y 溶液中滴加KOH 溶液,所得混合溶液的pH 与离子浓度变化的关系如下图所示,下列有关说法错误..的是A. 曲线M 表示pH与lg的变化关系B. a点溶液中:c(H+) ― c(OH-)=2c(Y2-)+c(HY-) ― c(K+)C. H2Y 的第二级电离常数K a2(H2Y)=10-4.3D. 交点b的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)4.25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中()()OHlgHcc-+的关系如图所示。
下列说法正确的是A. H2A的电离方程式为H2A H++HA -B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/LC. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)D. 25℃时,该氨水的电离平衡常数为7 b101 Kb-=-5.常温下,将0.1mol/LNaOH溶液分别滴加到0.1mol/LHA溶液和HB溶液中,两混合溶液中离子浓度与pH 的变化关系如图所示,下列说法不正确的是A. K a(HB)<K a(HA)B. a点时,c(A-)=c(HA)>c(Na+)>c(H+)>c(OH-)C. 常温下,0.1mol/LNaA溶液的pH大于0.1mol/LNaB溶液的pHD. 向HB溶液中加入NaOH溶液,混合溶液中c(B-)/c(HB)=10[pH-pKa(HB)](已知:pKa=-lgKa)6.向XmL0.01mol/L的氨水中滴加等物质的量浓度的H2SO4溶液,测得混合溶液的POH=—lgc(OH-)、温度随加入的硫酸溶液体积的变化如图所示。
专题05 物质的量分数曲线-2019高考复习专题——酸碱中和滴定曲线大全(原卷版)

1.25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH) + c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH 的关系如图所示。
下列说法正确的是A. 丙酸的酸性比甲酸强B. CH3CH2COOH CH3CH2COO-+ H+的lgK=-4.88C. 若0.1mol/L 甲酸溶液的pH=2.33,则0.01mol/L 甲酸溶液的pH=3.33D. 将0.1mol/L 的HCOOH溶液与0.1mol/L 的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c (HCOO-)>c(OH-)>c(H+)2.室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是A. K b2的数量级为10-8B. X(OH)NO3水溶液显碱性C. 等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c[X(OH)+]D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)3.25℃时,在“H2A―HA-―A2-”的水溶液体系中,H2A、HA-和A2-三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。
下列说法正确的是A. 在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,α(HA-)一定增大B. 将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)C. NaHA溶液中,HA-的水解能力小于HA-的电离能力D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA-)一定相等4.常温下,HA为一元弱酸。
已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如右图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
强碱滴定二元弱酸曲线-2019高考复习专题——酸碱中和滴定曲线大全L-1NaOH溶液。
有关微粒物质的量变化如下图(其L-1 H2A溶液中滴加0.2 mol·1.常温下,向20 mL 0.2 mol·中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。
根据图示判断,下列说法正确的是()A. H2A在水中的电离方程式是:H2A===H++HA-、HA-H++A2-B. 等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性C. 当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH-)D. 当V(NaOH)=30mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)【答案】C2.已知:pK a= -lgK a,25℃时,H2SO3的pK a1=1.85,pK a2=7.19。
常温下,用0.1mol/LNaOH溶液滴定20mL 0.1mol/L H2SO3溶液的滴定曲线如图所示。
下列说法不正确的是A. A点所得溶液中:V o等于lOmLB. B点所得溶液中:C. C点所得溶液中:D. D点所得溶液中水解平衡常数【答案】A【解析】分析:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,结合亚硫酸的电离平衡常数分析;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,根据溶液中电荷守恒分析;C.根据亚硫酸的电离平衡常数结合电荷守恒分析;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,根据水解常数与电离常数的关系计算。
详解:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,H2SO3的一级电离平衡常数为K a1=c(H+)c(HSO3-)/c(H2SO3)=10-1.85mol/L,所以c(H+)=K a1,表明溶液中c(NaHSO3)=c(H2SO3),若恰好是10mLNaOH,由于此时溶液显酸性,则所得溶液中c(H2SO3)<c(NaHSO3),因此所加NaOH体积需<10mL,才能使溶液中c(NaHSO3)=c(H2SO3),即V0<10mL,A错误;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,为第一个滴定终点,溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),B正确;C.H2SO3的二级电离平衡常数为K a2=c(H+)c(SO32-)/c(HSO3-)=10-7.19mol/L,C点溶液的pH=7.19,即溶液中c(H+)=10-7.19mol/L,则c(H+)=K a2,表明溶液中c(SO32-)=c(HSO3-),溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),溶液显碱性,则溶液中c(Na+)>3c(HSO3-),C正确;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,为第二个滴定终点,此时亚硫酸钠水解使溶液显碱性,则K h1=K w/K a2=10-14/10-7.19=10-6.81,D正确。
答案选A。
3.常温下,向10.0mL 0.10 mol·L-1某二元酸H2R溶液中滴加入同物质的量浓度的NaOH溶液,测得溶液的pH随NaOH溶液体积的变化如右图所示。
下列说法中正确的是A. 无法判断H2R是强酸还是弱酸B. 曲线上m点时溶液中c(Na+)>c(HR-) >c(R2-)>c(H+)C. HR-的电离能力大于水解能力D. 溶液中c(Na+)+c(H+)=c(HR-)+c(R2-)+c(OH-)【答案】C【解析】A、常温下,10.0mL 0.10 mol·L-1某二元酸H2R溶液如是强酸,c(H+)= 0.20 mol·L-1,PH=-lg0.20=0.7,图中可以看出该酸为弱酸,故A错误;B. 加入同物质的量浓度的NaOH溶液10ml,溶质为NaHR,曲线上m点时呈酸性,HR-的电离大于水解,溶液中c(Na+) >c(R2-)>c(HR-)>c(H+),故B错误;C、由B选项可知,HR-的电离能力大于水解能力,故C正确;D、溶液中存在电荷守恒:c(Na+)+c(H+)=c(HR-)+2c(R2-)+c(OH-),故D错误;故选C。
4.已知:pKa=-lgKa,25℃时H2A的pK a1=1.85;pKa2=7.19。
常温下,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如右图所示(曲线上的数字为pH)。
下列说法正确的是A. a点所得溶液中c(HA)+c(A2-)+c(HA-)=0.1mol/LB. b点所得溶液中:c(H2A)+2c(H+)=c(A2-)+2c(OH-)C. 对应溶液水的电离程度:a>b>c>dD. C点所得溶液中:c(Na+)>3c(HA-)【答案】D5.常温下,H2A是一种易溶于水的二元酸,将NaOH溶液滴入等物质的量浓度的H2A溶液中,溶液中H2A、HA-、A2-的物质的量分数(a)随溶液pH的变化关系如图所示。
下列说法错误的是A. 常温下,H2A HA-+H+的电离平衡常数K a1=10-3.30B. 当c(Na+)=2c(A2-)+c(HA-)时,溶液呈中性C. pH=6.27时,c(A2-)=c(HA-)>c(H+)>c(OH-)D. V(NaOH溶液):V(HA溶液)=3:2时,2c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+)【答案】D【解析】分析:A项,根据电离平衡常数表达式和点( 3.30,0.5)计算K a1;B项,根据电荷守恒判断;C 项,根据点( 6.27,0.5)和图像判断;D项,用电荷守恒、物料守恒判断。
详解:A项,H2A H++HA-的电离平衡常数K a1=,当c(HA-)=c(H2A)时溶液的pH=3.30即溶液中c(H+)=10-3.30,代入K a1=10-3.30,A项正确;B项,NaOH滴入H2A溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),当c(Na+)=c(HA-)+2c(A2-)时,c(H+)=c(OH-),溶液呈中性,B项正确;C项,根据图像pH=6.27时,溶液中c(A2-)=c(HA-),溶液呈酸性,c(H+)c (OH-),C项正确;D项,NaOH滴入H2A溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HA-)+2c (A2-)+c(OH-),NaOH溶液和H2A溶液物质的量浓度相等,当V(NaOH溶液):V(H2A溶液)=3:2时,溶液中的物料守恒为2c(Na+)=3[c(H2A)+c(HA-)+c(A2-)],将两式整理得,13c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+),D项错误;答案选D。
6.常温下,二元弱酸H2A 溶液中滴加NaOH 溶液,所得混合溶液pH 与离子浓度变化如图所示,下列说法正确的是()A. 直线M 表示pH 与lg的变化关系B. K a2( H2A) =10-4.3C. 交点e的溶液中:c(H2A)=c(A2- )>c( HA-)>c(H+)>c(OH-)D. f点溶液中:c(H+)-c(OH-)=c(HA-)+c(A2-)-c(Na+)【答案】B7.常温下,用0.01mol/L的NaOH溶液滴定某浓度的H2N2O2(二元弱酸)溶液,所得溶液中H2N2O2、HN2O2-、N2O22-三种微粒的物质的量分数(δ)与溶液PH的关系如图所示。
则下列说法中正确的是A. 该滴定过程应该选择甲基橙作为指示剂B. K a1(H2N2O2)的数量级为10-4.2C. pH=1.2溶液中:c(Na+)+c(H+)=c(OH-)+c(H2N2O2)D. pH=4.2溶液中:c(Na+)>2c(N2O22-)+c(HN2O2-)【答案】C【解析】A、用强碱NaOH滴定H2N2O2,应用酚酞做指示剂,故A错误;B、PH=1.2时,c(HN2O2-)=c(H2N2O2),Ka1(H2N2O2)=c(H+)c(HN2O2-)/c(H2N2O2)=c(H+)=10-1.2,Ka1(H2N2O2)的数量级为10-1.2,故B错误;C、pH=1.2,c(HN2O2-)=c(H2N2O2),溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HN2O2-)=c(OH-)+c(H2N2O2),故C正确;D、pH=4.2溶液中:c(Na+)+c(H+)=c(OH-)+2c(N2O22-)+c(HN2O2-),溶液呈酸性,c(Na+)<2c(N2O22-)+c(HN2O2-),故D错误;故选C。
8.25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是A. 溶液的pH=5时,硫元素的主要存在形式为HSO3-B. 当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-)C. 向pH=8的上述溶液中滴加少量澄清石灰水,323c HSOc SO的值增大D. 向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小【答案】C【解析】试题分析:A.分析题给图像可知溶液的pH=5时,硫元素的主要存在形式为HSO3-,A项正确;B.根据电荷守恒知c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),当溶液恰好呈中性时c(H+)=c(OH-),则c(Na+)>c(SO32-)+c(HSO3-),B项正确;C.向pH=8的上述溶液中滴加少量澄清石灰水发生反应HSO3—+OH-= SO32-+H2O,Ca2++SO32—=CaSO3,参加反应的HSO3—比SO32—多,的值减小,C项错误;D.向pH=3的上述溶液中滴加少量稀硫酸发生反应H++HSO3-=H2SO3,α(HSO3-)减小,D项正确;答案选C。
9.向10 mL 0.1mol/L二元弱酸H2A溶液中滴加0.1mol/L NaOH 溶液,溶液中各组分物质的量分数δ(X) [δ(X)=]随pH的变化如图所示。
下列叙述错误的是A. K a1(H2A) 为10-3.1B. pH=5.0时,c(Na+)>c(HA-)>c(H+)>c(OH-) >c(A2-)C. pH=8.2时,c (Na+) +c(H+) =c(OH-) +3c(A2-)D. pH 由5.0 调至10.5时,主要反应的离子方程式为HA-+OH-=A2-+H2O【答案】B【解析】A. 由图像可知pH=3.1时,H2A与HA-的曲线相交,则c(H2A)=c(HA-),K a1(H2A) == 10-3.1,故A正确;B. pH=5.0时,溶液中的溶质为NaHA,c(H2A)= c(A2-),溶液显酸性,说明HA-的水解程度小于电离程度,水也要电离出部分氢离子,因此c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) ,故B错误;C. pH=8.2时,c(HA-)=c(A2-),根据电荷守恒, c (Na+) +c(H+) =c(OH-) +2c(A2-)+ c(HA-)= c(OH-) +3c(A2-),故C正确;D. pH=5.0时,溶液中的溶质为NaHA,pH 由5.0 调至10.5 时,主要反应的离子方程式为HA-+OH-=A2-+H2O,故D正确;故选B。
