2020高考化学新高考地区专用:非选择题规范练辑1(一) 无机化学工艺流程综合题+Word版含解析 (1)
2020届高三理综化学I卷高考12题题型—— 第8题 以工艺流程为主流的无机综合题

2020届高三理综化学I 卷高考12题题型—— 第8题 以工艺流程为主流的化学综合题型特训21.磷精矿湿法制备磷酸的一种工艺流程如下:已知:磷精矿主要成分为Ca 5(PO 4)3(OH),还含有Ca 5(PO 4)3F 和有机碳等。
溶解度:Ca 5(PO 4)3(OH)<CaSO 4·0.5H 2O(1)上述流程中能加快反应速率的措施有________。
(2)磷精矿粉酸浸时发生反应:2Ca 5(PO 4)3(OH)+3H 2O +10H 2SO 4=====△10CaSO 4·0.5 H 2O +6H 3PO 4①该反应体现出酸性关系:H 3PO 4________H 2SO 4(填“>”或“<”)。
②结合元素周期律解释①中结论:P 和S 电子层数相同,_________________________________________________________。
(3)酸浸时,磷精矿中Ca 5(PO 4)3F 所含氟转化为HF ,并进一步转化为SiF 4除去。
写出生成HF 的化学方程式:________________________________________________________。
(4)H 2O 2将粗磷酸中的有机碳氧化为CO 2脱除,同时自身也会发生分解。
相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。
80 ℃后脱除率变化的原因:____________________________________________。
(5)脱硫时,CaCO 3稍过量,充分反应后仍有SO 2-4残留,原因是____________________________________;加入BaCO 3可进一步提高硫的脱除率,其离子方程式是____________________________________________________________________________________________________________。
(通用版)2020新高考化学复习第9题无机化工流程题课件

2.转化过程中反应条件的控制方法 (1)溶液的 pH ①控制反应的发生,增强物质的氧化性或还原性,或改变 水解程度。 ②控制溶液的酸碱性使其中的某些金属离子形成氢氧化物 沉淀。如若要除去 Al3+、Mn2+溶液中含有的 Fe2+,先用氧化剂 把 Fe2+氧化为 Fe3+,再调溶液的 pH。 调节 pH 所需的物质一般应满足两点:能与 H+反应,使溶 液 pH 增大;不引入新杂质。例如:若要除去 Cu2+溶液中混有 的 Fe3+,可加入 CuO、Cu(OH)2、Cu2(OH)2CO3 等物质来调节 溶液的 pH。
解析:(1)酸性条件下,SO2 与 Na2CO3 溶液生成 NaHSO3。 (2)工艺中加入 Na2CO3 固体并再次通入 SO2,其目的是得到 NaHSO3 过饱和溶液。
答案:(1)NaHSO3 (2)得到 NaHSO3 过饱和溶液
3.(2015·全国卷Ⅰ·节选)硼及其化合物在工业上有许多用 途。以铁硼矿(主要成分为 Mg2B2O5·H2O 和 Fe3O4,还有少量 Fe2O3、FeO、CaO、Al2O3 和 SiO2 等)为原料制备硼酸(H3BO3) 的工艺流程如下所示:
解析:(1)硼镁矿粉中加入(NH4)2SO4 溶液反应生成 NH3, 氨 气 与 碳 酸 氢 铵 溶 液 反 应 的 化 学 方 程 式 为 NH4HCO3 + NH3===(NH4)2CO3。
(2)硼镁矿中的 SiO2、Fe2O3、Al2O3 与(NH4)2SO4 溶液不反 应,也不溶解,过滤后形成滤渣 1。因为 KSCN 溶液遇 Fe3+变 为红色,所以 KSCN 溶液常用于 Fe3+的检验。
考点一 反应原料的预处理与条件的控制 [真题集训·明规律]
2020版高考化学一轮复习无机化学工艺流程题的解题策略课件(35张)

题型二 提纯类化工流程题 1.明确常用的提纯方法 (1)水溶法:除去可溶性杂质。 (2)酸溶法:除去碱性杂质。 (3)碱溶法:除去酸性杂质。 (4)氧化剂或还原剂法:除去还原性或氧化性杂质。 (5)加热灼烧法:除去受热易分解或易挥发的杂质。 (6)调节溶液的 pH 法:如除去酸性溶液中的 Fe3+等。
(2)水浸——与水接触反应或溶解。 (3)酸浸——与酸接触反应或溶解,使可溶性金属进入溶液,不 溶物通过过滤除去。 (4)灼烧——除去可燃性杂质或使原料初步转化,如从海带中提 取碘时的灼烧就是为了除去可燃性杂质。 (5)煅烧——改变结构,使一些物质能溶解,并使一些杂质在高 温下氧化、分解,如煅烧高岭土。 [注意] 提高矿石浸出率的方法为①加热升温;②将矿石研成 粉末;③搅拌;④适当增大酸的浓度。
金属离子
Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+
开始沉 淀的 pH
8.1 6.3 1.5 3.4 8.9 6.2 6.9
沉淀完 全的 pH
10.1 8.3 2.8 4.7 10.9 8.2 8.9
(1)“滤渣 1”含有 S 和________;写出“溶浸”中二氧化锰与硫 化锰反应的化学方程式:________________________________。 ( 2 ) “ 氧 化 ” 中 添 加 适 量 的 MnO2 的 作 用 是 ____________________________________________________。 (3)“调 pH”除铁和铝,溶液的 pH 范围应调节为__________~ 6 之间。 (4)“除杂 1”的目的是除去 Zn2+和 Ni2+,“滤渣 3”的主要成分 是__________。
(5)“除杂 2”中 F-与 Mg2+反应生成 MgF2 沉淀,若溶液酸度 过高,则 F-与 H+结合生成弱电解质 HF,导致 MgF2(s) Mg2+(aq)+2F-(aq)平衡向右移动,Mg2+不能完全除去。 (6)“沉锰”时 Mn2+与 HCO- 3 反应生成 MnCO3、CO2 和 H2O, 由此可写出离子方程式。(7)化合物 LiNixCoyMnzO2 中,当 x =y=13时,根据化合价代数和为 0 得 1+2×13+3×13+4z-2×2= 0,解得 z=13。
2020届高考化学二轮优选练习题:无机(化工)工艺流程附答案

2020届高考化学二轮优选练习:无机(化工)工艺流程附答案*无机(化工)工艺流程*1、医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程为:已知:查阅资料得知氢氧化物沉淀时的pH如下表。
氢氧化物Fe(OH)3Al(OH)3开始沉淀时的pH 2.3 4.0 开始溶解:7.8完全沉淀时的pH 3.7 5.2 完全溶解:10.8(1)CaCO3与盐酸反应的离子方程式:_________________________________。
(2)除杂操作是加入氢氧化钙,调节溶液的pH为________,目的是除去溶液中少量的Al3+、Fe3+。
检验Fe(OH)3是否沉淀完全的实验操作是________________________。
(3)过滤时需用的玻璃仪器有________。
滤渣主要成分的化学式:________。
(4)酸化时加盐酸的目的为①_______________________________________,②防止Ca2+在蒸发时发生水解。
(5)为什么蒸发结晶要保持在160 ℃:__________________________________。
(6)若所测样品CaCl2·2H2O的质量分数偏高(忽略其他实验误差),可能的原因之一为__________________________________________________________ _________________________________________________________________。
解析根据流程可知,加入氢氧化钙的目的是通过调节溶液的pH使Al3+、Fe3+转化为Fe(OH)3、Al(OH)3,使其沉淀完全,根据表中的数据可知,选择的pH应使得两种离子都生成沉淀,特别要保证Al3+全部沉淀后不能再溶解,故选择pH为5.2~7.8。
2020届高考无机化学工艺流程专题提升试题答案详解教师版(21页)
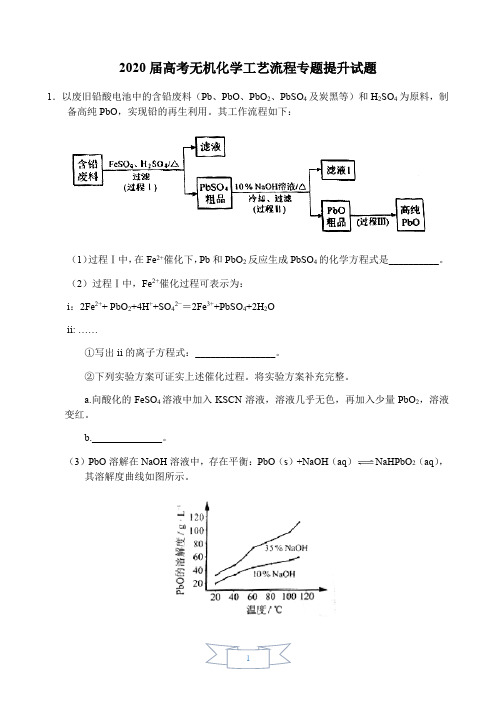
2020届高考无机化学工艺流程专题提升试题1.以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。
其工作流程如下:(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:i:2Fe2++ PbO2+4H++SO42−=2Fe3++PbSO4+2H2Oii: ……①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。
将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)NaHPbO 2(aq),其溶解度曲线如图所示。
①过程Ⅱ的目的是脱硫。
滤液1经处理后可在过程Ⅱ中重复使用,其目的是_____(选填序号)。
A.减少PbO的损失,提高产品的产率B.重复利用氢氧化钠,提高原料的利用率C.增加Na2SO4浓度,提高脱硫效率②过滤Ⅲ的目的是提纯,综合上述溶解度曲线,简述过程Ⅲ的操作_______________________。
【答案】(1)Pb + PbO2 + 2H2SO4==2PbSO4+ 2H2O。
(2)①2Fe3++Pb+SO42—==PbSO4+2Fe2+;②取a中红色溶液少量,加入过量Pb,充分反应后,红色褪去。
(3)①A、B;②将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃,充分溶解后,趁热过滤,冷却结晶,过滤、洗涤并干燥得到PbO固体。
②根据PbO的溶解度曲线,提纯粗Pb的方法为将粗PbO溶解在35%NaOH溶液中配成高温下的饱和溶液,降温结晶、过滤,洗涤并干燥即可得到PbO。
2.氟化钡可用于制造电机电刷、光学玻璃、光导纤维、激光发生器。
2020年高考化学真题-工艺流程题(习题版)

2020年高考真题工艺流程题1.(2020年山东新高考)以菱镁矿(主要成分为MgCO 3,含少量SiO 2,Fe 2O 3和A12O 3)为原料制备高纯镁砂的工艺流程如下:已知浸出时产生的废渣中有SO 2,Fe(OH)3和Al(OH)3。
下列说法错误的是A .浸出镁的反应为4232MgO+2NH Cl=MgCl +2NH +H O ↑B .浸出和沉镁的操作均应在较高温度下进行C .流程中可循环使用的物质有NH 3、NH 4ClD .分离Mg 2+与Al 3+、Fe 3+是利用了它们氢氧化物K sp 的不同2.(2020年新课标Ⅰ)钒具有广泛用途。
黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO 2、Fe 3O 4。
采用以下工艺流程可由黏土钒矿制备NH 4VO 3。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH 如下表所示: 金属离子Fe 3+ Fe 2+ Al 3+ Mn 2+ 开始沉淀pH1.9 7.0 3.0 8.1 完全沉淀pH3.2 9.04.7 10.1回答下列问题:(1)“酸浸氧化”需要加热,其原因是___________。
(2)“酸浸氧化”中,VO +和VO 2+被氧化成2VO +,同时还有___________离子被氧化。
写出VO +转化为2VO +反应的离子方程式___________。
(3)“中和沉淀”中,钒水解并沉淀为252V O xH O ⋅,随滤液②可除去金属离子K +、Mg 2+、Na +、___________,以及部分的___________。
(4)“沉淀转溶”中,252V O xH O ⋅转化为钒酸盐溶解。
滤渣③的主要成分是___________。
(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是___________。
(6)“沉钒”中析出NH 4VO 3晶体时,需要加入过量NH 4Cl ,其原因是___________。
2020版高三化学考试试题调研:无机化学基础——工艺流程综合
2020版高三化学试题调研:无机化学基础——工艺流程综合【考情调研】一、工艺流程题的命题特点1.试题形式以工业上制备某物质(纯净物)为目的,把实际生产(或设计)中的过程以简图的形式表现出来。
2.命题思想(1)元素守恒思想。
原料中的“某元素”经多步转化最终“存留”于目标产物中,该思想是工艺流程图的主线。
(2)物料转化思想。
工艺流程图中呈现的各个“方框”一般表示工业生产中的反应釜,方框中的物质表示反应釜中的“主要物质”,方框之间的“箭头”表示“转化关系”,箭头的上方或下方一般注明转化时加入的试剂或需控制的条件等。
(3)教材联系生产的思想。
工艺流程题中的大部分化学反应来源于教材,部分陌生的化学反应,其反应原理源于教材;流程图中的工业操作(反应装置)与教材中的实验操作(实验装置)相对应。
(4)绿色环保思想。
对环境无害的物质可以直接排放,部分物质需要循环利用,实现资源利用最大化。
3.考查内容(1)工艺流程题是综合性较高的题型,在元素化合物转化的过程中考查元素化合物性质。
主要考向:①氧化还原反应、复分解反应类型的化学方程式(离子方程式)的书写②沉淀溶解平衡的运用;③弱电解质的电离及盐类水解原理的应用。
(2)实验仪器与实验操作。
工艺流程中的反应产物多为混合物,为达到制备目的必然涉及反应条件的控制、物质的提纯、物质检验等实验内容,所以反应条件的控制、物质的提纯、物质检验等是该类试题的常考内容。
(3)产率及纯度的计算。
由于工业生产中企业追求的是产品的纯度及产率,故部分试题还会考查物质的纯度或产率的计算。
二、工艺流程题的解题模型由于该类题多以制备某纯净物为目的,所以该类题多以“含核心元素的原料”到“含核心元素的目标产物”的转化为主线,以除杂和除杂实验操作为辅线进行命题。
该类题的解题模型如下:分析实验操作类型:实验过程主要为分离杂质,故其操作 多为过滤、分液、 蒸发结品、燕等。
分析“含核心元素的物质、的转化反:“含核心元素的物所与所加试剂主要发生氧化还原反应或复分解反应,逐 步转化为日标产物分析加入试剂的作用:向反应体系中加入酸、碱、盐溶液或通入气体物质,使“含核心元素的物质”逐步转化为 目标产物或与杂质物质反应达到除杂目的三、解析步骤及典例 1.抓主线、明思路抓主线即分析起始物质中哪些“核心元素”最要存留于目标产物中,以及含核心元素的物质在工艺流程中经过哪些反应,最终转化为目标产物。
2020届高考化学二轮优选练习:无机(化工)工艺流程包含答案
2020届高考化学二轮优选练习:无机(化工)工艺流程含答案*无机(化工)工艺流程*1、钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。
利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-===Fe2++TiOCl42-+2H2O。
(1)化合物FeTiO3中铁元素的化合价是________。
(2)滤渣A的成分是________。
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式是_____________________________________________________________________ ___。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如下图所示。
反应温度过高时,Ti元素浸出率下降的原因是________________。
(5)反应③的化学方程式是____________________________________________ ________________________________________________________________。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是________。
(7)若采用钛酸锂(Li 4Ti 5O 12)和磷酸亚铁锂(LiFePO 4)作电极组成电池,其工作原理为:Li 4Ti 5O 12+3LiFePO 4充电放电Li 7Ti 5O 12+3FePO 4该电池充电时阳极反应式是__________________。
解析 (1)FeTiO 3可表示为FeO·TiO 2,由此可知铁元素的化合价是+2。
(2)FeTiO 3、MgO 、CaO 均可以溶于盐酸,故滤渣中只有SiO 2。
2020届高考化学二轮复习大题精准训练 制备类无机工艺流程题.docx
2020届高考化学二轮复习大题精准训练——制备类无机工艺流程题1.氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。
用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd?+等)制取氧化锌的工艺流程如图所示:已知:相关金属离子[c(M n+) = 0.1 mol/L]生成氢氧化物沉淀的pH如下表所示:回答下列问题:⑴为调节溶液的pH,则试剂X为(填化学式),(2)除杂时加入高*孟酸钾的作用是,发生反应的离子方程式为O(3)“过滤”所得滤渣的主要成分是(填化学式)。
(4)写出“碳化合成”的化学方程式:;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:2.钛被称为继铁、铝之后的第三金属。
工业上常用硫酸酸解钛铁矿(主要成分为FeTiO3, 还含有部分Fe2O3)的方法制取金红石(TiO2),再还原Ti()2制取金属钛。
工业制取TiC)2的工艺流程图如下:回答下列问题:⑴钛酸亚铁(FeTQ)中Ti的化合价为(2)钛液1中钛以TiO2+的形式存在,则FeTiO3与硫酸反应的离子方程式为(3)为提高钛铁矿的酸解率,可添加适量氧化剂,依据下图判断,添加的最佳氧化剂为(填化学式)。
100j ▲▲90- ---------- "o o o o 8 7 6 5 la®*KMnO4 -^NaClO -*-KClC>3• I I I I I I I I I I20 30 40 50 60 70时间/min不同氧化剂对钛铁矿酸解率的影响(4)钛液1中加入的A物质是,流程中的操作a是(5)制取金红石过程中,需要测定TiO?+的含量。
取lOOmL钛液1,加铝粉,使其发生反应3TiO2+ +Al + 6H+ = 3Ti3+ + Al3+ + 3H2O,反应消耗铝1.35g,则钛液1 中TiO2+的物质的量浓度为。
(新课标)2020高考化学二轮复习第Ⅱ(一)无机化学工艺流程综合题[含答案]
(3)通过计算说明,常温下,若“调 pH”为 7,Cu2+是否沉淀完全______________。
(溶液中离子浓度小于 10-5mol·L-1 时,认为该离子沉淀完全)
(4)“沉锰”需将温度控制在 70
℃左右,温度不能过高或过低的原因为
____________。
(5)结晶所得 NH4VO3 需进行洗涤、干燥。合适的洗涤试剂为______________;证明 NH4VO3 已洗涤干净的实验操作及现象为________________________________________。
答案:(1)使反应物充分接触,加快反应速率 蒸发浓缩
(2)①除锰外,硫酸浓度越低(高),浸出率越低(高)
②硫酸浓度与锰的浸出率相关性不完全一致
(3)①1 氧化亚铁离子,便于之后除去
②6NH3·H2O+3Fe3++2SO2-4 ===NH4Fe3(SO4)2(OH)6↓+5NH+4
(4)是 Ca2+恰好沉淀完全时,c2(F-)
回答下列问题: (1)“氧化酸解”的实验中,控制反应温度为 150 ℃,不同氧化剂对钛铁矿酸解率的 影响如图所示。50 min 时,要求酸解率大于 85%,所选氧化剂应为________;采用 H2O2 做 氧化剂时,其效率低的原因可能是___________________________________。
NaBH4+2MgO。(2)滤液最终提取出溶质 NaBO2,碱性条件下
Mg2+形成滤渣氢氧化镁。(3)依题意,其中一种气体为 SO2,结合原子守恒以及 Mg2+水解的
特性,可推测另一产物为 HCl,反应为 SOCl2+H2O===SO2↑+2HCl↑,产生的氯化氢可抑制
氯化镁水解。(4)①根据电池反应可知,电池正极发生 H2O2 的还原反应:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
非选择题规范练(一)无机化学工艺流程综合题(建议用时:35分钟)1.硫酸锰在锰系产品中具有重要地位,一种由软锰矿(MnO2)和硫铁矿(FeS2)制备硫酸锰的流程如下:回答下列问题:(1)将软锰矿、硫铁矿和硫酸按一定比例放入反应釜中,搅拌,加热保温反应一定时间,其中搅拌、加热的目的是____________________;从“除质2”后的溶液中得到MnSO4固体的操作为________、降温结晶、过滤和干燥。
(2)如图是在一定条件下,不同浓度的硫酸对各元素浸出率的影响,由此得出的相关结论是①________________________;②______________________。
(3)除铁剂为H2SO5和氨水。
①H2SO5中S的化合价为+6,其中过氧键的数目为________,加入其目的是__________________________。
②写出Fe3+生成沉淀黄铵铁矾[NH4Fe3(SO4)2(OH)6]的离子方程式:________________________________________________________________________。
(4)工业除质剂为MnF2,发生反应为(已知,该温度下MnF2、CaF2和MgF2的K sp分别为5.0×10-3、2.0×10-10、8.0×10-11):反应ⅠMnF2(s)+Ca2+CaF2(s)+Mn2+反应ⅡMnF2(s)+Mg2+MgF2(s)+Mn2+若滤液中c(Mg2+)=0.02 mol·L-1,加入MnF2(s),使Ca2+恰好沉淀完全,即溶液中c(Ca2+)=1.0×10-5mol·L-1,此时是否有MgF2沉淀生成?________(填“是”或“否”),原因是________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________(结合计算解释)。
2.(新题预测)硼氢化钠(NaBH4)是有机合成中常用的还原剂。
一种制备工艺如下(部分条件和产物省略):回答下列问题:(1)MgH2和NaBO2合成硼氢化钠的化学方程式为________________________________________________________________________。
(2)难溶的Mg2B2O5与浓氢氧化钠溶液反应的离子方程式为________________________________________________________________________。
(3)SOCl2溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧时加入SOCl2的目的是______________________________________________________。
(4)已知镁-H2O2酸性燃料电池反应为Mg+H2O2+H2SO4===MgSO4+2H2O。
常温下,电解质溶液为200 mL 0.1 mol·L-1硫酸溶液。
①写出正极的电极反应式:________________________。
②若电路转移0.038 mol电子时,溶液pH为________(忽略溶液体积变化,不考虑H2O2电离)。
(5)“有效氢含量”是衡量含氢还原剂的还原能力指标,定义为每克含氢还原剂的还原能力与多少克H2的还原能力相当。
则NaBH4的“有效氢含量”为________(结果保留两位小数)。
(6)工业上,也可以利用NaBO2、HCHO和生石灰在加热条件下制备NaBH4,并得到副产物CaCO3,该反应中氧化产物与还原产物的物质的量之比为________。
3.五氧化二钒(V2O5)在冶金、搪瓷、磁性材料等领域有重要应用。
实验室以含钒废料(含V2O3、CuO、MnO、SiO2、Al2O3、有机物)为原料制备V2O5的一种流程如下:已知Ⅰ.含钒离子在溶液中的主要存在形式与溶液pH的关系如表所示:pH 4~6 6~8 8~10 10~12含钒离子VO+2VO-3V2O4-7VO3-4Ⅱ.25难溶电解质Cu(OH)2Mn(OH)2Al(OH)3K sp 2.2×10-204×10-14 1.9×10-33Ⅲ.NH4VO3在水中的溶解度:20 ℃、4.8 g·L-1;60 ℃、24.2 g·L-1。
回答下列问题:(1)“焙烧”的目的是___________________________________________。
(2)“滤渣1”的用途为_________________________________(写出一种即可)。
(3)通过计算说明,常温下,若“调pH”为7,Cu2+是否沉淀完全________________________________________________________________________ ________________________________________________________________________。
(溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全)(4)“沉锰”需将温度控制在70 ℃左右,温度不能过高或过低的原因为__________________________________。
(5)结晶所得NH4VO3需进行洗涤、干燥。
合适的洗涤试剂为______________;证明NH4VO3已洗涤干净的实验操作及现象为___________________________________ ________________________________________________________________________ ________________________________________________________________________。
(6)“煅烧”时生成两种能参与大气循环的气体,该反应的化学方程式为________________________________________________________________________。
4.TiO2和CaTiO3都是光电转化材料,某研究小组利用钛铁矿(主要成分为FeTiO3,还含有少量SiO2等杂质)来制备,并利用黄钾矾[KFe3(SO4)2(OH)6]回收铁的工艺流程如下:回答下列问题:(1)“氧化酸解”的实验中,控制反应温度为150 ℃,不同氧化剂对钛铁矿酸解率的影响如图所示。
50 min时,要求酸解率大于85%,所选氧化剂应为________;采用H2O2做氧化剂时,其效率低的原因可能是___________________________________。
(2)“氧化酸解”的滤液①中加入尿素[CO(NH2)2],TiO2+转化为TiO2,写出相应的离子方程式:____________________________________,使用尿素而不直接通入NH3的原因是______________________________。
(3)写出“高温煅烧”中由TiO2制备CaTiO3的化学方程式:________________________________________________________________________。
(4)使Fe3+恰好沉淀完全时,溶液中c(Fe3+)=1.0×10-5mol·L-1,计算此时溶液的pH≈________。
[Fe(OH)3的K sp=1.0×10-39、水的K w=1.0×10-14](5)黄钾矾沉淀为晶体,含水量很少。
回收Fe3+时,不采用加入氨水调节pH制得Fe(OH)3的原因是__________________________。
5.碲(Te)常用于冶金工业,也是石油裂解的催化剂。
工业上用精炼铜的阳极泥(主要含有TeO2,还含有少量Ag、Au)为原料制备单质碲的一种工艺流程如下:已知TeO2微溶于水,易溶于较浓的强酸和强碱。
(1)从滤渣A中分离出Au的方法是__________________________________________。
(2)“沉碲”时控制溶液的pH为4.5~5.0,生成TeO2沉淀。
防止溶液局部酸性过强的操作是________________________________________________________________________ ________________________________________________________________________。
(3)写出“碱浸”时发生反应的离子方程式:______________________________________。
滤液B经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到的副产品是__________________(填化学式)。
(4)为了提高“碱浸”的浸出率,宜采取的措施有________________________________(写两条即可)。
“酸溶”时要控制温度,温度不宜过高,原因是__________________________。
(5)写出“还原”中发生反应的化学方程式:____________________________________。
非选择题规范练(一)无机化学工艺流程综合题1.解析:(1)从“除质2”后的溶液中得到MnSO4固体,是由溶液得到固体的过程,实验操作为蒸发浓缩、降温结晶、过滤和干燥。
(2)根据图示,pH越大,即硫酸浓度越小,各元素的浸出率越低,但锰元素有反常,即硫酸浓度与锰的浸出率相关性不完全一致。
(3)①根据化合物中各元素的正负化合价的代数和为0可知,H2SO5中5个O总化合价为-8。
设-2价氧个数为x,-1价氧个数为y,则x+y=5,-2x-y=-8,解得x=3,y=2。
2个-1价氧形成一个过氧键。
H2SO5含有过氧键,具有强氧化性,加入的目的是氧化亚铁离子,便于之后除去。
②向溶液中加入氨水生成沉淀黄铵铁矾,离子方程式为6NH3·H2O+3Fe3++2SO 2-4===NH 4Fe 3(SO 4)2(OH)6↓+5NH +4。
