人教版高中化学选修四——课本习题参考答案
人教版高中化学选修四高二化学高答案.docx
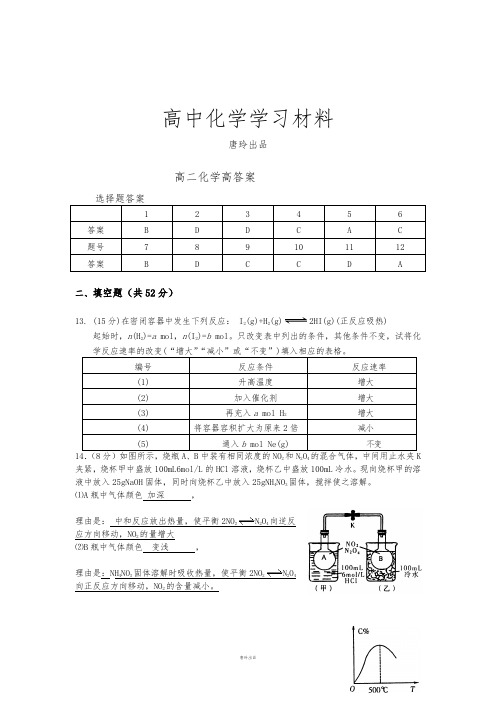
高中化学学习材料唐玲出品高二化学高答案选择题答案1 2 3 4 5 6答案 B D D C A C 题号7 8 9 10 11 12 答案 B D C C D A二、填空题(共52分)13. (15分)在密闭容器中发生下列反应: I2(g)+H2(g)2HI(g)(正反应吸热)起始时,n(H2)=a mol,n(I2)=b mol。
只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”“减小”或“不变”)填入相应的表格。
编号反应条件反应速率(1) 升高温度增大(2) 加入催化剂增大(3) 再充入a mol H2增大(4) 将容器容积扩大为原来2倍减小(5) 通入b mol Ne(g) 不变14.(8分)如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K 夹紧,烧杯甲中盛放100mL6mol/L的HCl溶液,烧杯乙中盛放100mL冷水。
现向烧杯甲的溶液中放入25gNaOH固体,同时向烧杯乙中放入25gNH4NO3固体,搅拌使之溶解。
⑴A瓶中气体颜色加深,理由是:中和反应放出热量,使平衡2NO2N2O4向逆反应方向移动,NO2的量增大⑵B瓶中气体颜色变浅,理由是:NH4NO3固体溶解时吸收热量,使平衡2NO2N2O4向正反应方向移动,NO2的含量减小。
15.(9分)可逆反应aA+bB cC在不同温度下,从正反应开始到t秒时混合物中C的百分含量与温度关系如右图所示,分析图像,回答下列问题:⑴T<500℃时,随T升高,C%增大的原因是:T<500℃时,反应尚未达到平衡,所以随温度升高反应速率加快,因此在相同的反应时间内生成了更多的产物C;;⑵T﹥500℃时,随T升高,C%减小的原因是:T>500℃时,反应速率更快,但反应达到平衡后继续升高温度平衡向逆方向移动使产物C 的量减少;⑶综合上述分析可得出结论:此反应的正方向的热效应为放热反应(填“放”、“吸”16、(6分)CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:[Cu(H2O)4]2++4C1一 [CuCl4]2- +4H2O蓝色黄色现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法⑴加水稀释⑵加AgNO3 溶液17、(每空2分,共14分)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小)。
高二化学选修4课后习题参考答案(全)

新课标高中化学课后习题答案【选修 4 课后答】『必修 1 部分答案』第一章 (2)第一节化学反应与能量的变化 (2)第二节燃烧热能源 (3)第三节化学反应热的计算 (4)第二章 (7)第一节化学反应速率 (7)第二节影响化学反应速率的因素 (7)第三节化学平衡 (8)第四节化学反应进行的方向 (9)第三章 (9)第一节弱电解质的电离 (9)第二节水的电离和溶液的酸碱性 (10)第三节盐类的水解 (11)第四节难溶电解质的溶解平衡 (12)人教版新教材--高中化学必修 1 课后习题答案 (14)第一章从实验学化学 (14)第一节化学实验基本方法 (14)化学计量在试验中的应用 (14)第一章习题 (15)化学物质及其变化 (15)物质的分类 (15)离子反应 (16)氧化还原反应 (17)金属及其化合物 (18)金属的化学性质 (18)几种重要的金属化合物 (18)用途广泛的金属材料 (19)第一章第一节化学反应与能量的变化四、习题参考(一)参考答案1. 化学反应过程中所释放或吸收的能量,叫做反应热,在恒压条件下,它等于反应前后物质的焓变,符号是H,单位是kJ/mol 。
例如 1 mol H 2 (g) 燃烧,生成 1 mol H 2 O(g) ,其反应热H=-241.8 kJ/mol。
2. 化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子。
旧键断裂需要吸收能量,新键形成需要放出能量。
当反应完成时,若生成物释放的能量比反应物吸收的能量大,则此反应为放热反应;若生成物释放的能量比反应物吸收的能量小,反应物需要吸收能量才能转化为生成物,则此反应为吸热反应。
(二)补充习题1 .下列说法不正确的是()。
A.放热反应不需加热即可发生B.化学反应过程中的能量变化除了热能外,也可以是光能、电能等C.需要加热才能进行的化学反应不一定是吸热反应D.化学反应热效应数值与参加反应的物质多少有关2.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。
高二化学选修4课后习题参考答案(全)

新课标高中化学课后习题答案【选修4课后答】『必修1部分答案』第一章 (2)第一节化学反应与能量的变化 (2)第二节燃烧热能源 (3)第三节化学反应热的计算 (4)第二章 (7)第一节化学反应速率 (7)第二节影响化学反应速率的因素 (7)第三节化学平衡 (8)第四节化学反应进行的方向 (9)第三章 (9)第一节弱电解质的电离 (9)第二节水的电离和溶液的酸碱性 (10)第三节盐类的水解 (11)第四节难溶电解质的溶解平衡 (12)人教版新教材--高中化学必修1课后习题答案 (14)第一章从实验学化学 (14)第一节化学实验基本方法 (14)化学计量在试验中的应用 (14)第一章习题 (15)化学物质及其变化 (15)物质的分类 (15)离子反应 (16)氧化还原反应 (17)金属及其化合物 (18)金属的化学性质 (18)几种重要的金属化合物 (18)用途广泛的金属材料 (19)第一章第一节化学反应与能量的变化四、习题参考(一)参考答案1. 化学反应过程中所释放或吸收的能量,叫做反应热,在恒压条件下,它等于反应前后物质的焓变,符号是ΔH,单位是kJ/mol。
例如 1 mol H2 (g)燃烧,生成 1 mol H2O(g),其反应热ΔH=-241.8 kJ/mol。
2. 化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子。
旧键断裂需要吸收能量,新键形成需要放出能量。
当反应完成时,若生成物释放的能量比反应物吸收的能量大,则此反应为放热反应;若生成物释放的能量比反应物吸收的能量小,反应物需要吸收能量才能转化为生成物,则此反应为吸热反应。
(二)补充习题1.下列说法不正确的是()。
A.放热反应不需加热即可发生B.化学反应过程中的能量变化除了热能外,也可以是光能、电能等C.需要加热才能进行的化学反应不一定是吸热反应D.化学反应热效应数值与参加反应的物质多少有关2.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。
高中化学人教版必修一二选修三四五课后习题答案全套Word版全套高中化学人教版课后习题答案

6.BD
7.胶体区别于其他分散系得本质特征是胶体粒子的大小在 1~100nm 范围。
胶体的应用,例如明矾净水、豆浆加石膏成豆腐、静电除尘、江河入海口易形成沙洲、血液
透析、饱和氯化铁溶液用于应急性止血等。
第二章第二节
1.水溶液 熔融状态 电离 阴阳离子 阳离子 H+ 阴离子 OH-
金属离子或铵根离子 酸根离子 H+ + OH-=H2O
2.两种电解质在溶液中相互交换离子的反应
生成难溶物、易挥发物质、弱电解质
3.C 4.C 5.C 6.B 7.D
8.(1) NaOH=Na++OH-
(2) CuCl2=Cu2++2Cl-
(3) Fe2(SO4)3=2Fe3++3SO42-
(4) Ba(NO3)2=Ba2++2NO3-
2 / 71
9.(1) SO42-+Ba2+=BaSO4
10.略
第二章温习题 1.(1)A 组 CO2 ;B 组 非金属单质或气体等; C 组 O2 ; D 组 酸或强电解质等 (2) 2Cu+O2+H2O+CO2=Cu2(OH)2CO3 转移 4e2.还原性 3. C;S 和 KNO3 4.A 5.C 6.D 7.B 8.C 9.A 10.B 11.稀硫酸
(注:从水溶液里析出的硅酸其实都是原硅酸 H4SiO4,书上为了简便,就把它写成了硅酸)
4.B(注:SiO2+4HF = SiF4↑+2H2O;NaOH 与 SiO2 的反应太慢,故并不选 D。)
5.玻璃、石英、陶瓷里都含有大量的 SiO2,熔融烧碱时有:SiO2+2NaOH=Na2SiO3+H2O 反应
人教版高中化学选修四全套课后练习题及答案解析

1.1化学反应与能量的变化第1课时练习1.下列对化学反应的认识错误的是( )A.会引起化学键的变化B.会产生新的物质C.必然引起物质状态的变化D.必然伴随着能量的变化【解析】化学反应的本质是化学键的断裂和形成,表现为有新物质生成,同时伴随着能量的变化;而化学变化中的反应物和生成物的状态在反应前后可能相同,也可能不相同,故C项错误。
【答案】 C2.下列反应中反应物总能量高于生成物总能量的是( )A.二氧化碳与碳反应生成一氧化碳B.碳与水蒸气反应生成一氧化碳和氢气C.碳酸钙受热分解D.盐酸与氢氧化钠反应【解析】反应物总能量高于生成物总能量的反应应该是放热反应。
【答案】 D3.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全,生成了新物质硫化亚铁。
该现象说明( ) A.该反应是吸热反应B.该反应是放热反应C.铁粉和硫粉在常温下容易发生反应D.生成物硫化亚铁的总能量高于反应物铁粉和硫粉的总能量【解析】铁粉和硫粉混合,停止加热后,反应仍可持续进行,说明该反应是放热反应,即生成物的总能量低于反应物的总能量。
【答案】 B4.下列图示变化为吸热反应的是( )【解析】 选项B 中反应物的总能量大于生成物的总能量,该反应为放热反应;浓H 2SO 4溶于水放出热量,但不属于化学反应;Zn 与稀盐酸的反应为放热反应。
【答案】 A5.已知反应X +Y===M +N 为吸热反应,对这个反应的下列说法中正确的是 ( )A .X 的能量一定低于M 的能量,Y 的能量一定低于N 的能量B .因为该反应为吸热反应,故一定要加热反应才能进行C .破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量D .X 和Y 的总能量一定低于M 和N 的总能量【解析】 已知X +Y===M +N ΔH >0,说明X 与Y 的总能量低于M 与N 的总能量,A 错误,D 正确;破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,C 错误;吸热反应有的不需要加热也可进行,如氢氧化钡晶体与氯化铵搅拌即可反应,B 错误。
高中化学选修4课后习题参考答案-人教版

人教版高中化学选修四——《化学反应原理》课本习题参考答案第一单元第一节化学反应与能量的变化1.化学反应过程中所释放或吸收的能量,叫做反应热,在恒压条件下,它等于反应前后物质的焓变,符号是ΔH,单位是kJ/mol。
例如1mol H2(g)燃烧,生成1mol H2O(g),其反应热ΔH=-241.8kJ/mol。
2.化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子。
旧键断裂需要吸收能量,新键形成需要放出能量。
当反应完成时,若生成物释放的能量比反应物吸收的能量大,则此反应为放热反应;若生成物释放的能量比反应物吸收的能量小,反应物需要吸收能量才能转化为生成物,则此反应为吸热反应。
第一节燃烧热能源1.在生产和生活中,可以根据燃烧热的数据选择燃料。
如甲烷、乙烷、丙烷、甲醇、乙醇、氢气的燃烧热值均很高,它们都是良好的燃料。
2.化石燃料蕴藏量有限,不能再生,最终将会枯竭,因此现在就应该寻求应对措施。
措施之一就是用甲醇、乙醇代替汽油,农牧业废料、高产作物(如甘蔗、高粱、甘薯、玉米等)、速生树木(如赤杨、刺槐、桉树等),经过发酵或高温热分解就可以制造甲醇或乙醇。
由于上述制造甲醇、乙醇的原料是生物质,可以再生,因此用甲醇、乙醇代替汽油是应对能源危机的一种有效措施。
3.氢气是最轻的燃料,而且单位质量的燃烧热值最高,因此它是优异的火箭燃料,再加上无污染,氢气自然也是别的运输工具的优秀燃料。
在当前,用氢气作燃料尚有困难,一是氢气易燃、易爆,极易泄漏,不便于贮存、运输;二是制造氢气尚需电力或别的化石燃料,成本高。
如果用太阳能和水廉价地制取氢气的技术能够突破,则氢气能源将具有广阔的发展前景。
4.甲烷是一种优质的燃料,它存在于天然气之中。
但探明的天然气矿藏有限,这是人们所担心的。
现已发现海底存在大量水合甲烷,其储量约是已探明的化石燃料的2倍。
如果找到了适用的开采技术,将大大缓解能源危机。
5.柱状图略。
化学选修4课后习题答案
化学选修4课后习题答案第一章:化学平衡与溶液习题1:在500 mL 0.1 mol/L HCl 溶液中加入1 g KCl,求该溶液的pH值。
首先,计算KCl的摩尔量:摩尔质量(KCl) = 39.1 + 35.5 = 74.6 g/mol摩尔量(KCl) = 质量(KCl) / 摩尔质量(KCl) = 1g / 74.6g/mol = 0.0134 mol然后,计算盐酸(HCl)的摩尔量:摩尔质量(HCl) = 1.0 + 35.5 = 36.5 g/mol摩尔量(HCl) = 浓度(HCl) * 体积(HCl) = 0.1 mol/L * 0.5 L = 0.05 mol根据物质的摩尔量关系,可知盐酸(HCl)反应完全后的物质摩尔量:KCl:HCl = 1:1,所以 KCl 的摩尔量 = HCl 的摩尔量 = 0.0134 mol所以,盐酸(HCl)与KCl反应后,生成溶液中的氯离子的摩尔量为:氯离子(Cl-)的摩尔量 = 0.05 mol + 0.0134 mol = 0.0634 mol由此可得溶液中氯离子的浓度:浓度(Cl-) = 摩尔量(Cl-) / 体积溶液 = 0.0634 mol / 0.5 L = 0.1268 mol/ L根据氯离子的浓度求溶液的pH值:pH = -lg[Cl-] = -lg(0.1268) ≈ 0.9所以该溶液的pH值约为0.9。
习题2:若已知 0.1 mol/L HCl 和 0.05 mol/L NaOH 完全反应生成水和盐的化学方程式,求生成的氯化钠的质量。
化学方程式为:HCl + NaOH → NaCl + H2O根据方程式可知,1 mol HCl 反应生成 1 mol NaCl。
所以 0.1 mol/L HCl 反应生成的 NaCl 的摩尔质量:摩尔质量(NaCl) = 23.0 + 35.5 = 58.5 g/mol所以生成的 NaCl 的质量为:质量(NaCl) = 摩尔质量(NaCl) * 反应生成的 NaCl 的摩尔量= 58.5 g/mol * 0.1 mol/L * 1 L = 5.85 g所以生成的氯化钠的质量为 5.85 g。
新课标高中化学(选修4)课后题答案第1-3章
第一章第一节化学反应与能量的变化四、习题参考(一)参考答案1. 化学反应过程中所释放或吸收的能量,叫做反应热,在恒压条件下,它等于反应前后物质的焓变,符号是ΔH,单位是kJ/mol。
例如1 mol H2 (g)燃烧,生成1 mol H2O(g),其反应热ΔH=-241.8 kJ/mol。
2. 化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子。
旧键断裂需要吸收能量,新键形成需要放出能量。
当反应完成时,若生成物释放的能量比反应物吸收的能量大,则此反应为放热反应;若生成物释放的能量比反应物吸收的能量小,反应物需要吸收能量才能转化为生成物,则此反应为吸热反应。
(二)补充习题1.下列说法不正确的是()。
A.放热反应不需加热即可发生B.化学反应过程中的能量变化除了热能外,也可以是光能、电能等C.需要加热才能进行的化学反应不一定是吸热反应D.化学反应热效应数值与参加反应的物质多少有关2.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。
该现象说明了()。
A.该反应是吸热反应B.该反应是放热反应C.铁粉和硫粉在常温下难以发生反应D.生成物硫化亚铁的总能量高于反应物铁粉和硫粉的总能量3.沼气是一种能源,它的主要成分是CH4。
0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ热量,则下列热化学方程式中正确的是()。
4. 下列关系式中正确的是A.a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>0参考答案1.A;2.B、C;3.C;4. C。
第二节燃烧热能源四、习题参考(一)参考答案1. 在生产和生活中,可以根据燃烧热的数据选择燃料。
如甲烷、乙烷、丙烷、甲醇、乙醇、氢气的燃烧热值均很高,它们都是良好的燃料。
2. 化石燃料蕴藏量有限,不能再生,最终将会枯竭,因此现在就应该寻求应对措施。
措施之一就是用甲醇、乙醇代替汽油,农牧业废料、高产作物(如甘蔗、高粱、甘薯、玉米等)、速生树木(如赤杨、刺槐、桉树等),经过发酵或高温热分解就可以制造甲醇或乙醇。
最新人教版化学选修4课本练习题答案(最新)名师资料合集
化学选修4课本课后练习题答案第一章第一节(P.6)1 .化学反响过程中所释放或吸收的能量,叫做反响热,在恒压条件下,它等于反响前后物质的始变,符号是AH,单位是kJ/mol o 例如1 mol H2 (g)燃烧,生成1 mol H2O(g),其反响热A H=-241.8 kJ/mol o2 .化学反响的实质就是反响物分子中化学键断裂, 形成新的化学键,重新组合成生成物的分子.旧键断裂需要吸收能量,新键形成需要放出能量.当反响完成时,假设生成物释放的能量比反响物吸收的能量大,那么此反响为放热反响;假设生成物释放的能量比反应物吸收的能量小,反响物需要吸收能量才能转化为生成物,那么此反响为吸热反响.第二节(P.10)1 .在生产和生活中,可以根据燃烧热的数据选择燃料.如甲烷、乙烷、丙烷、甲醇、乙醇、氢气的燃烧热值均很高,它们都是良好的燃料.2 .化石燃料蕴藏量有限,不能再生,最终将会枯竭,因此现在就应该寻求应对举措.举措之一就是用甲醇、乙醇代替汽油,农牧业废料、高产作物(如甘蔗、高粱、甘薯、玉米等)、速生树木(如赤杨、刺槐、枝树等),经过发酵或高温热分解就可以制造甲醇或乙醇.由于上述制造甲醇、乙醇的原料是生物质,可以再生,因此用甲醇、乙醇代替汽油是应对能源危机的一种有效举措.3 .氢气是最轻的燃料,而且单位质量的燃烧热值最高,因此它是优异的火箭燃料,再加上无污染,氢气自然也是别的运输工具的优秀燃料.在当前,用氢气作燃料尚有困难,一是氢气易燃、易爆,极易泄漏,不便于贮存、运输;二是制造氢气尚需电力或别的化石燃料,本钱高.如果用太阳能和水廉价地制取氢气的技术能够突破,那么氢气能源将具有广阔的开展前景.4 .甲烷是一种优质的燃料,它存在于天然气之中.但探明的天然气矿藏有限,这是人们所担忧的.现已发现海底存在大量水合甲烷,其储量约是已探明的化石燃料的2倍.如果找到了适用的开采技术,将大大缓解能源危机.5 .柱状图略.关于如何合理利用资源、能源,学生可以自由设想. 在上述工业原材料中,能源单耗最大的是铝;产量大,因而总耗能量大的是水泥和钢铁.在生产中节约使用原材料,增强废旧钢铁、铝、铜、锌、铅、塑料器件的回收利用,均是合理利用资源和能源的举措.6 .公交车个人耗油和排出污染物量为私人车的1/5 ,从经济和环保角度看,开展公交车更为合理.第三节(P.14)1. C(s)+O2 (g) == CO2 (g)A H=-393.5 kJ/mol2.5 mol C 完全燃烧, A H=2.5 mol x (-393.5 kJ/mol ) =-983.8kJ/mol2. H2 (g) 的燃烧热A H=-285.8 kJ/mol欲使H2完全燃烧生成液态水,得到1 000 kJ的热量,需要H2 1 000 kJ + 285.8 kJ/mol=3.5 mol3. 设S的燃烧热为A HS(s)+O2 (g) == SO2 (g)32 g/mol A H4 g -37 kJA H=32 g/mol x (-37 kJ) +4 g =-296 kJ/mol4.设CH4的燃烧热为A HCH4 (g)+O2 (g) == CO2 (g)+2H2O(g)16 g/mol AH1 g -55.6 kJA H=16 g/mol x (-55.6 kJ) +1 g =-889.6 kJ/mol5 . (1)求3.00 mol C 2H完全燃烧放出的热量QGH (g)+5/2O 2 (g) == 2CO 2 (g)+H 2O (l)26 g/mol A H2.00 g -99.6 kJ A H=26 g/mol x (-99.6 kJ) + 2.00 g=-1 294.8 kJ/molQ=3.00 mol x (-1 294.8 kJ/mol)=-3 884.4 kJ 〜-3 880 kJ(2)从4题CH的燃烧热为-889.6 kJ/mol ,与之相比,燃烧相同物质的量的C2h2放出的热量多.6 . CO(g)+H 2O(g)==CC2(g)+ H 2(g) A H=-41 kJ/mol7 .1 kg人体脂肪储存32 200 kJ能量,行走1 km消耗170 kJ, 求每天行走5 km, 1年因此而消耗的脂肪量:170 kJ/km X 5 km/d x 365 d + 32 200 kJ/kg=9.64 kg8 .此人脂肪储存的能量为4.2 X105 kJ.快速奔跑1 km要消耗420 kJ能量,此人脂肪可以维持奔跑的距离为: 4.2 X 105 kJ- 420 kJ/km=1 000 km9 . 1 t 煤燃烧放热2.9X107 kJ50 t水由20 C升温至100 C,温差100 C -20 C=80 C,此时需吸热:50X 103 kg X80 CX 4.184 kJ/(kg ?C )=1.673 6 X 107 kJ 锅炉的热效率=(1.673 6 X 107 kJ +2.9 X 107 kJ ) X 100% =57.7%10 .各种塑料可回收的能量分别是:耐纶 5 m3 X 4.2X104kJ/m3=21 X 104 kJ聚氯乙烯50 m3 X 1.6 X 104 kJ/m3=80 X 104 kJ丙烯酸类塑料5 m3 X 1.8 X 104 kJ/m3=9 X 104 kJ聚丙烯40 m3 x 1.5X104 kJ/m3=60 x 104 kJ 将回收的以上塑料加工成燃料,可回收能量为21X104 kJ+80 X 104 kJ+9 X 104 kJ+60 X 104 kJ=170X 104 kJ=1.7 X 106 kJ第二章第一节(P.18)1. 略.2.化学计量数.3. (1) A; (2) C; (3) Bo4. D.5. A.第二节(P.24)2. (1)加快.增大了反响物的浓度,使反响速率增大.(2)没有加快.通入N2后,容器内的气体物质的量增加,容器承受的压强增大,但反响物的浓度(或其分压)没有增大,反响速率不能增大.(3)降低.由于参加了N2,要保持容器内气体压强不变,就必须使容器的容积加大,造成H2和I2蒸气的浓度减小,所以,反响速率减小.(4)不变.在一定温度和压强下,气体体积与气体的物质的量成正比,反响物的物质的量增大一倍,容器的容积增大一倍,反响物的浓度没有变化,所以,反响速率不变.(5)加快.提升温度,反响物分子具有的能量增加,活化分子的百分数增大,运动速率加快,单位时间内的有效碰撞次数增加, 反响速率增大.3. A.催化剂能够降低反响的活化能,成千上万倍地提升反响速率,使得缓慢发生的反响2CO+2NO== N2+2CO2速进行.给导出的汽车尾气再加压、升温的想法不符合实际.第三节(P.32)1 .正、逆反响速率相等,反响物和生成物的质量(或浓度)保持不变.K=------- C»-------- 1<:工2 • KBM 16.3 .反响混合物各组分的百分含量,浓度、温度、压强(反响前后气体的物质的量有变化的反响),同等程度地改变正、逆反响, 不能使.4 . (1)该反响是可逆反响,1 mol N2和3 mol H2不能完全化合生成2 mol NH3 ,所以,反响放出的热量总是小于92.4 kJ .(2)适当降低温度,增大压强.5 . B ; 6. C ; 7. C ; 8. C .9.设:CO的消耗浓度为x.NCOC * - HQ 片式(飞))♦N H.O) —了广――白:接外方.舍去负设.…门:——7 = 3,066 ^=0.00751( 口. 01 —JC)的转化率为比累;』=75.第四节(P.36)1 .钱盐溶解常常是吸热的,但它们都能在水中自发地溶解.把两 种或两种以上彼此不发生反响的气体依次通入到同一个密闭容器 中,它们能自发地混合均匀.2 .在封闭体系中始减和嫡增的反响是容易自发发生的.在判断化学反响的方向时不能只根据始变A H< 0或嫡增中的一项就得出结论,而是要全面考虑才能得出正确结论.第三章 水溶液中的离子平衡 第一节 弱电解质的电离(P.43-44)习题(4)错.醋酸中的氢没有全部电离为 H o冰(5)错.此题涉及水解较复杂,不要求学生考虑水解.4 (1)不变.一定温度下,该比值为常数一一平衡常数. 2) ) 4.18 X 10 4mol/L*5.(1) 电离难的原因:a 、一级电离出H f 后,剩下的酸根阴离子 带负电荷,增加了对H +的吸引力,使第二个H+离子电离困难的多;b 、一级电离出的H +抑制了二级的电离.(2)木头中的电解质 杂质溶于水中,使其具有了导电性.3) (1)错.导电水平的强弱取决于电解质溶液 中离的浓度,因此强、弱电解质溶液导电能 力与二者的度及强电解质的溶解性有关.(2)错.酸与碱反响生成盐,所需碱的量只与酸的物质的量有关,盐酸和醋酸都是一元酸, 浓度相同的盐酸和醋酸中含有相同物质的量的(3)错.一水合氨是弱碱,在水溶液中是局部电离的,其电离平 衡受氨水浓度的影响,浓溶液的电离程度低于稀溶液.因此氨水 稀释一倍时,其OH 浓度降低不到一半.1. (P.52-53)习题4.2.红・ H 2O, 4, NH,;Cl 2,Cl -, H+,ClO -,HClO,H 2O, OHA5. D6.AD9.注:不同品牌的同类物品,其相应的pH 可能不尽相同.可.2+HO -——- SOT + 2HCl T液易发生水解, AlCl 3 • 6 H 2O 与SOC 2混合加热,SOC12,H 2O 中的结晶水作用,生成无水 A1C1 3及SO 和HC1气I效果是增加水解反响的反响物c ( SbC13),加氨水可生成的 HC1,以减少生成物 c (H +),两项操作的作用 平衡向水解反响的方向移.,MgC12 ^HO 水解反响的生成物 HC1逸出反响体系, 或少可逆反响的生成,从而可使平衡不断向水解反11. (1)酸性(2) 10,1 X10"mo1/L (3) 9 mL 图略. (P.59)习题 1. D 2. B 3. C 4. D5.甲,即使是弱酸,所电离出的H +必须与强碱电离出的 OH 相等(pH=7),即c (A)=C(M +) o6.>,A1 3++2SO 2+2BS2++4OH = 2BaSOd +AQ +2HO二;2A1 " +3SO 2 +3BgT +6OH = 3BaSC 4 J +2A1(OH) 3 J_ 2- - _ — —— —2+ 2—7 CC 3 +HO ---------- HCO +OH ,Ca +CO =CaCO工_、、、.>>一、、、.>>.—. . » »一 ? 、. ?、2 18. Na z CO 溶放的pH>NaHC 嗡放的pH,由于由HCO 电离成 CO比由H 2CO 电离成HCOT 更难,即NaCO 与NaHC 比更弱的弱酸盐, 所以水解程度会大一些.MgSO-7H2.没有类似可促进水解反响进行的情况.(P.67)习题 1.文字描述略.2. C ;3. C ;4. D .5 . (1) S 2—与4作用生成的H 2S 气体会逸出反响体系,使 FeS 的 沉淀溶解平衡向溶解方向移动.(2)硫酸钙也难溶于水,因此向碳酸钙中加硫酸是沉淀转化的问题,但硫酸钙的溶解度大于碳酸钙,转化不能实现.醋酸钙溶于水,且醋酸提供的H+与碳酸钙沉淀溶解平衡中的CO2-作用,可生成CO逸出反响体系,使其沉淀溶解平衡向溶解的方向移动.(3)硫酸溶液中的SO2-对BaSO的沉淀溶解平衡有促进平衡向生成沉淀的方向移动的作用.6 .略.习题(P.73)1 .由化学能转变为电能的装置. 氧化反响,负极;复原反响,正极.2.铜,Cu-2e-= Cu+;银,Ag++e-= Ag.3. a、c、d、bo4. B;5. B、D.6.装置如图4-2所示.负极:Zn-2e-= Zn2+正极:Fe2++2e- = Fe (P.78)习题1. A ;2.D ;3. C.4.铅蓄电池放电时的电极反响如下:负极:Pb(s)+SO42-(aq) — 2e- = PbSO4⑸锌铁原电池装置正极:PbQ(s)+4H +(aq)+SO42-(aq)+2e -=PbSO(s)+2H 2O(l) 铅蓄电池充电时的电极反响如下:阴极:PbSO ⑸+2e - = Pb(s)+SO 42-(aq) 阳极:PbSO(s)+2H 2O(l) — 2e-= Pb6(s)+4H +(aq)+SO42-(aq) 总反响方程式:Phim - Ph(Q 十]H St ) < J -;(s(P.83)习题1. A ;2. D.3.原电池是把化学能转变为电能的装置,电解池是由电能转化为化学能的装置.例如锌铜原电池,在锌电极上发生氧化反响,称为负极,在铜电极上发生复原反响,称为正极.2+负极:Zn-2e = Zn (氧化反响)正极:Cu++2e- = Cu (复原反响)电子通过外电路由负极流向正极.电解池:以CuCl2溶液的电解装置为例. 与电源正极相连的电极叫做阳极,与电源负极相连的电极叫阴极. 阳极:2Cl--2e-= CI2T (氧化反响)阴极:Cu++2e- = Cu (复原反响)电子通过外电路由阳极流向阴极.4.电镀是把待镀金属制品作阴极,把镀层金属作阳极,电解精炼铜是把纯铜板作阴极,粗铜板作阳极,通过类似电镀的方法把铜电镀到纯铜板上去,而粗铜中的杂质留在阳极泥或电解液中,从而到达精炼铜的目的.其电极主要反响如下:阳极(粗铜):Cu-2e- = Cu 2+(氧化反响)阴极(纯铜):Cu++ 2e- = Cu (复原反响)图4-2补充:假设粗铜中含有锌、馍、银、金等杂质,那么在阳极锌、馍等比铜活泼的金属也会被氧化:阳极(粗铜):Zn-2e-= Zn2+ Ni—2e = Ni 2+由于附着在粗铜片上银、金等金属杂质不如铜活泼,不会在阳极被氧化,所以当铜氧化后,这些微小的杂质颗粒就会掉进电解质溶液中,沉积在阳极附近(即“阳极泥〞,成为提炼贵重金属的原料).在阴极,电解质溶液中Zn2+和刈2+的氧化性又不如Cu2+强,难以在阴极获得电子被复原,故Zn2*D Ni2+被滞留在溶液中.因此, 在阴极只有Cu2+被复原并沉积在纯铜片上,从而到达了通过精炼提纯铜的目的.5 .电解饱和食盐水的电极反响式为:阳极:2Cl--2e- = Cl 2 T (氧化反响)阴极:2H++2e- = H 2T (复原反响)或阴极:2HaO+2e = H 2T +2OH (复原反响)总反响:2NaCl+2HO = 2NaOH+Hf +C12T在阴极析出1.42 L H 2,同时在阳极也析出1.42 L Cl 2.6 .依题意,电解XCl2溶液时发生了如下变化:XGIh 但心X + Ulx t7VT< X > * 1 mot22- 4 "之/ 121一M(X)=3.2 g X 22.4 L/(1 mol X 1.12 L)=64 g/mol即X的相对原子质量为64.又由于2Cl - - 2e - = Cl 2 T2 mol 22.4Ln(e -) 1.12Ln(e-)=2 mol x 1.12 L/22.4 L=0.1 mol 即电路中通过的电子有0.1 mol. (P.87-88)习题1. 负极;Fe-2e- = Fe 2+;正极;析氢腐蚀:2H++2e- = H 2?,吸氧腐蚀:2H2O+O+4e = 4OH-2. (1)电化学腐蚀,铁和铁中的杂质碳以及残留盐溶液形成了原电池.(2)提示:主要是吸氧腐蚀.2Fe-4e- = 2Fe2+; 2H2O+OMe,一 _ " =4OH ;Fe2++2OH = Fe(OH) 2, 4Fe(OH) 2+Q+2H2O = 4Fe(OH) 33. C ;4. B、D;5. A、C;6. D.7 .金属跟接触到的枯燥气体(如Q、Cl2、SO)或非电解质液体直接发生化学反响而引起的腐蚀,叫做化学腐蚀.不纯的金属跟电解质溶液接触时,会发生原电池反响,比拟活泼的金属失去电子而被氧化,这种腐蚀叫做电化学腐蚀.金属腐蚀造成的危害甚大,它能使仪表失灵,机器设备报废,桥梁、建筑物坍塌,给社会财产造成巨大损失.8 .当钢铁的外表有一层水膜时,水中溶解有电解质,它跟钢铁中的铁和少量的碳形成了原电池.在这些原电池里,铁是负极,碳是正极.电解质溶液的H+在正极放电,放出因此这样的电化腐蚀叫做析氢腐蚀.如果钢铁外表吸附的水膜酸性很弱或呈中性, 溶有一定量的氧气,此时就会发生吸氧腐蚀,其电极反响如下:负极:2Fe-4e- = 2Fe 2+正极:2HzO+GMe- = 4OH-总反响:2Fe+2H2O+O== 2Fe(OH) 29 .镀锌铁板更耐腐蚀.当镀锌铁板出现划痕时,暴露出来的铁将与锌形成原电池的两个电极,且锌为负极,铁为正极,故铁板上的镀锌层将先被腐蚀,镀锌层腐蚀完后才腐蚀铁板本身.镀锡铁板如有划痕,锡将成为原电池的正极,铁为负极,这样就会加速铁的腐蚀.可设计如下实验:取有划痕的镀锌铁片和镀锡铁片各一块, 放在经过酸化的食盐水中浸泡一会儿,取出静置一段时间,即可见到镀锡铁片外表较快出现锈斑,而镀锌铁片没有锈斑.即说明上述推测是正确的.。
化学选修四-课后习题及参考答案
化学选修4化学反应原理课后习题和答案第一章化学反应与能量第一节化学反应与能量的变化P5习题1.举例说明什么叫反应热,它的符号和单位是什么?2.用物质结构的知识说明为什么有的反应吸热,有的反应放热。
3.依据事实,写出下列反应的热化学方程式。
(1)1molN2(g)与适量H2(g)起反应,生成NH3(g),放出92.2kJ热量。
(2)1molN2(g)与适量O2(g)起反应,生成NO2(g),吸收68kJ热量。
(3)1molCu(s)与适量O2(g)起反应,生成CuO(s),放出157kJ热量。
(5)(l),(6)(l),1、O(g),2、反应12化石燃料蕴藏量有限,不能再生,最终将会枯竭,因此现在就应该寻找对应措施。
措施之一就是用甲醇、乙醇代替汽油,农牧业废料、高产作物(甘蔗、高粱、甘薯、玉米等)、速生树木(如赤杨、刺槐、桉树等),经过发酵或高温热分解就可以制造甲醇或乙醇。
由于上述制造甲醇、乙醇的原料是可以再生的,因此用甲醇、乙醇代替汽油是应对能源危机的一种有效措施。
3、用氢气作燃料有什么优点?在当今的技术条件下有什么问题?它的发展前景如何?氢气是最轻的燃料,而且单位质量的燃烧值最高,因此它是优异的火箭燃料,再加上无污染,氢气自然也是别的运输工具的优秀燃料。
在当前,用氢气作燃料尚有困难,一是氢气易燃、易爆,极易泄漏,不便于贮存、运输;二是制造氢气尚需电力或别的化石燃料,成本高。
如果用太阳能和水廉价地制取氢气的技术能够突破,则氢气能源将具有广阔的发展前景。
4、科学家发现海底存在大量水合甲烷,请你谈谈甲烷燃料开发的前景。
甲烷是一种优质的燃料,,它存在于天然气之中。
但探明的天然气矿藏有限,这是人们所担心的。
现已发现海底存在大量水合甲烷,其储量约是已探明的化石燃料的2倍。
如果找到了适用的开采技术,将大大缓解能源危机。
请画出一张柱状图来形象地表述这些数据,并提出合理利用资源、能源的设想。
在上述工业原材料中,能源单耗最大的是铝;产量大,因而总耗能量大的是水泥和钢铁。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人教版高中化学选修四一一课本习题参考答案人教版高中化学选修四一一《化学反应原理》课本习题参考答案J1. 化学反应过程中所释放或吸收的能量,叫做反应热,在恒压条件下,它等于反应前后物质的焓变,符号是△ H,单位是kJ/mol。
例如1 mol H (g)2 燃烧,生成1 mol HO(g),其反应热4 2H=-241.8 kJ/mol。
2. 化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子。
旧键断裂需要吸收能量,新键形成需要放出能量。
当反应完成时,若生成物释放的能量比反应物吸收的能量大,则此反应为放热反应;若生成物释放的能量比反应物吸收的能量小,反应物需要吸收能量才能转化为生成物,则此反应为吸热反应1W卓4 :;JI g 2 W⑴M g) F 出! f C k 亠 F i7.( J-lirt 灯•HMt)1 :;1I 'u i “I* 匕 1 -厂|H1iH-!_.7 11mol([iJ ii 11*41' nt,:i kJ nn(;」+ i ■■J _■卜:-?HIJl 1» A H-iJ * L|inoii i t11 (1 > -学{L (ji J ― 9( < 11) I I i I i AJI-j .1 JM k l rni3:仁■:I) I ■■ .H ■' ^:■< 'IF,皿IL - j AH'1 <1tEUI 1! 211 'll- 1 :;! - H : J 厂 1 M ;!■ Tif >(X:』■1H-il kJ mill第二节1. 在生产和生活中,可以根据燃烧热的数据选择燃料。
如甲烷、乙烷、丙烷、甲醇、乙醇、氢气的燃烧热值均很高,它们都是良好的燃料。
2. 化石燃料蕴藏量有限,不能再生,最终将会枯竭,因此现在就应该寻求应对措施。
措施之一就是用甲醇、乙醇代替汽油,农牧业废料、高产作物(如甘蔗、高粱、甘薯、玉米等)、速生树木(如赤杨、刺槐、桉树等),经过发酵或高温热分解就可以制造甲醇或乙醇。
由于上述制造甲醇、乙醇的原料是生物质,可以再生,因此用甲醇、乙醇代替汽油是应对能源危机的一种有效措施。
3. 氢气是最轻的燃料,而且单位质量的燃烧热值最高,因此它是优异的火箭燃料,再加上无污染,氢气自然也是别的运输工具的优秀燃料。
在当前,用氢气作燃料尚有困难,一是氢气易燃、易爆,极易泄漏,不便于贮存、运输; 二是制造氢气尚需电力或别的化石燃料,成本高。
如果用太阳能和水廉价地制取氢气的技术能够突破,则氢气能源将具有广阔的发展前景。
4. 甲烷是一种优质的燃料,它存在于天然气之中。
但探明的天然气矿藏有限,这是人们所担心的。
现已发现海底存在大量水合甲烷,其储量约是已探明的化石燃料的2 倍。
如果找到了J适用的开采技术,将大大缓解能源危机。
5. 柱状图略。
关于如何合理利用资源、能源,学生可以自由设想。
在上述工业原材料中,能源单耗最大的是铝; 产量大,因而总耗能量大的是水泥和钢铁。
在生产中节约使用原材料,加强废旧钢铁、铝、铜、锌、铅、塑料器件的回收利用,均是合理利用资源和能源的措施。
6. 公交车个人耗油和排出污染物量为私人车的1/5 ,从经济和环保角度看,发展公交车更为合理。
1. C(s)+O (g) == CO (g) 22△ H二393.5 kJ/mol2.5 mol C 完全燃烧,△ H=2.5 mol x(-393.5 kJ/mol)=-983.8 kJ/mol 2. H(g) 的燃烧热△ H=-285.8 kJ/mol 2欲使H完全燃烧生成液态水,得到12000 kJ 的热量,需要H 1 000 kJ?285.8 2kJ/mol=3.5 mol3. 设S 的燃烧热为△ H S(s)+O (g) == SO (g) 2232 g/mol △ H4 g -37 kJ△H=32 g/mol x(-37 kJ)?4 gJ=-296 kJ/mol4. 设CH的燃烧热为△ H 4CH (g)+O (g) == CO (g)+2HO(g) 422216 g/mol △ H1 g -55.6 kJ△H=16 g/mol x ( -55.6 kJ)?1 g=-889.6 kJ/mol5. (1) 求3.00 mol C2H2 完全燃烧放出的热量QCH (g)+5/2O (g) == 2CO (g)+HO22222(l)26 g/mol AH2.00 g -99.6 kJA H=26 g/mol x( -99.6 kJ)?2.00 g=-1 294.8 kJ/molQ=3.00 mol x(-1 294.8 kJ/mol)=-3884.4 kJ?-3 880 kJ⑵从4题已知CH4的燃烧热为-889.6 kJ/mol ,与之相比,燃烧相同物质的量的CH放出的热量多。
226. 写出NH燃烧的热化学方程式3NH (g)+5/4O (g) == NO 322(g)+3/2HO(g) 2将题中(1) 式乘以3/2,得:3/2H (g)+3/4O (g) == 3/2HO(g) 2223/2A H=3/2x(-241.8 kJ/mol) 1=-362.7 kJ/mol将题中(2) 式照写:1/2N (g)+O (g) == NO (g) 222 A H=+33.9 kJ/mol 2将题中(3) 式反写,得NH (g) == 1/2N (g)+3/2H (g) 322- A H=46.0 kJ/mol 3 再将改写后的3式相加,得:■/ II? 1»「-M>n,-巧■kJ im ilW・i可W M ' • iH '7 | . :. ■屮强.!!kJ y|1、II.上\7:-| 1,' n j1 ;J ri^MWE 和■ii i|人山阖蜡住鑿丄门二—上】“”応7. 已知1 kg人体脂肪储存32 200 kJ能量,行走1 km消耗170 kJ,求每天行走5 km, 1年因此而消耗的脂肪量:170 kJ/km X 5 km/d x 365 d?32 200kJ/kg=9.64 kg8. 此人脂肪储存的能量为4.2 x 105 kJ。
快速奔跑1 km要消耗420 kJ能量,此人脂肪可以维持奔跑的距离为:4.2 x 105 kJ?420 kJ/km=1 000 km 79. 1 t 煤燃烧放热2.9 X 10 kJ 50 t 水由20 ?升温至100 ?,温差100 ?-20 ?=80 ?,此时需吸热:350x 10kg X 80 ? X 4.1 847kJ/(kg??)=1.673 6 x 10 kJ7锅炉的热效率=(1.673 6 x 107kJ?2.9 x 10 kJ) x 100%=57.7%10. 各种塑料可回收的能量分别是:334 耐纶5 m x 4.2 x 104 kJ/m=21 x 10kJ334 聚氯乙烯50 m x 1.6 x 104 kJ/m=80 x 10kJ3丙烯酸类塑料 5 m x1.8x10434kJ/m=9x10 kJ334 聚丙烯40 m x1.5x104 kJ/m=60x10 kJ将回收的以上塑料加工成燃料,可回收能量为4 4 4 4 21 x 10kJ+80x 10kJ+9x 10kJ+60x 104 6kJ=170x10kJ=1.7x10 kJJ JJ J第二单元第一节 1. 略。
J J2. 1?3?2 。
3. (1)A;(2)C;(3)B 。
4. D 。
5. A 。
1. (1) 加快。
增大了反应物的浓度,使反应速率增大。
(2) 没有加快。
通入N 后,容器内2( 或其分压) 没有的气体物质的量增加,容器承受的压强增大,但反应物的浓度增大,反应速率不能增大(3) 降低。
由于加入了 N,要保持2容器内气体压强不变,就必须使容器的容积加大,造成H 和I 蒸气的浓度22减小,所以,反应速率减小。
(4)不变。
在一定温度和压强下,气体体积与气 体的物质的量成正比,反应物的物质的量增大一倍,容器的容积增大一倍,反应物 的浓度没有变化,所以,反应速率不变。
(5)加快。
提高温度,反应物分子具有的能量增加,活化分子的百分数增大, 运动速率加快,单位时间内的有效碰撞次数增加,反应速率增大。
2. A 。
催化剂能够降低反应的活化能,成千上万倍地提高反应速率,使得缓慢发生的反应2CO+2NO== N+2CO 迅速进行。
给导出的汽车尾气再加压、的想法不合乎实际。
1.正、逆反应速率相等,反应物和生成物的质量 (或浓度)保持不变。
3.反应混合物各组分的百分含量,浓度、温度、压强 (反应前后气体的物质的量有变化的反应),同等程度地改变正、逆反应,不能使。
4. (1)该反应是可逆反应,1 mol N2和3 mol H 不能完全化合生成2 mol 2 NH 所以,反应放出的热量总是小 3于 92.4 kJ 。
⑵适当降低温度,增大压强。
5. B; 6. C; 7. C; 8. C浓度为x升温2.9.设:CO 的消耗d (n ■ H < M(i'k of ^}~itUJf 游去9l#6 JT-T?_ =3,066 j=U. (W75d (ci, i H _r)rc)前转化車为罟罟=75. j % |第四节1.铵盐溶解常常是吸热的,但它们都能在水中自发地溶解。
把两种或两种以上彼此不发生反应的气体依次通入到同一个密闭容器中,它们能自发地混合均匀。
2. 在封闭体系中焓减和熵增的反应是容易自发发生的。
在判断化学反应的方向时不能只根据焓变△ H,0或熵增中的一项就得出结论,而是要全面考虑才能得出正确结论。
第三单元第一节1.2.氨水中存在的粒子:NH?HO 32-+NH OH 4-+-氯水中存在的粒子:Cl 、Cl 、H CIO 2J J3. ⑴ 错。
导电能力的强弱取决于电解质溶液中离子的浓度,因此强、弱电 解质溶液导电能力与二者的浓度及强电解质的溶解性有关。
(2)错。
酸与碱反应生成盐,所需碱的量只与酸的物质的量有关,盐酸和醋酸 都是一元酸,物质的量浓度相同的盐酸和醋酸中含有相同物质的量的H,(3) 错。
一水合氨是弱碱,在水溶液中是部分电离的,其电离平衡受氨水浓度 的影响,浓溶液的电离程度低于稀,溶液。
因此氨水稀释一倍时,其 OH 浓度降低不到一半。
(4) 错。
醋酸中的氢没有全部电离为 H探(5)错。
此题涉及水解较复杂,不要求学生考虑水解不变。
一定温度下,该比值为常数一一平衡常数。
,4⑵ 4.18 X 10 mol/L5. (1)略;(2)木头中的电解质杂质溶于水中,使其具有了导电性。
1. ????;????2. NH , 4, OH,, NH3?H2OH,9.注:不同品牌的同类物品,其相应的pH可能不尽相同。
