白介素6测定试剂盒(化学发光免疫分析法) 产品技术要求新产业
白介素6检测试剂注册技术审评指南

附件1白介素6检测试剂注册技术审评指南本指南旨在指导注册申请人对白介素6检测试剂注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指南系对白介素6检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指南是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其它方法,也可以采用,但是需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指南。
本指南是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指南相关内容也将适时进行调整。
一、适用范围白介素6检测试剂是指利用抗原抗体反应的免疫学方法对人血清、血浆、全血中的白介素6(Interleukin 6, IL-6)进行体外定量检测的试剂。
本指南适用于以酶标记、(电)化学发光标记、(时间分辨)荧光标记等方法标记抗体,以微孔板、管、磁颗粒、微珠和塑料珠等为载体的定量检测白介素6的免疫分析试剂。
不适用于免疫层析法以及单独申请注册的白介素6校准品和质控品。
根据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)、《体外诊断试剂注册管理办法修正案》(国家食品药品监督管理总局令第30号)和《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号),白介素6检测试剂管理类别为Ⅱ类,分类编码为6840。
本指南适用于进行首次注册申报和相关许可事项变更的产品。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、产品描述、有关生物安全性方面的说明、研究结果的总结评价以及同类产品在国内外上市情况介绍等内容。
综述资料应符合《体外诊断试剂注册管理办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。
白介素-6(IL-6)测定试剂盒(荧光免疫层析法)产品技术要求
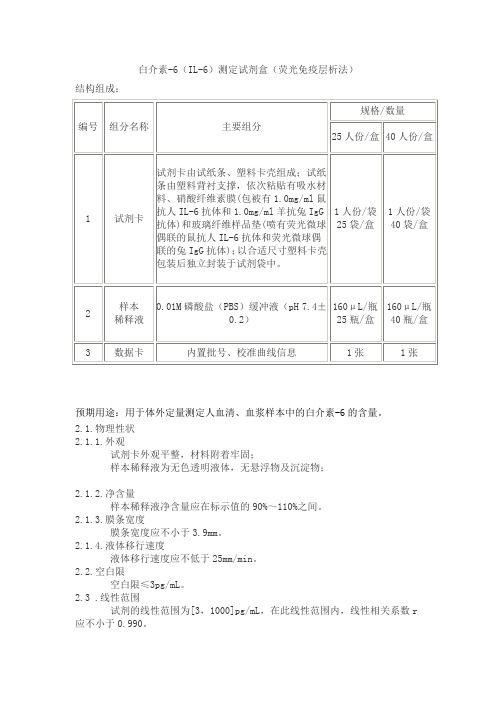
白介素-6(IL-6)测定试剂盒(荧光免疫层析法)
结构组成:
预期用途:用于体外定量测定人血清、血浆样本中的白介素-6的含量。
2.1.物理性状
2.1.1.外观
试剂卡外观平整,材料附着牢固;
样本稀释液为无色透明液体,无悬浮物及沉淀物;
2.1.2.净含量
样本稀释液净含量应在标示值的90%~110%之间。
2.1.
3.膜条宽度
膜条宽度应不小于3.9mm。
2.1.4.液体移行速度
液体移行速度应不低于25mm/min。
2.2.空白限
空白限≤3pg/mL。
2.3 .线性范围
试剂的线性范围为[3,1000]pg/mL,在此线性范围内,线性相关系数r 应不小于0.990。
2.4.测量精密度
2.4.1.重复性
用质控品重复测试,所得结果的变异系数(CV)≤15%;
2.4.2.批间差
用质控品重复测试3个批号的试剂盒,所得结果的变异系数(CV)≤15%。
2.5.准确度
回收率在85%~115%之间。
2.6 .稳定性
试剂在4℃~30℃密封避光保存,原包装存放的试剂有效期为12个月;取效期末的样品检测外观、膜条宽度、液体移行速度、空白限、线性范围、重复性、准确度,应分别符合2.1.1、2.1.3、2.1.4、2.2、2.3、2.4.1、2.5的要求。
2.7.溯源性
根据GB/T21415-2008的要求提供含有产品校准曲线信息的数据卡,本产品校准曲线信息可溯源至企业工作校准品。
白细胞介素6(IL-6)测定试剂盒(电化学发光免疫分析法)产品技术要求lztk
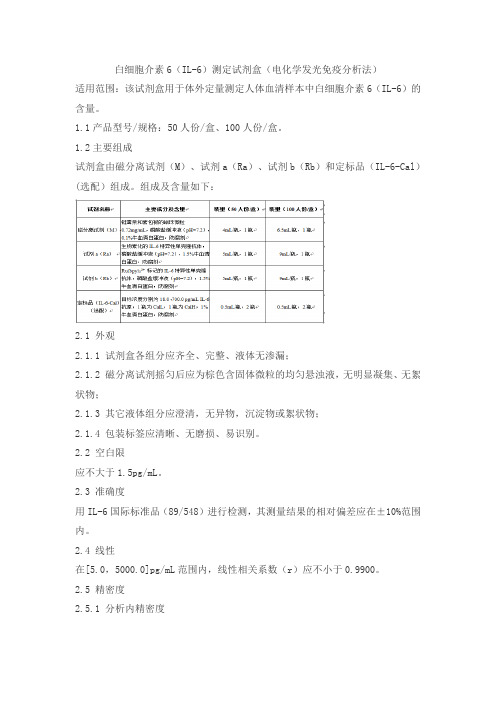
白细胞介素6(IL-6)测定试剂盒(电化学发光免疫分析法)适用范围:该试剂盒用于体外定量测定人体血清样本中白细胞介素6(IL-6)的含量。
1.1产品型号/规格:50人份/盒、100人份/盒。
1.2主要组成试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(IL-6-Cal)(选配)组成。
组成及含量如下:2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于1.5pg/mL。
2.3 准确度用IL-6国际标准品(89/548)进行检测,其测量结果的相对偏差应在±10%范围内。
2.4 线性在[5.0,5000.0]pg/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 分析内精密度在试剂盒的线性范围内,浓度为(30.0±6.0pg/mL)和(500.0±100.0pg/mL)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(30.0±6.0pg/mL)和(500.0±100.0pg/mL)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,定标品溯源到IL-6国际标准品(89/548)。
白介素6(IL-6)测定试剂盒产品技术要求深圳市锦瑞生物
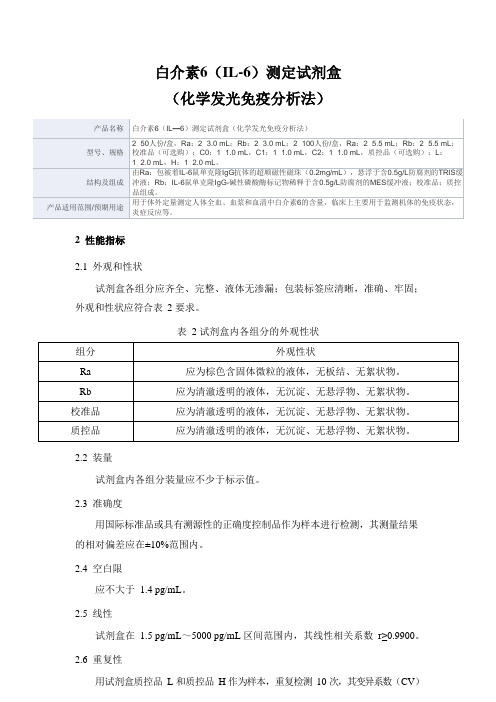
白介素6(IL-6)测定试剂盒
(化学发光免疫分析法)
2性能指标
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;外观和性状应符合表2 要求。
表 2 试剂盒内各组分的外观性状
2.2装量
试剂盒内各组分装量应不少于标示值。
2.3准确度
用国际标准品或具有溯源性的正确度控制品作为样本进行检测,其测量结果的相对偏差应在±10%范围内。
2.4空白限
应不大于 1.4 pg/mL。
2.5线性
试剂盒在 1.5 pg/mL~5000 pg/mL 区间范围内,其线性相关系数r≥0.9900。
2.6重复性
用试剂盒质控品L 和质控品H 作为样本,重复检测10 次,其变异系数(CV)
应不大于7%。
2.7批间差
用3 个批号试剂盒分别检测同一瓶质控品L 和质控品H,3 个批号试剂盒之间的批间变异系数(CV)应不大于9%。
2.8质控品测定值
用试剂盒配套的校准品校准测量系统后,以试剂盒配套的质控品作为样本进行检测,其测定结果应在标示范围内。
2.9质控品均一性
瓶间变异系数(CV)应不大于10%。
2.10校准品测量准确度
用工作校准品校准测量系统后,以试剂盒配套的校准品作为样本进行检测,其测定结果与标示值的相对偏差应在±10%范围内。
2.11校准品均一性
瓶间变异系数(CV)应不大于10%。
4.01 降钙素原 ∕ 白介素-6测定试剂盒(荧光免疫层析法)技术要求

医疗器械产品技术要求编号:降钙素原/白介素-6测定试剂盒(荧光免疫层析法)1 产品型号/规格及其划分说明1.1 型号型号:型号G、型号Q。
1.2 规格1人份/盒,2人份/盒,3人份/盒,5人份/盒,10人份/盒,20人份/盒,25人份/盒,30人份/盒,40人份/盒,50人份/盒,100人份/盒,200人份/盒。
1.3 产品型号/规格划分说明产品型号划分主要根据产品注册单元进行划分,其中型号G由检测卡、样本缓冲液组成;型号Q由检测卡、样本缓冲液、质控物组成。
规格划分主要根据产品单人份铝箔包装的检测卡装量来进行规格划分。
产品形式由产品型号和规格组合形成。
产品型号/规格划分类型(例子)2 性能指标2.1 物理检查2.1.1 外观试剂盒各组分齐全、完整,包装无破损;液体组分澄清、无漏液;标签牢固,内容清晰、准确。
质控物应外观均匀,形成完整的冻干品,复溶后清亮,无浑浊及沉淀。
2.1.2 液体移行速度液体移行速度应不小于10mm/min。
2.2 线性2.2.1 PCT项目试剂盒项目PCT线性在0.1ng/mL~50.0ng/mL范围内,线性相关系数|r|应≥0.990。
2.2.2 IL-6项目试剂盒项目IL-6线性在3.0pg/mL~4000.0pg/mL范围内,线性相关系数|r|应≥0.990。
2.3 准确性2.3.1 PCT项目测定回收率应在85%~115%范围内。
2.3.2 IL-6项目用IL-6国际标准品配制的准确性校准品或经标化的准确性校准品进行检测,其检测结果的相对偏差应在±15.0%范围内。
注:国家、省质量监督抽检和风险监测、第三方仲裁检验时应采用国家/国际标准品。
2.4 检出限试剂盒项目PCT检出限不高于0.05ng/mL,项目IL-6检出限不高于1.5pg/mL。
2.5 重复性试剂盒项目PCT和IL-6每个项目的重复性变异系数(CV)不高于10%。
2.6 批间差试剂盒项目PCT和IL-6每个项目的批间变异系数(CV)不高于15%。
白介素6测定试剂盒(化学发光法)产品技术要求丽珠

1.1外观
试剂盒各组分应齐全、完整,液体无渗漏;包装标签应清晰、准确、牢固。
1.2检出限
空白限(limit of blank,LoB)应不大于1.0pg/mL。检出限(limiБайду номын сангаас of detection,LoD)应不大于1.5pg/mL。
1.3准确度
检测准确度参考品,其测量结果的相对偏差应不超过±15%。
1.4线性
线性范围不窄于10pg/mL~4000pg/mL,线性相关系数|r|应不低于0.990。
1.5重复性
测试重复性参考品,所得结果的变异系数(CV)应不大于8%。
1.6批间差
测试重复性参考品,所得结果的批间变异系数(CV)应不大于10%。
产品名称
白介素6测定试剂盒(化学发光法)
型号、规格
3×14人份/盒
结构及组成
1、白介素6免疫反应测试筒抗白介素6结合磁微粒:抗白介素6鼠单克隆抗体(包被抗体)包被的磁微粒;抗白介素6酶标抗体:含碱性磷酸酶标记的抗白介素6鼠单克隆抗体(检测抗体)。2、测试筒支架
产品适用范围/预期用途
本产品适用于体外定量测定人血清或血浆中白介素6(Interleukin 6,IL-6)的浓度。用于炎症反应的辅助诊断。
白介素-6(IL-6)测定试剂盒(荧光免疫层析法)产品技术要求pdtys
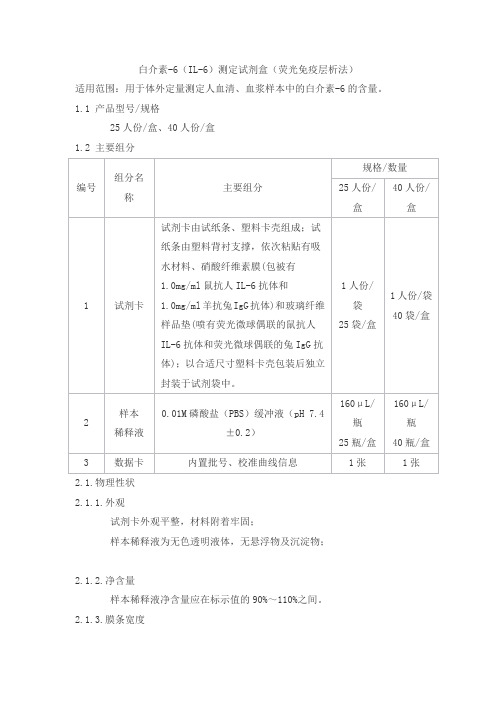
白介素-6(IL-6)测定试剂盒(荧光免疫层析法)
适用范围:用于体外定量测定人血清、血浆样本中的白介素-6的含量。
1.1 产品型号/规格
25人份/盒、40人份/盒
1.2 主要组分
2.1.物理性状
2.1.1.外观
试剂卡外观平整,材料附着牢固;
样本稀释液为无色透明液体,无悬浮物及沉淀物;
2.1.2.净含量
样本稀释液净含量应在标示值的90%~110%之间。
2.1.
3.膜条宽度
膜条宽度应不小于3.9mm。
2.1.4.液体移行速度
液体移行速度应不低于25mm/min。
2.2.空白限
空白限≤3pg/mL。
2.3 .线性范围
试剂的线性范围为[3,1000]pg/mL,在此线性范围内,线性相关系数r 应不小于0.990。
2.4.测量精密度
2.4.1.重复性
用质控品重复测试,所得结果的变异系数(CV)≤15%;
2.4.2.批间差
用质控品重复测试3个批号的试剂盒,所得结果的变异系数(CV)≤15%。
2.5.准确度
回收率在85%~115%之间。
2.6 .稳定性
试剂在4℃~30℃密封避光保存,原包装存放的试剂有效期为12个月;取效期末的样品检测外观、膜条宽度、液体移行速度、空白限、线性范围、重复性、准确度,应分别符合2.1.1、2.1.3、2.1.4、2.2、2.3、2.4.1、2.5的要求。
2.7.溯源性
根据GB/T21415-2008的要求提供含有产品校准曲线信息的数据卡,本产品校准曲线信息可溯源至企业工作校准品。
白介素-6(IL-6)测定试剂盒(荧光免疫层析法)产品技术要求

白介素-6(IL-6)测定试剂盒(荧光免疫层析法)
结构组成:
预期用途:用于体外定量测定人血清、血浆样本中的白介素-6的含量。
2.1.物理性状
2.1.1.外观
试剂卡外观平整,材料附着牢固;
样本稀释液为无色透明液体,无悬浮物及沉淀物;
2.1.2.净含量
样本稀释液净含量应在标示值的90%~110%之间。
2.1.
3.膜条宽度
膜条宽度应不小于3.9mm。
2.1.4.液体移行速度
液体移行速度应不低于25mm/min。
2.2.空白限
空白限≤3pg/mL。
2.3 .线性范围
试剂的线性范围为[3,1000]pg/mL,在此线性范围内,线性相关系数r 应不小于0.990。
2.4.测量精密度
2.4.1.重复性
用质控品重复测试,所得结果的变异系数(CV)≤15%;
2.4.2.批间差
用质控品重复测试3个批号的试剂盒,所得结果的变异系数(CV)≤15%。
2.5.准确度
回收率在85%~115%之间。
2.6 .稳定性
试剂在4℃~30℃密封避光保存,原包装存放的试剂有效期为12个月;取效期末的样品检测外观、膜条宽度、液体移行速度、空白限、线性范围、重复性、准确度,应分别符合2.1.1、2.1.3、2.1.4、2.2、2.3、2.4.1、2.5的要求。
2.7.溯源性
根据GB/T21415-2008的要求提供含有产品校准曲线信息的数据卡,本产品校准曲线信息可溯源至企业工作校准品。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2. 性能指标
2.1 外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;试剂盒内组分(磁性微球除外)应为澄清的液体,无沉淀、无悬浮物、无絮状物。
2.2 批内精密度
批内变异系数(CV)应≤8%。
2.3 批间精密度
批间变异系数(CV)应≤15%。
2.4 准确度
回收率应在(90.0%~110.0%)范围内。
2.5 空白限
空白限应≤0.500 pg/mL。
2.6 线性
在(1.500~5000)pg/mL浓度区间内,线性相关性系数(r)绝对值应≥0.9900。
2.7 校准品均一性
)应≤8%。
校准品均一性(CV
均一性
2.8 质控品预期结果
质控品1每次测定结果应在(28.0~52.0)pg/mL范围内,质控品2每次测定结果应在(175~325)pg/mL范围内。
2.9 质控品均一性
质控品均一性(CV
)应≤8%。
均一性。
